文章信息
- 贾会霞, 吴立栓, 胡建军, 卢孟柱
- Jia Huixia, Wu Lishuan, Hu Jianjun, Lu Mengzhu
- 柳树种质资源遗传多样性和亲缘关系的CE-AFLP分析
- Genetic Diversity and Genetic Relationship of Salix Germplasms Revealed by CE-AFLP Analysis
- 林业科学, 2013, 49(6): 37-44
- Scientia Silvae Sinicae, 2013, 49(6): 37-44.
- DOI: 10.11707/j.1001-7488.20130606
-
文章历史
- 收稿日期:2012-12-24
- 修回日期:2013-04-24
-
作者相关文章
柳树(Salix)栽培历史悠久,在编筐、栅栏、防护架、医药、园林绿化和生物滤池等方面都有非常广泛的应用(Pulford et al.,2003 ; Volk et al.,2006)。近年来,随着世界能源危机形势日益严峻,一些生长速度快、生物量高的短轮伐期矮生(short-rotationcoppice,SRC)柳树作为重要的生物质能源树种,被应用于生物能源发电和生物燃料制备等方面(Brereton et al.,2010 ; 李洪等,2010)。柳树物种丰富,全世界约有520多种,绝大多数种类分布在北半球温带地区,少数种类分布于南美洲和非洲的南部,包括垫状灌木、灌木、小乔木及乔木等多种生活型; 我国有275种,其中189种是特有种(Karp et al.,2011)。由于柳树为柔荑花序,花部形态单一,许多种类具有表型可塑性,种内种间杂交频繁且倍性复杂,所以柳树的分类较为困难,多数从形态学方面进行区分(Karp et al.,2011 ; 陈家辉等,2008)。此外,目前对柳树种质资源遗传多样性和亲缘关系远近的了解较少,这也成为柳树种质资源保存利用和育种的瓶颈。传统形态学鉴定方法已不能较为系统地对柳树进行科学分类并鉴定种质间的亲缘关系,因此,对柳树种质资源进行此方面的研究有着重要的意义。
随着分子生物学技术的不断发展,各种分子标记技术的出现为柳树从基因组水平上进行品种鉴定、系统分类和遗传多样性分析提供了有力的工具。目前,常用的分子标记有 RFLP、RAPD、SSR、AFLP和SNP等,其中 AFLP 标记是 Vos等(1995)发明的一种高效检测 DNA 多态性的分子标记方法,稳定性高,重现性好,对于天然杂交多样、倍性复杂、基因组信息量少的柳树是一种非常理想的标记(Karp et al.,2011)。 Beismann等(1997)利用 AFLP 对白柳(S. alba)和爆竹柳(S. fragilis)2个自然种群及其杂交种进行区分,解决了爆竹柳及其杂交种形态学相似难区分的难题。Barker等(1999)采用 RAPD和AFLP 2种技术对生物能源柳进行了遗传多样性和亲缘关系分析,发现 AFLP 技术在亲缘关系较近的无性系中可以提供更多的遗传变异信息。 Kopp等(2002)利用 AFLP 绘制了绵毛柳(S. erioclada)杂交亲本的指纹图谱,并指出根据 AFLP 指纹图谱可以预测使其子代产生较大遗传变异的亲本组合。 Trybush等(2008)对英国的154个柳树基因型(包含50种)进行了荧光 AFLP 分析,该研究将三蕊柳(S. triandra)划分到柳亚属,这对传统分类学是一个挑战。毛细管电泳-AFLP(CE-AFLP)技术是将传统的 AFLP 标记与荧光标记和毛细管电泳相结合的高通量检测方法,分辨率高、自动化程度高、操作简便,具有非常广阔的应用前景(Luo et al.,2003 ;Wong et al.,2004)。目前该技术已经在茶(Camellia sinensis)(季鹏章等,2009)和烟草(Nicotiana tabacum)(李凤霞等,2010)等植物中得到有效的应用。本研究以从国内外搜集的在生产上常用于栽培绿化和生物质能源的37份柳树种质资源为材料,利用 CE-AFLP 技术对其遗传多样性和亲缘关系进行研究,为其分子生物学分类、种质资源保存与利用及品种改良等研究提供重要依据。
1 材料与方法 1.1 材料供试的37份柳树种质资源试材(表 1)于2012年5月采自中国林业科学研究院苗圃。取幼嫩的叶片放入自封袋中,保存在冰盒里带回实验室,置于- 80 ℃冰箱中备用。表 1中组的划分依据王战等(1984)建立的体系(《中国植物志》第20卷2分册)。
|
|
采用 CTAB 法(Allen et al.,2006)提取幼嫩叶片中的DNA,0.8 % 琼脂糖凝胶电泳检测 DNA 的完整性,紫外分光光度计测定样品 DNA 的浓度和纯度,将浓度稀释至200 ng·L-1,置于-20 ℃冰箱中备用。
1.3 AFLP 分析AFLP 分析依照吕金辉等(2012)在柳树上构建的 AFLP 反应体系进行。使用 EcoRⅠ/ MseⅠ和PstⅠ/ MseⅠ2组限制性内切酶。采用 EcoRⅠ+ 1 / MseⅠ+ 1和PstⅠ+ 1 / MseⅠ+ 1引物组合进行预扩增,EcoRⅠ+ 3 / MseⅠ+ 3和PstⅠ+ 2 /MseⅠ+ 3 引物组合进行选择性扩增,其中 Mse Ⅰ + 3引物的5 ' 端加 Cy5荧光进行标记。
利用 GenomeLabTM GeXP 遗传分析系统检测选择性扩增产物。将 SLS(甲酰胺)与 DSS-400(DNA 分子量内标-400)按100 ∶ 1的体积比混匀后,吸取20 μL 混合液加入96孔上样板中,加入0.3~0.5 μL 选择性扩增产物,离心后加1滴矿物油防止样品蒸发,然后将样品放入 CEQ8000遗传分析仪中,通过变性→分离→电泳→检测4个程序完成毛细管电泳。
1.4 数据处理利用遗传分析系统中 Fragments 软件对收集的原始数据进行处理,根据分子量内标得出片段大小,将有峰的位置记为“1 ”,无峰的位置记为“0 ”,转换为“0,1 ”矩阵。将2次重复试验进行比较,重复性不好的峰剔除,保留有效峰,人工调整系统自动输出矩阵图。采用 NTSYS-pc 2.10 e 软件进行遗传多样性分析,使用软件中的 SimQual 程序计算样品间的 DICE 遗传相似系数 GS和遗传距离 GD,用 SAHN 程序进行 UPGMA(非加权成对算术平均法)聚类分析,通过 Tree plot 模块生成聚类图; 将数据通过Dcenter 中心化后,采用 Eigen 方法进行主分析分析。
2 结果与分析 2.1 引物的筛选和扩增从80对引物组合中筛选出11对扩增条带较多、稳定且多态性高的引物组合对37份柳树种质进行扩增,扩增条带在60~400 bp 之间,共获得条带数1 580条,多态性条带数1 399条,多态率在80.65 %~94.67 % 之间; 平均每对引物扩增的多态性条带数为127.2,多态率为88.54 %,表明柳树种质间的遗传多样性较高。其中引物 MCAC / PCA 的多态率最高,为94.67 % ; 引物 MCTG / PAA 的多态率最低,为80.65 % 。11对不同引物组合的扩增结果见表 2 。图 1是引物 MTTG-PCA 对部分柳树种质的扩增图谱。
|
|
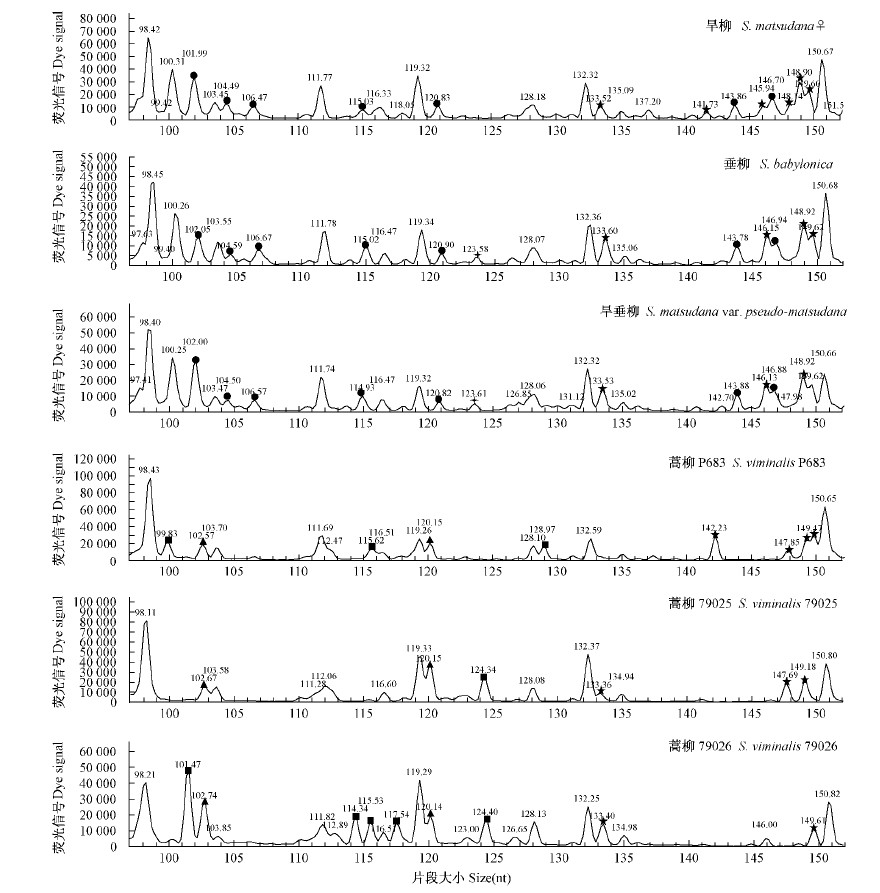 |
图 1 引物 MTTG-PCA 对3份柳组材料和3份蒿柳组材料的扩增图谱(100~150 bp)
Fig. 1 Amplification patterns of 3 materials from Sect. Salix and 3 materials from Sect. Vimen by primer MTTG-PCA(100-150 bp)
●代表 6份柳树材料中柳组材料相对于蒿柳组材料所特有的位点 ,特异位点有102 ,104 ,106 ,115 ,121 ,144 ,147 bp; ▲6份柳树材料中蒿柳组材料相对于柳组材料所特有的位点 ,特异位点有103 ,120 bp; 柳组内材料的多态性位点 ,垂柳和旱垂柳有123 bp,而旱柳没有该位点 ; ■蒿柳组内材料的多态性位点100 ,101 ,114 ,115 ,117 ,124 ,129 bp; ★6份材料中柳组和蒿柳组之间的特异位点133 ,142 ,146 ,149 ,150 bp。 ●represents specific loci of Sect. Salix relative to Sect. Vimen,including 102 ,104 ,106 ,115 ,121 ,144 and 147 bp.▲ represents specific loci of Sect. Vimen relative to Sect. Salix,including 103 bp and 120 bp. represents specific loci in Sect. Salix,S. babylonica and S. matsudana var. pseudo-matsudana have 123 bp locus,but S. matsudana has not.■ represents specific loci in Sect. Vimen,including 100 ,101 ,114 ,115 ,117 ,124 and 129 bp.★ represents specific locibetween Sect. Salix and Sect. Vimen,including 133 ,142 ,146 ,149 and 150 bp. |
将11对引物扩增出的条带作为原始矩阵,利用 NTSYS-pc 软件计算37份种质间的 Dice 遗传相似系数和遗传距离(表 3),遗传相似系数在0.529 6~0.986 1之间,遗传距离在0.014 0~0.570 2之间。引自德国的蒿柳77683和蒿柳78195遗传相似系数最大,为0.986 1,说明这2份种质的亲缘关系非常近; 引自美国的绵毛柳P719与中国的旱垂柳亲缘关系最远,遗传相似系数为0.529 6 。基于遗传相似系数对37份种质进行聚类分析(图 2)。在相似系数0.63时,37份柳树种质可分为2大类:一类是乔木柳; 另一类除康定柳为小乔木外,其他均为灌木柳。
|
|
 |
图 2 基于 DICE 相似系数的37份种质的聚类
Fig. 2 Dendrogram of 37 Salix germplasms based on AFLP data
1-37编号同表 1 。下同。 1-37 codes refer to the samples listed in Tab. 1 . The same below. |
乔木柳中,主要包括柳组的10份材料、柳组内杂交种和未知亲本来源的竹柳。旱垂柳是旱柳和垂柳的杂交种,在聚类结果中,旱垂柳与旱柳和垂柳聚为一小类,且位于两亲本之间,表明旱垂柳继承亲本遗传信息无偏于单亲。垂爆柳是垂柳和爆竹柳的杂交后代,但是垂爆柳与爆竹柳相似性较高,说明垂爆柳的遗传信息偏向父本。苏柳 J172 、苏柳 J795和苏柳 J799在相似系数为0.88时聚为一类,且与绦柳亲缘关系较近。绦柳是旱柳的栽培变种,但是聚类结果中二者未聚在一起,其相似系数为0.86,说明这2份种质在基因组水平上发生较大变异。旱柳Drago 是引自意大利的旱柳杂交种(Allegro et al.,2010),与生长速度快且材质优良的竹柳聚为一类,并与绦柳、苏柳 J172 、苏柳 J795和苏柳 J799亲缘关系较近,其中后3个乔木柳无性系分别来源于垂柳、白柳、旱柳等亲本杂交,说明这几个柳树种质亲缘关系较近。
当相似系数为0.72时,将除乔木柳外的21份灌木柳分为5类:
第ⅰ类包括筐柳组的簸箕柳和沙柳、银柳组的银芽柳、杞柳组的杞柳、郝柳组的红皮柳,以及簸箕柳与杞柳正反交的2个杂交后代(杞簸柳 JW9 -6和簸杞柳 JW8 -26)。簸箕柳 P295虽然与沙柳属于筐柳组,但簸箕柳 P295与银芽柳的亲缘关系相对较近,相似系数为0.88,而与沙柳相似系数为0.81 。杞簸柳 JW9 -6是杞柳和簸箕柳的杂交后代,簸杞柳 JW8 -26是簸箕柳和杞柳的杂交后代,两者均与杞柳的亲缘关系较近。
第ⅱ类只有五蕊柳组中的康定柳。
第ⅲ类包含蒿柳组的8份材料和S.humboldtiana。在蒿柳组中,6份蒿柳材料和2份毛枝柳材料在相似系数为0.76时分为2小类;引自德国的5份蒿柳材料(蒿柳78106 、蒿柳79025 、蒿柳79026 、蒿柳77683和蒿柳78195)聚在一起,并与引自英国的蒿柳 P683存在较大的遗传差异,说明不同地理区域的材料遗传差异较大。引自德国的 S.humboldtiana 与德国蒿柳聚在一起,说明两者亲缘关系较近。
第ⅳ类只有黄花柳组中的灰柳 P604 。
第ⅴ类是绵毛柳组中的绵毛柳 P715 、P718和P719,这3份材料均引自美国纽约,说明它们可能来源于同一杂交组合。
2.3 柳树种质资源的主成分分析主成分分析可以从多个方向和多个层面更直观准确地反映材料间的亲缘关系,对37份柳树种质进行主成分分析(图 3,图 4)。结果表明,第一、第二和第三主成分的贡献率分别为27.51 % 、10.73 %和8.36 %,累计贡献率为46.60 % 。通常认为前3个主要特征向量方差占总方差40 % 以上,降维效果满意(Huch et al.,1982)。坐标位置越近则表明亲缘关系越近,二维和三维主坐标分析结果与聚类结果基本一致。乔木柳紧密地聚集在一起,位于图左侧; 灌木柳与乔木柳的距离相隔较远,位于图右侧;灌木柳内种质分布较为松散。
 |
图 3 37份柳树种质的二维主成分分析
Fig. 3 Two-dimensional principal component analysis for 37 Salix germplasms
|
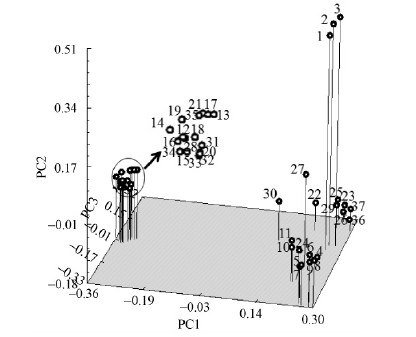 |
图 4 37份柳树种质的三维主成分分析
Fig. 4 Three-dimensional principal component analysis for 37 Salix germplasms
|
柳树是分类系统上最为困难的植物类群之一(陈家辉等,2008),且有关柳树亲缘关系和遗传差异方面的研究较少。本研究利用 CE-AFLP 技术采用11对引物组合对从国内外搜集的在生产上常用于栽培绿化和生物质能源的37份柳树种质资源进行扩增分析,共扩增出1 580条条带,多态性条带数为1 399,多态率在80.65 %~94.67 %,说明柳树的遗传多样性丰富。同时,对37份柳树种质进行遗传多样性分析和亲缘关系鉴定,为柳树分子生物学分类和育种研究提供了理论依据。37份种质可以分为2大类,一类是乔木柳,一类除小乔木康定柳外,其他均为灌木柳,表明利用分子标记的方法可以鉴别同一物种中的不同生活型。第Ⅰ大类乔木柳主要包含柳组内种质,第Ⅱ大类中的第ⅱ类、第ⅲ类、第ⅳ类和第ⅴ类分别包含了五蕊柳组、蒿柳组、黄花柳组和绵毛柳组的种质,这与基于形态特征的传统分类结果一致(王战等,1984 ; Trybush et al.,2008)。
本文的分类结果与传统分类结果也存在一些差异: 乔木柳中,苏柳 J172是垂柳与白柳杂交的子代再与黎城旱柳杂交选育出的优良品种,J795和J799是北京旱柳与新疆白柳杂交后代的姊妹株,但这3种苏柳未与垂柳、白柳和旱柳聚在一起;推测原因可能是本研究中的垂柳、白柳和旱柳不是苏柳 J172 、J795和J799的原始杂交亲本,而垂柳、白柳和旱柳因分布不同区域造成群体内也存在较大的遗传差异。绦柳是旱柳的变种,但与旱柳的亲缘关系较远,与苏柳的3个品种聚为一类,可能是在遗传进化过程中,发生较大的遗传变异。竹柳有显著的耐盐碱和快速生长特性(朱继军等,2012),在生产中广泛推广种植,但其起源具有争议,本研究发现其与江苏省林业科学研究院培育的用材品种 J795 、J799和J172等亲缘关系较近,说明其可能与这几个品种起源于相同或相近的亲本。
第Ⅱ大类第ⅰ类中包含筐柳组、银柳组、杞柳组和郝柳组的种质资源,说明这4组柳树的亲缘关系相对较近,其中筐柳组中的簸箕柳P295与沙柳亲缘关系相对较远,而与银芽柳聚在一起。原因可能为:1)传统分类学是从形态学方面对柳树进行区分,未直接从基因组水平进行研究,所以分类上可能会存在一些偏差和失误; 2)簸箕柳 P295和沙柳的地理分布差异较大,簸箕柳分布于我国南方江浙、山东、河南等地,沙柳分布于我国西北干旱半干旱地区,从而造成二者遗传差异较大。
本研究表明 CE-AFLP 技术可以从 DNA 水平上反映柳树种质资源的遗传差异,并鉴定其亲缘关系和分析遗传多样性,可以辅助柳树进行科学分类和育种。所以,将传统形态学分类与分子标记技术相结合,可以为柳树分子生物学分类、种质资源保存与利用及品种改良等研究奠定坚实的基础。
| [1] |
陈家辉,孙航,杨永平.2008.柳树的分支系统学分析.云南植物研究,30(1): 1-7.( 2) 2)
|
| [2] |
季鹏章,蒋会兵,黄兴奇,等.2009.古茶园、台地茶园遗传多样性的AFLP分析.遗传,31(1): 101-108.( 1) 1)
|
| [3] |
李凤霞,王卫锋,王鲁,等.2010.烟草属植物遗传多样性和亲缘进化关系的荧光AFLP分析.中国农业科学,43(12): 2418-2427.( 1) 1)
|
| [4] |
李洪,胡建军.2010.11个能源林杨柳无性系热值季节及年度变化.林业科学研究,23(3): 425-429.( 1) 1)
|
| [5] |
吕金辉,胡建军,卢孟柱.2012.基于毛细管电泳的柳树AFLP分子标记研究.北京林业大学学报,34(1): 51-57.( 1) 1)
|
| [6] |
王战,方振富.1984.中国植物志:第20卷2分册.北京:科学出版社.( 2) 2)
|
| [7] |
朱继军,陈必胜,王玉勤,等.2012.苏柳、竹柳等速生能源柳引种研究.安徽农业科学,40(29): 14290-14291.( 1) 1)
|
| [8] |
Allegro G, Giorcelli A, Deandrea G, et al. 2010. Damage assessment of the leafhopper Asymmetrasca decedens(Paoli, 1932)(Homoptera: Cicadellidae) on Salix spp. in Italy. Tercer Congreso Internacional de Salicáceas en Argentina,1(1): 1-6.( 1) 1)
|
| [9] |
Allen G C, Flores-Vergara M A, Krasynanski S, et al. 2006. A modified protocol for rapid DNA isolation from plant tissues using cetyltrimethyla-mmonium bromide. Nature Protocols, 1(5): 2320-2325.( 1) 1)
|
| [10] |
Barker J H, Matthes M, Arnold G M, et al.1999. Characterisation of genetic diversity in potential biomass willows (Salix spp.) by RAPD and AFLP analyses. Genome, 42(2): 173-183.( 1) 1)
|
| [11] |
Beismann H, Barker J, Karp A,et al.1997. AFLP analysis sheds light on distribution of two Salix species and their hybrid along a natural gradient. Molecular Ecology, 6(10): 989-993.( 1) 1)
|
| [12] |
Brereton N J B, Pitre F E, Hanley S J, et al. 2010. QTL mapping of enzymatic saccharification in short rotation coppice willow and its independence from biomass yield. BioEnergy Research, 3(3): 251-261.( 1) 1)
|
| [13] |
Huch G, Gauch J R. 1982. Multivariate analysis in community ecology. Cambridge University Press.( 1) 1)
|
| [14] |
Karp A, Hanley S J, Trybush S O, et al. 2011. Genetic improvement of willow for bioenergy and biofuels free access. Journal of Integrative Plant Biology, 53(2): 151-165.( 3) 3)
|
| [15] |
Kopp R, Smart L, Maynard C, et al. 2002. Predicting within-family variability in juvenile height growth of Salix based upon similarity among parental AFLP fingerprints. TAG Theoretical and Applied Genetics, 105(1): 106-112.( 1) 1)
|
| [16] |
Luo M C, Thomas C, You F M, et al. 2003. High-throughput fingerprinting of bacterial artificial chromosomes using the snapshot labeling kit and sizing of restriction fragments by capillary electrophoresis. Genomics, 82(3): 378-389.( 1) 1)
|
| [17] |
Pulford I, Watson C. 2003. Phytoremediation of heavy metal-contaminated land by trees. Environment International, 29(4): 529-540.( 1) 1)
|
| [18] |
Trybush S, Jahodová Š, Macalpine W, et al. 2008. A genetic study of a Salix germplasm resource reveals new insights into relationships among subgenera, sections and species. BioEnergy Research, 1(1): 67-79.( 2) 2)
|
| [19] |
Volk T, Abrahamson L, Nowak C, et al. 2006. The development of short-rotation willow in the northeastern United States for bioenergy and bioproducts, agroforestry and phytoremediation. Biomass and Bioenergy, 30(8/9): 715-727.( 1) 1)
|
| [20] |
Vos P, Hogers R, Bleeker M, et al. 1995. AFLP: a new technique for DNA fingerprinting. Nucleic Acids Research, 23(21): 4407-4414.( 1) 1)
|
| [21] |
Wong K Y, Chuan Y C, Aggareal A, et al. 2004. Identifying patterns of DNA for tumor diagnosis using capillary electrophoresis-amplified fragment length polymorphism (CE-AFLP) screening. Journal of Bioinformatics and Computational Biology, 2(3): 569-587.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49


