文章信息
- 王瑫, 李永, 朴春根, 汪来发, 朱天辉
- Wang Tao, Li Yong, Piao Chungen, Wang Laifa, Zhu Tianhui
- 2种杨树可培养内生细菌的多样性和季节动态变化
- Diversity and Seasonal Fluctuations of Culturable Endophytic Bacteria Isolated from Two Poplars
- 林业科学, 2013, 49(5): 135-146
- Scientia Silvae Sinicae, 2013, 49(5): 135-146.
- DOI: 10.11707/j.1001-7488.20130518
-
文章历史
- 收稿日期:2012-10-31
- 修回日期:2013-02-03
-
作者相关文章
2. 中国林业科学研究院森林生态与保护研究所国家林业局森林保护学重点实验室 北京 100091
2. Key Laboratory of Forest Protection of State Forestry Administration Research Institute of Forest Ecology, Enviroment and Protection, CAF Beijing 100091
1866年,De Bary首次提出了内生菌(Endophyte)的概念,认为凡是在植物体内的微生物均为内生菌。1992年,Kloepper等(1992)提出植物内生细菌(Endophytic bacteria)是一类定殖于植物内部且不引起植物病害的细菌。随着植物微生态系统研究的深入,现在被大多数研究学者广泛接受的植物内生细菌的定义是,在植物一生或至少一生中的某个阶段能进入活体植物组织内,并不使植物组织的表型特征和功能发生变化的细菌称为内生细菌(Wilson,1995)。近年来研究发现,内生细菌几乎存在于所有健康植物体内,其可以增强或赋予宿主抗病、抗干旱、固氮等能力,还可以促进植物生长、防治植物病害以及修复重金属污染等(姚领爱等,2010; 卢昕等,2007)。因而,研究植物内生细菌的群落多样性和数量消长规律对内生细菌开发和利用具有重要意义。
目前,植物内生细菌的报道主要集中在草本植物或木本植物的叶片、根系等部位,而对木本植物干部组织的内生细菌报道相对较少。王爱华等(2010)对柑橘(Citrus reticulata)健康植株和病株韧皮部组织内生细菌的研究发现,二者存在明显差异,但都获得了较为丰富的群落多样性组成。Safiyh等(2009)和Fiona等(2006)在对Populus trichocarpa ×deltoides cv. Hoogvorst 的内生细菌研究中,分离到一些具有碳汇固定作用和促进植物新陈代谢,以及对植物有修复作用的内生细菌。赵桂华等(2008)开展了南林351 杨(Populus deltoides Harvard×P.deltoides‘Lux’)、土耳其杨(P. deltoides‘S307-26’)和天演杨(P.×euramericana)枝条内生真菌种类及其分布情况的调查,但未涉及内生细菌研究。杨树(Populus spp.)因其具有速生丰产、轮伐期短,容易杂交和无性繁殖等特点成为世界上主要的用材林之一。优良的杨树无性系品种,对解决木材短缺和提供大量造纸原料有着重要作用(王战等,1988)。近年来,由于杨树栽植品种比较单一,降低了对害虫大面积发生的抵御能力。为减轻杨树害虫危害,韩一凡等培育出以健杨为外植体的转Bt 基因欧美杨,即健杨94(Populus×euramericana cv. Robusta 94),其具有抗食叶害虫及耐寒和速生等特性(李淑梅等,2008)。三倍体毛白杨(P.tomentosa)是朱之悌等采用染色体部分替换和染色体加倍技术,将传统38 条染色体的二倍体毛白杨,改造为有57 条染色体的三倍体新品种,具有苗期短、速生、栽培周期短等一系列优点(朱之悌,2002)。2种杨树为我国新培育的优良品种,其内生菌情况未见报道。本研究通过对2个杨树品种树干皮层内生细菌的物种多样性、群落组成及其优势种群季节动态变化规律的研究,了解这2种经特殊改造的杨树体内潜在病原菌以及生防菌等有益微生物的状况,为杨树病虫害防治、有益微生物的开发利用奠定基础。
1 材料与方法 1.1 材料 1.1.1 材料采集样品采集时间: 2010年7,10月; 2011年1,4,7,10月; 2012年1,4月; 采集地点为河南省濮阳市清丰县柳各乡窑厂杨树人工林地,林龄为6~7年生,随机3 点采样,每点选取健株各3 株,采样部位距地面1~1.2 m,采集15 cm×5 cm 的三倍体毛白杨和健杨94树皮组织并做好标记。装入无菌的自封袋中,带回中国林业科学研究院森林生态环境与保护研究所植物病原与病害治理实验室,保藏于4 ℃冰箱,于48 h 内进行分离培养。
1.1.2 主要仪器及试剂Longgene A200 PCR仪,Vilber 3000 凝胶成像系统,Nano drop1000 核酸测定仪。
16S rDNA 片段扩增所用的2×PCR Master Mix购自天根生化科技有限公司,通用引物由上海英潍捷基生物技术有限公司合成,其余菌株分离所需试剂均来自国产分析纯。
1.1.3 培养基牛肉膏蛋白胨培养基(NA):牛肉膏3 g,蛋白胨10 g,氯化钠5 g,琼脂粉15~20 g,蒸馏水1 000 mL,pH 7.0,混匀分装后高压灭菌,用于内生细菌分离培养。
胰蛋白胨大豆琼脂培养基(TSA):胰蛋白胨15 g,大豆蛋白胨7.5 g,氯化钠30 g,琼脂粉20 g,蒸馏水1 000 mL,pH7.0,混匀分装后高压灭菌,用于分离菌株纯化保藏。
1.2 内生细菌的分离与纯化采回的样品用无菌水冲洗干净,然后用无菌手术刀片在三倍体毛白杨和健杨94的3个重复上分别切取1.0 g 组织,共3.0 g,用70%的酒精消毒30 s,无菌水洗3 次后,再用4%的NaClO 消毒3 min后,无菌水洗3 次,将最后一次洗涤液涂抹平板,30℃黑暗培养24 h,用于表面消毒的对照,检查表面消毒是否彻底。
将已表面消毒的树皮组织剪碎,放入无菌的研钵,加入灭菌的石英砂和30 mL 无菌水,充分研磨振荡培养30 min,稀释10-1,10-2,10-3,10-4共4个梯度,分别吸取100 μL 研磨液涂布NA 平板,每个处理3 次重复,30 ℃黑暗培养48 h,选取生长最为均匀的梯度,进行平板计数。
依据菌落的大小、颜色、是否突起,边缘特征、表面光滑与否、透明度等方面的差异,挑取单菌落在NA 平板上划线纯化,纯化后转接TSA 斜面于4 ℃保藏备用(方中达,1998; 东秀珠等,2001)。
1.3 内生细菌的生理生化鉴定采用优势度指数比较判断优势菌群。优势度计算公式为: D=N/NT。其中N为分离的每属内生细菌的种类数量,NT为分离到内生细菌的全部种类数量。根据《伯杰氏细菌鉴定手册》(John et al.,1994)和《常见细菌系统鉴定手册》(东秀珠等,2001)对所得的优势菌群进行形态和生理生化鉴定。
1.4 内生细菌的分子生物学鉴定 1.4.1 内生细菌DNA提取用改良的CTAB 法提取细菌总DNA: 将过夜培养的菌体用无菌水洗下,12 000 r·min-1离心收集菌体,加入1×TE、2%CTAB和3 mol·L-1 NaCl 溶液各200 μL,振荡混匀后经液氮/沸水冻融法反复裂解3 次,65 ℃水浴10 min,加入等体积氯仿进行抽提,12 000 r·min-1离心10 min,吸取上清液,加入1.5 倍体积无水乙醇混匀后置于-20 ℃冷冻20 min 以沉淀DNA,12 000 r·min-1 离心15 min 后倒掉上清液,加入70%乙醇清洗盐离子等杂质,晾干,加入1×TE 溶解DNA,置于-20 ℃备用。
1.4.2 内生细菌16S rDNA的扩增16S rDNA 扩增采用细菌通用引物(Julian et al.,1998):27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')。PCR 反应体系为25 μL: 2×PCR Master mix 12.5 μL,引物各1 μL,模板DNA 1 μL,加ddH2O 补足25 μL。PCR 反应程序为: 94℃预变性5 min; 94℃变性30 s,52 ℃退火45 s,72 ℃延伸1 min,35个循环; 72 ℃最后延伸8 min。反应结束后,取3~4 μL PCR 扩增产物进行1%(W/V)的琼脂糖凝胶电泳检验。PCR 产物由上海英潍捷基生物有限公司纯化后测序。
1.4.3 内生细菌16S rDNA 鉴定及系统发育分析将分离菌株16S rRNA 序列与该种模式菌株序列进行比较,相似性大于97%的分离菌视为同种,小于97%的视为未定种。测序结果在EzBioCloud(http://ztaxon-e.ezbiocloud.net/)和BLAST(http://www.ncbi.nlm.nib.gov/blast/blast.cgi)上进行同源性分析比较。用Clustal X 进行多序列比对,用MEGA4.0(Molecular Evolutionary Genetics Analysis)软件包,采用邻接法(Neighbor-Joining)聚类分析并构建系统进化树,自展值(Bootstrap,1 000 次重复检验)(卡依尔等,2011)。
2 结果与分析 2.1 2种杨树可培养内生细菌鉴定 2.1.2 2种杨树可培养内生细菌鉴定结果从分离过程分析,2种杨树皮层组织经过表面消毒后,最后一次清洗的无菌水涂布NA 平板,30 ℃培养48 h后未有菌落生长,可以认定分离到的菌株均为内生细菌。根据菌落形态(大小、色泽及边缘光滑与否等)特征挑取单菌落进行分离、纯化及保藏,2年共分离纯化得到532个菌株(共8 次,2种杨树)。通过16S rDNA序列同EzBioCloud网站比对鉴定,结果显示,大多数菌株与已知模式菌株的序列相似性在97%~100%之间,分离菌株分属于26个属,47个种。详细鉴定结果和优势菌群生理生化特征见表 1,2,3。
|
|
|
|
|
|
本研究选取的具有代表性的26个属的47种内生细菌,属于细菌域的4个大的系统发育类群: 即厚壁菌门(Firmicutes)、线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、变形菌门的α-变形菌纲(α-Proteobacteria)和γ-变形菌纲(γ-Proteobacteria),其中厚壁菌门的分离比例为12.3%,包括葡萄球菌属(Staphylococcus)、芽孢杆菌属(Bacillus)、类芽孢菌属(Paenibacillus)3个属; 放线菌门的分离比例为16.1%,包括微杆菌属(Microbacterium)、纤维菌属(Cellulomonas)、壤球菌属(Agrococcus)、Amnibacterium、考克氏菌属(Kocuria)、小杆菌属(Curtobacterium)、类诺卡氏菌属(Nocardioides)7个属; 拟杆菌门的分离比例最少,为3.7%,包括黄杆菌属(Flavobacterium)1个属; α-变形菌纲的分离比例最多为46.9%,接近总分离比例的一半,包括甲基杆菌属(Methylobacterium)、鞘氨醇单胞菌(Sphingomonas)、橙单胞菌属(Aurantimonas)、根瘤菌属(Rhizobium)、副球菌属(Paracoccus)、玫瑰单胞菌属(Roseomonas)、新鞘脂菌属(Novosphingobium)7个属; γ-变形菌纲的分离比例次之,为21%,包括志贺氏杆菌(Shigella)、Brenneria、肠杆菌属(Enterobacter)、埃希氏菌属(Escherichia)、假单胞菌属(Pseudomonas)、藤黄单胞菌属(Luteimonas)、成团泛菌属(Pantoea)、黄单胞菌(Xanthomonas)8个属。总之,2种杨树的内生细菌以变形菌门的细菌为主要类群,从基于16S rDNA 序列构建的系统发育树中可看出,2种杨树树皮可培养内生细菌体现出较为丰富的系统发育多样性(图 1,2)。
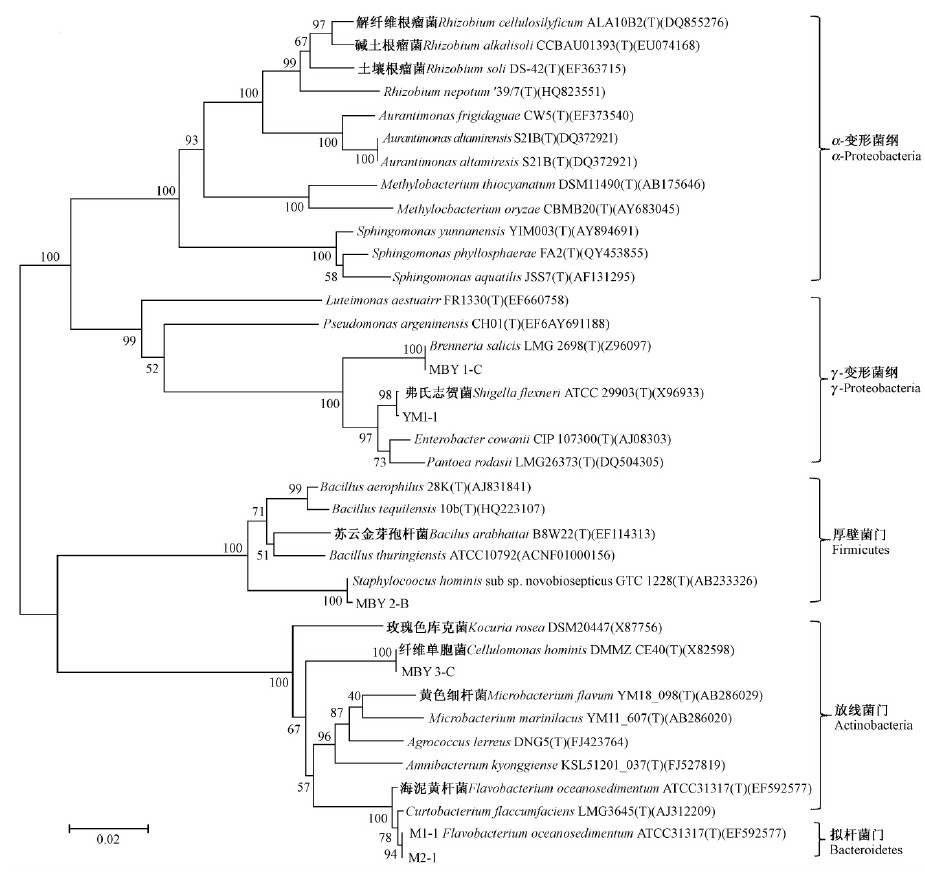 |
图 1 利用NJ法基于16S rDNA序列构建三倍体毛白杨可培养细菌系统发育树
Fig. 1 Phylogenetic tree of culturable endophytic bacteria from triploid Populus tomentosa based on 16S rDNA using NJ method
|
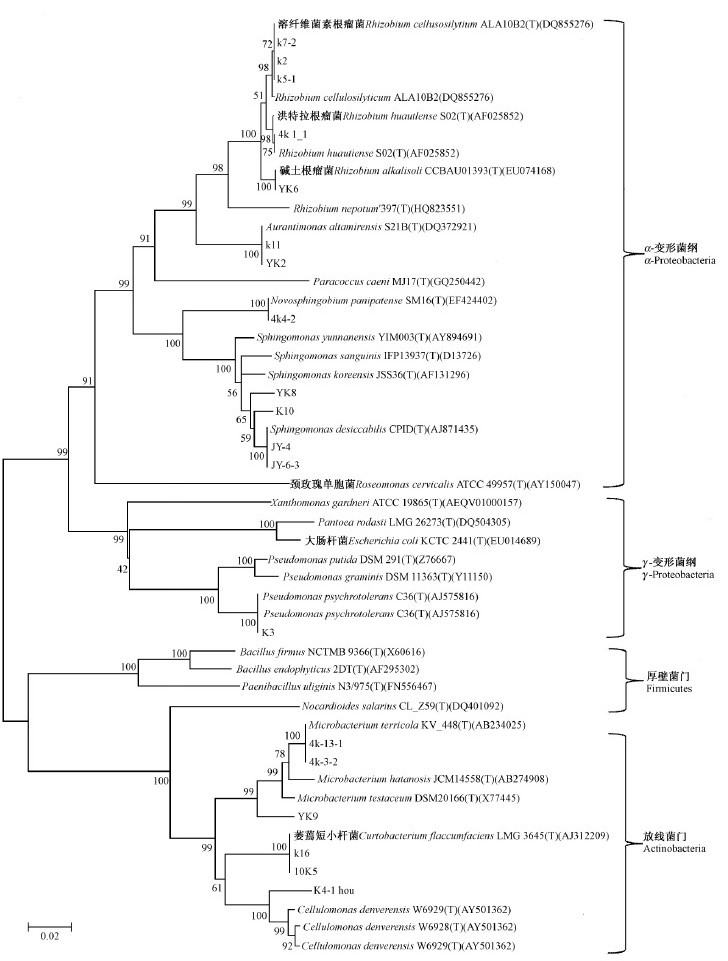 |
图 2 利用NJ法基于16S rDNA序列构建健杨94可培养细菌系统发育树
Fig. 2 Phylogenetic tree of culturable endophytic bacteria from Populus × euramericana cv. Robusta 94 based on 16S rDNA sequences using NJ method
|
从三倍体毛白杨中分离得到的可培养内生菌属于18个属,共30个种。其中以根瘤菌属、芽孢杆菌属、橙单胞菌属、纤维菌属4个属为主,分离率分别为15.16%、13%、10.23%、10.17%,4个属的总分离比例超过50%。三倍体毛白杨树皮中可分离内生细菌优势菌群为根瘤菌属,共分离到4个种,分别是解纤维根瘤菌、R. nepotum、碱土根瘤菌和土壤根瘤菌。芽孢杆菌属居次,共分离到4个种,分别是解纤维根瘤菌、B. arabhattai、B. tequilensis和苏云金芽孢杆菌。除了以上出现频率较高的优势细菌属以外,还分离到了其他14个属的细菌,每个属内的菌株数量虽然不多,但是能充分地反映三倍体毛白杨中可培养内生细菌的多样性和群落结构的特征,详细结果见表 1和图 1。
2.2.2 健杨94可培养内生细菌群落结构从健杨94中分离得到的可培养内生菌属于16个属,共22种细菌。以根瘤菌属、微杆菌属、橙单胞菌属、类诺卡氏菌属4个属为主,分离率分别为21.75%、17.84%、11.72%、9.48%,4个属的总分离比例接近60%。健杨94树皮中可分离内生细菌优势菌群为根瘤菌属,共分离到3个种,分别是解纤维根瘤菌、洪特拉根瘤菌和碱土根瘤菌。微杆菌属次之,仅分离到2个种,分别是Microbacterium radiodurans和M. terricola。此外,尽管鞘氨醇单胞菌属的分离比例只有6.45%,但却分离到4个不同的菌株,在种类上远远多过其他优势菌群。除了以上出现频率较高的细菌属以外,还分离到了其他12个属的细菌,虽然每个属的菌株数量不多,但是也能充分地反映健杨94中可培养内生细菌的多样性和群落结构的特征,详细结果见表 2和图 2。
2.2.3 2种杨树可培养内生细菌群落结构差异性从表 1和图 1可以看出,三倍体毛白杨和健杨94树皮可分离内生菌存在较大差异,从三倍体毛白杨分离得到的可培养细菌属和种均多于健杨94。两者的优势种群均为根瘤菌属,但是却只有2个相同种。另外,2种杨树都分离到且量较多的属为橙单胞菌属,三倍体毛白杨中分离得到2个种(Aurantimonasaltamirensis和A. frigidaquae),而健杨94中只分离1个种(A. altamirensis)。
2种杨树均分离到但量较少的细菌属有: 假单胞菌属、鞘氨醇单胞菌属、橙单胞菌属、纤维菌属、芽孢杆菌属、微杆菌属、成团泛菌属共7个属。
仅从健杨94中分离得到的细菌属有: 埃希菌属、副球菌属、小杆菌属、类诺卡氏菌属、玫瑰单胞菌属、新鞘脂菌属和类芽孢杆菌属共7个属。仅从三倍体毛白杨中分离得到的细菌属有: 葡萄球菌属、甲基杆菌属、Amnibacteriu、志贺氏杆菌属、壤球菌属、Brenneria、肠杆菌属、考克氏菌属、黄杆菌属、藤黄单胞菌属共10个属。可以明显地看出,2种杨树可分离内生细菌种群差异很大。
对三倍体毛白杨和健杨94在不同季节可培养内生细菌种类的分离结果表明(图 3),这2种杨树在不同季节内可培养内生细菌种类差异明显,经2010 -07—2012-04 的观察,结果显示,总体变化规律为三倍体毛白杨各季节可培养内生细菌种类少于或与健杨94持平,健杨94各季节分离种属多在5种以上,而三倍体毛白杨各季节分离种属则在3种以上。二者在不同季节各分离到的种属见图 3。
 |
图 3 2种杨树不同季节内生细菌种类动态变化
Fig. 3 Dynamics of species of culturable endophytic bacteria in different seasons of two poplars
|
三倍体毛白杨和健杨94在不同季节可培养内生细菌数量分析表明(图 4),这2种杨树在不同季节内可培养内生细菌数量存在明显的差异变化,2010-07—2012-04 近2年的数据显示,可培养内生细菌的总体变化规律为: 健杨94内生细菌夏季>春季>秋季>冬季,夏季可培养内生细菌数量达1.65 ×106和1.45×106 cfu·g-1; 三倍体毛白杨内生细菌秋季>夏季>冬季>春季,秋季可培养内生细菌数量达0.86×106和1.08×106 cfu·g-1。二者内生细菌的变化规律并不一致,但总体表现为夏秋2季均高于冬春2季。
 |
图 4 2种杨树不同季节内生细菌数量动态变化
Fig. 4 Dynamics of total amount of culturable endophytic bacteria in different seasons of two poplars
|
三倍体毛白杨和健杨94在不同季节可培养内生细菌种类及其数量的分析结果表明,春季三倍体毛白杨的优势种群是橙单胞菌,分离比例为40.9%;健杨94则是根瘤菌,但分离比例仅占36.5%; 二者均分离到芽孢杆菌,其中三倍体毛白杨中分离比例较高,占33.3%,而健杨94中分离比例很低,只有3.80%(图 5-A)。
 |
图 5 2种杨树可分离内生细菌种类及其含量 Fig. 5 Diagram of genera and their total amount of culturable endophytic bacteria in different seasons of two poplars A. 春季Spring; B. 夏季Summer; C. 秋季Autumn; D. 冬季Winter. 代号的含义见表1,2。The meaning of code is shown in Tab. 1,2 |
夏季三倍体毛白杨的优势种群是微杆菌,分离比例仅占21.5%; 健杨94则是纤维菌,分离比例为41.81%; 二者均分离到了根瘤菌和鞘氨醇单胞菌。三倍体毛白杨中根瘤菌的分离比例为14.65%,低于健杨94的分离比例18.05%,三倍体毛白杨中鞘氨醇单胞菌的分离比例为5.65%,显著低于健杨94的分离比例14.98%(图 5-B)。
秋季三倍体毛白杨的优势种群是纤维菌,分离比例较高,为40.69%,健杨94则是微杆菌,分离比例为40.25%; 二者均分离到了微杆菌和假单胞菌。三倍体毛白杨中微杆菌的分离比例仅为17.65%,而健杨94中微杆菌为优势种群,显著高于三倍体毛白杨,三倍体毛白杨中假单胞菌的分离比例为0.93%,显著低于健杨94的分离比例6.70%(图 5-C)。
冬季三倍体毛白杨和健杨94的优势种群均是根瘤菌,2个树种中分离比例都比较高,分别为54.19%和46.42%。二者均分离到了鞘氨醇单胞菌,分离比例分别为7.33%和19.45%(图 5-D)。
3 结论与讨论本文首次研究了三倍体毛白杨和健杨94树皮内生细菌群落结构及其优势种群的季节动态变化情况,采用纯培养方法分别从不同季节的杨树树皮内共分离到内生细菌532 株,分属于26个属,共47种,其中从三倍体毛白杨中分离得到18 属,30个种,健杨9416 属,22个种,2种杨树树干皮层具有丰富的内生细菌多样性。Safiyh等(2009)从Populus trichocarpa×P. deltoides 的根、芽上分离到78 株内生细菌,分属于细菌4 大类群,其中以变形菌纲的细菌属种为优势属种,如肠杆菌属,单胞菌属(Stenotrophomonas),假单胞菌属和沙雷菌属(Serratia)等,并通过接种试验证明内生细菌对植物新陈代谢有促进作用。卡依尔·玉素甫等(2011)从胡杨(P. euphratica)中分离内生细菌62 株,分属于细菌4 大类群,其优势菌群为假单胞菌属和芽孢杆菌属。Izumi等(2008)对樟子松(Pinus sylvestris var.mongolica)、白桦(Betula platyphylla)和花楸(Sorbuspohuashanensis)等针叶树的内生细菌进行了基于16S rRNA 序列的多样性分析,发现其以芽胞杆菌属、类芽胞杆菌属、假单胞菌属等为主要优势菌群,由此可见,木本植物的内生细菌呈现出整体一致的特点,但研究仍然主要集中于根,叶等组织器官,对于韧皮部组织的内生细菌研究较少。
目前,在各种农作物及果树等经济作物中发现的内生细菌隶属50 多个属,已超过120种(Berg et al.,2006)。植物内生细菌中有很多是对植物生长或微生态环境有利的菌群,如能产生IAA 促进植物生长并且能起到解磷作用的假单胞菌属、泛菌属,能够结瘤固氮的根瘤菌属(Li et al.,2008),能够拮抗病原菌的类芽胞杆菌属、微杆菌属、芽胞杆菌属(Trivedi et al.,2011),能够分解有机除草剂和烃类化合物的Methylobacterium等(Madsen et al.,2001)。另外一些新发现的植物内生菌属的功能尚未确定,有待进一步研究。本文分离到的47 株菌株也属于细菌4 大类群,这与关于其他杨树内生细菌的报道是一致的,但优势菌群却不完全相同。本文研究的三倍体毛白杨以根瘤菌属和芽孢杆菌属为优势菌群,健杨94的优势菌群则为根瘤菌属和微杆菌属。二者都以根瘤菌属为优势菌群,根瘤菌属是一大类群能在豆科植物结瘤固氮的细菌的统称,早在1997年对红花草内生细菌的研究中就发现,根瘤菌属在改善植物固氮能力,提高植物修复能力中起到重要作用(Sturz et al.,1997)。在2种杨树干部皮层组织均分离到根瘤菌,这表明其为杨树组织器官的内生细菌,并能推断杨树根部很可能具有固氮能力。芽孢杆菌属则是一类常见的植物内生细菌,在许多植物和环境中都有发现,并且表现出良好的生防潜力(Reiter et al.,2006)。微小杆菌属则被报道为能有效降解土壤中的重金属离子,并且能定殖于植物内部,起到改善土壤生物量产出,促进植物生长的作用(Sheng et al.,2008)。
多年来,杨树一直受到灰斑病(Coryneumspp.)、叶锈病(Melampsora spp.)、烂皮病(Valsaspp.)、杨白潜蛾(Leucoptera susinella)、杨枯叶蛾(Gastropacha populifolia)、春尺蠖(Apocheimacinerarius)等病原菌和害虫的危害,这些病虫害极大地加剧了林木的衰败与生态体系的破碎化进程。从杨树干部分离到的内生细菌用于杨树腐烂病病原的拮抗,表明菌株JK-SH001(Burkholderia pyrrocinia)有显著的抗病作用,并能定殖于杨树干部(任嘉红等,2009)。同样,也是该属的菌种B. cepacia 被报道能降解甲苯化的有机物,从而对杨树的适生环境进行修复(Safiyh et al.,2005)。本研究在2种杨树都分离到一定比例的芽孢杆菌,研究表明芽孢杆菌属是改善宿主抗病、抗逆能力的主要功能菌群(卢镇岳等,2006),如枯草芽孢杆菌(Bacillus subtilis)就是一种对各种植物病原菌有着良好拮抗作用和定殖作用的生防菌株(王星云等,2007; Erick et al.,2013)。因而,从杨树可培养内生细菌中筛选出的一批具有生物防治作用的内生菌资源,将在提高杨树的抗病虫能力和促进杨林复壮等方面具有潜在的实践意义。
2种杨树在不同季节内可培养内生细菌种类差异明显,总体上三倍体毛白杨各季节可培养内生细菌种类少于或与健杨94各季节可培养内生细菌持平。2种杨树内生细菌分离量随季节变化规律为,健杨94夏季>春季>秋季>冬季,夏季可培养内生细菌数量最高可达1.65×106 cfu·g-1 ; 三倍体毛白杨: 秋季>夏季>冬季>春季,秋季可培养内生细菌数量最高可达1.08×106 cfu·g-1。2种杨树内生细菌分离量变化规律并不一致,但总体表现为夏秋2季均高于冬春2季。这与大多植物内生细菌受到季节变化的影响是整体一致的,即温暖的季节内生细菌多样性大于寒冷的季节(黎起秦,2006; Stefano et al.,2003),原因之一可能是春季和冬季的温度低于夏天和秋季,春冬2季的很多内生细菌处于休眠状态,含量极低,无法被分离到,所以导致夏秋分离率高于春冬季; 原因之二可能是与树体的生长阶段有关,夏秋2季杨树生长最茂盛,体内营养物质最为丰富,所以更适于内生细菌的生长和繁殖。因此,不同季节变化会改变温度、湿度等影响因子,从而导致寄主植物生长条件改变,间接影响植物内生细菌的生长。
2种杨树在各个季节的优势菌群则既表现出差异性也表现出同一性,三倍体毛白杨和健杨94在前3个季节中表现出差异,却在冬季表现出一致性,即以根瘤菌属为主,且健杨944个季节中大多以其为主,这说明根瘤菌属在杨树体内的适生性和定殖能力都比其他内生细菌强,能够长期稳定的占据优势地位,也就说明健杨94内部可能存在较强的固氮能力,这是否与该种杨树转Bt 基因而提高了抗逆性,从而影响了内生细菌优势菌群的定殖分布有关值得探讨。而在夏季和秋季,三倍体毛白杨和健杨94的优势菌群出现差异,前者夏季以微杆菌属为主,后者以纤维菌属为主,秋季则恰好相反。纤维菌属是一类能分泌纤维素酶的细菌,其在杨树体内定殖对生长有怎样的影响也值得深入探讨。2种杨树几乎在4个季节都分离到了鞘氨醇单胞菌,其对改善土壤质量、降低重金属污染有着显著的效果(Sheng et al.,2008),这表明2种杨树对于环境的适生能力较强,丰富的内生细菌能够提高其对环境的抗逆性。
由于许多细菌的生长条件难以人工模拟或难以培养,因此,采用传统的纯培养方法只能分离得到一部分植物内生细菌,并不能真正全面地反映植物内生细菌群落的多样性。每种内生细菌生长所需营养物质有所差别,甚至差别很大,卡依尔等采用了3种培养基(TSA、LB和NA培养基)用于分离Ugan 古河道胡杨可培养内生细菌结果表明,采用TSA 培养基分离效果好于NA 培养基(卡依尔·玉素甫等,2011)。此外,在植物内生细菌分离时,在分离培养基中添加分离样品汁液,尽量模拟内生细菌的宿主环境来保证内生细菌的分离量,可以更加真实地反映植物内生细菌的情况。
| [1] |
东秀珠,蔡妙英. 2001. 常见细菌系统鉴定手册. 北京: 科学出版社.( 2) 2)
|
| [2] |
方中达. 1998. 植病研究方法. 北京: 中国农业出版社.( 1) 1)
|
| [3] |
卡依尔·玉素甫,谢仁娜依·甫拉提,玛丽帕·吐达洪,等. 2011. Ugan古河道胡杨可培养内生细菌的多样性. 微生物学报,51(2):178-188.( 3) 3)
|
| [4] |
黎起秦,谢义灵,林纬,等. 2006. 广西番茄内生细菌的多样性和数量动态. 生物多样性,14(6):534-540.( 1) 1)
|
| [5] |
李淑梅,张春玲,胡建军,等. 2008. 转基因抗虫杨树新品种‘健杨94’. 林业科学,44(7):141.( 1) 1)
|
| [6] |
卢昕,黄贵修. 2007. 植物内生细菌生防作用研究进展. 华南热带农业大学学报,13(4):28-33.( 1) 1)
|
| [7] |
卢镇岳,杨新芳,冯永君. 2006. 植物内生细菌的分离、定殖与应用.生命科学,18(1):90-95.( 1) 1)
|
| [8] |
任嘉红,王艳芳,叶建仁. 2009. 杨树腐烂病拮抗细菌的筛选及其定殖研究. 西部林业科学,38(2):6-11.( 1) 1)
|
| [9] |
王爱华,殷幼平,熊红利,等. 2010. 广西柑橘黄龙病植株韧皮部内生细菌多样性分析. 中国农业科学,43(23):4823-4833.( 1) 1)
|
| [10] |
王星云,宋卡魏,张荣意. 2007. 枯草芽孢杆菌B68 拮抗物质对香蕉冠腐病的抑菌作用及其稳定性测定. 中国生物防治,23(4): 391-393.( 1) 1)
|
| [11] |
王战,董世林. 1988. 杨树生态学特性与成林规律的研究. 国土与自然资(2):源研究,39-43.( 1) 1)
|
| [12] |
姚领爱,胡之璧,王莉莉,等. 2010. 植物内生菌与宿主关系研究进展. 生态环境学报,19(7):1750-1754.( 1) 1)
|
| [13] |
赵桂华,石立岩,杨怀光,等. 2008. 杨树内生真菌的分离和鉴定. 南京林业大学学报:自然科学版,32(2):76-78.( 1) 1)
|
| [14] |
朱之悌. 2002. 三倍体毛白杨新品种简介. 北京林业大学学报,24(Supp.): 60-62.( 1) 1)
|
| [15] |
Berg G,Hallmann J. 2006. Control of plant pathogenic fungi with bacterial endophytes//Schulz B J E,Boyle C J C,Sieber T N.Microbial Root Endophytes,Springer-Verlag,Berlin,Germany,53-69.( 1) 1)
|
| [16] |
Erick F R,Mamy R,Denis R. 2013. Study invitro of the impact of endophytic bacteria isolated from Centella asiatica on the disease incidence caused by the hemibiotrophic fungus Colletotrichum higginsianum. Antonie van Leeuwenhoek,103: 121-133.( 1) 1)
|
| [17] |
Fiona P M,Tanja B,Brigitte B,et al. 2006. Endophytic bacterial diversity in poplar trees growing on a BTEX-contaminated site: The characterisation of isolates with potential to enhance phytoremediation. Systematic and Applied Microbiology,29(7): 539-556.( 1) 1)
|
| [18] |
Izumi Hironari,Anderson I C,Killhamk K,et al. 2008. Diversity of predominant endophytic bacteria in European deciduous and coniferous trees. Canadian Journal of Microbiology,54 (3): 173-179.( 1) 1)
|
| [19] |
John G H, Nobel R K, Peter H A. 1994. Bergey's Manual of Determinative Bacteriology. 9th ed. Balotimore: Williams and Wilkins Press.( 1) 1)
|
| [20] |
Julian R M,Takuichi S,Andrew J W,et al. 1998. Design and evalution of useful bacterium specific PCR primers that amplify genes coding for bacterial 16S rRNA. Appiled and Enviromental Microbiology,64 (2):795-799.( 1) 1)
|
| [21] |
Kloepper J W,Beauchamp C J. 1992. A review of issues related to measuring colonization of plant roots by bacteria. Canadian Journal of Microbiology,38(12):1219-1232.( 1) 1)
|
| [22] |
Li Jihong,Wang Entao,Chen Wenfeng,et al. 2008. Genetic diversity and potential for promotion of plant growth detected in nodule endophytic bacteria of soybean grown in Heilongjiang province of China. Soil Biology and Biochemistry,40(1) :238-246.( 1) 1)
|
| [23] |
Reiter B,Sessitsch A. 2006. Bacterial endophytes of the wildflower Crocus albiflorus analyzed by characterization of isolates and by a cultivation-independent approach. Canadian Journal of Microbiology,52: 140-149.( 1) 1)
|
| [24] |
Safiyh T,Tanja B,Bill G,et al. 2005. Horizontal gene transfer to endogenous endophytic bacteria poplar improves phytoremediation of toluene. Applied and Enviromental Microbiology,71(12):8500-8505.( 1) 1)
|
| [25] |
Safiyh T,Craig G,Daniel van D,et al. 2009. Genome survey and characterization of endophytic bacteria exhibiting a beneficial effect on growth and development of poplar trees. Appl Enviro Microbiol,75(3):748-757.( 2) 2)
|
| [26] |
Sheng Xiafang, Xia Juanjuan, Jiang Chunyu, et al. 2008.Characterization of heavy metal-resistant endophytic bacteria from rape(Brassica napus)roots and their potential in promoting the growth and lead accumulation of rape. Enviromental Pollution,156: 1164-1170.( 2) 2)
|
| [27] |
Stefano M,Emanuela B,Francescopaolo D C,et al. 2003. Fluctuation of bacteria isolated from elm tissues during different seasons and from different plant organs. Research in Microbiology,154(2): 105-114.( 1) 1)
|
| [28] |
Sturz A V,Chritie B R,Matheson B G,et al. 1997. Biodiversity of endophytic bacteria which colonize red clover nodules,roots,stems and foliage and their influence on host growth. Biol Fertil Soils,25:13-19.( 1) 1)
|
| [29] |
Trivedi P,Spann T,Wang N. 2011. Isolation and chcaracterization of beneficial bacteria associated with citrus roots in Florida. Microbial Ecology,62(2):324-336.( 1) 1)
|
| [30] |
Wilson D. 1995. Endophyte-the evolution of a term,and larification of its use and definition. Oikos,73: 274-276.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

