文章信息
- 李思蒙, 王永林, 黄冬辉, 田呈明
- Li Simeng, Wang Yonglin, Huang Donghui, Tian Chengming
- 杨树炭疽病菌原生质体遗传转化的建立及绿色荧光蛋白的表达
- Establishment of a PEG-Mediated Genetic Transformation System and Expression of Green Fluorescence Protein in Colletotrichum gloeosporioides
- 林业科学, 2013, 49(5): 121-127
- Scientia Silvae Sinicae, 2013, 49(5): 121-127.
- DOI: 10.11707/j.1001-7488.20130516
-
文章历史
- 收稿日期:2012-06-20
- 修回日期:2012-10-08
-
作者相关文章
2. 河北秦皇岛经济技术开发区园林绿化管理处 秦皇岛 066004
2. Landscaping Management Office of Qinhuangdao Economic and Technological Development Zone Qinhuangdao 066004
杨树(Populus)是一类优良树种,具有抗性强、生长快、轮伐期短的特点,在生态公益林、防护林、商品林以及园林景观建设等用途中具有重要作用。由胶孢炭疽菌(Colletotrichum gloeosporioides)引起的杨树炭疽病是杨树的重要病害之一(朱克恭,1989),病原菌主要侵染枝、叶,导致大片的杨树叶片枯死(贺伟等,1991)。杨树炭疽病先后在北京、河南、河北、山东、陕西、宁夏等地区发生,尤以毛白杨(P.tomentosa)和北京杨(P.×beijingensis)等杨树受害严重。
受林木生长发育特点和传统森林病理研究局限性等的影响,种水平上森林病害的发生机制森林病理学研究尤为缺乏,阐明病程中寄主-病原物相互作用的分子基础,揭示寄主、病原物与病程相关的基因及其结构、表达和调控机制等病理学问题已成为森林病理学亟需开展的研究工作。
炭疽菌(Colletotrichum)作为一种重要的模式病原真菌,在病原学、寄主与病原互作、侵染结构分化等研究方面具有重要的价值(Perfect et al.,1999;Dean et al.,2012)。胶孢炭疽菌作为炭疽菌属中重要的种,其侵染策略为半活体营养型,在植物中可进行潜伏侵染(徐红梅等,2004),侵入机制复杂,期间涉及大量的基因参与不同阶段的表达调控,只有对其进行分子手段为基础的功能基因组学研究,才能更好地完善其寄主-病原物互作的相关机制。炭疽病菌的遗传转化将是研究其生长发育与致病过程分子机制的有效工具,也是更好地开发及利用其基因功能的有益特性的前提(Weld et al.,2006;Dean et al.,2012)。
常用的真菌遗传转化方法有CaC12/PEG介导的原生质体转化法(CaC12/polyethylene glycol)(Liu et al.,2012)、电穿孔转化法(Tanaka et al.,2011)、基因枪转化法(Djulic et al.,2011)、限制性内切酶介导转化法(REMI)(Turgeon et al.,2010)和根癌农杆菌介导的转化方法(ATMT)(Santhanam,2012)。最早在1987 年,Rodriguez和Yoder 利用带有amdS+基因和hph 基因的质粒使用原生质体转化法成功转化了菜豆炭疽菌(C.lindemuthiaum)(Rodriguez et al.,1987)。随后,包括原生质体转化法在内,电穿孔转化法(Robinson et al.,1999)、限制性内切酶介导的(Thon et al.,2000)和根癌农杆菌介导的(O'Connell et al.,2004)转化方法被相继应用于不同的炭疽菌遗传转化系统的建立中。目前,将基因绿色荧光蛋白(GFP)和合适的转化系统结合起来,有效地监控基因的活性并分析基因的功能,成为了研究植物病原真菌与寄主互作的一种非常有效的非染色技术(Rohel et al.,2001),在炭疽菌中同样适用(Horowitz et al.,2002)。真菌PEG介导的原生质体转化是一种传统的转化方法,其基本的转化步骤为:原生质体的制备,转化过程中外源DNA 的吸收,选择培养基中菌丝的再生。这种方法虽然存在一些潜在的缺点,包括需要制备高浓度的原生质体、相对较低的转化效率、产生部分瞬时转化子和多拷贝整合,但是由于其具有简便有效的操作步骤、简单的试验设备和较低的成本、稳定的核分裂以及受体种群的广泛性等明显优势在不断优化下一直应用至今,成为获得转化子的最普遍的转化技术(Case et al.,1979;Olmedo-Monfil et al.,2004;Weld et al.,2006;Liu et al.,2012)。
因此,本研究建立了PEG介导的杨树炭疽病菌原生质体转化系统,并且获得了性状能够稳定遗传的GFP转化菌株,旨在为研究杨树炭疽病菌致病相关基因提供有效便捷的工具,如在只构建1次载体的情况下进行大量基因的敲除;同时为探索该病菌侵染杨树的相关机制奠定基础,以期寻求控制该病害的有效途径。
1 材料与方法 1.1 试验材料 1.1.1 供试菌株及质粒供试菌株为本实验室保存的杨树炭疽病菌的强致病性菌株C1-5-2,按常规方法保存在PDA培养基上。含潮霉素B 抗性的质粒gGFP购自FGSC(Kansas City,KS,USA),携带有分别以trpC和gpd为启动子的hph 基因和GFP基因。
1.1.2 主要试剂及培养基原生质体缓冲液:1%Lysing enzyme,用0.7 mol·L-1 NaCl 作为稳渗液制备。STC 溶液:20% 蔗糖,50 mmol·L-1 Tris-HCl(pH8.0),50 mmol·L-1 CaC12,去离子水充分溶解,高压蒸汽灭菌。PTC 溶液:60% PEG4000 溶于STC中,高压蒸汽灭菌。潮霉素B 购自生工生物工程(上海)有限公司,使用终浓度为300 μg·mL-1。
PDA固体培养基(常规方法配制),TB3液体培养基(酵母提取物3 g、酪蛋白氨基酸3 g、蔗糖20%、1 L蒸馏水),TB3固体培养基(TB3液体培养基中加入0.65%~0.75%琼脂)。
1.2 杨树炭疽病菌对潮霉素B的敏感性测定C1-5-2培养4天后,沿菌落边缘用直径为5 mm的打孔器打取菌丝块,转接到潮霉素B 浓度分别为0,100,150,200,250和300 μg·mL-1的PDA培养基上,置于25 ℃培养箱中生长4天,观察记录生长情况。
1.3 杨树炭疽病菌原生质体的制备及转化 1.3.1 杨树炭疽病菌原生质体的制备用4 mLTB3液体培养基收集杨树炭疽病菌的分生孢子约4×108个,接种于100 mL TB3液体培养基中,25 ℃摇床150 r·min-1培养24 h,双层纱布过滤收集菌丝。将幼嫩菌丝用0.7 mol·L-1 NaCl 冲洗2次,置于20 mL原生质体缓冲液中,30 ℃摇床70 r·min-1酶解3.5 h。双层Miracloth(Calbiochem,USA),过滤收集原生质体于离心管中,冷冻离心机3 000 r·min-1,4 ℃下离心10 min。去上清,1 mL STC 悬浮,5 000 r·min-1室温下离心5 min 再次收集原生质体,去上清,加入STC 悬浮原生质体,使终浓度达到108·mL-1备用。
1.3.2 杨树炭疽病菌原生质体的转化在50 mL离心管中加入30 μL gGFP质粒DNA,再加入250 μL上述制备的原生质体,轻弹混匀,室温放置20 min,分2次加入1.2 mL 的PTC 溶液,轻弹混匀,室温放置20 min。先加入3 mL TB3液体培养基,翻转混匀,静置2 min,再加入5 mL TB3液体培养基,翻转混匀,静置2 min。将离心管倾斜60°放入摇床中固定,70 r·min-1,20 ℃下过夜培养12~14 h,进行菌丝再生。第2天显微镜观察再生情况后,向离心管中加入潮霉素浓度为250 μg·mL-1的25 mLTB3固体培养基,颠倒混匀,倒2个平板,置于25 ℃恒温培养箱中黑暗培养。
1.3.3 杨树炭疽病菌转化子的获得待菌落从TB3培养基上长出后,用潮霉素浓度为300 μg·mL-1的PDA培养基覆盖,25 ℃培养。2~3天后将长出的单菌落转接到含有潮霉素300 μg·mL-1的PDA培养基上,25 ℃培养。将继续生长的转化子单胞纯化,-70 ℃保存。
1.4 杨树炭疽病菌转化子的PCR鉴定从纯化后的转化子单孢菌株菌落上切出20~30个边长2 mm 菌丝块培养于CM 液体培养基中,2天后使用CTAB 法提取液培的转化子和野生型菌株基因组DNA,分别用潮霉素特异性引物和GFP特异性引物进行PCR 扩增,鉴定阳性转化子。PCR 扩增hph 基因的引物为hph-sec(5'-GCGAAGAATCTCGTGCTTTC-3')和hph-for(5'-GATGTTGGCGACCTCGTAT T-3')。PCR 扩增GFP的引物为GFPfor(5'-ATGGTG AGCAAGGGCGAGGAG-3')和GFPrev(5'-TTACTTG TACAGCTCGTCCATG-3')。
1.5 杨树炭疽病菌转化子的稳定性检测将阳性转化子转接于没有潮霉素选择压力下的PDA培养基上,生长6天后,再次转接,连续培养5代后,转接到含有潮霉素(300 μg·mL-1)的PDA培养基上观察转化子是否对潮霉素保持抗性,并用荧光显微镜观察GFP表达是否存在衰减现象。
1.6 转化子GFP荧光的观察取在PDA培养基上培养至产孢的转化子菌落,挑取分生孢子和菌丝,在荧光显微镜(Leica DM2500 的激光显微镜系统,装备有474/40 nm 激发波长和505/40 nm 吸收波长的Leica 数字相机DFC425C)下观察。使用75% 的乙醇浸泡边长为2 cm的洋葱(Allium cepa)表皮,进行孢子萌发试验,在2,4,6,8,10,12,24 h 时观察洋葱表皮上孢子萌发产生的附着胞和菌丝。
2 结果与分析 2.1 杨树炭疽病菌对潮霉素B的敏感性培养4天后,在不含有潮霉素的对照组PDA平板中,杨树炭疽病菌野生型菌落平均直径为3.92 cm(图 1A)。在含有潮霉素的选择培养基中,潮霉素浓度为100,150,200,250,300 μg·mL-1的菌落平均直径依次为1.49,1.31,1.15,0.99,0.50 cm(图 1B~F),说明潮霉素可以有效抑制野生型杨树炭疽病菌的生长。当潮霉素浓度达到300 μg·mL-1时,能够完全抑制菌丝生长,因此,将后续试验中杨树炭疽病菌转化子的筛选浓度确定为300 μg·mL-1。
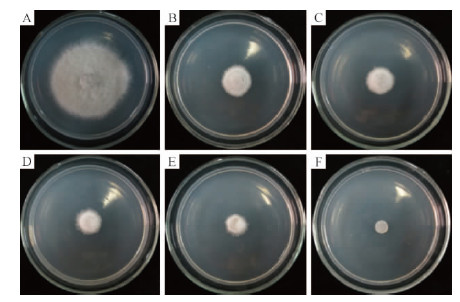 |
图 1 杨树炭疽病菌对潮霉素B的敏感性
Fig. 1 Sensitivity of C.gloeosporioides C1-5-2 isolate to hygromycin B
A-F.潮霉素浓度依次为0,100,150,200,250,300 μg·mL-1。 A-F.Concentrations of hygromycin B at 0,100,150,200,250 and 300 μg·mL-1,respectively. |
转化过程中,当原生质体浓度达到108·mL-1时(图 2B),显微镜观察菌丝再生效果良好(图 3A),即可获得相对较多的转化子。依据覆盖后的含有潮霉素(300 μg·mL-1)的初筛平板上再次长出的单菌落计算转化效率,结果显示:在加入质粒DNA为10 μg时,平均获得414个转化子,平均转化效率为41个转化子·μg-1 DNA。将转化子的单菌落挑出,转接到潮霉素浓度为300 μg·mL-1的PDA平板上再次筛选,小部分转化子生长速度缓慢且一定大小后停止生长,初步分析可能由于质粒DNA 插入位点不同或在有丝分裂过程中基因片段丢失,引起表达量过低或产生杂合体,导致其停止生长。
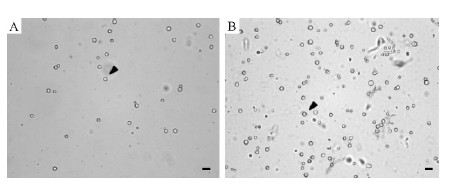 |
图 2 杨树炭疽病菌原生质体
Fig. 2 Protoplasts of C.gloeosporioides
A.优化前原生质体数量为106·mL-1; B.优化后原生质体数量超过108·mL-1(标尺: 10 μm) A.106 protoplasts·mL-1; B.More than 108 protoplasts·mL-1.(Bar:10 μm). |
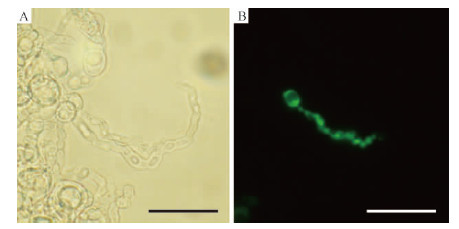 |
图 3 杨树炭疽病菌原生质体的再生菌丝
Fig. 3 Regeneration of protoplasts of C.gloeosporioides
A.明亮视野下观察结果; B.荧光显微镜观察结果。(标尺:25 μm) A.View under brightfield; B.View under fluorescence microscopy. (Bar:25 μm) |
随机挑取10个纯化后的转化子基因组DNA和野生型菌株C1-5-2的基因组DNA作为模板,用PCR方法鉴定其是否含有插入的潮霉素标记基因和GFP表达基因。以质粒gGFP和野生型菌株C1-5-2分别作为正负对照,用潮霉素特异性引物hph-sec/for和GFP特异性引物GFPfor/rev分别扩增hph和GFP基因片段,结果表明:10个转化子和作为阳性对照的质粒gGFP均能扩增出预期条带,而作为阴性对照的野生型C1-5-2则不能得到扩增条带(图 4)。由PCR扩增结果可以得出结论,潮霉素抗性基因和GFP表达基因已经成功插入到转化子染色体中。
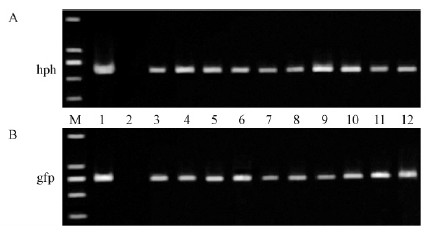 |
图 4 杨树炭疽病菌转化子PCR鉴定
Fig. 4 PCR identification of transformants of C.gloeosporioides
A.潮霉素特异性引物扩增结果,在605 bp 处得到扩增条带; B.GFP 特异性引物扩增结果,在720 bp 处得到扩增条带。M. Marker(DL2000); 1. gGFP 质粒; 2. 阴性对照; 3-12. 10 个转化子。 A. Amplification of gene hph, and the sizes was 605 bp; B. Amplification of gene GFP,and the size was 720 bp.M.Marker (DL2000); 1.gGFP plasmid; 2. Negative control;3-12.Ten randomly selected transformants. |
将鉴定后的10个转化子转接到不含有潮霉素选择压力的PDA培养基上,培养6天,连续转接5代,然后再转接到含有潮霉素(300 μg·mL-1)的PDA培养基上生长,生长速度没有发生变化,并且仍然发出绿色荧光。
2.4 杨树炭疽病菌GFP转化子的荧光观察荧光显微镜下观察原生质体的再生菌丝,通过与明亮视野下的观察(图 3A)进行对比,表明部分再生菌丝已表达荧光(图 3B)。为了证实上述经鉴定整合了GFP的转化子能够表达绿色荧光,随机选择一个转化子在PDA培养基上培养至产生大量分生孢子,收集孢子和菌丝在荧光显微镜下观察。杨树炭疽病菌分生孢子可以发出很强的绿色荧光(图 5A),单独放大一个孢子可以看到整个孢子具有绿色荧光,中心的细胞核处荧光更强(图 5C),与明亮视野下显微镜观察的形态一致(图 5B),菌丝和分生孢子梗均能发出明亮的荧光(图 5F),分生孢子盘在荧光显微镜下也全部可见(图 5G)。将收集到的分生孢子接种至洋葱表皮上,4h 时孢子开始萌发产生附着胞(图 5D),与明亮视野下显微镜观察形态一致(图 5E)。
 |
图 5 杨树炭疽病菌GFP转化子的绿色荧光观察
Fig. 5 Green fluorescence of GFP-tagged C.gloeosporioides isolate
分生孢子(A,C),分生孢子萌发产生附着胞(D,箭头所示),菌丝和分生孢子梗(F),分生孢子盘(G);在明亮视野下分生孢子(B)和萌发产生附着胞(E)。(标尺: B,C,D,E 10 μm,A,F,G 25 μm) Conidia (A and C),appresorium germinated from conidium (D,arrow),mycelia and conidiophores (F),acervulus (G) viewed under fluorescence microscopy.(Bar:B,C,D,E 10 μm,A,F,G 25 μm) |
本研究在借鉴禾谷镰刀菌PEG介导的原生质体转化(Wiebe et al.,1997)、禾生炭疽菌REMI 转化法(Thon et al.,2000)等丝状真菌原生质体转化方法(Liu et al.,2012)的基础上,通过不断优化,成功实现了PEG介导的杨树炭疽病菌的转化,得到了41个转化子·μg-1DNA 的平均转化效率。1988 年禾生炭疽菌(C.graminicola)原生质体转化效率为13个转化子·μg-1 DNA(Panaccione et al.,1988),Poplawski等(1997)使用5 种质粒对柱花草炭疽菌(C.gloeosporioldes)进行原生质体转化,发现不同质粒和相同质粒不同加入量下得到的转化效率差异悬殊。近年来对建立不同寄主植物的胶孢炭疽菌转化体系的研究中,多数研究使用了农杆菌介导的转化方法(De Groot et al.,1998;方丽,2005;曾大兴等,2006;林春花等,2009;张俊等,2011)。虽然这种方法可以得到很高的转化效率,1次转化可以得到大量突变体,便于突变体库的建立。但是对于作为后续进行基因敲除等研究的基础,需要反复构建载体以适合不同的敲除片段。所以本试验在建立杨树炭疽病菌转化系统时使用了PEG介导的原生质体转化法,以便于简化后续致病基因研究中的工作量。
在原生质体的制备阶段,原生质体的数量直接影响转化效果,包括菌丝量、菌龄、酶解液的选择、酶解时间、离心参数的设定等都对原生质体的数量产生显著影响。YEPD液体培养基是很多丝状真菌转化中的菌丝培养液,但在本试验中对于杨树炭疽病菌,使用TB3液体培养基所获得的菌丝更多,并且菌龄为24 h 的菌丝生理状态最佳,释放的原生质体活力最强。使用1.2 mol·L-1 KCl制备酶解液通常可以得到理想的酶解效果,但试验中原生质体数量始终无法超过103·mL-1。后使用0.7 mol·L-1NaCl溶解Lysing enzyme 制备原生质体缓冲液使原生质体数量明显增加。酶解120 min 后,每15 min 记录1次原生质体数量,发现从210 min 开始原生质体数量基本不再增加,此时室温下4 000 r·min-1离心5 min可以得到106·mL-1的原生质体(图 2A),同时发现有相当数量的原生质体死亡,初步判断由于原生质体自身非常脆弱,在裂解酶的破坏和稳渗液的保护同时存在下,对外界压力非常敏感。在对离心参数进行调试后发现,当离心参数设为3 000 r·min-1,4 ℃,离心10 min 时,原生质体数量能够达到108·mL-1以上(图 2B)。
在原生质体转化过程中,PEG的凝聚作用是原生质体吸收外源DNA 的关键。研究发现:溶解PEG的缓冲液中CaC12浓度对PEG发挥作用至关重要。使用浓度为50 mmol·L-1 CaC12配制的STC 溶液溶解PEG得到的PTC 溶液,能够使原生质体和质粒DNA 的凝聚效果达到最好。初步分析,可能当Ca2+浓度低时,不能保持原生质体膜内外的电位平衡,使原生质体生理活性下降。同时发现温度过高可能影响菌丝再生,在20 ℃条件下进行再生,过夜摇培后再生的大量菌丝肉眼可见。
在获得突变再生菌丝后,使用有效的选择标记获得转化子成为了关键步骤,本试验选用的为潮霉素B抗性标记基因hph,是目前炭疽菌转化中使用最为广泛的选择标记,对于黄瓜炭疽菌(C.lagenarium)(Kojima et al.,2002)、鳄梨炭疽菌(C.gloeosporioides)(Yakoby et al.,2001)、有节黧豆炭疽菌(C.gloeosporioides)(Robinson et al.,1999)等的生长有良好的抑制效果,抑制浓度为50~100 μg·mL-1。依据杨树炭疽病菌对潮霉素B 的敏感性测定结果笔者将300 μg·mL-1定为筛选浓度,虽然可以达到预期筛选效果,但是敏感性相对较小,使用浓度过高使试验成本增加,不能作为最佳选择标记。
在杨树炭疽病菌转化系统成功建立的同时,转化子的GFP荧光表达强而清晰,性状可以稳定遗传,分生孢子和菌丝的生长发育没有发生变化,因此可以为进行杨树炭疽病菌与杨树互作的相关研究提供良好材料,如杨树炭疽病菌侵染杨树叶片过程中的显微结构的观察。在对稻瘟菌(Magnaporthegrisea)与寄主互作的研究中(Marcel et al.,2010),GFP不仅可以示踪侵染过程,还可以监测侵染过程中相关基因的表达,为证明病原真菌的侵染策略提供初步的依据。同时,GFP在定量检测植物组织中病原物的数量和侵染过程中寄主植物抗性反应等方面的应用潜力巨大。
随着分子生物学技术的高速发展,大量真菌及寄主的全基因组成功测序,基因随机诱变和定向突变技术作为研究真菌基因功能的有效工具,与不同真菌的转化系统相结合便可对其进行遗传操纵,使遗传转化在功能基因组学的研究方面做出巨大贡献。
综上所述,PEG介导的杨树炭疽病菌遗传转化系统的建立,将为探索杨树炭疽病菌致病相关基因功能与作用方式奠定基础,成为基因敲除的有力工具,并且可以为阐明杨树炭疽病菌生长发育与致病过程的分子机制提供强大的技术支持。
| [1] |
方丽. 2005. 农杆菌介导的禾谷镰刀菌和瓜类炭疽菌转化及致病性突变体初步筛选. 杭州:浙江大学硕士学位论文.( 1) 1)
|
| [2] |
贺伟,杨旺,沈瑞祥. 1991. 北京杨炭疽病的初步研究,森林病虫通讯,(4):7-9.( 1) 1)
|
| [3] |
林春花,刘先宝,蔡吉苗,等. 2009. 橡胶树尖孢炭疽菌绿色荧光蛋白(GFP)标记转化株的获得. 热带作物学报,(10):1495-1500.( 1) 1)
|
| [4] |
徐红梅,陈京元,肖德林. 2004. 林木炭疽病研究进展,湖北林业科技,(4):40-42.( 1) 1)
|
| [5] |
曾大兴,李敏慧,姜子德. 2006. 根癌农杆菌介导的香蕉炭疽菌转化. 仲恺农业技术学院学报,18(4):42-44.( 1) 1)
|
| [6] |
张俊,吕延超,刘晓妹,等. 2011. 芒果尖孢炭疽病病原菌的绿色荧光蛋白基因标记. 热带作物学报,32(9):1708-1710.( 1) 1)
|
| [7] |
朱克恭. 1989.树木炭疽病, 森林病虫通讯,(2):37-40.( 1) 1)
|
| [8] |
Case M E, Schweizer M, Kushner S R, et al. 1979. Efficient transformation of Neurospora crassa by utilizing hybrid plasmid DNA.Proc Natl Acad Sci USA,76(10):5259-5263.( 1) 1)
|
| [9] |
De Groot M J A, Bundock P, Hooykaas P J J, et al. 1998.Agrobacterium tumefaciens-mediated transformation of filamentous fungi. Nat Biotechnol,16(9):839-842.( 1) 1)
|
| [10] |
Dean R,Van Kan J A,Pretorius Z A,et al. 2012. The Top 10 fungal pathogens in molecular plant pathology. Mol Plant Pathol,13(4) :414-430.( 2) 2)
|
| [11] |
Djulic A,Schmid A,Lenz H,et al. 2011. Transient transformation of the obligate biotrophic rust fungus Uromyces fabae using biolistics,Fungal Biology,115(7):633-642.( 1) 1)
|
| [12] |
Horowitz S,Freeman S,Sharon A. 2002. Use of green fluorescent protein-transgenic strains to study pathogenic and nonpathogenic lifestyles in Colletotrichum acutatum. Phytopathology, 92(7):743-749.( 1) 1)
|
| [13] |
Kojima K,Kikuchi T,Takano Y,et al. 2002. The mitogen-activated protein kinase gene MAF1 is essential for the early differentiation phase of appressorium formation in Colletotrichum lagenarium,Mol Plant-Microbe Interact,15(12):1268-1276.( 1) 1)
|
| [14] |
Liu Z, Friesen T L. 2012. Polyethylene glycol(PEG)-mediated transformation in filamentous fungal pathogens. Methods Mol Biol,835: 365-375.( 3) 3)
|
| [15] |
Marcel S,Sawers R,Oakeley E,et al. 2010. Tissue-adapted invasion strategies of the rice blast fungus Magnaporthe oryzae. Plant Cell,22(9):3177-3187.( 1) 1)
|
| [16] |
O'Connell R,Herbert C,Sreenivasaprasad S,et al. 2004. A novel Arabidopsis-Colletotrichum pathosystem for the molecular dissection of plant-fungal interactions. Mol Plant-Microbe Interact,17(3):272-282.( 1) 1)
|
| [17] |
Olmedo-Monfil V,Cortes-Penagos C,Herrera-Estrella A. 2004. Three decades of fungal transformation: key concepts and applications.Methods Mol Biol,267: 297-313.( 1) 1)
|
| [18] |
Panaccione D G,McKiernan M,Hanau R M. 1988. Colletotrichum graminicola transformed with homologous and heterologous benomylresistance genes retains expected pathogenicity to corn. Mol Plant-Microbe Interact,1: 113-120.( 1) 1)
|
| [19] |
Perfect S E,Hughes H B,O'Connell R J,et al. 1999. Colletotrichum: A model genus for studies on pathology and fungal-plant interactions,Fungal Genet Biol,27(2/3):186-198.( 1) 1)
|
| [20] |
Poplawski A M,He C,Irwin J A,et al. 1997. Transfer of an autonomously replicating vector between vegetatively incompatible biotypes of Colletotrichum gloeosporioides. Curr Genet,32(1):66-72.( 1) 1)
|
| [21] |
Robinson M, Sharon A. 1999. Transformation of the bioherbicide Colletotrichum gloeosporioides f. sp. Aeschynomene By electroporation of germinated conidia. Curr Genet,36(1-2):98-104.( 2) 2)
|
| [22] |
Rodriguez R J,Yoder O C. 1987. Selectable genes for transformation of the fungal plant pathogen Glomerella cingulata f. sp. phaseoli(Colletotrichum lindemuthianum).Gene,54(1):73-81.( 1) 1)
|
| [23] |
Rohel E A,Cavelier N,Hollomon D W. 2001. Microscopic analysis of the effect of azoxystrobin treatments on Mycosphaerella graminicola infection using green fluorescent protein(GFP)-expressing transformants. Pest Manag Sci,57(11):1017-1022.( 1) 1)
|
| [24] |
Santhanam P. 2012. Random insertional mutagenesis in fungal genomes to identify virulence factors,Methods Mol Biol,835: 509-517.( 1) 1)
|
| [25] |
Tanaka E,Kumagawa T,Tanaka C,et al. 2011. Simple transformation of the rice false smut fungus Villosiclava virens by electroporation of intact conidia. Mycoscience,52(5):344-348.( 1) 1)
|
| [26] |
Thon M R,Nuckles E M,Vaillancourt L J. 2000. Restriction enzymemediated integration used to produce pathogenicity mutants of Colletotrichum graminicola. Mol Plant-Microbe Interact,13(12):1356-1365.( 2) 2)
|
| [27] |
Turgeon B G,Condon B,Liu J,et al. 2010. Protoplast transformation of filamentous fungi. Methods Mol Biol,638: 3-19.( 1) 1)
|
| [28] |
Weld R J,Plummer K M,Carpenter M A,et al. 2006. Approaches to functional genomics in filamentous fungi. Cell Res,16(1):31-44.( 2) 2)
|
| [29] |
Wiebe M G,Nováková M,Miller L,et al. 1997. Protoplast production and transformation of morphological mutants of the Quorn mycoprotein fungus,Fusarium graminearum A 3/5,using the hygromycin B resistance plasmid pAN7-1. Mycol Res,101(7):871-877.( 1) 1)
|
| [30] |
Yakoby N, Zhou R, Kobiler I, et al. 2001. Development of Colletotrichum gloeosporioides restriction enzyme-mediated integration mutants as biocontrol agents against anthracnose disease in Avocado fruits,Phytopathology,91(2):143-148.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

