文章信息
- 蒋淑磊, 陈加飞, 赵树堂, 卢孟柱
- Jiang Shulei, Chen Jiafei, Zhao Shutang, Lu Mengzhu
- 应用nanoLC-MS/MS分析毛白杨次生维管系统的蛋白质表达谱
- Proteome Profile in Secondary Vascular System of Populus tomentosa by nanoLC-MS/MS
- 林业科学, 2013, 49(5): 43-53
- Scientia Silvae Sinicae, 2013, 49(5): 43-53.
- DOI: 10.11707/j.1001-7488.20130507
-
文章历史
- 收稿日期:2012-09-04
- 修回日期:2013-02-12
-
作者相关文章
2. 中国林业科学研究院林业研究所 北京 100091;
3. 中国林业科学研究院林业新技术研究所 北京 100091
2. Research Institute of Forestry,Chinese Academy of Forestry Beijing 100091;
3. Research Institute of Forestry New Technology,Chinese Academy of Forestry Beijing 100091
木材是次生维管系统发育的最终产物,其过程包括细胞分裂、细胞扩张、细胞壁加厚、细胞程序性死亡及心材形成等过程(Oh et al.,2003),而维管形成层向外分化成次生韧皮部和向内分化成次生木质部,因此,研究次生维管系统发育的分子机制对了解木材形成的分子机制具有重要意义(Plomion et al.,2001)。
有关细胞木质化的分子机制研究存在多个研究系统。利用细胞离体系统研究了木质素的合成不仅只在维管植物的形态建成过程中,而且在各种压力反应中也合成木质素(Sato et al.,2011),但该系统不能模拟木材发育过程中的形成层细胞分化。通过8 h光照16 h 暗培养可延长拟南芥(Arabidopsisthaliana)维管形成层活动的时间(Dolan et al.,1995),其主根(Zhao et al.,2005)、下胚轴(Sibout et al.,2008)和花梗(Lev-Yadun et al.,2004; Liu et al.,2008)中发生维管形成层,由于形成层活动有限,维管组织生长量少,研究结果不能完全反映木材细胞分化程序和分子调控过程(Fukuda,2004)。在木本植物中,研究者通过构建EST 文库的方法分别从杨树(Populus)(Sterky et al.,2004)、刺槐(Robiniapseudoacacia)(Yang et al.,2004)、火炬松(Pinustaeda)(Allona et al.,1998)等植物中获得了有关木材发育的EST 序列。此外,cDNA 芯片也被广泛用于木材形成组织的转录谱研究并据此在火炬松(Egertsdotter et al.,2004; Whetten et al.,2001)、刺槐(Yang et al.,2004)、桉树(Eucalyptus)(Paux et al.,2004)和毛白杨(Populus tomentosa)(Wang et al.,2009)中鉴定了大量有关木材形成的基因。然而,有关木材形成组织蛋白质组分析的报道并不多。Gion等(2005)采用2D LC-MS/MS和MALDIMS的方法鉴定了25年生、14年生和3年生海岸松(Pinus pinaster)基部到顶端形成层形成过程中,其组织的蛋白质表达情况,所鉴定的蛋白质多具有防御、碳水化合物和氨基酸代谢、细胞骨架以及细胞壁合成等功能。Celedon等(2007)采用2-DE和LCMS/MS 的方法分析了不同树龄的巨桉(Eucalyptusgrandis)木材形成组织的蛋白质表达情况,共鉴定了240个蛋白质。应用蛋白质组学的方法,分析了杨树次生维管组织单个氨基酸的多态性(Abraham et al.,2012),发现杨树在干旱时期形成层组织的蛋白质表达模式发生了显著变化(Durand et al.,2011),研究了欧洲黑杨(Populus nigra)木质主根在应对机械应力时蛋白质表达情况,共鉴定到207个蛋白质(Trupiano et al.,2012)。本课题组采用2DE-PAGE技术与质谱(MALDI-TOF MS)结合(Du et al.,2006)和多维色谱与质谱结合(HPCF/HPRP-MALDI-TOFMS)(陈军,2006)的方法建立了毛白杨次生维管系统再生过程的蛋白质表达谱,分别获得199个和724个特异表达蛋白质,表明了基因表达与次生维管系统发育过程的关系。
毛白杨的次生维管系统活动程度决定了木材质量,鉴定该组织区域的蛋白质,有利于了解木材形成这个复杂的生物学过程,以及所涉及的基因。本研究采用聚丙烯凝胶电泳(SDS-PAGE)结合钠升级液相色谱与电喷雾电离串联质谱联用(nanoLC-ESIMS/MS)方法分析毛白杨形成层区域的蛋白质组,初步比较形成层和未成熟木质部的蛋白质组差异,并分析了部分蛋白质在次生维管系统发育过程中的作用。
1 材料与方法 1.1 试验材料采用剥皮方法,取材植株为生长于河北省任丘市的4年生毛白杨无性系。于2007年6月中旬,在毛白杨树干形成层活动旺盛时期,选取干型通直、生长健壮和生长环境通风透光性好的植株,在距植株基部约1 m 开始,向上环剥1 m,剥皮后未成熟木质部标记为D0S,形成层及韧皮部标记为D0B。用刀片分别刮取树皮内侧(D0B)和树干表面(D0S)的材料,放入冻存管中,投入液氮冻存。
1.2 试验方法 1.2.1 蛋白质的提取参考本实验室陈军(2006)的蛋白质提取方法。
1.2.2 电泳及酶解重悬1.2.1所获蛋白质并采用Bradford方法测定其浓度,采用12%的聚丙烯酰胺凝胶对蛋白质样品进行预分离,上样量为40 μg,电泳电压为80 V。经考马斯亮蓝染色和脱色后,将每个样品(泳道,D0S和D0B切割为约30个宽度不等的胶块,经DTT还原和碘乙酰胺烷基化后,用Trypsin对蛋白质进行胶内酶切,回收获得同等数量的不同肽段混合物,肽段经冷冻干燥后于-80 ℃冻存以备进一步的LC-MS/MS分析。
1.2.3 LC-MS/MS预柱规格: 300 μm i.d.×5 mm,C18,5 μm,100A(Dionex P/N 160454); 反相柱规格: 75 μm i.d.×15 cm,C18,3 μm,100A;流动相组成: 上样缓冲液为5%ACN/0.1%FA/94.9%H2O,流动相A 为5%ACN/0.1%FA/94.9%H2O,流动相B 为95%ACN/0.1%FA/4.9%H2 O。上样泵流速0.02 mL·min-1,柱流速0.3 μL·min-1,上样体积1.4 μL,进样方式为μlPickup; 在90 min内,ACN 比例从0 上升到50%,而后由50%一直升高到98%,并且在98%维持10 min,再由98%下降至5%,并在5%维持10 min,平衡反相色谱柱。质谱参数设置: 1.8 kV 喷雾电压; XCalibur 软件控制数据采集; 正离子模式; 120 min 样品采集时间,由1个扫描片段构成,扫描事件包括1个全扫描和5个数据依赖型扫描,扫描范围为m/z 400~1 700;酶解所获的每个肽段混合物进行2 次LC-MS/MS 分析(重复2 次),2个样品(D0B和D0S)分别获得约60个质谱数据集。
1.2.4 数据分析蛋白质鉴定目标数据库由来自JGI 的毛果杨蛋白质数据库(1.1 版,ftp:∥ftp.jgi-psf.org/pub/JGI_data/Poplar/annotation/v1.1/proteins.Poptr1_1.JamboreeModels.fasta.gz)及由软件RcpaBiosolution 1.9.0(RCPA 提供)构建的反向数据库2 部分构成。采用Turbo SEQUEST软件(Biowork3.2)进行目标数据库与质谱数据集间的比对。质量类型: 平均前体/单一同位素片段(averageprecursor/monoisotopic fragment),最多2个漏切位点、肽段容错率0.8AMU以及片段离子容错率0.8;肽段所允许的翻译后修饰最多为3个。动态修饰:甲硫氨酸的羟基化作用; 固定修饰: 半胱氨酸的羧基氨基甲基化。经过搜库所获得的.out 文件应用BuildSummary 软件(BPRC 提供)进行蛋白质水平的鉴定。假阳性发现率控制在5%以内; △Cn 设为0.1;当Charge+1,Xcorr≥1.75;当Charge+2,Xcorr≥2.25;当Charge+3,Xcorr≥2.75。将LC-MS/MS所获数据集按样品分为D0B和D0S两大组分分别进行蛋白质鉴定,最终蛋白质鉴定标准为含有至少2个不同的肽段(uniquePeptide ≥2)。所获得的蛋白质采用Phobius(Käll et al.,2007)软件预测转膜结构和信号肽。通过BlastX 方法获得与鉴定杨树蛋白质最佳匹配的拟南芥同源蛋白质。
2 结果与分析 2.1 毛白杨次生维管系统的蛋白质表达谱2个样品D0B和D0S经一维凝胶电泳分离(图 1),切胶并胶内还原、烷基化和酶解后,得到60个肽段混合物,每个肽段混合物经过色谱-质谱分析后,共获得了140个数据集。经数据库搜索和筛选,仅在树皮内侧(D0B)存在的蛋白质为380个,仅在树干表面(D0S)存在的蛋白质为216个,而同时出现在D0B和D0S的蛋白质为279个。这些蛋白质的功能涉及氨基酸运输和代谢、细胞周期控制、细胞骨架、翻译后修饰和转录等22个功能类别,此外有近8%属于功能未知蛋白质(图 2)。在已知功能的22个蛋白质类别中,细胞骨架类、细胞内分泌和运输类、氨基酸运输和代谢类、碳水化合物运输和代谢类、翻译后修饰类以及翻译相关蛋白质在形成层区域的表达明显高于未成熟木质部(图 3)。等电点(pI)分布显示,所有鉴定蛋白质主要分布于4~7的酸性区间和7~11的碱性区间(图 4)。所获的蛋白质经Phobius软件预测,分别鉴定出41个蛋白质含转膜结构域、72个蛋白质含信号肽,其中9个蛋白质同时具有转膜结构域和信号肽。此外,含转膜结构域的蛋白质主要分布于形成层区域(D0B),而信号肽蛋白质则在形成层区域和未成熟木质部平均分布(表 1)。
 |
图 1 样品D0S和D0B总蛋白的一维凝胶电泳分离 Fig. 1 Separation of total proteins extracted from D0S and D0B by 1D SDS-PAGE D0S: 树干表面Surface of stem; D0B: 树皮内侧Inside of tree bark. |
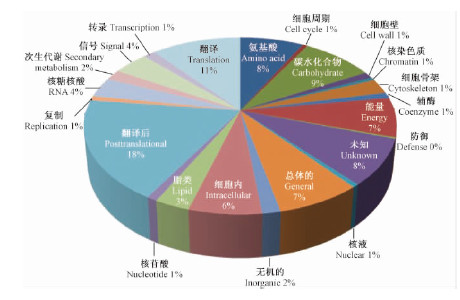 |
图 2 毛白杨形成层区域蛋白质组的功能分类
Fig. 2 Functional categories of proteome from cambial zone in P.tomentosa
|
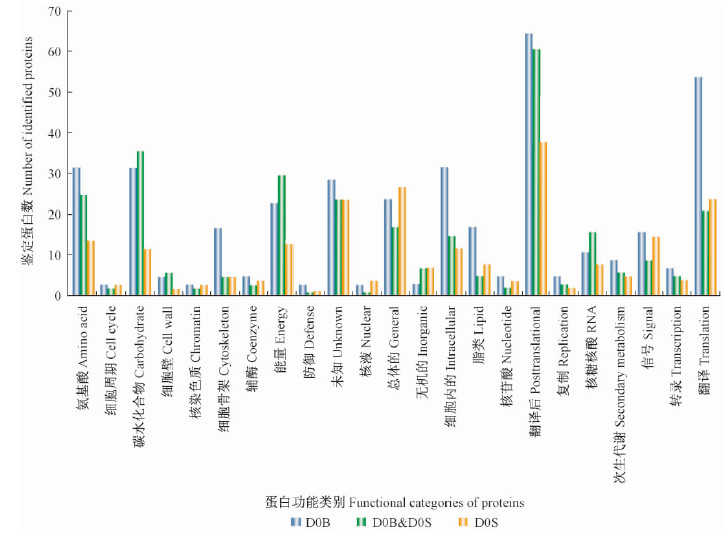 |
图 3 不同功能类别蛋白质在D0B和D0S中的分布
Fig. 3 The distribution of different functional categories in D0B and D0S
|
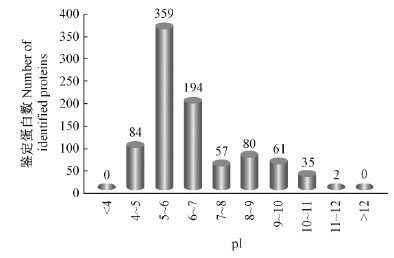 |
图 4 鉴定蛋白质的等电点分布
Fig. 4 The pI distribution of identified proteins
|
|
|
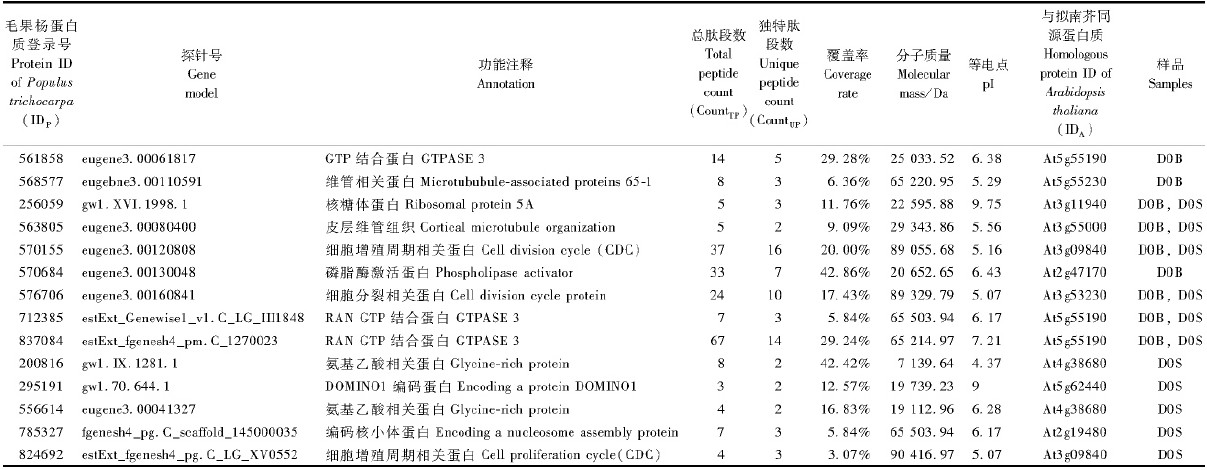
共发现14种与细胞分裂密切相关的蛋白质(表 2),其中包括2个细胞分裂周期蛋白CDC48和3个GTP 结合蛋白RAN3。
|
|
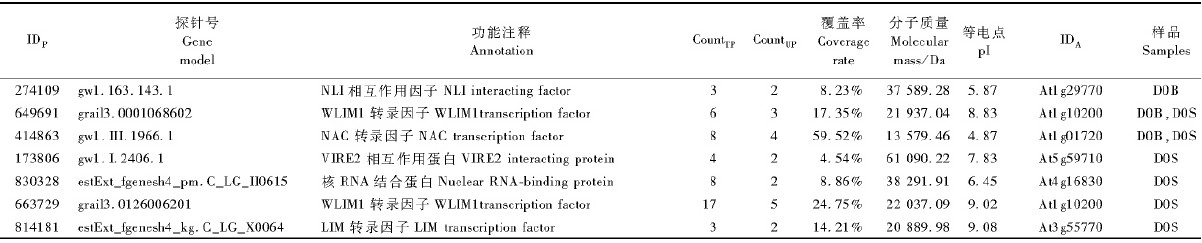
发现7个转录因子,只在D0S表达的3个,只在D0B表达的1个,2个部位都有表达的2个(表 3)。
|
|
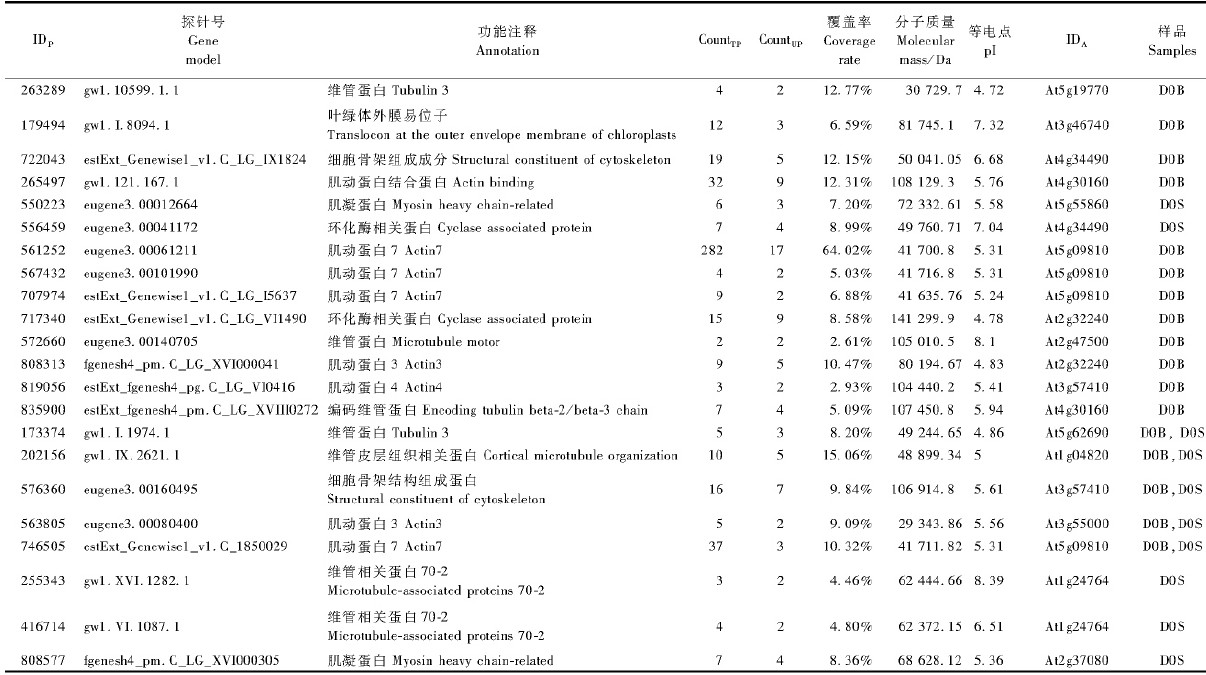
细胞骨架在细胞壁形成和细胞形态发生中起到重要作用,均与次生维管形成相关。本研究中发现22个可能与细胞骨架相关的蛋白质(表 4),其中肌动蛋白和微管蛋白数较多。
|
|
细胞信号转导主要研究生物体在受环境刺激时基因对细胞分化、增殖和发育过程的调节作用,包括环境刺激的分子途径、细胞感受及其在生物个体发育过程中如何调节基因表达和代谢生理反应。细胞信号转导相关蛋白质包括信号分子的合成与释放、CAMP受体、钙调素相关蛋白、肌醇磷脂信号通路相关蛋白、G蛋白结合蛋白和参与激素信号传递中的蛋白等。本研究中共发现31个与细胞信号转导相关蛋白质(表 5),其中钙调素蛋白和G 蛋白较多。
|
|
作为植物细胞特有的结构,细胞壁性质很大程度上决定着木材的材性。细胞壁主要成分是纤维和果胶,由胞间层、初生壁和次生壁3部分组成。细胞壁在发育阶段可能受环境的刺激,其组分的组成比例呈现动态变化(Chaffey,1999a; 1999b)。本研究鉴定到14个与细胞壁相关蛋白质(表 6)。
|
|
形成层的活动起自细胞分裂,同时Schrader等认为木质部细胞在成熟之前也具有一定的分裂能力(Schrader et al.,2004),因此D0B和D0S均含有具分裂能力的细胞,细胞分裂蛋白质(celldivision control protein,CDC)在2个样品中均有表达,可能与该类蛋白质在细胞分裂周期中的保守功能有关。此外,核内小分子GTP 结合蛋白质Ran 是一个基因表达调控子,它在真核生物中高度保守,参与调控细胞周期中各个时期的许多细胞生命活动(Clarke et al.,2001; Nicolás et al.,2001;Wiese et al.,2001)。Yano等(2006)在培养烟草(Nicotiana tabacum)细胞中发现,甲基CpG 结合GTPase-Ran 互作,影响细胞中染色体的移动达到调控细胞周期; 在本研究中,RanGTP(712385,837084,毛果杨蛋白质数据库蛋白质登录号,下同)蛋白质在D0B和D0S中均有表达,可能也与在细胞周期调控中的复杂机制有关。
3.2 转录因子相关蛋白质本研究鉴定出较多的转录因子,在D0S(未成熟木质部细胞)中鉴定到3个含LIM(Lin-Isl-Mecdomain)(814181,663729,649691)结构域的转录因子表达蛋白,推测含LIM 结构域的类转录因子参与未成熟木质部分化。同时,该部位还存在1个NLI(NLI include an N-terminal homodimerization domainand a C-terminal LIM interaction domain)转录复合子。研究表明,NLI在真核生物细胞发育的调节作用中功能保守,它主要促进启动子和增强子的长距离互作,并介导转录控制相关分子之间的关联,可能通过决定LIM 同源结构域蛋白的互作因子来调节转录活性(Protopopov et al.,2003)。因此,LIM同源结构域蛋白和NLI蛋白的同时存在进一步表明它们在未成熟木质部细胞发育的调控中具有重要作用。还发现NAC(NAM,ATAF1/2和CUC2)转录因子家族蛋白,这些具有转录活性调节结构域的蛋白质在次生维管发育中具有重要作用(Ohtani et al.,2011;Wang et al.,2011)。
3.3 细胞骨架相关蛋白质微管是细胞骨架的主要成分之一,对于细胞分裂和次生壁合成都有重要作用,同时在木质部形成过程中也起到重要作用(Chaffey et al.,1997)。本研究共鉴定了2个微管蛋白(173374,263289)。在高等植物中存在多种微管关联蛋白(Hussey et al.,2002),本研究中鉴定了2个微管关联蛋白MAP70家族成员(255343和416714),且均存在于未成熟木质部一侧(D0S),该结果与拟南芥木质化细胞中MAP70 调节细胞次生壁模式形成的现象一致(Pesquet et al.,2010),说明其与次生维管组织的分化、发育有关。此外鉴定了8个肌动蛋白,这些肌动蛋白及其调节蛋白均主要在D0B一侧存在,可能参与形成层细胞分裂过程。
3.4 信号转导相关蛋白质研究发现的蛋白质564011,编码一个黄素腺嘌呤二核苷酸结合蛋白(DIMINUTO)。在拟南芥中,通过研究diminuto 基因突变体发现: diminuto 基因影响微管蛋白基因TUB1 并影响植物细胞的伸长(Takahashi et al.,1995),且其同源基因dwarf1 负责在油菜素内酯合成途径前期将2,4-亚甲胆甾醇转化为菜油甾醇。蛋白质564011 仅在未成熟木质部表达,表明它可能通过参与油菜素内酯信号途径影响未成熟木质部细胞的扩张。此外,还存在14-3-3(551637和818454)和TRIP(720028和833555)等通过参与油菜素内酯信号途径来影响植物发育的蛋白质。
钙调素结合蛋白通常含有1个螺旋-卷曲-螺旋(helix-loop-helix)结构,1个或多个EF手型(EFhand)基序,这些感应元件通常在钙离子浓度瞬间增加时就感受到(Lecourieux et al.,2006)。作者所在实验室利用定性蛋白质组学和基因芯片的方法发现PtCaM 主要在形成层区域表达,表明它的功能可能与形成层的发生与活动密切相关(Du et al.,2006; Wang et al.,2009)。在鉴定的钙调素作用相关蛋白中,蛋白质648236 是谷氨酸脱羧酶,它与钙调素结合并调节植物发育的机制已经得到大量报道(Baum et al.,1993; Zik et al.,2006); 此外蛋白质736748和739211 均属于伴侣蛋白CPN20 家族,Yang等(2000)研究表明,CPN20 与钙调素的结合可能调节Rubisco 的组装,该蛋白质在形成层区域和未成熟木质部中均有表达。钙调素依赖蛋白酶(calcium-dependent protein kinase,CDPK)既可作钙感应器又可作效应器(Yang et al.,2003; Itoh et al.,2011),本研究中,413635属于CDPK 类的蛋白,表达于形成层区域,同时多种与钙调素存在相互作用的蛋白质也表达于该区域,因此大量与钙调素存在相互作用的物质可能共同参与形成层区域细胞的分裂和分化。
3.5 细胞壁形成相关蛋白质细胞壁主要是由纤维和果胶蛋白组成,次生壁主要是纤维素、微纤丝在初生壁纵向排列或随机排列堆积的结果,主要发生在木质部径向生长结束后(Plomion et al.,2001),研究这些组分是如何相互结合、相互作用并随着细胞分化和发育等植物的生理生化变化的,有利于揭示木材的形成机制。本研究中所鉴定的与纤维素合成有关的蛋白包括直接编码纤维素合酶类(246818)和葡糖醛酸脱氢酶(706198)以及多个纤维素合成基质,而仅获的2个木质素合成相关蛋白CCOAMT(649581)和COMT(824484)均只在D0S中表达; 在Zhang等(2011)建立的杨树次生维管系统转录组基因表达谱中也发现了这2个基因,研究结果也揭示了木质化作用主要发生于未成熟木质部一侧细胞。
在所鉴定到的仅在树皮内侧(D0B)存在的蛋白质380个和仅在树干表面(D0S)存在的蛋白质216个,与前人应用蛋白质组学的方法鉴定到的199个蛋白质进行了比较(Du et al.,2006),钙调素相关蛋白、木质素合成相关蛋白、NAC 转录因子和热激蛋白都得到鉴定,也充分说明了本研究系统的可靠性。本研究中还鉴定到几个新蛋白质,例如564011,246818,706198,814181,663729,649691等,这些新蛋白质需要做相应的具体功能研究。对鉴定的蛋白质定制抗体,采用蛋白质免疫组化的方法探索蛋白质的功能定位,对感兴趣的蛋白质做基因克隆和进一步的基因功能鉴定研究,为揭示木材形成调控机制提供基础。
本研究的取样方法,可以将形成层(位于D0B)与未成熟木质部(主要在D0S)分开,但其仍含有已经初步分化的木质部细胞。因此,本研究获得的D0B中特异表达的基因可能参与形成层细胞的分裂和初步分化,而在2个组织表达的基因可能主要参与未成熟木质部细胞的分化。获得的这些基因还包括大量的未知基因,需要进一步鉴定其在形成层活动(木材形成过程)中的作用。
| [1] |
陈军. 2006. 多维色谱法分析毛白杨次生维管系统再生过程的蛋白质表达谱. 北京: 中国林业科学研究院博士学位论文.( 2) 2)
|
| [2] |
Abraham P,Adams R,Giannone R J,et al. 2012. Defining the boundaries and characterizing the landscape of functional genome expression in vascular tissues of Populus using Shotgun Proteomics. Journal of Proteome Research,11(1):449-460.( 1) 1)
|
| [3] |
Allona I,Quinn M,Shoop E,et al. 1998. Analysis of xylem formation in pine by cDNA sequencing. PNAS,16(95):9693-9698.( 1) 1)
|
| [4] |
Baum G,Chen Y,Arazi T,et al. 1993. A plant glutamate decarboxylase containing a calmodulin binding domain. Cloning,sequence,and functional analysis. Journal of Biological Chemistry,268: 19610 - 19617.( 1) 1)
|
| [5] |
Celedon P A F,de Andrade A,Meireles K G X,et al. 2007. Proteomic analysis of the cambial region in juvenile Eucalyptus grandis at three ages. Proteomics,13(7):2258-2274.( 1) 1)
|
| [6] |
Chaffey N J,Barnett J R,Barlow P W. 1997. Visualization of the cytoskeleton within the secondary vascular system of hardwood species. Journal of Microscopy,187(2) :77-84.( 1) 1)
|
| [7] |
Chaffey N. 1999a. Cambium old challenges-new opportunities. Trees-Structure and Function,13(3):138-151.( 1) 1)
|
| [8] |
Chaffey N. 1999b. Wood formation in forest trees: from Arabidopsis to Zinnia. Trends in Plant Science,4: 203-204.( 1) 1)
|
| [9] |
Clarke P R,Zhang C. 2001. Ran GTPase: a master regulator of nuclear structure and function during the eukaryotic cell division cycle?. Trends in Cell Biology,11(9):366-371.( 1) 1)
|
| [10] |
Dolan L,Roberts K. 1995. Secondary thickening in roots of Arabidopsis thaliana: anatomy and cell surface changes. New Phytologist,131(1):121-128.( 1) 1)
|
| [11] |
Du Juan,Xie Hongli,Zhang Deqiang,et al. 2006. Regeneration of the secondary vascular system in poplar as a novel system to investigate gene expression by a proteomic approach. Proteomics,6(3):881 - 895.( 3) 3)
|
| [12] |
Durand T C,Sergeant K,Renaut J,et al. 2011. Poplar under drought: Comparison of leaf and cambial proteomic responses. Journal of Proteomics,74(8):1396-1410.( 1) 1)
|
| [13] |
Egertsdotter U,Zyl L M,MacKay J,et al. 2004. Gene expression during formation of earlywood and latewood in loblolly pine: expression profiles of 350 genes. Plant Biology,6(6):654-663.( 1) 1)
|
| [14] |
Fukuda H. 2004. Signals that control plant vascular cell differentiation. Nature Reviews Molecular Cell Biology,5: 379-391.( 1) 1)
|
| [15] |
Gion J M,Lalanne C,Provost G L,et al. 2005. The proteome of maritime pine wood forming tissue. Proteomics,5(14):3731-3751.( 1) 1)
|
| [16] |
Hussey P J,Hawkins T J,Igarashi H,et al. 2002. The plant cytoskeleton: recent advances in the study of the plant microtubule-associated proteins MAP-65,MAP-190 and the Xenopus MAP215-like protein, MOR1. Plant Molecular Biology,50(6):915-924.( 1) 1)
|
| [17] |
Itoh T,Nakata M,Ishida S,et al. 2011. The mechanism of substrate recognition of Ca2+ dependent protein kinases. Plant Signaling & Behavior,6(7):924-926.( 1) 1)
|
| [18] |
Käll L,Krogh A,Sonnhammer E L L. 2007. Advantages of combined transmembrane topology and signal peptide prediction—the Phobius web server. Nucl Acids Res,35(2):W429-W432.( 1) 1)
|
| [19] |
Lecourieux D,Ranjeva R,Pugin A. 2006. Calcium in plant defencesignalling pathways. New Phytologist,171(2):249-269.( 1) 1)
|
| [20] |
Lev-Yadun S,Wyatt S E,Flaishman M A. 2004. The inflorescence stem fibers of Arabidopsis thaliana Revoluta (ifl1) mutant. Journal of Plant Growth Regulation,23(4):301-306.( 1) 1)
|
| [21] |
Liu Zhongda,Duguay J,Ma Fengshan,et al. 2008. Modulation of eIF5A1 expression alters xylem abundance in Arabidopsis thaliana. Journal of Experimental Botany,59(4):939-950.( 1) 1)
|
| [22] |
Nicolás F J,Moore W J,Zhang C M,et al. 2001. XMog1,a nuclear Ranbinding protein in Xenopus, is a functional homologue of Schizosaccharomyces pombe Mog1p that co-operates with RanBP1 to control generation of Ran-GTP. J Cell Sci,114: 3013-3023.( 1) 1)
|
| [23] |
Oh S,Park S,Han K H. 2003. Transcriptional regulation of secondary growth in Arabidopsis thaliana. Journal of Experimental Botany,54(393):2709-2722.( 1) 1)
|
| [24] |
Ohtani M,Nishikubo N,Xu B,et al. 2011. A NAC domain protein family contributing to the regulation of wood formation in poplar. The Plant Journal,67(3) :499-512.( 1) 1)
|
| [25] |
Paux E,Tamasloukht M B,Ladouce N,et al. 2004. Identification of genes preferentially expressed during wood formation in Eucalyptus. Plant Molecular Biology,55(2):263-280.( 1) 1)
|
| [26] |
Pesquet E,Korolev A V,Calder G,et al. 2010. The microtubuleassociated protein AtMAP70-5 regulates secondary wall patterning in Arabidopsis wood cells. Current Biology,20(8):744-749.( 1) 1)
|
| [27] |
Plomion C,Leprovost G,Stokes A. 2001. Wood formation in trees. Plant Physiology,127(4):1513-1523.( 2) 2)
|
| [28] |
Protopopov A,Kashuba V,Zabarovska V I,et al. 2003. An integrated physical and gene map of the 3. 5-Mb chromosome 3p21. 3 (AP20) region implicated in major human epithelial malignancies. Cancer Research,63: 404-412.( 1) 1)
|
| [29] |
Sato Y,Yajima Y,Tokunaga N,et al. 2011. Comparison between tracheary element lignin formation and extracellular lignin-like substance formation during the culture of isolated Zinnia elegans mesophyll cells. Biologia,66(1):88-95.( 1) 1)
|
| [30] |
Schrader J,Nilsson J,Mellerowicz E,et al. 2004. A high-resolution transcript profile across the wood-forming meristem of poplar identifies potential regulators of cambial stem cell identity. Plant Cell,16(9):2278-2292.( 1) 1)
|
| [31] |
Sibout R,Plantegenet S,Hardtke C S. 2008. Flowering as a condition for xylem expansion in Arabidopsis hypocotyl and root. Current Biology, 18(6):458-463.( 1) 1)
|
| [32] |
Sterky F,Bhalerao R R,Unneberg P,et al. 2004. A Populus EST resource for plant functional genomics. Proceedings of the National Academy of Sciences of the United States of America,101 (38):13951 - 13956.( 1) 1)
|
| [33] |
Takahashi T,Gasch A,Nishizawa N,et al. 1995. The DIMINUTO gene of Arabidopsis is involved in regulating cell elongation. Genes Dev,9: 97-107.( 1) 1)
|
| [34] |
Trupiano D,Rocco M,Renzone G,et al. 2012. The proteome of Populus nigra woody root: response to bending. Annals of Botany,110(2):415-432.( 1) 1)
|
| [35] |
Wang M,Qi X,Zhao S,et al. 2009. Dynamic changes in transcripts during regeneration of the secondary vascular system in Populus tomentosa Carr. revealed by cDNA microarrays. BMC Genomics, 10: 215-221.( 2) 2)
|
| [36] |
Wang H,Zhao Q,Chen F,et al. 2011. NAC domain function and transcriptional control of a secondary cell wall master switch. The Plant Journal,68(6) :1104-1114.( 1) 1)
|
| [37] |
Whetten R,SunY H,Zhang Y,et al. 2001. Functional genomics and cell wall biosynthesis in loblolly pine. Plant Molecular Biology, 47(1 /2):275-291.( 1) 1)
|
| [38] |
Wiese C,Wilde A,Moore M S,et al. 2001. Role of importin-beta in coupling Ran to downstream targets in microtubule assembly. Science,291(5504):653-656.( 1) 1)
|
| [39] |
Yang J,Kamdem D P,Keathley D E,et al. 2004. Seasonal changes in gene expression at the sapwood-heartwood transition zone of black locust (Robinia pseudoacacia) revealed by cDNA microarray analysis. Tree Physiol,24(4):461-474.( 2) 2)
|
| [40] |
Yang T,Poovaiah B. 2003. Calcium/calmodulin-mediated signal network in plants. Trends in Plant Science,8(10):505-512.( 1) 1)
|
| [41] |
Yang T,Poovaiah B W. 2000. Arabidopsis chloroplast chaperonin 10 is a calmodulin-binding protein. Biochemical and Biophysical Research Communications,275(2):601-607.( 1) 1)
|
| [42] |
Yano A,Kodama Y,Koike A,et al. 2006. Interaction between methyl CpG-binding protein and Ran GTPase during cell division in tobacco cultured cells. Ann Bot,98(6):1179-1187.( 1) 1)
|
| [43] |
Zhao C,Craig J C,Petzold H E,et al. 2005. The xylem and phloem transcriptomes from secondary tissues of the Arabidopsis roothypocotyl. Plant Physiology,138(2):803-818.( 1) 1)
|
| [44] |
Zhang J,Gao G,Chen J J,et al. 2011. Molecular features of secondary vascular tissue regeneration after bark girdling in Populus. New Phytologist,192(4):869-884.( 1) 1)
|
| [45] |
Zik M,Fridmann-Sirkis Y,Fromm H. 2006. C-terminal residues of plant glutamate decarboxylase are required for oligomerization of a highmolecular weight complex and for activation by calcium/calmodulin. Biochimica et Biophysica Acta (BBA) -Proteins & Proteomics,1764 (5):872-876.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49