文章信息
- 田雨浓, 马伟, 韦庆慧, 韩旭洋, 罗帅, 陈旭日, 邱本军, 马玲
- Tian Yunong, Ma Wei, Wei Qinghui, Han Xuyang, Luo Shuai, Chen Xuri, Qiu Benjun, Ma Ling
- α-蒎烯对大麦虫体内解毒酶活性的影响
- Effects of α-pinene Fumigation on Detoxifying Enzymes Activities of Zophobas morio
- 林业科学, 2013, 49(4): 152-156
- Scientia Silvae Sinicae, 2013, 49(4): 152-156.
- DOI: 10.11707/j.1001-7488.20130423
-
文章历史
- 收稿日期:2012-07-05
- 修回日期:2013-02-16
-
作者相关文章
2. 黑龙江中医药大学 哈尔滨 150040
2. Chinese Medicine, Heilongjiang University Harbin 150040
当今人们的环保意识不断提高,寻找替代化学农药进行有害生物综合防治成为当今各国科研工作者关注的热门话题(Isman,2008; Rajendran et al.,2008)。随着精油类农药商品化的成功,这必将大力促进此类植物源农药的研制,可以预见植物精油用于植物病虫害的防治将是今后的发展趋势之一(袁海滨等,2007)。
α-蒎烯是一种植物体内挥发性有机化合物,具有杀虫和抑菌活性,是许多种植物精油活性成分的重要组成部分(凌育赵等,2006; Yang et al.,2006; 何益良等,2008)。已有研究表明,α-蒎烯对松纵坑切梢小蠹(Tomicus piniperda)和黑条木小蠹(Trypodendron lineatum)具有较强引诱作用(Schroeder,1988; Nordlander,1990; Schroeder et al.,1994; Czokajlo et al.,1999),对杂拟谷盗(Tribolium confusum)成虫有较强的触杀作用、驱避作用和熏蒸作用(吕建华等,2010)。α-蒎烯以及含有α-蒎烯的植物精油对储藏物害虫衣鱼(Lepisma saccharina)、大田害虫棉铃虫(Helicoverpa armigera)、斜纹夜蛾(Spodoptera litura)、土传病菌尖孢镰刀菌(Fusarium oxysporum)具有良好的控制作用(Wang et al.,2006; Sekine et al.,2007; Liu et al.,2008)。因此,α-蒎烯以及含有α-蒎烯的植物精油在有害生物防治领域具有很高的研究价值和广阔的开发利用前景,值得进一步深入研究。
大麦虫(Zophobas morio)俗称麦片虫、麦谷虫或超级面包虫,隶属于昆虫纲(Insecta)鞘翅目(Coleoptera)拟步行甲科(Tenebrionidae),是我国从东南亚国家引进的昆虫,通常将其作为昆虫试验材料进行生物学(Fleissner et al.,1993)、形态学(Kutsch et al.,1994)、分类学(Scofield et al.,1995)、酶学(Viviani et al.,2009)与环境学(苗少娟等,2010)等方面的研究。本研究测定了α-蒎烯对大麦虫4龄幼虫的生物活性,并就α-蒎烯对大麦虫体内羧酸酯酶(CarE)、酸式磷酸酯酶(ACP)、碱式磷酸酯酶(ALP)和谷胱甘肽S-转移酶(GSTs)活性的影响进行了探讨,旨在初步探明α-蒎烯对昆虫的杀虫机制,为开发环境友好、高效、安全的新型杀虫剂提供理论依据。
1 材料与方法 1.1 供试昆虫大麦虫和麦麸购自哈尔滨大发花鸟虫鱼市场。驯化15天后挑选健壮,大小、颜色一致的4龄幼虫用于试验。大麦虫置于温度(23 ±2)℃、相对湿度65%、光周期12 L: 12 D的生化培养箱中,用麦麸喂养。
1.2 主要试剂考马斯亮蓝G-250、牛血清白蛋白(BSA)、苯甲基磺酰氟(PMSF)、二硫苏糖醇(DTT)、乙二胺四乙酸(EDTA)、还原型谷胱甘肽(GST)、对硝基苯酚磷酸二钠(PNPP)和对硝基苯酚(p-Nitrophenol)均购自Amresco公司,1-氯-2,4-二硝基苯(CDNB)、固蓝B 盐(Fast blue B salt)、α-蒎烯均购自美国Sigma公司,α-乙酸萘酯(α-NA)均购自国药集团化学试剂有限公司。
1.3 大麦虫幼虫急性毒性测定采用广口瓶密闭熏蒸法(张海燕等,2004)进行毒性测定。以α-蒎烯对大麦虫幼虫48 h的LC50为基准,用蒸馏水配制亚致死浓度LC20,将健康、大小一致的大麦虫幼虫放入1 000 mL的广口瓶中,每处理15头,每个浓度3个重复,观察大麦虫的中毒症状并及时挑出死亡个体,分别于12,24,36,48 h后统计死亡数,以探针触碰试虫,试虫对机械刺激无反应者视为死亡,以不施药的12,24,36,48 h大麦虫幼虫为空白对照。
1.4 酶液制备随机选取3头大麦虫幼虫加10 mL预冷的提取液,玻璃匀浆器冰浴充分匀浆,于4 ℃高速离心,上清液即为酶液。ACP、ALP、GSTs和CarE所用匀浆液和离心参数如下: GSTs匀浆液为0.1mol·L-1 PBS(含1 mmol·L-1 EDTA-Na2、0.2 mmol·L-1 PMSF和0.2 mmol·L-1 DTT,pH 7.0),离心力为10 000×g,离心30 min。磷酸酯酶匀浆液为0.1mol·L-1 PBS(pH 7.0),离心力为10 000×g,离心15 min。CarE匀浆液为0.04 mol·L-1 PBS(pH 7.0),离心力为12 000×g,离心15 min。
1.5 酶活性测定蛋白质含量测定参照Bradford(1976)的考马斯亮蓝G-250法。
GSTs活性测定参照Booth等(1961)方法并略有改动。以CDNB为底物时,在测定试管中分别加入2.3 mL 0.1 mol·L-1 PBS(pH 6.5),0.5 mL 9mmol·L-1还原型谷胱甘肽(GSH)和0.03 mL酶液,0.1 mL 45 mol·L-1 DCNB 底物,在空白对照杯中以PBS代替正常酶,于340 nm波长处,用时间驱动程序在双光束紫外分光光度计上每隔0.5 min 记录1次OD340数值,共记录3 min。
CarE活性测定参照Van Asperen(1962)方法并略有改动。取0.002 mL待测酶液与1.8 mL 3×10-4 mol·L-1 α-NA混匀,于30 ℃水浴保温10 min,加入1 mL显色剂(1%固蓝B盐与5%十二烷基酸钠体积比为2: 5)终止反应,于600 nm波长下测定OD600值。
ACP活性测定参照马红梅等(2008)方法。在管中加入2.3 mL 0.1 mol·L-1 pH 4.6醋酸缓冲液和0.5 mL 7.5×10-3 mol·L-1 PNPP(pH 4.6),测定管分别加入0.08 mL酶液,摇匀,37 ℃水浴经常摇动,保温30 min后,用2 mL 0.1 mol·L-1 NaOH终止反应,空白管在终止反应后补加0.08 mL酶液,测定OD400值,重复3次。
ALP活力测定同ACP活力测定,用0.4 mol·L-1巴比妥钠-HCl缓冲液(pH 9.6)代替醋酸缓冲液,其余测定方法同酸性磷酸酯酶。
GSTs、CarE、ACP、ALP的酶活性均以每mg蛋白质每min分解底物的纳摩尔数表示(nmol·min-1mg-1 protein)。
1.6 数据统计分析采用POLO软件计算ACP、ALP、GSTs和CarE对大麦虫幼虫半致死浓度(LC50)、亚致死浓度(LC20)以及95%置信区间。用Excel绘图。运用SPSS 16.0软件对同一时间处理下不同浓度对酶活性影响采用Duncan氏方法进行显著性分析(α=0.05)。
2 结果与分析 2.1 α-蒎烯对大麦虫幼虫的急性毒性α-蒎烯对大麦虫幼虫48 h的毒力测定结果见表 1。
|
|
从表 1中可以看出,α-蒎烯对大麦虫幼虫12,24,36和48 h的LC50分别为86.886,79.274,39.313和21.435 μg·L-1,随着作用时间的延长半致死浓度LC50逐渐降低,表明α-蒎烯对大麦虫的毒性作用随时间增加逐渐加强。选择α-蒎烯48 h的LC50(21.435 μg·L-1)和48 h的LC20(12.140 μg·L-1)作为处理浓度,测定α-蒎烯对大麦虫幼虫解毒酶的影响。
2.2 中毒症状在熏杀试验中观察到,试虫接入广口瓶初期均表现出不同程度的兴奋症状,有的翻滚甚至跳跃,有的在广口瓶内快速爬行,随后渐趋缓慢,最后静止不动,有被麻醉的可能性存在。12,24,36,48 h分别观察时,处理组幼虫有的虫体渐渐变黑,并表现抽搐、痉挛,并伴有吐水现象,虫体失水变软,身体萎缩,最后死亡; 有的处理组试虫被麻醉但没完全死亡,用探针触碰试虫,不动或有迟钝的反应,根据症状分析应为麻醉之后苏醒的。
2.3 α-蒎烯对大麦虫幼虫体内解毒酶活性的影响1)对CarE的影响从图 1可以看出,2种浓度的α-蒎烯处理大麦虫幼虫12,24,36,48 h,亚致死浓度LC20、致死中浓度LC50处理组CarE活性均低于对照,各处理组对CarE均表现为抑制作用,且均达到显著水平。12,24,36,48 h各时间点,LC20的抑制率为19.14%~41.21%,LC50浓度的抑制率为36.79%~70.04%,LC50浓度各时间点的抑制率均高于LC20浓度各时间点的抑制率; 2种浓度的最大抑制率均出现在12 h时,抑制率分别为41.21%,70.04%。
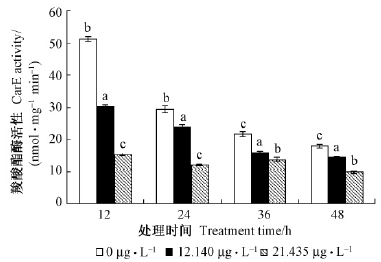 |
图 1 2种浓度的α-蒎烯对大麦虫幼虫体内CarE活性影响
Fig. 1 Effects of α-pinene on CarE activities in Z. morio larvae
图中数据为平均数±标准差。不同字母表示同一时间不同浓度间差异显著(Duncan 氏检验,P<0.05 ) ; 下同。Data in the figure are mean ± SD. Different letters above bars showed significant difference at the 0.05 level at the same time among different α-terpineol concentrations by Duncan’s test. The same below. |
2)对ACP的影响从图 2可以看出,LC20浓度处理大麦虫幼虫12,24,36,48 h,ACP活性均高于对照,表现为激活作用,分别为对照的1.38,2.26,1.12,1.33倍,除36 h外,其余各时间点均表现达到了显著水平; LC50浓度处理的大麦虫幼虫12,24,36 h,其体内ACP活性均高于对照,分别为对照的1.32,2.31,1.09倍,12,24 h表现为显著的激活作用,而36 h的激活作用未达到显著水平; LC50浓度处理48 h,ACP活性低于对照,表现为抑制作用,但未达到显著水平。
 |
图 2 2种浓度的α-蒎烯对大麦虫幼虫体内ACP 活性影响
Fig. 2 Effects of α-pinene on ACP activities in Z. morio larvae
|
3)对ALP的影响从图 3可以看出,2种浓度的α-蒎烯处理大麦虫幼虫12 h,处理组的ALP活性均高于对照,分别为对照的1.64,1.51倍,表现为显著激活作用。2种浓度处理大麦虫幼虫24,36 h和48 h,处理组ALP活性均低于对照,表现为抑制作用,除LC50浓度处理48 h外,其余均达到显著水平; 其中LC20浓度处理48 h的抑制作用最大,抑制率为45.17%,LC50浓度处理24 h的抑制作用最大,抑制率为50.41%。
 |
图 3 2种浓度的α-蒎烯对大麦虫幼虫体内ALP 活性影响
Fig. 3 Effects of α-pinene on ACP activities in Z. morio larvae
|
4)对GSTs的影响从图 4可以看出,2种浓度的α-蒎烯处理大麦虫幼虫12 h,处理组GSTs活性均高于对照,分别为对照的1.06,1.03倍,表现为激活作用,但都未达到显著水平; 处理24,36和48 h,LC20、LC50浓度处理组GSTs活性均低于对照,表现为抑制作用,除LC50浓度处理48 h外,其余均达到显著水平; LC20浓度处理48 h的抑制作用最大,抑制率为38.36%,LC50浓度处理24 h的抑制作用最大,抑制率为75.58%。
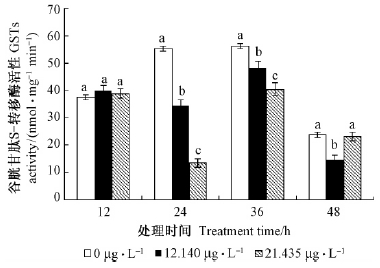 |
图 4 2种浓度的α-蒎烯对大麦虫幼虫体内GSTs活性影响
Fig. 4 Effects of α-pinene on GSTs activities in Z. morio larvae
|
CarE是昆虫体内重要的解毒酶系之一,一方面具有生理功能,代谢内源化合物,同时也具有防御功能,保护自身免受外来不利因子的为害(Yu et al.,1979)。有研究结果表明,大叶丁香(Eugenia caryophyllata)丙酮提取物对皮氏叶螨(Tetragchus piercei)CarE有抑制作用(陈青等,2004),竹提取物对棉铃虫幼虫CarE也有抑制作用(操海群等,2006)。本研究同样发现,LC20、LC50 2种浓度的α-蒎烯能抑制大麦虫幼虫体内CarE活性,且随着处理时间的延长,处理浓度的增大,对幼虫体内CarE的活性抑制作用逐渐增强。
磷酸酯酶是昆虫体内重要的代谢酶系,可参与多种生化反应,在昆虫生长发育及对外源毒物的解毒代谢方面均具有重要的作用。磷酸酯酶分为ACP和ALP 2种,ACP和ALP可分别在酸性和碱性条件下水解单核苷酸及核蛋白,为多种代谢过程提供磷酸盐离子(Senthil et al.,2005)。已有研究表明,某些植物源物质可诱导或抑制磷酸酯酶活性,如松油烯-4-醇能诱导家蝇(Musca domestica)成虫ACP活性增加,但抑制ALP的活性(马志卿等,2008),猪毛蒿(Artenisia scoparia)精油能抑制玉米象(Sitophilus zeamais)成虫的ACP和ALP的活性(尚利娜等,2010a)。本试验结果表明,LC20、LC50 2种浓度的α-蒎烯处理大麦虫幼虫,初期处理阶段,α-蒎烯刺激幼虫使其体内ALP的活性被逐渐诱导激活,随着处理时间的延长,ALP的活性有逐渐被抑制的趋势,最终使幼虫体内ALP的活性表现为被抑制的作用; 而幼虫体内ACP在高浓度(LC50)长时间(48 h)处理后,其体内的ACP表现出抑制作用。
GSTs是昆虫对杀虫药剂代谢中重要的共扼酶系之一,它催化内源性的GSH反应,对底物进行亲核共扼代谢,特别是许多有机磷化合物能被GSTs解毒(吕敏等,2003)。植物次生物质对该酶系的影响与其对昆虫的毒杀作用有关,如黄花蒿(A. annua)精油抑制玉米象成虫的GSTs的活性(尚利娜等,2010b),低剂量的β-细辛醚可诱导谷蠹成虫GSTs活性的增加,而高剂量的β-细辛醚抑制了GSTs的活性(宋旭红等,2008)。本研究结果表明,LC20、LC50 2种浓度的α-蒎烯处理大麦虫幼虫12h,其体内GSTs的活性被诱导增加,而处理24,36,48 h,抑制了其体内GSTs的活性。
经α-蒎烯处理的大麦虫,α-蒎烯能够影响幼虫体内CarE、ACP、ALP和GSTs的活性,并随着处理浓度的增加和时间的延长呈现了一定的浓度-时间效应,其体内的CarE、ACP、ALP和GSTs最终均表现为抑制的作用,幼虫体内的解毒作用被抑制,导致了幼虫本身生理机能下降,最终使幼虫死亡。这些酶参与了大麦虫幼虫对α-蒎烯的应答机制,而关于这些酶系基因水平与α-蒎烯的关系还有待进一步深入研究。
| [1] |
操海群, 岳永德, 彭镇华, 等. 2006. 竹提取物对棉铃虫幼虫体内几种酶系活性的影响. 林业科学, 42(7): 145-148.( 1) 1)
|
| [2] |
陈青, 杨卫帆, 覃丽金, 等. 2004. 大叶丁香丙酮提取物对皮氏叶螨的毒力及代谢酶活性的影响. 热带作物学报, 25(2 ): 33-36.( 1) 1)
|
| [3] |
何益良, 王黎明. 2008. α-蒎烯大气化学反应的研究进展. 化学研究, 19(2): 97-101.( 1) 1)
|
| [4] |
凌育赵, 曾满枝, 陈祖佑, 等. 2006. 沙姜挥发油化学成分的GC/MS 分析. 河南工业大学学报:自然科学版, 27(1) :75-76.( 1) 1)
|
| [5] |
吕建华, 林敏刚, 屠亚伟. 2010. α-蒎烯对杂拟谷盗成虫的控制作用. 中国粮油学报, 25(12): 88-91.( 1) 1)
|
| [6] |
吕敏, 刘惠霞, 吴文君. 2003. 谷胱甘肽S-转移酶与昆虫抗药性的关系. 昆虫知识, 43(3): 204-207.( 1) 1)
|
| [7] |
马红梅, 陈海婴, 柳小青, 等. 2008. 德国小蠊磷酸酯酶及谷胱甘肽S-转移酶生化特性的变化与抗药性的关系研究. 中国媒介生物学及控制杂志, 9(5): 422-423.( 1) 1)
|
| [8] |
马志卿, 冯俊涛, 郭志波, 等. 2008. 松油烯-4-醇对家蝇几种代谢酶及酚氧化酶的影响. 浙江大学学报:农业与生命科学版, 34(5): 509-515.( 1) 1)
|
| [9] |
苗少娟, 张雅林. 2010. 大麦虫Zophobas morio 对塑料的取食和降解作用研究. 环境昆虫学报, 32(4): 435-444.( 1) 1)
|
| [10] |
尚利娜, 袁海滨, 魏春艳, 等. 2010a. 猪毛蒿精油对玉米象体内4种解毒酶活力的抑制. 东北师大学报:自然科学版, 42(4): 116-120.( 1) 1)
|
| [11] |
尚利娜, 袁海滨, 魏春艳, 等. 2010b. 黄花蒿精油对玉米象成虫体内酶活力的影响. 吉林农业大学学报, 32(6): 616-621.( 1) 1)
|
| [12] |
宋旭红, 邱艳, 黄衍章, 等. 2008. β-细辛醚对谷蠹成虫体内四种酶活性的影响. 昆虫学报, 51(9): 986-991.( 1) 1)
|
| [13] |
袁海滨, 尚利娜, 赵炟焮, 等. 2007. 蒿属4种植物精油对绿豆象的杀虫活性测定. 吉林农业大学学报, 29(6): 612-61.( 1) 1)
|
| [14] |
张海燕, 邓勇学, 王进军, 等. 2004. 植物精油对谷蠹成虫熏蒸活性的研究. 西南农业大学学报:自然科学版, 26(2): 423-425.( 1) 1)
|
| [15] |
Bradford M M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding. Analytical Biochemistry, 72(2): 248-254.( 1) 1)
|
| [16] |
Booth J, Boyland E, Sims P. 1961. An enzyme from rat liver catalyzing conjugations with glutathione. Biochem J, 79(3): 516-524.( 1) 1)
|
| [17] |
Czokajlo D, Teale S A. 1999. Synergistic effectof ethanol to α-pinene in primary attraction of the larger pine shoot beetle, Tomicus piniperda. Journal of Chemical Ecology, 25(5): 1121-1130.( 1) 1)
|
| [18] |
Fleissner G, Fleissner G, Frisch B. 1993. A new type of putative nonvisual photoreceptors in the optic lobe of beetles. Cell and Tissue Research, 273(3): 435-445.( 1) 1)
|
| [19] |
Isman M B. 2008. Botanical insecticides: for richer, for poorer. Pest Management Science, 64(1): 8-11.( 1) 1)
|
| [20] |
Kutsch W, Urbach R, Breidbach O. 1994. Comparison of motor patterns in larval and adult stage of a beetle, Zophobas morio. Journal of Experimental Zoology, 267(4): 389-403.( 1) 1)
|
| [21] |
Liu X X, Chen Q B, Wang Z H, et al. 2008. Allelopathic effects of essential oil from Eucalyptus grandis × E. urophylla on pathogenic fungi and pest insects. Frontiers of Forestry in China, 3(2): 232-236.( 1) 1)
|
| [22] |
Nordlander G. 1990. Limonene inhibits attraction to α-pinene in the pine weevils Hylobius abietis and H. pinastri. Journal of Chemical Ecology, 16(4): 1307-1320.( 1) 1)
|
| [23] |
Rajendran S, Sriranjini V. 2008. Plant products as fumigants forstoredproduct insect control. Journal of Stored Products Research, 44(2): 126-135.( 1) 1)
|
| [24] |
Schroeder L M, Weslien J. 1994. Reduced offspring production in bark beetle Tomicus piniperda in pine bolts baited with ethanol and α- pinene, which attract antagonistic insects. Journal of Chemical Ecology, 20(7): 1429-1444.( 1) 1)
|
| [25] |
Schroeder L M. 1988. Attraction of the bark beetle Tomicus piniperda and some other bark- and wood-living beetles to the host volatiles α-pinene and ethanol. Entomologia Experimental et Applicata, 46(3): 203-210.( 1) 1)
|
| [26] |
Scofield A M, Witham P, Nash R J, et al. 1995. Castanospermine and other polyhydroxy alkaloids as inhibitors of insect glycosidases. Comparative Biochemistry and Physiology A Molecular & Integrative, 112(1): 187-196.( 1) 1)
|
| [27] |
Sekine T, Sμgano M, Majid A, et al. 2007. Antifungal effects of volatile compounds from black zira(Bunium persicum) and other spices and herbs. Journal of Chemical Ecology, 33(11): 2123-2132.( 1) 1)
|
| [28] |
Senthil N S, Kalaivani K, Murugan K, et al. 2005. The toxicity and physiological effect of neem limonoids on Cnaphalocrocis medinalis(Guene ) the rice leaf folder. Pesticide Biochemistry and Physiology, 81(2): 113-122.( 1) 1)
|
| [29] |
Van Asperen K. 1962. A study of housefly esterases by means of a sensitive colorimetric method. J Insect Physiol, 8(4): 401-414.( 1) 1)
|
| [30] |
Viviani V R, Prado R A, Arnoldi F C G, et al. 2009. An ancestral luciferase in the Malpighi tubules of a non-bioluminescent beetle. Photochemical & Photobiological Sciences, 8(1): 57-61.( 1) 1)
|
| [31] |
Wang S Y, Wan C L, Fang H C, et al. 2006. Essentialoil from the leaves of cryptomeria japonica acts as a silverfish(Lepisma saccharina) repellent and insecticide. Journal of Wood Science, 52(6): 522-526.( 1) 1)
|
| [32] |
Yu S J, Berry R E, Teniene L C. 1979. Host plant stimulation of detoxifying enzymes in a phophagous insect. Pestic Biochem Pysiol, 12(3): 280-284.( 1) 1)
|
| [33] |
Yang X W, Zhang P, Tao H Y, et al. 2006. GC-MS analysis of essential oil constituents from rhizome and root of Notopterygium forbesii. Journal of Chinese Pharmaceutical Sciences, 15(4): 200-205.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

