文章信息
- 应叶青, 杜旭华, 姜琴, 徐川梅, 吴家胜
- Ying Yeqing, Du Xuhua, Jiang Qin, Xu Chuanmei, Wu Jiasheng
- 干旱胁迫下毛竹根尖Ca2+分布及外源Ca2+作用机制
- Distribution of Ca2+ at the Tip of Phyllostachys edulis Root under Drought Stress and Physiological Functions of Exogenous Ca2+
- 林业科学, 2013, 49(4): 141-146
- Scientia Silvae Sinicae, 2013, 49(4): 141-146.
- DOI: 10.11707/j.1001-7488.20130421
-
文章历史
- 收稿日期:2012-12-15
- 修回日期:2013-02-27
-
作者相关文章
2. 浙江农林大学亚热带森林培育国家重点实验室培育基地 临安 311300;
3. 国家林业局竹子研究开发中心 杭州 310012
2. Nurturing Station for the State Key Laboratory of Subtropical Silviculture Zhejiang Agriculture and Forestry University Lin'an 311300;
3. China National Bamboo Research Center, State Forestry Administration Hangzhou 310012
Ca2+是植物细胞中重要的信号物质,参与许多逆境下生理信号的转导。植物干旱胁迫下产生的Ca2+信号,可通过与钙调蛋白等钙受体结合,放大信号并进行震荡传递,以此调节气孔关闭及活性氧的产生(Knight et al.,1997; Shinozaki,1997; 宗会等,2001),作出抵御逆境的有利反应。外源Ca2+能通过钙受体-三磷酸肌醇途径与植物体内钙信号产生偶联,从而发挥其生理调节作用(Han et al.,2003; Tang et al.,2007)。毛竹(Phyllostachys edulis)是我国南方重要经济树种,但生长进程中特别是秋季笋芽分化期经常会遭遇季节性干旱,致使毛竹的生长和竹笋的产量受到较大影响。目前,有关毛竹干旱胁迫的研究较少,主要集中在干旱对毛竹出笋(李龙有等,1987)、新竹生长(毛美红等,2012)和苗期生理特性影响(应叶青等,2011)等方面,而对于Ca2+调控毛竹的抗旱机制未见报道。本研究利用激光共聚焦显微技术研究干旱胁迫条件下毛竹根尖内Ca2+浓度的变化,探讨了外源Ca2+对毛竹抗旱相关酶防御系统的影响,为进一步研究Ca2+信号影响毛竹的抗旱生理机制奠定基础,并为施用外源钙缓解毛竹干旱胁迫提供理论依据。
1 材料与方法 1.1 苗木培养以种子培育毛竹实生苗用于根系Ca2+分布的观测。毛竹种子采自桂林同一单株,按GB2772-1999方法检验,净度为98.99%,千粒质量为13.645 g,含水量为12.2%。挑选饱满有光泽的毛竹种子剥掉种皮,温水(25 ℃)浸泡24 h,置于发芽盒内蒸馏水润湿的滤纸上,在恒温培养箱中培养(28 ℃ 16 h/25 ℃ 8 h,湿度70%),每天定时补充水分,更换滤纸,剔除霉烂和生长状态不良的幼苗。15天左右,幼根约1.5 cm时,用于PEG水培试验。
将前期按上述方法萌发并移栽于营养钵、生长相对一致的3年生毛竹实生苗用于盆栽试验。
1.2 试验处理试验处理分为水培和土培处理。水培试验选用PEG6000溶液模拟干旱,设置对照(0% PEG)、轻度胁迫(5% PEG)、中度胁迫(12.5% PEG)和重度胁迫(20% PEG)等4种处理,每个处理设置3重复,每重复3盆,干旱胁迫时间设置为5,10,15和20 min。
盆栽试验于2011年5月进行,设置对照(不添加试剂)、添加外源Ca2+处理(CaCl2)以及添加4种钙信号阻断剂处理,包括乙二醇-双-(2-氨基乙醚)四乙酸(EGTA),肝磷脂(heparin),三氯化镧(LaCl3)和氯丙嗪(CPZ)等。土壤水分控制在最大田间持水量的40%(称质量法控制),各种添加剂使用依据相关文献(刘娥娥等,2002; 高洪波等,2005),以土壤含水量为基数进行换算,每个处理设置3个重复,每个重复5盆。试验用样品选择每隔5天采样1次,连续采6次,于早上8点半随机取毛竹功能叶片放入冰盒带回实验室进行相关指标的测定。
1.3 Ca2+观察及酶活性测定Ca2+的观察采用荧光标记和激光共聚焦显微镜观察技术。选取各试验处理后毛竹根尖进行Ca2+荧光标记。标记方法参照相关文献(肖玉梅等,2004; Zhang et al.,1998),并有所改进。先将Fluo-3/AM(Molecular Probe,美国)溶于无水二甲基亚砜,使其浓度达到1 mmol·L-1,然后在体视显微镜下切下毛竹根尖(约5 mm)置于2-乙磺酸(MES)缓冲液中(含20 μmol·L-1Fluo-3AM),进行避光孵育(4 ℃,2 h/25 ℃,1 h)。最后将冲洗干净的根尖放在载玻片上,并加0.5 mL的缓冲液,用于激光共聚焦显微镜(LSM510)进行观察和扫描(激发波长488 nm,LP540 nm荧光收集)。扫描结果中Ca2+荧光的强弱及位置分别代表着Ca2+浓度大小及分布。
酶活性和生化物质含量测定主要依据相关文献(邹琦,2000; 李合生,2000)。丙二醛(MDA)含量采用硫代巴比妥酸法(TBA)测定; 超氧化物歧化酶(SOD)活性用NBT法,酶活性单位定义为将NBT的还原一直到对照一般时(50%)所需的酶量,以样品(鲜质量)所含总蛋白量计算酶活性; 过氧化物酶(POD)活性采用愈创木酚法,以样品(鲜质量)所含总蛋白量计算酶活性; 过氧化氢酶活性采用紫外吸收法测定。
1.4 数据统计分析数据分析采用SAS 9.1软件,绘图采用Sigmaplot软件进行。
2 结果与分析 2.1 干旱胁迫对毛竹根尖Ca2+强度和分布的影响1)毛竹根尖Ca2+分布特点毛竹的根尖结构从下至上依次可以分为根冠、分生区、伸长区和根毛区4个部分(图 1)。Ca2+荧光信号为绿色,绿色信号的强弱及分布区域代表Ca2+的多少及分布区域。
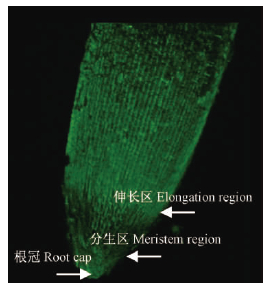 |
图 1 毛竹根尖Ca2+分布(× 10)
Fig. 1 The distribution of Ca2+ at the tip of Ph. edulis root( × 10)
|
图 1是激光共聚焦显微镜10倍物镜所拍摄图片,图 2是4倍物镜所拍摄的毛竹根尖不同层面的图片。由图 1可以看出: 根冠和伸长区分布有较多的Ca2+,分生区虽然也有Ca2+分布,但是明显较根冠和伸长区少。由图 2断层扫描结果同样可以看出: 分生组织区Ca2+荧光强度最弱(箭头所指),根冠和伸长区的Ca2+荧光强度较强。
 |
图 2 毛竹根尖不同层面Ca2+分布
Fig. 2 The distribution of Ca2 + in the different sections of Ph. edulis root tip
|
2)干旱胁迫对毛竹根尖Ca2+分布的影响从处理15min的结果看,干旱胁迫越强,毛竹根尖细胞质中Ca2+分布越多,而细胞壁和细胞膜上分布减少,而对照毛竹根尖细胞的Ca2+主要分布在细胞壁及细胞核上(图 3A)。轻度胁迫时(5%PEG)细胞膜上的Ca2+浓度减弱,而细胞质中开始出现Ca2+(图 3B); PEG 浓度达到12.5%时这种现象更明显(图 3C); 重度胁迫时(20%PEG),Ca2+已经比较均匀的充满了整个细胞质(图 3D)。干旱胁迫后Ca2+会汇集于细胞质中,干旱越严重,汇集越明显。
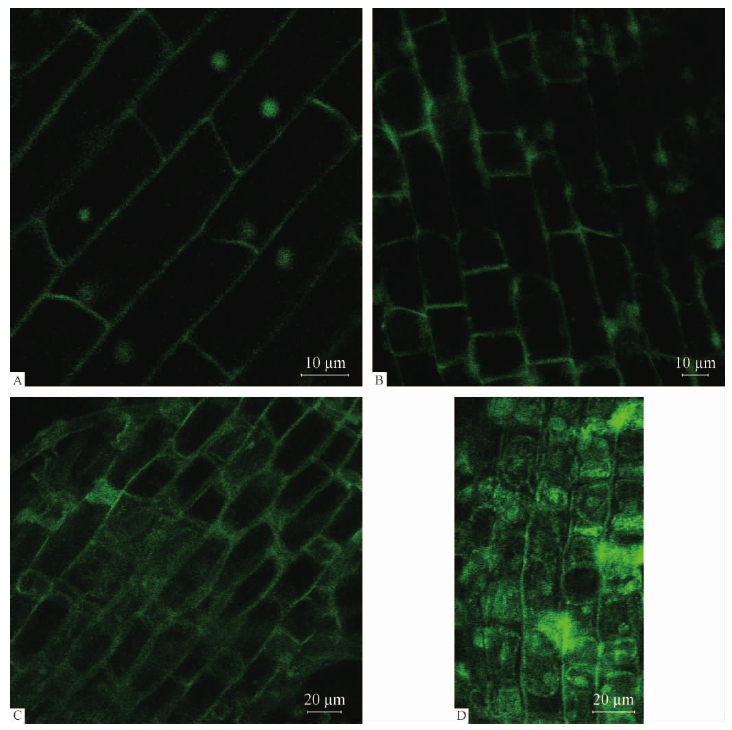 |
图 3 处理15 min后毛竹根尖Ca2+分布
Fig. 3 The distribution of Ca2+ at the tip of Ph. edulis root under 20% PEG (15min) A. 对照Control;B. 5% PEG; C. 12. 5% PEG; D. 20% PEG
|
3)干旱程度和时间对毛竹根尖Ca2+荧光强度的影响随干旱胁迫程度加剧,毛竹根尖Ca2+荧光强度不断提高,以20%PEG处理的Ca2+强度最大,并且随胁迫时间延长Ca2+荧光强度呈现先上升后下降的趋势,各胁迫处理的荧光强度均在15 min时最强,而对照处理的Ca2+荧光强度随胁迫时间延长基本不变,保持在65个单位(图 4)。方差分析表明: 同一胁迫时间点上各不同干旱胁迫处理与对照的Ca2+荧光强度差异均达到极显著水平(P<0.01)。这说明Ca2+对外界干旱胁迫作出了响应。另外,Ca2+荧光强度的大幅上升也暗示了胞外的Ca2+有可能通过各种通道进入了细胞内。
 |
图 4 干旱程度和时间对毛竹根尖的Ca2+强度影响
Fig. 4 The effect of drought stress level and stress time on the fluorescence intensity of Ca2+ at the tip of Ph. edulis root
|
1)外源Ca2+对细胞膜透性的影响相对电导率和MDA的含量变化能很好的表征细胞膜是否完好。随着干旱胁迫时间的延长,干旱胁迫处理(对照)以及干旱胁迫下添加外源Ca2+或抑制剂的处理,其电导率均呈现上升的趋势,处理25天后到达最大值;添加EGTA,heparin,LaCl3和CPZ等钙信号抑制剂处理,其各个时间点的相对电导率均显著高于对照(P<0.05),以heparin处理25天的相对电导率最高,超过对照10.1%。添加CaCl2的处理的相对电导率与对照相比,前期(15天)差异不显著(P>0.05),15天后显著低于对照组(P<0.05)(图 5)。这说明添加外源Ca2+一定时间后能显著降低膜透性,而钙信号的传导受到抑制后,膜透性增大,电导率显著上升。
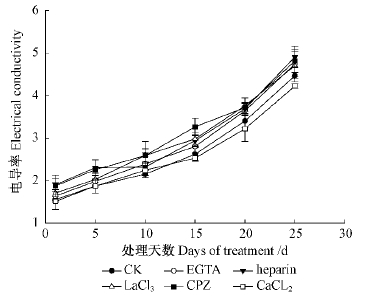 |
图 5 干旱胁迫下外源Ca2+及其信号抑制剂对毛竹叶片电导率的影响
Fig. 5 The effect of exogenous Ca2+ and its inhibitors on the electrical conductivity of Ph. edulis leaves under drought stress
|
随着干旱胁迫时间的延长,对照和其他处理的毛竹叶片MDA含量均呈上升趋势,处理25天时到达最大值。添加EGTA,GPZ和heparin等3种抑制剂处理,叶片MDA含量均显著高于对照(P<0.05),以EGTA处理25天时的MDA含量最高,达22.3 μmol·g-1,超出对照10.2%; 添加LaCl3抑制剂处理的MDA含量与对照相比差异不显著(P>0.05)。添加外源CaCl2的处理MDA含量,各时间点上均低于对照和抑制剂处理的MDA含量,差异达极显著水平(P<0.01)(图 6)。这说明外源Ca2+能一定程度缓解毛竹干旱胁迫引起的膜脂过氧化,产生较少的MDA,而多数钙信号抑制剂处理后会加剧膜脂过氧化,产生较多MDA,随处理时间延长,毛竹叶片的膜脂过氧化作用越明显,其膜结构和功能损坏越严重。
 |
图 6 不同处理对干旱胁迫下毛竹叶片MDA含量的影响
Fig. 6 The MDA content of Ph. edulis leaves with different treatment under drought stress
|
2)外源Ca2+和钙信号抑制剂对主要防御酶活性的影响随着干旱胁迫时间延长,对照和各处理的毛竹叶片的SOD活性均呈现上升趋势,处理25天时达到最大值。添加EGTA,heparin,LaCl3和CPZ等4种钙信号抑制剂处理,其各个时间点的SOD活性均极显著低于对照和CaCl2处理(P<0.01),以添加CPZ处理的SOD活性为最低,处理25天时仅有485 U·g-1,为对照的72.1%。添加外源CaCl2处理与对照间SOD活性差异显著(P<0.05)(图 7)。这说明添加CaCl2处理可能有利于干旱胁迫下毛竹叶片细胞膜SOD酶活性提高,而运用4种钙信号抑制剂阻断钙信号的传导后,则会显著降低细胞膜上SOD酶活性。
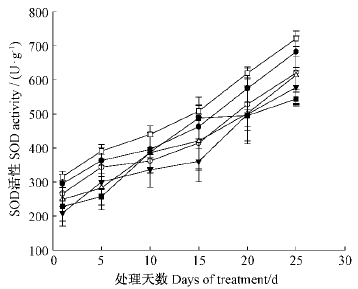 |
图 7 不同处理对干旱胁迫下毛竹叶片SOD活性
Fig. 7 The of SOD cutivity Ph. edulis leaves with different treatment MDA content under drought stress
|
片POD活性均呈现先上升后下降的趋势,其中对照和CaCl2处理的叶片POD活性均在15天时达到最大值,而EGTA,heparin,LaCl3和CPZ等4种钙信号抑制剂处理的POD活性则在20天达到最大值,随后逐渐下降。对照和CaCl2处理的叶片POD活性均高于4种抑制剂处理,15天时CaCl2处理以及heparin,LaCl3和CPZ抑制剂处理与对照间的差异均达到显著水平(P<0.05)(图 8),以CaCl2处理的POD活性为最大值,达到102.98 U·g-1 min-1,超过对照11.4%; 以LaCl3处理POD活性为最小值,仅有56.4 U·g-1 min-1,为对照的65.5%。15天时,EGTA抑制剂处理与对照间的POD活性差异不显著(P>0.05)。这说明heparin,LaCl3和CPZ抑制剂对POD影响显著,EGTA影响则相对较小。
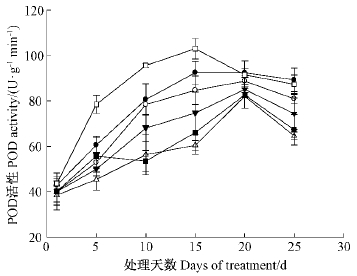 |
图 8 不同处理对干旱胁迫下毛竹叶片POD含量影响
Fig. 8 The POD activity of Ph. edulis leaves with different treatment under drought stress
|
钙信号抑制剂和CaCl2对毛竹叶片CAT的影响与对SOD影响较为相似。CAT活性随着处理时间均呈上升趋势,于25天时达到最大值。从第5天开始,4种钙信号抑制剂处理的CAT酶活性均极显著低于对照和CaCl2处理(P<0.01)。处理25天时EGTA抑制剂处理的CAT活性仅为3 395U·g-1min-1,为对照的60.2%。而从处理10天开始,CaCl2处理的CAT活性均要显著高于对照(P<0.05)(图 9)。这说明外源Ca2+能够有效提高细胞膜CAT活性,而添加钙信号抑制剂则会明显降低细胞膜CAT活性。
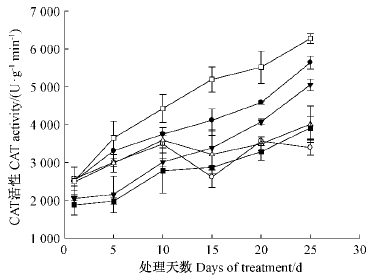 |
图 9 不同处理对干旱胁迫下毛竹叶片CAT活性的影响
Fig. 9 The CAT activity of Ph. edulis leaves with different treatment under drought stress
|
Ca2+是维持植物细胞正常生理功能的重要离子。外界胁迫后,植物细胞内Ca2+浓度会急剧升高,形成胞内外的浓度差,从而产生钙信号。钙信号在转导过程中一方面依靠浓度的震荡传递,另一方面依靠其下游的功能蛋白,如钙调蛋白、Ca2+感应器以及蛋白激酶/蛋白磷酸酶级联系统等,放大其信号,调控植物生长以适应胁迫环境(刘贯山等,2003; Smyth et al.,2006; Rozi et al.,2003)。Ca2+浓度的改变是钙信号转导系统的中心环节,外界胁迫所引发的最初反应几乎都是引起Ca2+浓度的升高(Hetheington et al.,2004)。本研究发现干旱胁迫下毛竹根尖的Ca2+呈不均匀分布,根尖的根冠和伸长区分布有较多Ca2+,分生区分布较少; 一定程度干旱胁迫后引起细胞内Ca2+浓度大幅升高,并且在Ca2+富集在细胞质内。细胞内游离Ca2+浓度的增加可能是胞外Ca2+通过专用通道的开启进入胞内的结果(Grabov et al.,1998)。
植物在干旱胁迫下会诱导SOD,POD,CAT等保护酶活性,以有效地清除自由基,保持体内活性氧的平衡,降低膜脂过氧化和MDA 积累量,增强植物的逆境适应性或抗性(Bolwer et al.,1992; Smirnoff et al.,1993; Scandalios et al.,1993)。适量的外源Ca2+供给能提高植物体内SOD,POD和CAT的活性或使之保持较高水平(Gong et al.,1995; 高洪波等,2005; 惠竹梅等,2007),降低电解渗解率和MDA含量(梁颖等,2001),稳定细胞膜电位(安国勇等,2002),缓解线粒体各项功能的伤害,以实现对逆境胁迫下植物细胞膜结构的保护(张召等,2012)。本试验中也发现干旱胁迫下毛竹叶片会诱导SOD,POD,CAT等保护酶活性,而且随干旱持续SOD,CAT活性都呈现上升趋势,POD则先上升后下降;添加外源Ca2+能显著提高POD,POD,CAT保护酶活性,降低电导率和MDA含量,而添加Ca2+信号抑制剂则使毛竹叶片的POD,SOD和CAT酶活性显著下降(仅EGTA对POD活性影响较小),电导率和MDA含量显著上升。说明毛竹抗旱性的形成受到Ca2+信号调控,而调节抗氧化保护酶活性是重要途径之一。因此,毛竹栽培生产面临季节性干旱时,可以适量使用外源钙肥,以缓解干旱胁迫的症状并提高毛竹生产力。
| [1] |
安国勇, 董发才, 胡楠, 等. 2002. 盐胁迫条件下钙对小麦根细胞膜电位和钾离子吸收的影响. 河南大学学报:自然科学版, 32(3): 25-28.( 1) 1)
|
| [2] |
高洪波, 郭世荣, 刘艳红, 等. 2005. 低氧胁迫下Ca2+、La3+和 EGTA 对网纹甜瓜幼苗活性氧代谢的影响. 南京农业大学学报, 28(2): 17-21.( 2) 2)
|
| [3] |
惠竹梅, 孙万金, 张振文. 2007. 外源Ca2+对水分胁迫下酿酒葡萄黑比诺主要抗旱生理指标的影响. 西北农林科技大学学报:自然科学版, 35 (9): 137-146.( 1) 1)
|
| [4] |
李合生, 孙群, 赵世杰, 等. 2000. 植物生理生化试验原理和技术. 北京: 高等教育出版社.( 1) 1)
|
| [5] |
李龙有, 张培新. 1987. 干旱和高温危害毛竹竹笋—幼竹生长初报. 竹子研究汇刊, 6(4): 55-59.( 1) 1)
|
| [6] |
梁颖, 王三根. 2001. Ca2+对低温下水稻幼苗膜的保护作用. 作物学报, 27(1): 59-63.( 1) 1)
|
| [7] |
刘娥娥, 宗会, 郭振飞, 等. 2002. 盐胁迫下LaCl3和CPZ 对稻苗抗氧化酶类活性的影响. 作物学报, 28(1): 42-46.( 1) 1)
|
| [8] |
刘贯山, 陈珈. 2003. 钙依赖蛋白激酶( CDPKs)在植物钙信号转导中的作用. 植物学通报, 20(2): 160-167.( 1) 1)
|
| [9] |
毛美红, 丁笑章, 傅柳方, 等. 2012. 干旱对毛竹林新竹成竹影响的调查分析. 世界竹藤通讯, 10(1): 12-16.( 1) 1)
|
| [10] |
肖玉梅, 陈玉玲, 黄荣峰, 等. 2004. 拟南芥保卫细胞微丝骨架的解聚可能参与了细胞外钙调素诱导的气孔关闭. 中国科学C 辑, 生命科学, 34(2): 129-135.( 1) 1)
|
| [11] |
应叶青, 郭璟, 魏建芬, 等. 2011. 干旱胁迫对毛竹幼苗生理特性的影响. 生态学杂志, 30(2): 262-266.( 1) 1)
|
| [12] |
张召, 梁元存, 王利, 等. 2012. 钙对酸化处理平邑甜茶根系抗氧化酶活性及线粒体功能的影响. 林业科学, 48(8): 87-93.( 1) 1)
|
| [13] |
宗会, 李明启. 2001. 钙信使在植物适应非生物逆境中的作用. 植物生理学通讯, 37(4): 330-335.( 1) 1)
|
| [14] |
邹琦. 2000. 植物生理学实验指导. 北京: 中国农业出版社.( 1) 1)
|
| [15] |
Bolwer C, Van Montagu M, Inze D. 1992. Superoxide dismutase and stress tolerance. Annu Rev Plant Physiol Plant Mol Bio, 43: 83-116.( 1) 1)
|
| [16] | Gong M, Chen S N, Song Y Q, et al. 1997. Effect of calcium and calmodulin on intrinsic heat tolerance in relation to antioxidant systems in maize seedling. Aust J Plant Physiol, 24(3): 371-379. |
| [17] |
Grabov A. 1998. Membrane voltage initiates calcium waves and potentiates calcium increase with abscisic acid in guard cells. Proc Natl Acad Sci USA, 95(8): 4778-4783.( 1) 1)
|
| [18] |
Han S, Tang R, Anderson L K, et al. 2003. A cell surface receptor mediates extracellular Ca2+ sensing in guard cells. Nature, 425(11): 196-200.( 1) 1)
|
| [19] |
Hetheington A M, Brownlee C. 2004. The generation of Ca2+signals in plants. Annu Rev Plant Biol, 55: 401-427.( 1) 1)
|
| [20] |
Knight H, Trewaras A J, Knight M R. 1997. Calcium signaling in Arabidopsis thaliana responding to drought and salinity. Plant J, 12(5): 1067-1068.( 1) 1)
|
| [21] |
Rozi A, Jia Y. 2003. A theoretical study of effects of cytosolic Ca2+ oscillations on activation of glycogen phosphorylase. Biophys Chem, 106(3): 193-202.( 1) 1)
|
| [22] |
Tang R H, Han S, Zheng H, et al. 2007. Coupling diurnal cytosolic Ca2+ oscillations to the CAS-IP3 pathway in Arabidopsis. Science Signalling, 315(5817): 1423-1426.( 1) 1)
|
| [23] |
Scandalios J G. 1993. Oxygen stress and superoxide dismutase. Plant Physiol, 101(1): 7-12.( 1) 1)
|
| [24] |
Shinozaki K, Yamaguchi-shinozaki K. 1997. Gene expression and signal transduction in water-stress response. Plant Physiol, 115(2): 327-334.( 1) 1)
|
| [25] |
Smirnoff N. 1993. The role of active oxygen in the response of plants to water deficit and desiccation. New Phytologist, 125(1): 27-58.( 1) 1)
|
| [26] |
Smyth J T, Dehaven W I, Jones B F, et al. 2006. Emerging perspectives in store-operated Ca2+entry: roles of Orai, Stim and TRP. Biochim. Biophys Acta, 1763(11): 1147-1160.( 1) 1)
|
| [27] |
Zhang W H, Zdenko R, John K. 1998. Determination of intracellular Ca2+in cells of intact wheat roots: loading of acetoxymethyl easter of Fluo-3 under low temperature. Plant Journal, 15(1): 147-151.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

