文章信息
- 欧阳乐军, 刘媛, 黄真池, 曾富华
- Ouyang Lejun, Liu Yuan, Huang Zhenchi, Zeng Fuhua
- 转TSRF 1基因尾叶桉的培育及其广谱抗病性
- Transformation of TSRF 1 into Eucalyptus urophylla and the Broad-Spectrum Disease Resistance of the Transgenic Plant to Diseases
- 林业科学, 2013, 49(4): 46-53
- Scientia Silvae Sinicae, 2013, 49(4): 46-53.
- DOI: 10.11707/j.1001-7488.20130407
-
文章历史
- 收稿日期:2012-08-29
- 修回日期:2012-10-16
-
作者相关文章
桉树原产澳大利亚,是桃金娘科(Myrtaceae)杯果木属(Angophora)、伞房属(Corymbia)和桉属(Eucalyptus)植物的统称,有1 039个种、亚种和变种。据统计,全世界桉树人工林面积超过2 000万hm2(Dibax et al.,2010)。由于桉树生长速度快、轮伐期短、耐干旱、耐瘦瘠、适应性广,且用途广泛,经济效益高,现已被世界近百个国家与地区引种,遍布于地中海地区、东南亚、美洲和非洲,目前已成为世界公认的三大人工林树种之一(Alcantara et al.,2011)。我国引种桉树已有100多年历史,在17个省(区)种植,每年新营造桉树林达30万hm2,到2011年,中国桉树人工林面积达到368万hm2,占全国人工林面积的6%以上,年生产木材近4 000万m3,占国内自主生产纸浆材的50%以上,每年带来的经济效益多达2 000亿元(杨民胜等,2011)。
随着大面积桉树纯林的营造,桉树青枯病等细菌性病害流行也愈加严重,成为桉树人工林发展的重大障碍(王艳丽等,2011)。由于利用化学方法进行防治效果不显著,加之对环境的副作用大,因此,培育广谱抗病新品种是解决问题的根本措施。桉属树种是异花授粉的多年生木本植物,杂种后代严重分离变异,利用基因工程育种可弥补常规育种技术的不足,缩短育种周期,加速优质、高抗新品种的选育进程(欧阳乐军等,2008)。本研究以尾叶桉(Eucalyptus urophylla)U6无菌种子苗下胚轴为外植体,通过对培养基的优化,建立该树种的组织培养再生体系,运用正交设计对影响尾叶桉遗传转化效率的影响因素进行了研究,建立尾叶桉遗传转化体系。将TSRF1基因转入尾叶桉,研究转基因植株抗病能力的变化,为桉树抗病转基因育种提供一定的参考。
1 试验材料 1.1 植物材料尾叶桉U6无性系种子由中国林业科学研究院桉树研究与开发中心提供。
1.2 菌种与质粒质粒pROK2、根癌农杆菌(Agrobacterium tumefaciens)LBA4404均由中国农业科学院生物技术研究所黄荣峰博士提供。pROK2质粒包含有TSRF1基因,该基因通过与植物抗病相关的顺式作用元件相互作用,调控下游抗病相关基因表达。
1.3 试剂新型脲类细胞分裂素(PBU)由本实验室李再峰教授提供; 2,4-二氯苯氧乙酸(2,4-D)、吲哚-3-丁酸(IBA)、萘乙酸(NAA)、吲哚乙酸(IAA)、6-苄基腺嘌呤(6-BA)、亚精胺(Spd)、腐胺(Put)、维生素C(Vc)、N-苯基-N'-1,2,3-噻二唑-5-脲(TDZ)、PCR试剂盒均购自生工生物工程(上海)有限公司,Southern杂交试剂盒购自Roche公司的DIG DNA Labeling and Detection Kit,其他试剂为国产分析纯。
2 试验方法 2.1 尾叶桉高效再生体系建立 2.1.1 愈伤组织的诱导尾叶桉无菌种子苗高3~5 cm时,将其下胚轴切成0.5~1.0 cm长的小段,接种于以MS+Vc 100 mg·L-1+蔗糖30 g·L-1+琼脂7 g·L-1为基本培养基、附加不同浓度梯度的6-BA和2,4-D或TDZ和2,4-D的培养基上,2周后统计愈伤组织诱导率。
2.1.2 不定芽的诱导及分化将长势良好的外植体转入不定芽诱导培养基上,基本培养基为BS(MS有机由B5有机替代)+腐胺500 μmol·L-1+亚精胺100 μmol·L-1+Vc 100 mg·L-1+蔗糖30 g·L-1+琼脂7 g·L-1,附加不同浓度梯度的6-BA,IBA和TDZ。10天左右更换新鲜培养基,25天后统计出芽率。
2.1.3 不同基本培养基以及植物生长调节剂对不定芽伸长的影响长度小于0.5 cm的短小芽丛转移到伸长培养基中,基本培养基为BS或1/2MS,附加Vc 100 mg·L-1、蔗糖30 g·L-1、琼脂7 g·L-1,以及不同浓度梯度的PBU和NAA,30天后观察不定芽伸长情况。
2.1.4 再生苗的生根将3~5 cm高的丛生芽切成单株后分别转入1/2MS培养基中,附加不同浓度梯度的IAA与NAA,20天后统计生根情况。
2.2 遗传转化体系优化的正交试验采用农杆菌介导法将含质粒pROK2的菌液浸染尾叶桉愈伤组织,按L9(34)正交表设计试验,用50 mg·L-1 Kan为抗生素筛选浓度,以抗性不定芽诱导率为指标,考察预培养时间(5,7,9天)、共培养时间(6,8,10天)、浸染时间(0.5,1.0,1.5天)、菌液OD值(0.5,0.6,0.7)4个因素对抗性不定芽诱导率的影响,每个因素设3个水平。
2.3 转基因植株的分子检测尾叶桉基因组DNA采用CTAB法微量提取。以拟转化植株基因组DNA为模板进行PCR检测,以质粒pROK2作阳性对照。用Roche公司DIG DNA Labeling and Detection Kit进行Southern杂交检测,操作步骤按说明书进行。
2.4 转基因尾叶桉的抗病性检测 2.4.1 转基因尾叶桉抗病接种待植株幼苗生长到5~6叶期,参照He等(1983)伤根浇注菌液接种法(土壤接种法青枯菌接种试验)。青枯病的病情指数及抗性级别计算方法参照华静月等(1984)的方法。
2.4.2 离体叶片抗病性调查将转化植株离体叶片用灭菌水冲洗干净,擦去叶片表面的水分后,放置在垫有多层滤纸的培养皿上,将带菌丝的疫霉菌小菌饼块紧贴在叶柄上,在25 ℃条件下保湿培养3天后,调查叶片发病情况。
2.4.3 转基因植株抗性相关酶活性测定注射器针筒尖端摩擦按压接种转基因植株的叶片72 h后,剪下植株叶片进行相关生理指标的测定。CAT,PAL,POD,PPO,SOD活性测定参考Agarwal(2007)的方法。H2O2,MDA含量测定参考Lin等(2000)的方法。
2.4.4 转基因植株TSRF1基因荧光定量PCR分析转基因植株分别接种青枯菌、疫霉菌和焦枯病菌12 h后,提取转基因植株总RNA,在BIO-RAD Real-TimePCR System上进行Real-time PCR分析,用相对定量的Pfaffl公式计算TSRF1基因扩增效率。
2.5 数据统计与分析每个试验处理均设置5个重复。培养条件为温度(25±2)℃,光照强度约32.5 μmol·m-2 s-1,光照时间12 h·d-1。数据利用SAS分析软件进行处理,文中百分率数据分析时经过正弦平方根转换。
3结果与分析 3.1 尾叶桉高效再生体系建立 3.1.1 愈伤组织的诱导由表 1可知,在不同浓度的植物生长调节剂组合处理下的愈伤组织诱导率差异达到显著水平。当6-BA浓度为0.6 mg·L-1、2,4-D 浓度为0.1 mg·L-1时,愈伤组织呈现活力最好的淡绿色,愈伤组织诱导率达到95.0%,外植体褐化率最低。在不同浓度的2,4-D与TDZ组合诱导下,愈伤组织的诱导率为38.3%~96.7%; 当2,4-D 0.1 mg·L-1、TDZ为2 μmol·L-1时愈伤组织诱导率达到96.7%,但愈伤组织呈白色和黄色,活力不如6-BA与2,4-D组合处理的好,且有玻璃化愈伤组织产生,不利于后续芽的分化。
|
|
不同浓度的植物生长调节剂组合对不定芽的诱导率差异显著(表 2)。IBA浓度过高时不利于芽的诱导,最适浓度为0.2mg·L-1。当TDZ为5 μmol·L-1时,诱芽率略有降低,优胜芽率明显下降。当TDZ为3 μmol·L-1、6-BA为0.5 mg·L-1时,诱芽率最高可达66.7%,优胜芽率也能达到51.7%。
|
|
由表 3可知,NAA和PBU所有浓度组合均能使短小芽丛伸长,在NAA浓度0.05 mg·L-1时,芽苗生长情况较好。相对于BS基本培养基,1/2MS对不定芽的诱导效果要好;1/2MS培养基添加0.6 mg·L-1的PBU及0.05mg·L-1的NAA,伸长达到2.0 cm以上的不定芽比率达到82.3%,且增殖的芽丛数也较多,叶片嫩绿。
|
|
由表 4可知,不定芽在接种第9~10天开始生根,第12~13天出根达到高峰期。当NAA为0.5 mg·L-1,IAA为0.2 mg·L-1时,平均生根数达到9.6条,平均根长达到2.5~3.0 cm,为较好的诱导生根的植物生长调节剂组合。
|
|
遗传转化参数优化的正交试验结果见表 5。各因素不同水平的抗性不定芽诱导率不同,其中组合6为最佳水平组合,抗性不定芽诱导率高达52.8%。各因素对不定芽诱导率的影响大小依次为共培养时间>预培养时间>浸染时间>菌液浓度,其中共培养时间对不定芽诱导率的影响最显著,而菌液浓度影响最小。最优组合为A2B3C1D2,即预培养7天、菌液浓度0.7、浸染0.5 h和共培养8天。
|
|
应用方差分析法(表 6)可知: 试验设计的共培养时间、预培养时间2个因素对抗性不定芽的诱导率有极显著影响; 菌液浓度、浸染时间在不同水平下对抗性不定芽的诱导率差异也达到显著水平。
|
|
经农杆菌浸染后的愈伤组织(图 1A,B)转入抗性不定芽诱导(图 1C),再经不定芽增殖(图 1D)、伸长(图 1E,F)以及生根培养(图 1G),最后移栽得到完整的再生植株(图 1H)。
 |
图 1 尾叶桉的遗传转化
Fig. 1 The genetic transformation procedures of E. urophylla
A,B. 愈伤组织; C. 不定芽诱导; D. 不定芽的增殖; E,F. 不定芽伸长; G. 生根; H. 移栽。 A, B. Callus inoculated; C. Induction of resistance shoots; D. Differentiation of resistant adventitious buds; E, F. Elongation of resistant shoots; G. Rooting of elongated shoot; H. Plants in a plastic pot in greenhouse. |
任意选取20株拟转化植株,进行PCR检测,结果发现共有4株转化植株扩增到目的条带,PCR阳性率为20%(图 2A)。图 2B中PCR-Southern blotting检测结果表明,杂交膜上含有能显色的目的基因片段,大小为250 bp,说明目的基因已插入到尾叶桉基因组中。
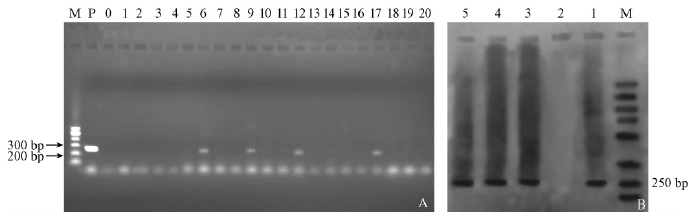 |
图 2 拟转基因尾叶桉的分子检测
Fig. 2 Detection of some putative transgenic E. urophylla
A: 拟转基因尾叶桉的PCR 检测M: 100 bp ladder Marker; O: 阴性对照; P: 阳性对照; 1-20: 转基因植株。B: 转基因尾叶桉PCR- Southern blotting 检测M: DL5000 bp Marker; 1: 阳性对照; 2: 阴性对照; 3-5: TSRF1条带。 A: PCR detection of some putative transgenic E. urophylla M: 100 bp ladder Marker; O: Non-transgenic plant; P: Positive control; 1-20: Transgenic plants. B: The PCR- Southern blotting detection of transformed E. urophylla M: DL5000 bp Marker; 1: Positive control; 2: Negative control; 3-5: TSRF1 gene. |
使用伤根接种的方法接种青枯菌。接种3天后,非转基因植株开始发病(图 3),转基因植株则在接种后第7天出现发病株。对照植株在接种12天时病情指数达到86.5,发病率为100%,其中86.7%的植株全株枯萎死亡。而转基因植株病情指数在接种19天时为55.4,存活率达到54.5%,转基因尾叶桉较对照提高2~2.9个抗性级别,评价为中等抗病水平。
 |
图 3 青枯菌接种3天后致病情况
Fig. 3 The incidence investigation of E. urophylla's leaves
in the 3th day after inoculation with Ralstonia solanacearum
NT: 非转基因植株Non-transgenic E. urophylla; T: 转基因植株Transgenic E. urophylla. |
未转基因尾叶桉离体叶片接种疫霉菌3天后,开始表现出病症,叶片出现明显的水渍状,而转TSRF1尾叶桉叶片无致病症状出现。直到6天后,转基因植株才在与病菌接触的叶柄附近出现水渍症状病症,而此时未转基因植株病症明显,整个叶片腐烂。
3.5 转基因植株酶活性测定转基因尾叶桉叶片接种青枯菌后,CAT活性由229.1 U·g-1 FW降低到152.3 U·g-1 FW,降到原来的33.5%,POD活性由89.0 U·g-1 FW降低到75.0 U·g-1 FW,降到原来的15.7%;而SOD活性由114.5 U·g-1 FW升高到174.3 U·g-1 FW,增幅为50.4%,PPO和PAL活性均比没有接种的植株有所提高,差异达到极显著水平(图 4)。转基因植株接种青枯菌后,H2O2含量增幅30%以上,MDA含量则由2.42 μmol·g-1 FW降低到1.4 μmol·g-1FW,降幅为70%(图 4)。
 |
图 4 尾叶桉相关生理指标变化
Fig. 4 The change of the physiological indexes of E. urophylla
NT: 非转基因植株; T: 转基因植株; T-Rs: 接种青枯菌的转基因植株; SOD: 超氧化物歧化酶; CAT:过氧化氢酶; PPO: 多酚氧化酶; PAL: 苯丙氨酸解氨酶; POD: 过氧化物酶;H2 O2 : 过氧化氢;MDA:丙二醛。不同字母表示差异极显著( P < 0. 01)。 NT: Non-transformed E.urophylla; T: Transgenic E.urophylla; T-Rs: Transgenic plants inoculated with R. solanacearum; SOD: Superoxide dismutase; CAT: Catalase; PPO: Polyphenol oxidase; PAL: Phenylalanine ammonia-lyase; POD: Peroxidase; H2O2 : Hydrogen peroxide; MDA: Malondialdehyde.Different letters indicate the significant difference( P<0.01) . |
转基因植株接种致病后,TSRF1基因转录效率都得到一定量的提高(图 5)。其中接种青枯菌12 h后,TSRF1基因转录效率提高到本底表达的9.1倍,最低是接种水杨酸,也提高了6.5倍。
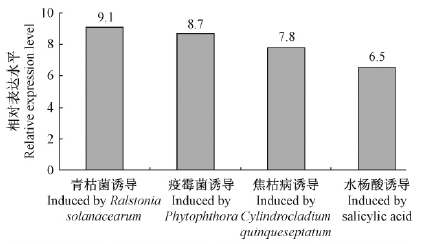 |
图 5 TSRF1基因表达特性分析
Fig. 5 Induced expression characteristics analysis of TSRF1 gene
|
桉树转基因成功的关键在于建立高效的组织培养再生体系和遗传转化体系。桉树是多年生木本植物,其细胞返幼状态差,难以脱分化,也难于分化成芽,外植体也极易褐化,因此,在组织培养中诱导愈伤组织形成和分化均有较大难度。本实验室利用PBU和其他植物生长调节剂组合成功建立了尾巨桉(Eucalyptus urophylla×E. gr and is)、广州一号桉(E. urophylla×E. tereticornis‘Guangzhou No.1’)等的高效再生体系(欧阳乐军等,2011; 2012),不定芽诱导率都可达到90%以上。在本试验中,通过优化不同浓度及种类的植物生长调节剂组合,尾叶桉愈伤组织诱导率达到95%以上,且活力旺盛,后续不定芽的分化与增殖较好,生根及移栽成活率均可达到95%以上。
研究表明,农杆菌转化植物细胞是一复杂的过程,最初是农杆菌对植物细胞的附着,接着是农杆菌的vir基因受诱导活化,最后是T-DNA的转移以及在植物细胞核基因组中的整合与表达等,因此,外植体的基因型及生理状态、农杆菌菌液浓度及浸染时间等都对外源基因转化效率有较大的影响(王关林等,2002)。本研究中通过正交试验优化遗传转化参数,建立了尾叶桉遗传转化体系,抗性芽的诱导率可达到50%左右,经PCR和Southern blotting检测结果表明,阳性植株比率达到20%,高于本试验前期报道的结果(Ouyang et al.,2012)。研究发现,预培养7天时外植体脱分化旺盛,形成胚性愈伤组织,是良好的感受态细胞,此时,农杆菌可以很容易和分裂细胞结合,提高转化效率; 同时,通过7天预培养,外植体伤口愈合,两端形成亚铃状的突起,从而降低了农杆菌对外植体的伤害,外植体褐化死亡减少,有利于抗性芽的分化。共培养时间也是影响转化效率的一个重要因素,通过适宜时间的共培养,防止农杆菌过度生长影响外植体的活力,减轻外植体与农杆菌长时间接触而受伤害程度; 同时,适宜时间的共培养也可避免农杆菌与外植体接触不充分而降低转化效率。本研究中发现,在尾叶桉遗传转化体系中,共培养8天时,有利农杆菌充分整合到外植体脱分化细胞,进而降低假阳性植株的比率,提高转化效率。浸染时间和菌液浓度对转化也有一定的影响,适宜的浸染时间和菌液浓度既可避免农杆菌对植物细胞的毒害作用又可使菌液与外植体充分接触,提高转化率。在本研究中,农杆菌菌液浓度在OD600=0.7,浸染0.5 h时,转化率最高。
危害桉树的病害种类很多,其中青枯病、焦枯病、灰霉病、茎腐病等细菌型和真菌型病害最为严重,而具广谱性抗病的目的基因太少,转化的抗病基因抗病范围有限,抗病范围过窄,一种基因只对个别的病原产生抗性,因此应选用具广谱抗病性基因,扩大抗病范围,提高转基因桉树的综合抗病的能力和实际应用效果。研究表明TSRF1通过与植物抗病相关的顺式作用元件相互作用,调控下游相关抗病基因表达,参与植物抗病相关的乙烯、水杨酸和茉莉素信号途径和ABA 信号途径的调控(张洪博,2005)。本研究中转TSRF1基因尾叶桉接种细菌性病原体青枯菌后,表现发病延迟,抗性提高,较对照最高可提高2.9个抗性级别; 而对真病型病原体疫霉菌的离体叶片抗性接种结果也表明转TSRF1尾叶桉抗性比非转基因植株明显要强,发病延迟,病症减轻。
大量研究证实,SOD、PAL、PPO等是与植物抗病性密切相关的酶,是植物抗逆性强弱的指标之一。研究表明,当生物或非生物逆境作用于植物时往往引起植物细胞中的氧化爆发(Bestwick et al.,1997)。然而过量的活性氧会造成氧化胁迫,使细胞产生细胞水平和分子水平上的不可逆损伤。植株体内的保护酶系统又不断清除活性氧,使得植物体内活性氧代谢维持在平衡状态。本研究发现,转基因尾叶桉接种青枯菌后SOD活性增幅达50%以上,PPO和PAL活性均与没有接种的植株差异达到极显著水平,通过酶活性的提高有效缓解了接种病菌对植株造成的伤害(Fletcher et al.,2006)。曾富华等(2005)报道H2O2可做为抗病信号,能激活植物与抗病相关的代谢过程,增强抗病能力。本试验中的转基因植株接种青枯菌后,MDA含量大幅下降,使得H2O2含量增加30%以上,从而可能激活了植株与抗病相关的代谢过程,增强抗病能力。荧光定量PCR结果也表明,转基因植株接种致病菌后,TSRF1基因转录效率都得到一定量的提高,且表现出对多种致病因子应答,最高转录表达倍数可提高近10倍左右。上述研究结果初步表明TSRF1基因能在一定程度提高植株的广谱抗病能力。
| [1] |
华静月, 张长龄, 何礼远. 1984. 我国植物青枯菌的生化型和其他生理差异. 植物保护学报, 11(1): 43-50.( 1) 1)
|
| [2] |
欧阳乐军, 黄真池, 沙月娥, 等. 2011. 新型分裂素PBU 对尾巨桉胚性愈伤组织诱导及植株再生的影响. 植物生理学报, 47(8 ): 785-791.( 1) 1)
|
| [3] |
欧阳乐军, 沙月娥, 黄真池, 等. 2012. 广州一号桉树高效组培再生体系的建立. 东北林业大学学报, 40(7): 14-17.( 1) 1)
|
| [4] |
欧阳乐军, 曾富华. 2008. 桉树分子育种研究进展. 分子植物育种, 6(6): 1146-4452.( 1) 1)
|
| [5] |
王关林, 方宏筠. 2002. 植物基因工程. 2版. 北京: 科学出版社.( 1) 1)
|
| [6] |
王艳丽, 李正楠, 李会平, 等. 2011. 桉树抗青枯病的鉴定技术. 林业科学, 47(6): 101-107.( 1) 1)
|
| [7] |
杨民胜, 谢耀坚, 刘杰锋. 2011. 中国桉树研究三十年. 北京: 中国林业出版社.( 1) 1)
|
| [8] |
张洪博. 2005. ERF 转录因子TSRF1的功能分析. 北京: 中国农业大学博士学位论文, 58-59.( 1) 1)
|
| [9] |
曾富华, 易克, 徐向丽, 等. 2005. 不同诱导处理后水稻悬浮细胞的活性氧变化与有关酶系的关系. 作物学报, 31(1): 18-23.( 1) 1)
|
| [10] |
Agarwal S. 2007. Increased antioxidant activity in Cassia seedlings under UV-B radiation. Biologia Plantarum, 51(1): 157-160.( 1) 1)
|
| [11] |
Alcantara G B, Bespalhok Filho J C, Quoirin M. 2011. Organogenesis and transient genetic transformation of the hybrid Eucalyptus grandis × Eucalyptus urophylla. Sci Agric, 68(2): 246-251.( 1) 1)
|
| [12] |
Bestwick C S, Brown I R, Bennett M H, et al. 1997. Localization of hydrogen peroxide accumulation during the hypersensitive reaction of lettuce cells to Pseudomonas syringae pv phaseolicola. Plant Cell, 9(2): 209-221.( 1) 1)
|
| [13] |
Dibax R, Deschamps C, Bespalhok Filho J C, et al. 2010. Organogenesis and Agrobacterium tumefaciens-mediated transformation of Eucalyptus saligna with P5CS gene. Biol Plantarum, 54(1): 6-12.( 1) 1)
|
| [14] |
Fletcher J, Bender C, Budowle B, et al. 2006. Plant pathogen forensics: capabilities, needs, and recommendations. Microbiol Mol Biol Rev, 70(2): 450-471.( 1) 1)
|
| [15] |
He L Y, Sequeira L, Kelman A. 1983. Characteristics of strains of Pseudomonas solancearum from China. Plant Disease, 67( 12 ): 1357-1361.( 1) 1)
|
| [16] |
Lin C C, Kao C H. 2000. Effect of NaCl stress on H2O2 metabolism in rice leaves. Plant Growth Regulation, 30(2): 151-155.( 1) 1)
|
| [17] |
Ouyang L J, He W H, Huang Z C, et al. 2012. Introduction of the Rs- AFP2 gene into Eucalyptus urophylla for resistance to Phytophthora capsici. Journal of Tropical Forest Science, 24(2): 198-208.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

