文章信息
- 尚峰男, 宋少宇, 田菊, 王君
- Shang Fengnan, Song Shaoyu, Tian Ju, Wang Jun
- 油松离体花粉管的生长及微丝骨架分布
- In Vitro Pollen Tube Growth and Distribution of Microfilaments in Pollen Tube of Pinus tabulaeformis
- 林业科学, 2013, 49(4): 34-38
- Scientia Silvae Sinicae, 2013, 49(4): 34-38.
- DOI: 10.11707/j.1001-7488.20130405
-
文章历史
- 收稿日期:2012-09-04
- 修回日期:2012-10-19
-
作者相关文章
2. 北京林业大学林学院 北京 100083
2. College of Forestry, Beijing Forestry University Beijing 100083
针叶树作为北半球重要的造林树种,在世界木材资源供给、生态环境维持等方面占据重要地位。油松(Pinus tabulaeformis)是我国重要乡土针叶树种,其适应性强,耐瘠薄,材质优良,在维持地区生态系统稳定及水土保持等方面发挥着重要作用(李伟等,2012)。随着国家对林木良种利用的日益重视,加强油松遗传改良对于保障我国林业资源安全、提高森林生产力、维持生态平衡价值巨大。田菊等(2012)对油松花粉离体培养条件进行了系统研究,成功筛选出适宜的液体培养基成分配比及培养温度,为深入研究油松花粉贮藏、推进油松种子园育种工作奠定了基础。
植物借助花粉管将雄配子传递到受精部位,是有性生殖的重要环节,对于植物种世代繁衍意义重大。花粉萌发和花粉管的生长是一个复杂的系统工程。其中微丝骨架作为花粉管的重要组成成分,在维持花粉管顶端生长(Taylor et al.,1997; Hepler et al.,2001)、细胞质及细胞器的运动(Vidali et al.,2001)以及细胞信号转导(Volkmann et al.,1999)等方面起着重要作用。目前尚缺乏有关油松花粉管内细胞骨架分布的相关研究。因此,本研究以油松花粉为材料,对离体培养条件下,其花粉萌发特征及管内微丝骨架分布规律进行了系统研究,为进一步开展油松遗传改良及细胞生物学研究奠定基础。
1 材料与方法 1.1 试验材料花粉采集于北京林业大学校园内生长健壮的油松单株,待其处于散粉期时,采集刚开始散粉的雄球花,置于室内自然干燥,收集花粉,-20 ℃保存。
1.2 研究方法 1.2.1 花粉离体萌发根据田菊等(2012)所确定的油松花粉离体萌发最佳培养条件,采用液体培养法,将10 mg油松花粉置于含2.00%蔗糖+0.075%硼酸+0.005% Ca(NO3)2的1 mL培养基中,26 ℃下光照振荡培养,重复3次。分别于培养12,18,24,36,48,60,72,84,96,108,120 h对花粉萌发率、花粉管长度及异形花粉管频率进行统计。每重复随机观察5个视野,统计花粉总数不少于300粒。花粉萌发率=(萌发花粉数/花粉粒总数)×100%; 异形花粉管百分率=(异形花粉数/萌发花粉数)×100%。
1.2.2 花粉管长度测量对不同培养时间的花粉分别取样,经4%多聚甲醛固定后,随机选取已萌发的花粉用显微测微尺测量花粉管长度,每样品随机测量50个花粉管。
1.2.3 微丝骨架及细胞核荧光定位参照Li等(2001)的方法,将不同萌发时间的油松花粉管进行微丝骨架荧光定位。具体操作: 采用4%多聚甲醛(50 mmol·L-1 Pipes配制)固定1 h,经相应缓冲液清洗后,用PBS配制的1% Triton X-100抽提1 h,PBS洗涤3次,每次15 min,然后用Rhodamine-Phalloidin染色2 h,相应缓冲液洗涤后用含DAPI的甘油封片。所有制片均采用Leica TCS-SP5型激光共聚焦扫描显微镜进行观察和照相。
2 结果与分析 2.1 油松花粉离体萌发形态油松花粉离体萌发过程中,呈现出不同的花粉管形态。除观察到大部分花粉仅从1个萌发孔发出1个单一花粉管(图 1A)外,还观察到多种异形花粉管形态,如具2条花粉管(图 1B)、具2条花粉管发生分枝(图 1C)、单一花粉管生长过程中分枝(图 1D-F)等现象。
 |
图 1 油松花粉离体萌发花粉管形态(标尺=50 μm)
Fig. 1 Morphological aspect of pollen tube in Pinus tabulaeformis ( Bar=50 μm)
A. 具有单一花粉管的油松花粉; B. 具2条花粉管的花粉粒; C. 不同萌发孔的2个花粉管生长过程发生分枝; D. 具1个分枝的单一花粉管花粉; E. 具2个分枝的单一花粉管花粉; F. 具有2轮分枝的单一花粉管花粉. A. Pollen grain with single tube; B. Pollen grain with two tubes; C. Two-tube grain with ramification; D. Single-tube grain with one ramification; E. Single-tube grain with two ramifications; F. Single-tube grain with two rounds of ramification. |
将油松花粉离体培养12 h,未观察到萌发现象。随着培养时间的延长,花粉逐渐萌发,且萌发率逐渐提高。由图 2A可知,培养24~36 h期间,萌发率从19.75%(±2.00%)急剧增长至77.15%(±1.25%),表明离体培养条件下,油松花粉的大量萌发主要集中于这一时间段。之后,萌发率增速减缓,至培养60 h后趋于稳定,达91%以上,不同培养时间萌发率差异不显著。
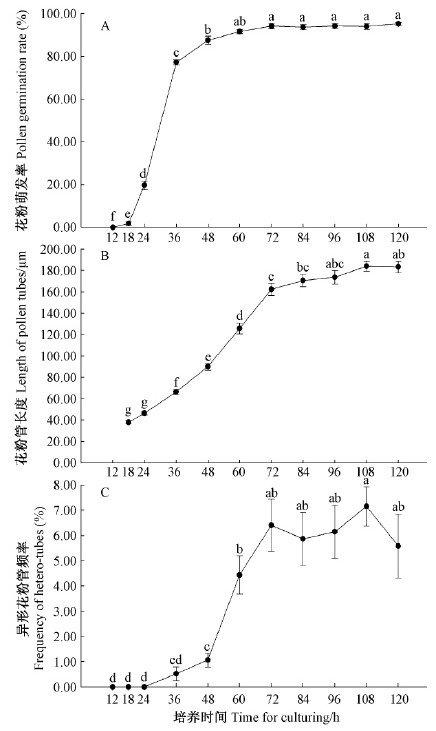 |
图 2 最适培养条件下花粉萌发率、花粉管长度及异形花粉管发生率随培养时间的变化
Fig. 2 Change of the pollen germination rate,tube length and
hetero-tube frequency with time for culturing under optimal condition
|
对不同培养时间花粉管长度进行测量,发现花粉管平均长度随着培养时间的延长呈现先逐渐增加后趋于稳定的趋势。由图 2B可看出: 培养18~72 h期间,花粉管生长速度较快,平均生长速度为2.30 μm·h-1; 培养72 h后,花粉管生长逐渐减缓,平均生长速度仅为0.47 μm·h-1,至96 h趋于稳定,花粉管长度可达173 μm以上; 培养96~120 h花粉管平均长度差异不显著,表明此时花粉管顶端生长势减弱。
异形花粉管发生频率与花粉萌发率呈极显著正相关(r=0.786 7,P=0.004 1),表明随着花粉萌发率的提高,异形花粉管发生频率不断增加,尤其当花粉萌发率达90%以上时,异形花粉管发生频率维持在4%以上(图 2C)。此外,对于分枝花粉管而言,通过测量花粉管分枝发生的位置,发现分枝主要发生于花粉管伸长至89.73(±3.44)μm处。
2.3 油松花粉及花粉管内微丝骨架的分布通过Rhodamine-Phalloidin进行荧光定位研究,共聚焦激光显微观察发现在油松花粉萌发过程的不同时期,其花粉管内的微丝骨架均有较好的保存。在尚未萌发的水合花粉中,由于造粉体的大量存在,微丝骨架围绕造粉体和细胞核表面形成网状结构(图 3A)。随着花粉的萌发,在萌发孔处形成较为密集的微丝束(图 3B)。当花粉管形成后,微丝骨架推动花粉管细胞核(管核)与造粉体在花粉管中向前移动,微丝束在花粉管前端的透明区形成与花粉管延伸方向平行的浓密网状结构(图 3C)。当花粉管生长较长时,花粉管前端的微丝束密度呈减小趋势(图 3D)。
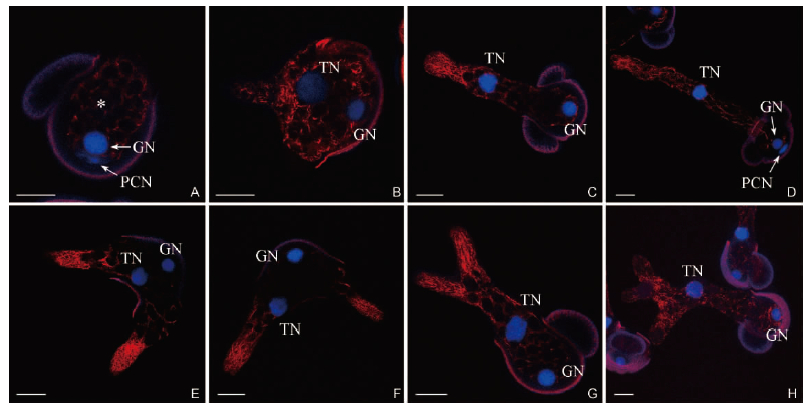 |
图 3 油松花粉萌发过程微丝骨架分布(标尺= 20 μm)
Fig. 3 Distribution of microfilament during pollen germination of Pinus tabulaeformis ( Bars = 20 μm)
红色荧光指示微丝骨架,蓝色荧光代表细胞核。GN: 生殖核; PCN: 原叶细胞核; TN: 花粉管细胞核。 A. 水合花粉中微丝骨架围绕造粉体和细胞核分布[* 表示花粉管细胞核(管核)位置,其处于另一光切片上]; B. 萌发初期在萌发孔处形成较为密集的微丝束; C. 萌发的花粉管中,微丝骨架推动造粉体和管核向花粉管内移动,在花粉管前段的透明区微丝束形成平行于花粉管伸长方向的浓密网状结构; D. 花粉管生长较长时,微丝骨架分布较为稀疏; E. 在具2条花粉管的花粉粒中,微丝束密集分布于花粉管透明区,管核尚在花粉粒内; F. 管核在微丝骨架的推动下进入2条花粉管的其中1条; G. 单花粉管分枝后,微丝骨架围绕造粉体和管核分布,并在前端的透明区汇集; H. 随着花粉管的伸长和分枝的增多,微丝束变得稀疏。 Red and blue show microfilament cytoskeletons and nuclei, respectively. GN: Generative nucleus; PCN: Prothallial cell-nucleus; TN: Tube nucleus. A. In hydrated pollen, microfilaments distribute around amyloplasts and nuclei ( * marks the place of the tube nucleus, which is on another optical section) ; B. In early germination, microfilament bundles densely form in aperture; C. Microfilaments move the amyloplasts and tube nucleus toward tip of tube and form a dense network parallel to the direction of tube elongation in clear zone; D. In long tube, distribution of microfilaments becomes thin; E. In grain with two tubes, microfilament bundles distribute densely in clear zone and tube nucleus is still within grain; F. The tube nucleus is moved into one of tubes by microfilaments; G. In ramified tube, microfilaments distribute around amyloplasts and tube nucleus and assemble in clear zone; H. With tube elongation and ramification increase, microfilament bundles become thin. |
在异形花粉管中也可观察到微丝骨架的存在(图 3E-H)。与单一花粉管相似,在异形花粉管中的造粉体堆积部位,微丝束盘绕造粉体形成空洞状,而在花粉管的透明区则呈现较为浓密的微丝束构造。而随着花粉管的伸长,花粉管分枝逐渐增多,管内的微丝束逐渐变得稀疏(图 3H)。
3 讨论 3.1 针叶树花粉管分枝现象及其作用目前,已在白云杉(Picea glauca)(Dawkins et al.,1993)、赤松(Pinus densiflora)(Terasaka et al.,1994)、黑松(Pinus thunbergii)(Terasaka et al.,1994; 李国平等,2007)、欧洲赤松(Pinus sylvestris)(de Win et al.,1996; Venäläinen et al.,1999)、欧洲云杉(Picea abies)(Anderhag et al.,2000)、银杏(Ginkgo biloba)(陆彦等,2009)、杉木(Cunninghamia lanceolata)(甘国峰等,2011)等树种相继发现花粉管分枝现象的存在,表明分枝花粉管可能是裸子植物花粉萌发过程的普遍特征,并且在生殖过程中发挥重要作用(Fernando et al.,2005)。其中,de Win等(1996)研究发现欧洲赤松花粉管分枝处距离花粉粒约50 μm。本研究发现油松花粉管分枝发生于花粉管生长89.73(±3.44)μm处,可见不同树种花粉管分枝发生位置存在差异。相关研究认为分枝花粉管可能在花粉管伸长过程中起到营养吸收和铆钉花粉管的作用(Dawkins et al.,1993; Fernando et al.,2005)。裸子植物花粉管生长缓慢,松属植物从传粉至受精需要经历1年多的时间(李国平等,2007),其花粉内生碳水化合物的储备并不足以支持花粉管的长期生长(Johri,1992)。不同树种花粉管分枝发生位置的差异可能代表不同物种花粉萌发对外界营养物质的依赖程度不同。此外,活体授粉情况下,松属花粉也被发现存在分枝现象,Venäläinen等(1999)认为具有分枝的花粉管可能比单一不具分枝的在珠心中能占据更大空间,进而将影响配子体竞争力。
3.2 油松花粉管萌发特征及对种子园营建的价值与被子植物相比,裸子植物普遍具有花粉萌发慢、花粉管生长迟缓的特征(Fernando et al.,2005)。Fernando等(2005)对针叶树花粉生长缓慢的原因进行了总结,认为松树干燥花粉含水量低、缺乏多聚核糖体、花粉萌发对来自于珠孔珠心或雌配子体分泌的促进因子的需求、花粉管壁酸性果胶质和胼胝质层的缺乏以及花粉管伸长依赖蛋白质的需求都会影响针叶树花粉管的生长。本研究发现油松花粉在培养初期12 h内未能观察到萌发现象,18 h时萌发率也仅为1.86%(±0.94%),说明充分水合对干燥花粉萌发非常重要。花粉培养60 h后,萌发率趋于稳定,达到91%以上,因此在离体萌发条件下,统计油松花粉萌发率应以培养60 h后统计为佳。Venäläinen等(1999)发现欧洲赤松不同无性系花粉管长度存在极显著差异,并且这种差异可能对不同无性系花粉参与受精的能力产生影响。因此,在从事油松种子园营建过程中,应对建园无性系的花粉萌发特征进行系统研究,以便为种子园无性系配置提供指导。
3.3油松花粉管微丝骨架分布与花粉管生长的关系微丝骨架的存在对于花粉管内细胞质和细胞器的运动具有重要作用(Vidali et al.,2001)。Lazzaro(1996)对欧洲云杉花粉管微丝骨架分布进行研究,发现微丝束阵列紧密包裹着造粉体和管核,使其悬浮在花粉管中,并推动其向顶部移动。Terasaka等(1994)利用赤松和黑松为材料,发现其花粉管细胞质颗粒周围充满了微丝蛋白,并且管核的移动也与微丝骨架具有密切关系。本研究油松花粉管内造粉体和管核被微丝骨架形成的网状结构所紧密包围,并且在不同发育阶段的花粉管中,造粉体和管核逐渐进入花粉管内,并向顶端移动,充分验证了微丝骨架对细胞器的推动作用。
极性生长是植物花粉管发育的重要属性,微丝骨架对花粉管极性生长起着关键作用(Taylor et al.,1997; Hepler et al.,2001)。Anderhag等(2000)对欧洲云杉的研究发现,在正常花粉管内存在平行于花粉管伸长方向的连续的网状微丝束,并且在花粉管顶端密集分布,而经细胞松弛素处理过的花粉管生长受到抑制,顶端微丝骨架缺乏,导致短小分枝的形成。本研究发现,油松花粉管顶端的透明区同样存在浓密的微丝束网络结构,表明微丝骨架对于油松花粉管的顶端极性生长同样重要。当花粉管生长较长时,微丝骨架在花粉管中的分布变得较为稀疏,尤其花粉管前端微丝骨架未呈现密集束状分布,与旺盛生长时期花粉管前端的微丝骨架分布存在明显差异,因此,推测微丝骨架的稀疏分布可能与离体培养较长时间后花粉管顶端生长变弱有关,这与培养72 h后,花粉管生长速度逐渐减缓,顶端生长势减弱的结果一致。在油松异形花粉管中,与单一花粉管具有相似的微丝骨架分布模式,各分枝的顶端透明区均存在浓密的网状微丝束结构,表明各分枝均具有较强的极性顶端生长能力。有关异形花粉管的形成机制有待进一步研究。
| [1] |
甘国峰, 徐进, 陆叶, 等. 2011. 杉木花粉和花粉管中微丝骨架. 林业科学, 47(3) : 175-177.( 1) 1)
|
| [2] |
李国平, 黄群策, 杨鹭生, 等. 2007. 黑松花粉体外萌发与花粉管生长的研究. 林业科学研究, 20(2) : 224-229.( 2) 2)
|
| [3] |
李伟, 朱松林, 李悦. 2012. 油松有性和无性繁殖植株的多性状比较. 北京林业大学学报, 34(1) : 46-50.( 1) 1)
|
| [4] |
陆彦, 林明明, 王莉, 等. 2009. 银杏花粉萌发生长与分枝式花粉管形成的观察. 电子显微学报, 28(5) : 426-431.( 1) 1)
|
| [5] |
田菊, 尚峰男, 宋少宇, 等. 2012. 油松花粉离体萌发及萌发特征研究. 中国农学通报, 28(28) : 21-27.( 2) 2)
|
| [6] |
Anderhag P, Hepler P K, Lazzaro M D. 2000. Microtubules and microfilaments are both responsible for pollen tube elongation in the conifer Picea abies (Norway spruce) . Protoplasma, 214(3) : 141- 157.( 2) 2)
|
| [7] |
Dawkins M D, Owens J N. 1993. In vitro and in vivo pollen hydration, germination, and pollen tube growth in white spruce, Picea glauca (Moench) voss. Int J Plant Sci, 154(4) : 506-521.( 2) 2)
|
| [8] |
de Win A H N, Knuiman B, Pierson E S, et al. 1996. Development and cellular organization of Pinus sylvestris pollen tubes. Sex Plant Reprod, 9(2) : 93-101.( 2) 2)
|
| [9] |
Fernando D, Lazzaro M, Owens J. 2005. Growth and development of conifer pollen tubes. Sex Plant Reprod, 18(4) : 149-162.( 3) 3)
|
| [10] |
Hepler P K, Vidali L, Cheung A Y. 2001. Polarized cell growth in higher plants. Annu Rev Cell Dev Biol, 17: 159-187.( 2) 2)
|
| [11] |
Johri B M. 1992. Haustorial role of pollen tubes. Ann Bot, 70 (5) : 471-475.( 1) 1)
|
| [12] |
Lazzaro M D. 1996. The actin microfilament network within elongating pollen tubes of the gymnosperm Picea abies ( Norway spruce ) . Protoplasma, 194(3) : 186-194.( 1) 1)
|
| [13] |
Li Y, Zee S Y, Liu Y M, et al. 2001. Circular F-actin bundles and a Gactin gradient in pollen and pollen tubes of Lilium davidii. Planta, 213(5) : 722-730.( 1) 1)
|
| [14] |
Taylor L P, Hepler P K. 1997. Pollen germination and tube growth. Annu Rev Plant Physiol Plant Mol Biol, 48: 461-491.( 2) 2)
|
| [15] |
Terasaka O, Niitsu T. 1994. Differential roles of microtubule and actinmyosin cytoskeleton in the growth of Pinus pollen tubes. Sex Plant Reprod, 7(5): 264-272.( 2) 2)
|
| [16] |
Venäläinen M O, Aronen T S, Häggman H M, et al. 1999. Differences in pollen tube growth and morphology among Scots pine plus trees. For Genet, 6(3) : 139-147.( 3) 3)
|
| [17] |
Vidali L, Hepler P K. 2001. Actin and pollen tube growth. Protoplasma, 215(1) : 64-76.( 2) 2)
|
| [18] |
Volkmann D, Baluška F. 1999. Actin cytoskeleton in plants: from transport networks to signaling networks. Microsc Res Techniq, 47 (2) : 135-154.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

