文章信息
- 邹传山, 曹传旺, 张国财, 王志英
- Zou Chuanshan, Cao Chuanwang, Zhang Guocai, Wang Zhiying
- 落叶松毛虫2种解毒酶的体躯分布特征及对3种杀虫剂敏感性比较
- Tissue Distribution of Two Detoxifying Enzymes in Dendrolimus superans and Their Susceptibility to Three Pesticides
- 林业科学, 2013, 49(3): 165-169
- Scientia Silvae Sinicae, 2013, 49(3): 165-169.
- DOI: 10.11707/j.1001-7488.20130323
-
文章历史
- 收稿日期:2012-03-15
- 修回日期:2012-10-26
-
作者相关文章
落叶松毛虫(Dendrolimus superans)又称西伯利亚松毛虫,隶属鳞翅目(Lepidoptera)枯叶蛾科(Lasiocampidae)。国内分布于北京、东北、内蒙古、新疆北部,是我国东北林区的重要害虫,除危害落叶松(Larix spp.)外,也危害红松(Pinus koraiensis)、油松(P. tabulaeformis)、樟子松(P. sylvestris var.mongolica)、云杉(Picea spp.)、冷杉(Abies spp.)等主要北方针叶树种。目前,有关落叶松毛虫的研究主要集中在发生规律及预测预报、对挥发物质的行为反应及药效防治试验等方面的研究,而有关杀虫剂对落叶松毛虫的毒理机制方面的研究未见报道。落叶松毛虫经常周期性发生且危害严重,给林业生产和生态建设造成巨大损失。应用杀虫剂仍是防治该害虫的主要措施之一。为了探索农药对落叶松毛虫解毒酶活性的影响及其代谢机制,本文在分析落叶松毛虫6 龄幼虫体内羧酸酯酶(CarE)和谷胱甘肽- S 转移酶(GST)组织分布规律的基础上,测定了3 种常用杀虫剂对落叶松毛虫离体CarE和GST活性的作用,为探索杀虫剂的作用机制和落叶松毛虫的毒理学奠定基础,同时为合理利用化学防治落叶松毛虫提供科学依据。
1 材料与方法 1.1 供试昆虫落叶松毛虫幼虫于2009 年6 月采自内蒙古自治区克什克腾旗芝瑞镇的兴安落叶松(L. gmelinii)人工林。采后于温度为(25 ± 1)℃、光照周期为14 L∶ 10 D、相对湿度为75% 的条件下进行室内人工饲养。
1.2 试剂及杀虫剂α-乙酸萘酯(α-naphthalenol)、固蓝B 盐(Fast blue B salt)、十二烷基硫酸钠(SDS)、毒扁豆碱(Eserine)、考马斯亮蓝G-250、1,2 - 二氯- 4 - 硝基苯(1,2-dichloro-4-nitrobenzene,DCNB)、还原型谷胱甘肽(GSH)、乙胺四乙酸二钠(EDTA)、苯甲基黄酰氟(PMSF)、二硫代苏糖醇(DTT)均购于SIGMA 公司; 磷酸钠、磷酸二氢钠、磷酸氢二钠、丙酮、三氯乙酸和牛血清蛋白均为分析纯级。供试杀虫剂信息见表 1。供试杀虫剂用丙酮配成一定浓度的母液,然后用蒸馏水稀释至所需浓度。
|
|
1)酶液的制备 取落叶松毛虫6龄幼虫6 头,用0. 1 mol·L- 1 pH7. 5 磷酸缓冲液(PBS)清洗体表,解剖后将头、中肠、脂肪体及表皮组织分别置于预冷的研钵中,加入10 mL 预冷PBS缓冲液,于4 ℃,8 000 r·min- 1 下离心15 min,取上清液于4 ℃,12 000 r·min- 1 再次离心10 min,取上清液作为酶源。
2)CarE 活性测定 CarE 活性测定参照VanAsperen(1962)的方法,略加改进。将0. 05 mL 稀释酶液与2. 00 mL 3 × 10-4 mol·L- 1 α-乙酸萘酯底物溶液(含毒扁豆碱1∶ 1)混匀,35 ℃ 水浴孵育10 min后,加入0. 90 mL 显色液(5% 十二烷基硫酸钠与1% 固蓝B 盐= 5∶ 2)终止反应,于600 nm 波长下测吸光度值OD600。根据α-萘酚标准曲线获得单位时间单位蛋白CarE 水解α-乙酸萘酯生成α-萘酚的含量,从而计算得到CarE 的比活力(μmol·min- 1 mg-1 protein),每组3 次重复。
3)GST 活性测定 GST 活性测定参照Habig(1974)和Oppenoort 等(1979)方法。总反应体系为3. 1 mL,含有1. 0 mL 0. 1 mol·L- 1 PBS、1. 0 mL5 mmol·L- 1 GSH和1. 0 mL 稀释酶液,35 ℃ 水浴孵育10 min,加入0. 1 mL 1 mmol·L- 1 DCNB 底物,于345 nm 波长下每隔30 s 测定吸光度值OD345,记录3 min内OD345变化值ΔOD345。GST 活性以每毫克蛋白质每分钟分解底物的微摩尔数表示(μmol·min- 1mg - 1 protein),每组3 次重复。
4)CarE和GST 体躯分布测定 通过试验方法1)获得落叶松毛虫6 龄幼虫头、中肠、脂肪体及表皮各组织的粗匀浆液,按照试验方法2)和3)分别测定各组织中CarE 及GST 的活性,并分别测定蛋白质含量,计算各组织中的CarE 及GST 比活力,每组3 次重复。
5)杀虫剂对离体CarE 活性抑制 分别将3 种杀虫剂配制成0. 000 1,0. 001 0,0. 010 0,0. 100 0,1. 000 0 mg·mL- 1 浓度梯度。CarE 活性测定方法同试验方法2)。总反应体系为3. 55 mL,将0. 05 mL 稀释酶液和0. 5 mL 不同浓度杀虫剂混合均匀,35 ℃水浴孵育10 min,然后加入2. 00 mL 3 × 10-4mol·L- 1α-乙酸萘酯底物溶液(含毒扁豆碱1∶ 1)后35 ℃ 水浴孵育5 min,最后加入1. 0 mL 显色液终止反应,测定OD600,同时设定对照组,每组3 次重复。
6)杀虫剂对离体GST 活性抑制 测定方法同试验方法3)。总反应体积3. 7 mL,将2. 0 mL PBS、0. 5 mL 不同浓度杀虫剂和0. 1 mL 稀释酶液混合均匀,35 ℃ 水浴孵育10 min,然后加入1. 0 mL GSH,最后加入0. 1mL DCNB 显色液并混匀,测定3 min内OD345的变化值ΔOD345,同时设定对照组,每组3次重复。
7)蛋白质含量测定 蛋白质含量测定参照Bradford(1976)考马斯亮蓝G-250 法。
8)数据统计分析 CarE 比活力$${\rm{( }}\mu mol \cdot {\min ^{ - 1}}m{g^{ - 1}}protein) = {W \over {T \times P}}$$。式中,W: 生成α-萘酚的量,μmol; T: 反应时间,min; P: 蛋白质含量,mg。
GST 比活力$${\rm{( }}\mu mol \cdot {\min ^{ - 1}}{g^{ - 1}}protein) = {{\Delta O{D_{345}} \times V} \over {\varepsilon \times L \times {V_E} \times P}}$$。式中,ΔOD345: 每分钟吸光值的变化值; V: 反应总体积,mL; ε: 消光系数为8. 5 L·mmol - 1 cm - 1 ; L: 比色皿光程,1 cm; VE: 酶液体积,mL; P: 蛋白质含量,mg。
体躯各组织CarE和GST 比活力所占百分比$${\rm{(\% ) = }}{{{\rm{Ai}}} \over {{\rm{A1 + A2 + A3 + A4}}}} \times 100{\rm{\% }}$$。式中,Ai为各组织中CarE和GST 的比活力,i = 1 ~ 4,分别表示头部、中肠、脂肪体、表皮。酶活性抑制率= [(对照管活性- 残留活性)/ 对照活性]× 100%。抑制率的抑制中浓度IC50的计算方法: 以杀虫剂质量浓度(mg·L- 1)的负对数值为横坐标(- log10杀虫剂浓度),抑制率(%)为纵坐标计算线性回归方程,并通过线性方程求出IC50。
采用Excel 2003和SPSS 18. 0 软件对数据进行处理和统计分析,试验结果用平均值± 标准差(mean ± SD)表示。
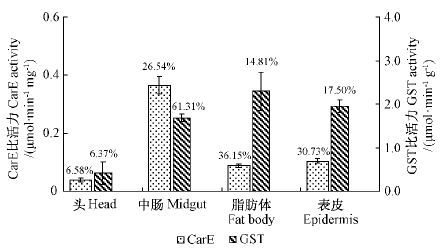
2 结果与分析 2.1 CarE和GST 体躯分布特征落叶松毛虫6 龄幼虫体内CarE和GST 在体躯内的分布见图 1。CarE 主要分布于中肠组织,占体躯的61. 31% ; 头部分布最少,占体躯的6. 37%。GST 则主要分布在脂肪体中,占整个体躯的36. 15%,头部分布最少,仅占体躯的6. 58%。
|
图1 落叶松毛虫6 龄幼虫CarE 和GST 活性体躯分布特征 Fig.1 Distribution of CarE and GST activity in 6 th instar D. superans larvae |
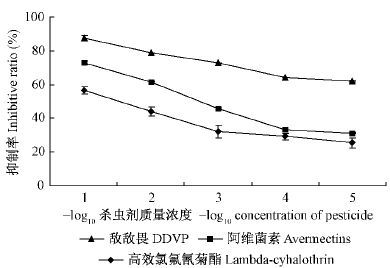
以杀虫剂质量浓度(mg·mL- 1)的负对数值为横坐标(- log10杀虫剂浓度),抑制率(%)为纵坐标,3种杀虫剂对落叶松毛虫6 龄幼虫离体CarE 活性影响如图 2 所示。3 种杀虫剂对落叶松毛虫幼虫离体CarE 活性均表现出不同程度的抑制作用,且杀虫剂与CarE 活性呈现明显的剂量- 效应关系,抑制率与杀虫剂质量浓度的负对数值成反比。当敌敌畏质量浓度为1. 000 × 10-4 mg·mL- 1 时,其对CarE 活性的抑制率大于50%(为61. 823%),因此可以得出敌敌畏对CarE 的抑制中浓度IC50小于1. 000 × 10-4 mg·mL- 1。通过线性回归方程计算得出阿维菌素和高效氯氟氰菊酯对CarE 的抑制中浓度IC50分别为1. 259 × 10 - 2和4. 529 × 10 - 1mg·mL- 1(表 2)。由于IC50可以反映CarE 对抑制剂的敏感性,IC50越小,表示酶对杀虫剂越敏感,从而得出落叶松毛虫6 龄幼虫CarE 对3 种杀虫剂的敏感性依次为: 敌敌畏> 阿维菌素> 高效氯氟氰菊酯。
|
图2 杀虫剂对落叶松毛虫6 龄幼虫离体CarE 活性影响 Fig.2 Effects of pesticides on in vitro CarE activityof 6 th instar D. superans larvae |
|
|
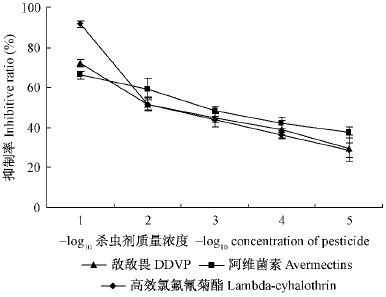
同理,以杀虫剂质量浓度(mg·mL- 1)的负对数值为横坐标(- log10杀虫剂浓度),抑制率(%)为纵坐标,3种杀虫剂对落叶松毛虫6 龄幼虫离体GST活性影响如图 3 所示。敌敌畏、阿维菌素和高效氯氟氰菊酯对落叶松毛虫幼虫离体GST 活性均有不同程度的抑制作用,且抑制率随着杀虫剂浓度的降低而增强,杀虫剂浓度与GST 活性同样呈现明显的剂量- 效应关系。
|
图3 杀虫剂对落叶松毛虫6 龄幼虫离体GST 活性影响 Fig.3 Effects of pesticides on in vitro GST activity of 6 th instar D. superans larvae |
通过线性回归计算得出敌敌畏、阿维菌素和高效氯氟氰菊酯3 种杀虫剂对GST 比活力的抑制中浓度IC50分别为1. 755 × 10 - 2,8. 044 × 10 - 3和9. 224× 10 - 3 mg·mL- 1(表 2)。因此,落叶松毛虫6 龄幼虫GST 对阿维菌素表现为最敏感,其次为高效氯氟氰菊酯,而敌敌畏最不敏感。
3 讨论昆虫的中肠是分泌消化酶、消化食物和吸收养分的主要部位。中肠分泌的酶包括酯酶、氧化酶、谷胱甘肽硫转移酶等,在这些酶的催化作用下,昆虫能够消化吸收营养,维持体内环境平衡。已有研究表明二化螟(Chilo suppressalis)幼虫CarE 主要集中于消化道和脂肪体内,血黑蝗(Melanoplus sanguinipes)体内胃盲囊、中肠和马氏管组织总酯酶活性较高。落叶松毛虫6 龄幼虫CarE 主要集中于中肠(61. 31%),这与上述报道结果相似。脂肪体是昆虫重要的中间代谢组织,在物质转换和有毒物质的解毒过程中起着重要的作用,它是昆虫体内物质和能量代谢的中心,许多生物学反应包括磷脂代谢、碳水化合物代谢、氨基酸代谢等都在脂肪体内进行,因此,人们将昆虫的脂肪体比拟为脊椎动物的肝脏。目前,国内外有大量文献报道了脂肪体是GST 主要分布组织。吕敏等(2003)报道了埃及伊蚊(Aedesaegypti)GST 活性以1,2 - 二氯- 4 - 硝基苯(DCNB)为底物时,脂肪体GST 活性占总活性的94%,以1 - 氯- 2,4 - 二硝基苯(CDNB)为底物时,脂肪体GST 活性为整体活性的50%,而表皮、中肠和血液分别仅为25%,15%和10%。Chang 等(1981)在研究家蝇(Musca domestica)GST 活性时发现,GST 主要集中在家蝇幼虫的脂肪体和中肠。另外,人们在对家蚕(Bombyx mori)脂肪体组织基因表达谱的研究中发现,GST 是脂肪体中表达量最高的酶类,在所有脂肪体表达蛋白中排第4 位。左伟东(2007)在GST 的时空表达研究中发现,BmGSTz2 在脂肪体中的表达量最高。本研究表明落叶松毛虫6龄幼虫GST 主要分布于脂肪体中(36. 15%),这一结果与张常忠等(2001)报道的棉铃虫(Helicoverpaarmigera)和侯成香等(2007)报道家蚕GST 的组织分布特征基本一致。这进一步表明昆虫脂肪体是代谢和解毒的主要组织器官,具有较高的解毒酶活性。CarE和GST 主要分布于落叶松毛虫6 龄幼虫的中肠和脂肪体中,这与它们是昆虫消化食物、吸收养分以及贮存排泄和解毒的主要组织有关。
羧酸酯酶是许多杀虫剂的作用靶标,同时也是昆虫对杀虫药剂代谢最重要的酶系之一,特别是对拟除虫菊酯和有机磷类杀虫药剂的代谢。王旭等(1998)和许雄山等(1999)曾先后报道了敌敌畏等有机磷药剂对棉铃虫离体羧酸酯酶有抑制作用,而且抑制率与杀虫剂的化学结构显著相关。程伟霞等(2004)研究表明嗜卷书虱(Liposcelis bostrychophila)和嗜虫书虱(L. entomophila)CarE 对敌敌畏敏感,而对其他有机磷类农药却表现出不敏感,并且通过聚丙烯酰胺凝胶电泳分析得出敌敌畏离体条件下对这2 种书虱酯酶同工酶的抑制力最强。本文研究结果表明3 种杀虫剂对落叶松毛虫CarE 均有抑制作用,但存在差异; 其中,敌敌畏对CarE 抑制力最强,其抑制中浓度与阿维菌素、高效氯氟氰菊酯分别相差4 个和5 个数量级,这与上述研究结果基本一致。这主要是由于敌敌畏化学结构中的O 具有强吸附电子的能力,因而易于与CarE 的活性中心丝氨酸发生反应,从而使酶失活。阿维菌素是十六元大环内酯化合物,由链霉菌中灰色链霉菌(Streptomycesavermitilis)发酵产生的,其化学式为C49 H74 O14,结构中大部分O 存在于十六元大环内,这样可能降低了O 吸附电子的能力; 而高效氯氟氰菊酯的化学式为C23H19ClF3NO3,其结构中的O 与2 个苯环相连,这可能大大降低了O 吸附电子的能力,从而导致高效氯氟氰菊酯对CarE 抑制力最弱。这也进一步表明杀虫剂对CarE 的抑制效果与其作用机制、化学结构有着直接联系。
GST 是重要的Ⅱ型解毒酶,参与有机磷、有机氯杀虫剂和植物次生物质的解毒。国内外大量研究表明有机磷、氨基甲酸酯、拟除虫菊酯及抗生素类杀虫剂对昆虫GST 均有抑制作用。汤方等(2009)研究报道高效氯氟氰菊酯和阿维菌素等21 种杀虫剂对杨扇舟蛾(Clostera anachoreta)各组织GST 均有不同程度抑制作用; Chen 等(2007)研究表明有机磷、氨基甲酸酯和拟除虫菊酯类杀虫药剂对棉铃虫GST均有抑制作用。汤方等(2007)研究发现阿维菌素和高效氯氰菊酯等5 种杀虫剂对黑翅土白蚁(Odontotermes formosanus)和黑胸散白蚁(Reticulitermes chinensis)GST 都有较强的体外抑制作用,其中,阿维菌素对黑胸散白蚁GST 活性的抑制作用最强。Prapanthadara 等(1998)发现大劣按蚊(Anopheles dirus)中的重组GST 可以被许多有机磷、有机氯和拟除虫菊酯杀虫剂所抑制; 赵志刚等(2009)研究发现高效氟氯氰菊酯对德国小蠊(Blattella germanica)GST 有抑制作用。本研究结果表明敌敌畏、阿维菌素和高效氯氟氰菊酯对落叶松毛虫GST 活性均有较强的抑制作用,这与前人研究的结果基本一致,但也存在差异,这可能由于不同昆虫体内的GST 同工酶种类和数量及其组成差异性造成的。
本文研究了落叶松毛虫6 龄幼虫CarE和GST2 种解毒酶体躯分布情况及对3 种杀虫剂的敏感性,这为明确3 种农药对落叶松毛虫的毒理机制及寻找高效、低毒、环境友好型农药提供了基础数据。然而,为了充分了解杀虫剂作用效果,进一步研究3种杀虫剂对落叶松毛虫的体内抑制作用是必要的。另外,由于杀虫剂作用于昆虫时,其体内存在的多种酶(解毒酶、保护酶等)参与代谢及调节,因此,落叶松毛虫其他酶系对不同杀虫剂的代谢过程有待进一步研究。
| [1] |
程伟霞,王进军,赵志模,等.2004.四种杀虫剂对两种书虱羧酸酯酶和乙酰胆碱酯酶的抑制作用.动物学研究,25(4):321-326.( 1) 1)
|
| [2] | 葛君,李兵,沈卫德.2010.昆虫脂肪体与抗药性的关系研究现状与分析.江苏农业科学,(6):183-185. |
| [3] |
侯成香,桂仲争.2007.家蚕谷胱甘肽硫-转移酶的组织分布及发育期变化规律.蚕业科学,33(3):409-413.( 1) 1)
|
| [4] | 黄诚华,方琦,叶恭银,等.2009.二化螟幼虫抗药性相关酶系的组织及亚细胞分布特征.广西农业科学,40(2):153-158. |
| [5] | 李莉,孟焕文,孙旭.2002.落叶松毛虫生物学.内蒙古农业大学学报,23(1):101-103. |
| [6] |
吕敏,刘惠霞,吴文君.2003.谷胱甘肽S-转移酶与昆虫抗药性的关系.昆虫知识,40(3):204-207.( 1) 1)
|
| [7] | 尚利娜,袁海滨,魏春艳,等.2010.黄花蒿精油对玉米象成虫体内酶活力的影响.吉林农业大学学报,32(6):616-621. |
| [8] | 尚利娜,袁海滨,魏春艳,等.2010.猪毛蒿精油对玉米象体内4种解毒酶活力的抑制.东北师大学报:自然科学版,42(4):145-149. |
| [9] |
汤方,张秀波,刘玉升,等.2009.21种杀虫剂和3种植物次生物质对杨扇舟蛾各组织谷胱甘肽S-转移酶的抑制作用.昆虫学报,52(5):576-581.( 1) 1)
|
| [10] |
汤方,朱涛,高希武,等.2007.七种抑制剂对两种白蚁谷胱甘肽S-转移酶活性抑制作用的比较.昆虫学报,50(12):1225-1231.( 1) 1)
|
| [11] |
王旭,高希武,郑炳宗,等.1998.有机磷药剂对棉铃虫羧酸酯酶的抑制作用.昆虫学报,41:12-18.( 1) 1)
|
| [12] | 吴秋雁.1981.昆虫脂肪体的代谢作用.昆虫知识,(6):92-95. |
| [13] |
许雄山,韩召军,王荫长.1999.羧酸酯酶与棉铃虫对有机磷杀虫剂抗性的关系.南京农业大学学报,22(4):41-44.( 1) 1)
|
| [14] |
张常忠,高希武,郑炳宗.2001.棉铃虫谷胱甘肽S-转移酶的活性分布和发育期变化及植物次生物质的诱导作用.农药学学报,3(1):30-35.( 1) 1)
|
| [15] |
赵志刚,霍新北.2009.高效氟氯氰菊酯对德国小蠊谷胱甘肽硫-转移酶抑制作用研究.预防医学论坛,3(15):198-201.( 1) 1)
|
| [16] |
左伟东.2007.家蚕谷胱甘肽S-转移酶基因BmGSTz2和BmGSTd3的克隆和表达.西南大学硕士学位论文.( 1) 1)
|
| [17] |
Bradford M M. 1976.A rapid sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 7 2: 248 - 254. ( 1) 1)
|
| [18] |
Chang C K, Clark A G, Fields A, et al. 1981.Some properties of a glutathione S-transferase from the larvae of Galleria mellonella. Insect Biochem, 11 ( 2) : 179 - 186.( 1) 1)
|
| [19] |
Chen F J, Zhang C Z, Gao X W. 2007.In vitro inhibition of glutathione S-transferases by several insecticides and allelochemicals in cotton bollworm, Helicoverpa armigera Hübner. Entomol Sci, 42 ( 2 ) : 296- 305. ( 1) 1)
|
| [20] | Cheng D J, Xia Q Y, Zhao P, et al. 2006.EST-based profiling and comparison of gene expression in the silkworm fat body during metamorphosis.Arch Insect Biochem Physiol, 61: 10 - 23. |
| [21] | Feng R Y, Isman M B. 1994.Tissue distribution and developmental changes in detoxication enzyme activities in the migratory grasshopper, Melanoplus sanguinipes ( Acrididea ) .Pesticide Biochemistry and Physiology, 48( 1) : 48 - 55. |
| [22] |
Habig W H, Pabst M J, Jakoby W B. 1974.Glutathione S-transferases: The first enzymatic step inmercapturic acid formation. Journal of Biological Chemistry, 249: 7130 - 7139. ( 1) 1)
|
| [23] |
Oppenoort F J, Van Der Pas L J T, Houx N W H. 1979.GIutathione- Stransferase and hydrolytic activity in a tetrachlorvinphos-resistance strain of housefly and their influence on resistance. Pesticide Biochemistry and Physiology, 1 1: 176 - 188.( 1) 1)
|
| [24] |
Prapanthadara L A, Ranson H, Somboon P, et al. 1998.Cloning, expression and characterization of an insect class I glutathione Stransferase from Anopheles dirus species B. Insect Biochemistry and Molecular Biology, 28( 5 - 6) : 321 - 329.( 1) 1)
|
| [25] |
Shen Y H, Cheng D J, Zha X F, et al. 2004.The gene expression proifle of the fat-body of silkworm, Bombyx mori: Gene expression proifle of the fat-body of the 5th instar Bombyx mori larvae. Science of Sericulture, 30( 1) : 24 - 27. ( 1) 1)
|
| [26] | Van Asperen K. 1962.A study of housefly esterases by means of a sensitive colorimetric method.Journal of Insect Physiology, 8 ( 4 ) :401 - 416. |
 2013, Vol. 49
2013, Vol. 49

