文章信息
- 邱念伟, 周峰, 王颖, 侯元同, 顾祝军
- Qiu Nianwei, Zhou Feng, Wang Ying, Hou Yuantong, Gu Zhujun
- 松树与杨树叶片叶绿素快相荧光动力学特征比较
- Comparison on Characteristics of the Fast Chlorophyll Fluorescence Induction Kinetics between Pinus Species and Populus Species
- 林业科学, 2013, 49(3): 136-143
- Scientia Silvae Sinicae, 2013, 49(3): 136-143.
- DOI: 10.11707/j.1001-7488.20130319
-
文章历史
- 收稿日期:2011-11-16
- 修回日期:2012-12-22
-
作者相关文章
2. 南京晓庄学院生物化工与环境工程学院 南京 211171
2. School of Biochemical and Environmental Engineering, Nanjing Xiaozhuang University Nanjing 211171
松属(Pinus)树种种类多、分布广、森林面积大,是林木引种和绿化造林最重要的树种之一。光合作用是植物生长发育的物质基础,是决定松树生产力的最重要的生理过程(McGarvey et al., 2004; 汪杰等,2004; Wu et al., 2006; 梁军生等,2009)。20世纪90年代以来,叶绿素荧光诱导技术(fluorescence induction,FI)逐渐成熟和普及,为研究植物光合作用提供了有力而便捷的工具(Bolhàr-Nordenkampf et al., 1993; Strasser et al., 1995;Strasser et al., 2000; Maxwell et al., 2000; Adams et al., 2004),已经在松树的光合作用研究中得到应用。
叶绿素荧光诱导技术分为慢相荧光动力学(用脉冲调制式荧光仪测定)和快相荧光动力学(用连续激发式荧光仪测定)2 类。慢相荧光动力学主要用来分析光合作用暗反应启动后光系统在光下的实际光能利用和分配情况,慢相荧光参数与植物碳同化能力有密切关系,同时也可以获得反映光系统潜在光化学活性的几个基础荧光参数(如Fo,Fm,Fv)。由于慢相荧光参数反映的是植物在光下的实际光合效率,并能探测植物光系统的运转状态(Maxwell et al., 2000),测定技术较快相荧光成熟,推广应用也较早,所以该项技术在松树的光合功能研究中应用较多(唐礼俊等,1997;Myers et al., 1999; Koehn et al., 2003;Zhang et al., 2005;段爱国等,2008;刘爽等,2009;刘亚丽等,2011)。但光合作用光反应是暗反应的能量来源,暗反应需要光反应不断驱动,了解不同松树的光反应过程同样重要。利用快相荧光动力学技术可以探测光反应系统的结构、活性和状态,且不受暗反应的干扰。与慢相荧光动力学相比,它的测定更为方便、快速、灵敏,离体活体均可测定,不受材料大小和形状的限制,测定过程仅需数秒;其所包含的光合信息也更为丰富,可以获得50多个反映叶片光合功能的荧光参数,还可以探测叶片的光合结构和能量流程(Strasser et al., 2000; 李鹏民等,2005;Alex and rina et al., 2011)。快相荧光测定系统日益革新,并逐渐成熟,在植物光合作用研究中也已广泛应用,但在松树的光合作用研究中却相对较少。
以往的研究结果显示: 高等被子植物健康功能叶片的叶绿素荧光动力学曲线均具有典型的O,J,I,P 相(Strasser et al., 1995; Strasser et al., 2000; 李鹏民等,2005;Alex and rina et al., 2011),包括毛白杨(Populus tomentosa)、柑橘(Citrus reticulata)、北美红栎(Quercus rubra)、山毛榉(Fagus sylvatica)、欧洲白蜡(Fraxinus excelsior)等被子植物树种(Bussotti et al., 2007; Han et al., 2009; Bussotti et al., 2011),因此也称为“OJIP 曲线”。Tyystjärvi等(1999)用0~8 s的慢相荧光动力学曲线鉴定不同的类群植物时发现,松树的初始荧光(0~1s)和慢相荧光强度(1~8s)均显著低于桦(Betula pendula)、黑麦(Secale cereale)和茅草(Elytrigial repens)等被子植物,但是他们并没有测定和比较松树与这些被子植物的OJIP 曲线。只检索到Lehner等(2003)的文献中提供了2 种松树OJIP 曲线,用以比较2 种松树在2 月和5 月份的光合差异,他们没有注意到2 种松树的快相荧光动力学曲线与被子植物典型的OJIP曲线显著不同,均没有明显的I 相; 国内还没有将快相荧光动力学技术应用到松树光合作用研究中的相关报道。通过比较被子植物树种与松树的OJIP曲线差异,将有助于了解松树的光反应特征,也将拓展快相叶绿素荧光项技术在松树光合作用研究中的应用。因此,本项研究选择了生活在同一试验区的广泛种植的毛白杨和速生杨(P. euramericana)作为被子植的物代表树种,与二针一束的油松(P. tabuiaeformis)和赤松(P. densiflora)、三针一束的白皮松(P. bungeana)、五针一束华山松(P.arm and ii)等4 种松属代表树种的快相叶绿素荧光动力学进行了比较,总结了松树快相荧光动力学的共同特点,同时结合其他光合参数,总结了松树的光反应特征,并筛选与松属光合能力有关的荧光参数。
1 材料与方法 1.1 试验地概况试验地位于山东省曲阜市西郊(35°36'N,116°58'E),海拔60.5m,属于暖温带季风性大陆气候,当地年均气温13.6℃,最高温度38℃,最低气温-15℃。常年平均日照时数2433h,太阳辐射年总量28.72 kJ·cm-2,常年降雨量666.3mm,年均相137林业科学49卷对湿度为68%,常年无霜期199天。
1.2 试验材料2011年5月中旬,选取曲阜师范大学校园内自然状况下生长良好的4种松树(树龄20~30年)。即油松、赤松、白皮松、华山松,以及2种杨树(树龄15~20年)。即毛白杨、速生杨为研究对象。选取各种树种的健康功能叶,叶片的健康状况用PSⅡ最大光化学效率(Fv/Fm)确定(BjÖrkman,1987)。每个树种选择3株,选取阳面、粗细均匀的枝条上的叶片(松树则为1年生枝条上的新生针叶),每株树选取2~3枝,每个小枝上选取2~3片(或针叶束)。
1.3 试验方法 1.3.1 叶片叶绿素含量的测定叶绿素的提取和含量测定参照张其德(1985)的方法,杨树叶片用一定面积的打孔器(直径0.9cm)打取3个叶圆片,然后剪碎叶片,用10mL80%丙酮溶液提取叶绿素至叶片无色。松树针叶取1束,用叶面积仪Li-3000A测定叶面积后,剪碎提取叶绿素。每个树种测定5个重复。
1.3.2 光合速率的测定天气晴好时,于9:00—11:00用Ciras-1型光合仪(英国PP system)测定各种树种的光合速率。测定条件: 大气CO2浓度400μmol·mol-1、相对湿度30%,光照强度1 000μmol·m-2s-1,温度25~28℃。杨树叶片的光合速率用PLC6(U)标准叶室测定,松树针叶光合速率测定采用PLC5(C)针叶叶室,叶面积用Li-3000A叶面积仪(美国LI-COR)测定,每个树种测定重复5次。
1.3.3 叶绿素快相荧光动力学参数的测定叶片在暗室中暗适应至少30min。然后用H and y PEA(Plant Efficiency Analyser; Hansatech InstrumentLtd.,UK)测定叶绿素快相荧光动力学。杨树叶片可以完全覆盖荧光夹测试孔,直接进行测定。测定松树针叶时,需将多束针叶平行排列在测试孔中,完全覆盖4mm2的测试孔,以保证照光叶面积相同。测定光源为650 nm 的红光,光照强度为3 000 μmol·m-2s-1的饱和光强,荧光信号的记录时程为1s,每种树种测定10个重复。利用专业软件BiolyzerHP3(Hansatech Instrument Ltd.,UK)处理和并解析叶绿素荧光动力学曲线。
荧光参数意义如下。Tfm:暗适应后从照光到达最大荧光所需的时间;Fo:暗适应后的最小荧光强度;Fm:暗适应后的最大荧光强度;Fv/Fm=(Fm-Fo)/Fm:PSⅡ最大光化学效率;Fo/Fm:热耗散的量子比率;Fv/Fo:表示捕获光能与热耗散能量的比例; F1,F2,F3,F4,F5:分别表示50,100,300μs和2,30ms时的荧光,即O/L/K/J/I相的荧光强度;Mo:原初光化学反应速率;Vj:在J相时的相对可变荧光强度;Vi:在I相时的相对可变荧光强度;ψET=1-Vj:表示PSⅡ捕获能量从QA传递到QB的效率;ψRE=1-Vi:表示PSⅡ捕获能量从QB传递到PSI的效率;φ(Po/Eo/Do/Ro):分别表示PSⅡ最大光化学效率(φPo)、用于电子传递的量子比率(φEo)、用于热耗散的量子比率(φDo)和PSI受体侧末端电子受体的量子产额(φRo)(反映PSI的相对活性);Sm=Area/Fv:指标准化面积,表示质体醌库大小;N:从开始照光至Fm的时间段内QA被还原的次数;Sm/Tfm:质体醌库被还原的速率;Kp:光化学反应的速率常数;Kn:非光化学反应的速率常数;(ABS/TRo/ETo/DIo)/RC:分别表示单位反应中心吸收的能量/被反应中心捕获的能量/用于电子传递的能量/热耗散的能量;(RC/ABS/TRo/ETo/DIo)/CSm:分别表示单位激发态面积反应中心数目/吸收的光量/被反应中心捕获的光量/用于电子传递的能量/热耗散的能量;SFI(abs):结构功能指数(structure and function index of plants);PI(ABS/CSo/CSm):分别表示以吸收光能(ABS)/基础荧光(Fo)/最大荧光(Fm)为基础的性能指数(performance index of plants);DF:表示光合驱动力(drive force for photosynthesis)。相关参数的运算及生理意义参见李鹏民等(2005)、Strasse等(2000)和Alex and rina等(2011)。
2 结果与分析 2.1 各树种叶片叶绿素含量的比较叶绿素是光合作用吸收和转化光能的物质,其含量对植物的光合能力有重要影响。图 1结果显示,7个物种叶片单位叶面积叶绿素含量在5.7~8.9mg·dm-2范围内,2种杨树之间叶绿素含量存在显著差异,4种松树的叶绿素含量也并不一致。其中油松、白皮松针叶与速生杨叶片的叶绿素含量相差不大。
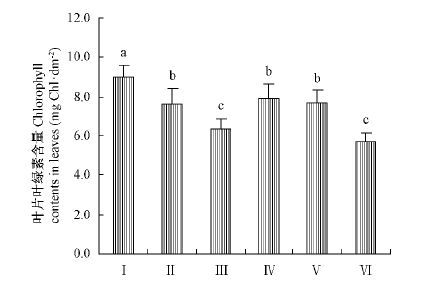
|
图1 杨树与松树叶片的叶绿素含量 Fig.1 Chlorophyll contents in leaves of Populus trees and Pinus trees 图中数据为平均值±标准差,标有不同字母表示差异显著(P< 0.05)。The data in Tab.1 are mean±SD. Different letters in the same column meant significant difference at 0.05 level.下同。The same below. |
松树和杨树的净光合速率(Pn)差异非常显著,两种杨树叶片的Pn均在23μmolCO2·m-2s-1以上,而4种松树Pn都低于9μmolCO2·m-2s-1,其中赤松的Pn最大为8.44μmolCO2·m-2s-1,油松、白皮松和华山松的Pn仅为4μmolCO2·m-2s-1左右(图 2)。
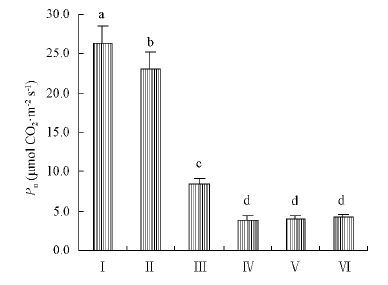
|
图2 杨树与松树叶片的净光合速率 Fig.2 Net photosynthetic rate of Populus trees and Pinus trees |
从松树和杨树OJIP原始曲线(图 3A)可以看出,在相同照光叶面积条件下,4种松树的荧光信号显著低于2种杨树。2种杨树健康功能叶片的叶绿素快相荧光动力学曲线属于典型的OJIP曲线,具有明显的O,J,I,P相。但4种松树的叶绿素快相荧光动力学曲线上均没有明显的I相(30ms),到达P相的时间快于杨树,这是4种松树OJIP曲线的共同特征。

|
图3 杨树与松树叶片的叶绿素a 快相荧光动力学曲线 Fig.3 Fast chlorophyll a fluorescence curves of Populus trees and Pinus trees Ⅰ: 毛白杨P.tomentosa;Ⅱ:速生杨P.euramericana;Ⅲ:华山松P.armandii; Ⅳ:白皮松P.bungeana;LⅤ:油松P.tabulaeformis; Ⅵ:赤松P.densiflora;下同。The same below.A.原始荧光数据绘制的曲线。The curves in drawn with the raw fluorescence data.B.用Fm-Fo进行标准化后的相对可变荧光曲线,Vt=(Ft-Fo)/(Fm-Fo)(Ft指任意时刻的荧光)。The curves drawn with the relative variable fluorescence data (Vt= Ft-Fo)normalized with Fm-Fo(Ft is the fluorescence at any time).C.以毛白杨为对照,其他5种树种为处理,对照和处理可变荧光差值(ΔVt)曲线,ΔVt=Vt(处理)-Vt(对照)。The curves drawn with subtraction of the relative variable fluorescence data (ΔVt),ΔVt=Vt(sample)-Vt(control). |
进行快相荧光动力学诱导时,虽然照光面积和照光强度相同,但不同物种及同一物种不同发育阶段叶片的OJIP曲线变异性较大,往往不具可比性。通过数学方法把荧光信号数据标准化,可以使所有曲线具有相同的起点、中点或终点,这样无论测定样品的形态、属性、大小是否相同,都可以进行比较。最常见的数据处理方法是用Fm-Fo进行标准化,标准化的荧光数据称为相对可变荧光,用“Vt”表示,Vt=(Ft-Fo)/(Fm-Fo)(Ft指任意时刻的荧光数值)。用Vt绘制的OJIP曲线O相的荧光强度均为0,P相的荧光强度均为1(图 3B),从中可以看出,4种松树标准化的OJIP曲线中I相仍然不明显,J相荧光明显低于2种杨树。为了更清楚地观察到树种间荧光动力学的差异,可以用图 3B中一个曲线为对照(本文以毛白杨为对照),然后用所有曲线与对照曲线的Vt之差(ΔVt)重新作图,这样对照就成了一条直线(图 3C)。ΔVt曲线显示,2类树种OJIP曲线最大差异出现在2,30,200ms左右,即J相、I相和P相。
用专用软件解析荧光动力学曲线可以得到反映光反应的50多个荧光参数。本文将最基础的和具有生理意义的39个荧光参数列于图 4,省去了10余个中间运算参数和重复参数。为便于比较不同树种的参数值,图 4中以毛白杨的荧光参数作为100%,用其他树种的荧光参数与毛白杨荧光参数的比值绘制成雷达图。荧光参数结果显示,毛白杨、速生杨、赤松、油松、白皮松、华山松叶片的PSⅡ最大光化学效率(Fv/Fm)均在0.832左右(分别为0.848,0.853,0.825,0.825,0.819,0.829),说明所选6种树种的叶片都是成熟健康的功能叶(BjÖrkman et al., 1987)。但松树的PSⅡ捕获光能与热耗散能量比例(Fv/Fo)显著低于2种杨树、热耗散量子比率(Fo/Fm、φDo)则显著高于2种杨树,说明松树的光能利用效率较低,松树的PSI相对活性(φRo)也显著低于杨树。不过,2类种树PSⅡ捕获光能用于电子传递的量子比率(φEo)差异不大。
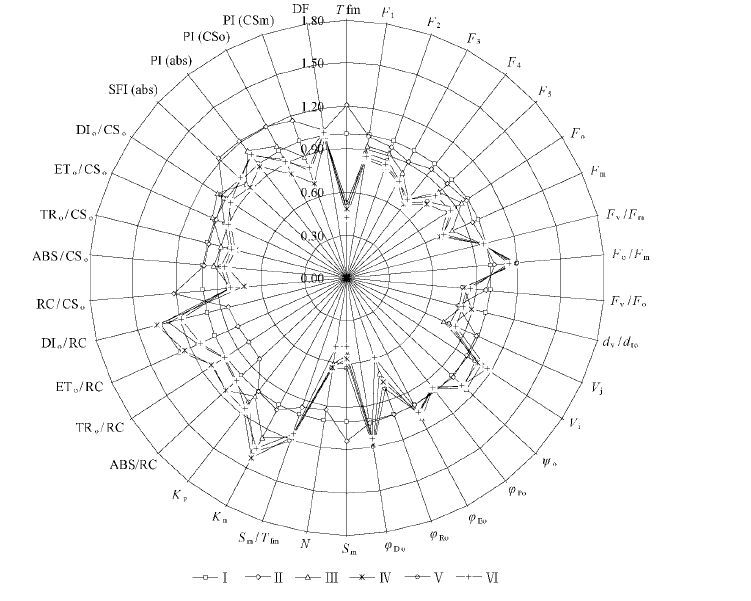
|
图4 杨树与松树叶绿素荧光参数比较 Fig.4 Radar plot of fluorescence data of Populus trees and Pinus trees |
2类树种到达P相的时间(Tfm)显著不同,松树大约为200~300ms,杨树大约为500~600ms;松树J相的相对可变荧光强度(Vj)明显低于杨树,所以松树PSⅡ捕获能量从QA传递到QB的效率(ψET=1-Vj)高于杨树,也就是说松树的PSⅡ反应中心QA的活性并不低,松树和杨树PSⅡ反应中心的原初光化学活性(Mo)也相差不大。但松树I相的相对可变荧光强度(Vi)显著高于杨树,因此PSⅡ捕获能量从QB传递到PSI的效率(ψRE=1-Vi)较低。松树针叶的另一个显著特点是其质体醌库(Sm)很小,仅为毛白杨的50%左右,质体醌的周转次数(N)也很小,仅为毛白杨的50%~70%,导致松树质体醌库还原速率(Sm/Tfm)较快,迅速达到P相(图 4)。松树的单位激发态面积反应中心数目(RC/CSm)较少也是其显著特征,约为毛白杨的60%~70%,由于照光面积和光照强度相同,所以松树每个PSⅡ反应中心接受的能量增多,表现为单个反应中的吸收的光量/被反应中心捕获的光量/用于电子传递的能140第3期邱念伟等:松树与杨树叶片叶绿素快相荧光动力学特征比较量/热耗散的能量(ABS/RC,TRo/RC,ETo/RC,DIo/RC)以及光化学反应的速率常数(Kp)和非光化学反应的速率常数(Kn)均相对高于杨树。但其单位激发态面积吸收的能量/被反应中心捕获的能量/用于电子传递的能量/热耗散的能量(ABS/CSm,TRo/CSm,ETo/CSm,DIo/CSm)仍是明显低于杨树的。在叶片荧光综合功能指数中,松树的结构功能指数(SFI)、性能指数[PI(ABS/CSo/CSm)]均小于毛白杨,但速生杨的这些荧光综合指数也小于毛白杨,且与松树差异不大。只有松树的PI(CSm)小于2种杨树,通过相关性分析发现,6种树种的PI(CSm)与它们的光合速率(Pn)呈正相关(r2=0.8814,P>0.05)。因此,PI(CSm)可以作为量化比较不同树种的光反应活性的参考指标。
3 讨论光合作用光反应和暗反应是相辅相成的,光合速率是光反应活性和碳同化活性的综合体现。本项研究所选的2种杨树叶片光合速率均在23μmolCO2·m-2s-1以上(图 2),邹建军等(2009)测定了13个杨树品系的光合速率,也均在18~30μmolCO2·m-2s-1。而松树单位面积叶片的光合速率普遍较低,均不超过10μmolCO2·m-2s-1,最低仅为4μmolCO2·m-2s-1左右(图 2)。因此,松树单位面积叶片的光合能力显著低于杨树。很多文献数据显示,松树针叶的碳同化活性和光能利用效率也均显著低于杨树叶片。如正常条件下不同杨树品系健康功能叶片的羧化效率在0.05~0.07之间(钱莲文等,2008),而松树的羧化效率在0.02~0.04之间(梁军生等,2009;赵天宏等,2009);松树针叶的表观量子效率也显著低于杨树叶片(梁军生等,2009;赵天宏等,2009)。这些结果可以初步解释松树针叶光合能力低于杨树的原因。但是,上述结果是碳同化启动后叶片光合能力的综合体现,不能获得叶片光反应能力的详细信息。
叶绿素快相荧光动力学则可以详细分析光反应过程和效率,且不受暗反应过程的影响。完整的叶绿素快相荧光动力学曲线由O/L/K/J/I∥H/G/P相组成,分别代表QA/未知可能组分(groupingprobability,PG)/放氧复合体(OEC)/QA-/QB-/QB2-/QBH2/电子受体最大还原态(electron carriers,ECred)的电子传递过程。其中,L相和K相只有植物材料经特殊处理或特殊状态下才能观察到;I/H/G3相反映的是QB的电子传递情况,此3相很难清楚地区分开,故统称“I相”,一般以30ms的荧光作为I相荧光强度(F5)。因此,典型的快相荧光动力学曲线均具有O/J/I/P相,又称为“OJIP曲线”(Tsimilli-Michael et al., 2008)。2类树种的OJIP曲线显示,2种杨树叶片的快相荧光动力学曲线均为典型的O/J/I/P相,图形与其他杨树品种类似(Bussotti et al., 2007; Bussotti et al., 2011)。与杨树相比,4种松树单位照光叶面积产生的荧光信号较弱(F1,F2,F3,F4,F5较小),其中I相不明显且信号最弱(F5),到达P相的时间较快(图 3A和图 4)。标准化OJIP曲线则显示,松树的OJIP曲线中J相相对荧光强度明显低于杨树,而I相相对荧光强度明显高于杨树(图 3C)。生化试验证据表明:QA和QB活性影响J相和I相荧光强度及达到P相的时间(Schansker et al., 2011)。因此,J,I,P相的特征反映了2类树种在QA和QB电子传递活性方面存在差异。
解析OJIP曲线得到的荧光参数可以更系统地分析2类树种在光反应结构与活性方面的差异,主要表现在以下2个方面:1)松树质体醌库(Sm)较小、QA的周转次数(N)少于杨树,质体醌库还原速率(Sm/Tfm)则明显快于杨树(图 4)。由于植物的质体醌库具有异质性(Strasser et al., 1995),快还原型PQ库先被完全还原(J-I相),随后才是慢还原型PQ库被还原(I-P相),这说明松树的I相不明显是由于慢还原型PQ库较小造成的。松树的质体醌库(Sm)较小,导致PQ库还原速度较快,所以松树到达P相的时间较短(Tfm),I相和P相重叠,这是松树OJIP曲线的典型特征。松树QA的周转次数(N)少也说明松树的PQ库相对较小(Strasser et al., 2000; 李鹏民等,2005)。2)松树单位激发态面积的反应中心数目(RC/CSm)较少。反应中心密度小,使得相同光照下的每个反应中心承受的光能增加,因而松树单位反应中心的能量流动(ABS/RC,TRo/RC,ETo/RC,DIo/RC)相对高于杨树,但松树单位激发态面积的比活性(ABS/CSm,TRo/CSm,ETo/CSm,DIo/CSm)明显小于杨树(图 4)。3)松树PSⅡ反应中心光化学活性与杨树差异不大。松树的原初光化学反应速率(Mo)与杨树差异不大,QA的电子传递效率(ψET)甚至高于杨树,而QB传递到PSI的效率(ψRE)较低。说明制约松树光反应活性的关键因素不是反应中心(QA),而是QB。综上所述,松树单位面积的反应中心数目及质体醌库的大小是影响其光反应活性的2个重要因素。反应中心数目少,捕获光能总能力就低,质体醌少,利用光能的效率就低,最终表现为松树的结构指数(SFI)和性能指数(PI)较低。在众多141林业科学49卷电子传递体中,QB的数量和活性尤为重要,因为QB是光合电子传递链中含量最多的电子传递体,其含量可达叶绿素分子的1/7,它既能传递电子,又能传递质子,是光合电子传递的关键步骤和限速环节,决定电子传递的速度和效率(Strasser et al., 2000; 李鹏民等,2005; Alex and rina et al., 2011)。在众多荧光参数中,性能指数PI 早已被证明是反映植物光反应能力的最为灵敏的荧光参数之一(Strasser et al., 2000; Alex and rina et al., 2011)。本文结果显示,PI(CSm)与2 类树种的光合速率(Pn)呈正比(图 1和图 4),这一现象在几种灌木光合作用研究中也有发现(Rolo et al., 2011),亦有文献用它来衡量城市绿化树种的光合能力(Hermans et al., 2003),因此可以作为评价不同树种光反应能力的参数。
4种松树单位面积针叶的光反应活性和效率均显著低于杨树,在快相荧光动力学曲线上最显著的特征是没有明显的I相。通过解析荧光参数发现,单位面积的反应中心数目较少及质体醌库的较小是影响其光反应活性的2个重要因素。此外,由于光反应和碳同化活性有协同效应,文献数据证明松树的碳同化活性也显著低于杨树。这一发现对松树的育种及生态学研究具有一定的参考价值,也有助于拓宽叶绿素快相荧光动力学技术在松树光合作用研究领域的应用。
| [1] |
段爱国,保尔江,张建国,等.2008.华山松不同叶龄、部位针叶叶绿素荧光参数的动态变化规律.北京林业大学学报:自然科学版,30(5):26-32.( 1) 1)
|
| [2] |
李鹏民,高辉远,StrasserRJ.2005.快速叶绿素荧光诱导动力学分析在光合作用研究中的应用.植物生理与分子生物学学报,31(6):559-566.( 5) 5)
|
| [3] |
梁军生,陈晓鸣,杨子祥,等.2009.云南松与华山松人工混交林针叶光合速率对光及CO2浓度的响应特征.林业科学研究,22(1):21-25.( 2) 2)
|
| [4] |
刘爽,王庆成,刘亚丽,等.2009.土壤酸度对脂松苗木光合和叶绿素荧光的影响.应用生态学报,20(12):2905-2910.( 1) 1)
|
| [5] |
刘亚丽,王庆成,杨远彪.2011.水分胁迫对脂松幼苗叶绿素荧光特征的影响.植物研究,31(2):175-179.( 1) 1)
|
| [6] |
唐礼俊,李渤生,唐崇钦,等.1997.华山松叶绿素荧光诱导动力学参数的地理变异及其与树高生长的关系.植物生态学报,21(5):474-479.( 1) 1)
|
| [7] |
钱莲文,张新时,郭建宏,等.2008.半常绿-常绿杨树3个品系光合特性研究.北京师范大学学报:自然科学版,44(4):424-428.( 1) 1)
|
| [8] |
汪杰,张纯明.2004.两种针叶树种光合特性研究.水土保持学报,18(5):159-162.( 1) 1)
|
| [9] |
张其德.1985.测定叶绿素的几种方法.植物学通报,3(5):60-64( 1) 1)
|
| [10] |
赵天宏,王美玉,赵艺欣,等.2009.大气O3浓度升高对城市油松光合作用的影响.北京林业大学学报,31(1):31-36.( 1) 1)
|
| [11] |
邹建军,赵云,林学巍,等.2009.不同杨树品系光合作用的研究.吉林林业科技,38(1):6-9.( 1) 1)
|
| [12] |
Adams III W W,Demmig-Adams B.2004. Chlorophyll fluorescence as a tool to monitor plant response to the environment.∥Papageorgiou G C,Govindjee. Advances in Photosynthesis and Respiration Series.Dordrecht,NL: Springer,583-604.( 1) 1)
|
| [13] |
Alexandrina S,Govindjee.2011. On the relation between the Kautsky effect(chlorophyll a fluorescence induction)and photosystem Ⅱ:Basics and applications of the OJIP fluorescence transient. Journal of Photochemistry and Photobiology B: Biology,104(1-2):236-257.( 5) 5)
|
| [14] |
Bolhàr-Nordenkampf H R,Öquist G.1993. Chlorophyll fluorescence as a tool in photosynthesis research ∥ Hall D O,Scurlock J M O,Bolhàr-Nordenkampf H R,et al. Photosynthesis and Production in A Changing Environment. London: Chapman & Hall,193-206.( 1) 1)
|
| [15] |
BjÖrkman O, Demmig B.1987. Photo yield of O2 evolution and chlorophyll f luorescence characteristics at 77 K among vascular plants of diverse origins.Planta,170(4):489-504.( 2) 2)
|
| [16] |
Bussotti F,Strasser R J,Schaub M.2007.Photosynthetic behavior of woody species under high ozone exposure probed with the JIP-test—a review.Environmental Pollution,147,430-437.( 2) 2)
|
| [17] |
Bussotti F,Desotgiu R,Cascio C,et al.2011.Ozone stress in woody plants assessed with chlorophyll a fluorescence.A critical reassessment of existing data.Environmental and Experimental Botany,73(1):19-30.( 2) 2)
|
| [18] |
Han S,Tang N,Jiang H X,et al.2009.CO2 assimilation,photosystem II photochemistry,carbohydrate metabolism and antioxidant system of citrus leaves in response to boron stress.Plant Science,176(1):143-153.( 1) 1)
|
| [19] |
Hermans C,Smeyers M,Rodriguez R M.2003.Quality assessment of urban trees: A comparative study of physiological characterisation, airborne imaging and on site fluorescence monitoring by the OJIP- test.Journal of Plant Physiology,160(1):81-90.( 1) 1)
|
| [20] |
Koehn A C,Roberds J H,Doudrick R L.2003.Variation among slash pine families in chlorophyll fluorescence traits.Canadian Journal of Forest Research,33(6):1102-1109.( 1) 1)
|
| [21] |
Lehner G,Lütz C.2003.Photosynthetic functions of cembran pines and dwarf pines during winter at timberline as regulated by different temperatures,snowcover and light.Journal of Plant Physiology, 160(2):153-166.( 1) 1)
|
| [22] |
Maxwell K,Johnson G N.2000.Chlorophyll fluorescence-a practical guide.Journal of Experimental Botany,51(345):659-668.( 2) 2)
|
| [23] |
McGarvey R C, Martin T A,White T L.2004.Integratingwithin-crown variation in net photosynthesis in loblolly and slash pine families.Tree physiology,24(11):1209-1220.( 1) 1)
|
| [24] |
Myers D A,Thomas R B,Delucia E H.1999.Photosynthetic responses of loblolly pine(Pinus taeda)needles to experimental reduction in sink demand.Tree Physiology,19(4 /5):235-242.( 1) 1)
|
| [25] |
Rolo V, Moreno G.2011.Shrub species affect distinctively the functioning of scattered Quercus ilex trees in Mediterranean open woodlands.Forest Ecology and Management, 261(11):1750-1759.( 1) 1)
|
| [26] |
Schansker G, Tóth S Z, Kovács L, et al.2011.Evidence for a fluorescence yield change driven by alight-induced conformational change within photosystem II during the fast chlorophyll a fluorescence rise.Biochimica et Biophysica Acta, 1807(9):1032-1043.( 1) 1)
|
| [27] |
Strasser R J,Srivastava A,Govindjee.1995.Polyphasic chlorophyll a fluorescence transient in plants and cyanobacteria.Photochemistry and Photobiology,61(1):32-42.( 3) 3)
|
| [28] |
Strasser R J,Srivastava A,Tsimilli-Michael M.2000.The fluorescence transient as a tool to characterise and screen photosynthetic samples ∥ Yunus M, Pathre U, Mohanty E.Probing Photosynthesis: Mechanisms, Regulation and Adaptation.London: Taylor & Francis,445-483.( 7) 7)
|
| [29] |
Tsimilli-Michael M, Strasser R J.2008.Experimental resolution and theoretical complexity determine the amount of information extractable from the chlorophyll fluorescence transient OJIP∥ Allen J F,Gantt E,Golbeck J H,et al.Photosynthesis.Energy from the Sun: 14 th International Congress on Photosynthesis.Dordrecht, NL: Springer,697-701.( 1) 1)
|
| [30] |
Tyystjrvi E,Koski A,Kernen M,et al.1999.The Kautsky curve is a built-in barcode.Biophysical Journal,77(2):1159-1167.( 1) 1)
|
| [31] |
Wu J B,Guan D X,Sun X M,et al.2006.Photosynthetic characteristics of dominant tree species and canopy in the broadleaved Korean pine forest of Changbai Mountains.Science in China Series D: Earth Sciences,49(2):89-98.( 1) 1)
|
| [32] |
Zhang S R,Dang Q L.2005.Effects of soil temperature and elevated atmospheric CO2 concentration on gas exchange, in vivo carboxylation and chlorophyll fluorescence in jack pine and white birch seedlings.Tree Physiology,25(5):523-531.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49
