文章信息
- 闵鹏, 齐代华, 贺丽, 唐元会, 周旭
- Min Peng, Qi Daihua, He Li, Tang Yuanhui, Zhou Xu
- 四川山矾幼树叶功能性状在毛竹干扰下的响应
- Response of Leaf Functional Traits of Symplocos setchuanensis Seedling to Different Disturbances Induced by Phyllostachys edulis
- 林业科学, 2013, 49(3): 70-77
- Scientia Silvae Sinicae, 2013, 49(3): 70-77.
- DOI: 10.11707/j.1001-7488.20130310
-
文章历史
- 收稿日期:2012-04-01
- 修回日期:2013-01-15
-
作者相关文章
植物功能性状(plant function traits,PFT)是指能够响应生存环境的变化或对生态系统功能有一定影响的植物性状,它对于指示植物与环境之间的关系,研究植物随环境影响而发生的变化具有十分重要的意义(Diaz et al,2001)。植物叶片功能性状(leaf functional traits,LFT)作为植物功能性状的一种与植物的生长对策及植物利用资源的能力等方面具有紧密联系,并且植物叶片对环境变化敏感且可塑性大(Bill et al., 2003; Denis et al., 2005),从而能够很好的反应出植物适应环境变化所形成的生存对策(Vendramini et al., 2002; Westoby,1998)。
比叶面积(specific leaf area,SLA)是叶片主要的功能性状之一(张林等,2004),它可以较好地反映出植物生长对策及植物利用资源的能力,对于生物量大小、生态系统功能等方面也有所体现(Vendramini et al., 2002; Westoby,1998; Craine et al., 2001; Weiher et al., 1999),并且不易受衰老和叶片结构和化学成分的影响(Quested et al., 2007)。而植物比叶面积的大小也会影响到植物氮磷元素的含量。其中植物体中的氮元素是植物结构的重要构成部分,而且还是生理代谢过程中众多活性蛋白和酶的成分元素,氮素对植物光合器官的合成和活性具有十分重要的调节作用(Maroco et al., 2002),从而影响着植物光合能量的分配和利用效率(Evans et al., 2001; 张绪成等,2009)。而磷元素则是植物必需的营养元素之一,它是植物体内有机化合物核酸、磷脂等的主要组成成分,同时它也可以作为底物或调节物直接或间接的参与光合作用的光合磷酸化和碳同化等重要过程(潘晓华等,1997),从而影响植物的光合作用。然而植物的光合作用除受到植物氮磷含量的影响外,还与植物叶绿素的含量与比例等密切相关。叶绿素a作为反应中心色素参与光能转换,而叶绿素b主要为天线色素与光能吸收与传递密切相关,叶绿素a∶ b的大小则可以反映出植物对于光环境变化的适应情况,是判断植物所处生境差异的重要因子之一。
四川山矾(Symplocos setchuanensis)为山矾科(Symplocos)常绿阔叶乔木,其种群为缙云山国家级自然保护区亚热带常绿阔叶林演替前期的优势种群(刘青松等,2006)。优势种群决定着群落结构和群落环境的特征,从而决定着群落的物种组成。演替前期优势种的发展动态,关系到群落向顶级演替能否顺利进行,并对群落演替有着十分重要的指示作用。然而竹林作为干扰树种可以从光环境、土壤环境等因素对于植物群落演替过程中林下植物的分布与优势度产生影响(Taylor et al., 2004)。目前对于竹林与森林发育关系的研究工作主要集中于种群分布、竹类的生物学特性、竹类种群生态学及竹类对森林群落结构的影响等方面(魏辅文等,1999; 周世强等,2000; 陶建平等,2006; 王微等,2007; 王永健等,2007; 李媛等,2007; Taylor et al., 1992;1993;1996;2004; Yu et al., 2006; Tao et al., 2007;Wang et al., 2006;2007;2009)。以上对于竹类的研究多集中于小径竹的研究,对于毛竹(Phyllostachys edulis)等经济竹类的研究又多考虑群落学方面的影响,而对于毛竹干扰下常绿阔叶林树种叶片功能性状适应方式的研究则较少。研究四川山矾幼树对于毛竹干扰影响下的适应方式,有利于揭示亚热带常绿阔叶林演替前期树种对于竹林影响在功能性状上的响应对策,从而可以为进一步研究退化生态系统的生态恢复、生物多样性保护及森林可持续经营提供理论依据。
1 材料与方法 1.1 研究区概况缙云山国家级自然保护区(以下简称“缙云山”)位于重庆市西北面,地理位置介于106°17'43″—106°24'50″ E,29°41'08″—29°52'03″ N之间,总面积7600.0hm2,最低海拔180.0m,最高海拔952.2m。缙云山常绿阔叶林是我国亚热带常绿阔叶林的典型代表,植物种类异常丰富,具有保存完好的常绿阔叶林生态系统,为科学研究提供了非常理想的场所。
1.2 样地设置与样品采集 1.2.1 样地设置在缙云山毛竹林与常绿阔叶林生长区域设置样地,分别设置2 块毛竹重度干扰的纯竹林(以下用Z1,Z2 代表),2 块毛竹中度干扰的竹阔混交林(以下用H1,H2 代表)和2 块无毛竹干扰的纯阔叶林(以下用K1,K2 代表)共6 块样地。样地面积为20m ×20m。相同类型样地的数据进行合并分析。在每块样地中选择3 ~5 株高度相近、长势基本一致的四川山矾幼树作为测定样株,共计24 株。6 块样地的基本特征见表 1,其中林分郁闭度运用Hemiview冠层分析系统(Delta-T,DevicesLtd,UK)获得,其他数据均为实地调查所得。
|
|
在测定样株上分别选取第2 至第5 侧枝的当年生、健康无病虫害叶片10 ~15 片用塑封带装好,并以样株为单位进行编号,带回实验室进行叶片方面的测定。
1.3 分析方法在每个样株的叶片内随机选取5 片进行比叶面积以及叶片N,P含量的测定,另随机选取5 片进行叶片光合色素含量的测定。
1.3.1 比叶面积测定运用根系扫描仪(EPSONExpression10000XL,USA)进行植物叶片面积的测定,将测定完面积的叶片用信封纸装好并编号,放入烘箱内60 ℃烘48h,待至恒质量后测定叶片的干物质质量,从而计算叶片的比叶面积。
1.3.2 叶片氮磷含量测定将测定比叶面积的烘干叶片,利用球磨仪(MM200,Retsch,Haan,Germany)将其磨成粉末进行叶片氮磷含量的测定,待测样品用H2SO4-HClO4消煮后,运用凯氏定氮蒸馏法测定叶片氮含量(Leaf nitrogen content,LNC),钼锑抗比色法测定叶片磷的含量(Leaf phosphoruscontent,LPC)。
1.3.3 叶片光合色素测定将待测叶片去除主脉与叶柄,剪碎后称质量,将称好的叶片碎片放入已编号的刻度试管中,加入15mL丙酮与无水乙醇1 ∶1的混合溶液,封盖、震荡,放置黑暗的条件下24h,待叶片中色素浸提完毕后,运用UV -2550 紫外可见光分光光度计(日本岛津)在645和663nm测定吸光率并按照Arnon(1949)的经典公式计算提取液中光合色素的浓度。
1.4 数据处理利用EXCEL软件进行基础数据输入。采用SPSS17.0 分析软件(SPSS17.0for Windows,Chicago,USA)对于毛竹不同干扰程度下四川山矾幼树的比叶面积、叶片氮磷含量、叶光和色素含量进行One-way ANOVA以及相关性分析。
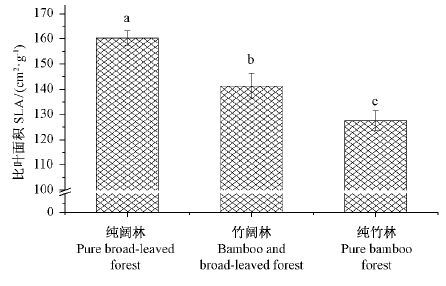
2 结果与分析 2.1 毛竹干扰下四川山矾幼树比叶面积的差异比叶面积(SLA)是反映林分内光照强度的指标,其数值大小直接受叶片厚度、形状和重量等方面的影响。比叶面积的大小能在一定程度上代表植物对环境资源的利用方式和能力,与环境适应对策关系密切(Ren et al., 2007; Duren et al., 2000; Yan et al., 2008)。在荫蔽条件下,叶片可以通过增大比叶面积来提高截获光的能力,从而提高光合作用的能力。若植物生活在强光下叶片则倾向于减小比叶面积来进行自我保护(Cornelissen et al., 2003)。毛竹不同干扰程度下四川山矾幼树比叶面积的大小如图 1 所示。四川山矾幼树比叶面积的大小随着毛竹干扰程度的增加具有减小的趋势,并且这一趋势具有极显著的差异(P <0.01)。这与表 1 中随着毛竹干扰程度的增大,群落的郁闭度逐渐降低的事实相互印证。
|
图1 毛竹不同干扰程度下四川山矾幼树比叶面积差异 Fig.1 The differences of specific leaf area ( SLA) of S. setchuanensis seedlings under different disturbance degrees in Ph. edulis forest |
氮磷元素是植物生长所需要重要的营养元素,也是陆地生态系统植物生长的主要限制因子(Ren et al., 2007)。氮磷元素的含量、分配比例直接关系到植物的生长以及植物对于环境的适应方式。对于植物叶片而言,氮元素既是叶片主要的结构物质,又是叶绿素、光合酶等主要的组成成分,并与碳的固定能力呈正相关关系(Wright et al., 2004; Zhao et al., 1998)。而磷元素则是核酸、膜脂以及直接能源ATP的主要组成成分,与植物的生长速率密切相关(Zeng et al., 2005)。不同干扰程度下四川山矾幼树叶片氮磷含量差异如表 2 所示。其中叶氮(LNC)和叶磷(LPC)分别基于质量和面积进行计算,即单位质量叶氮含量(Nmass)、单位质量叶磷含量(Pmass)、单位面积叶氮含量(Narea)、单位面积叶磷含量(Parea)。
|
|
由表 2 可见: 随着毛竹干扰程度的增强,四川山矾幼树Nmass,Narea,Parea的含量也随之增加,其中Narea在3 种干扰程度下均有显著的差异(P <0.05)。而Nmass和Parea的含量在纯竹林中显著高于其他2 种干扰程度。而对于Pmass与LNC∶ LPC在毛竹不同干扰程度下均无显著差异(P >0.05)。
2.3 毛竹干扰下四川山矾幼树叶片叶绿素分析叶绿素是植物叶片进行光合作用的主要色素,叶绿素含量与比例的多少一方面关系到植物进行光合作用的能力,另一方面也反映出植物适应环境的对策。毛竹不同干扰程度下四川山矾幼树叶绿素a(chla)、叶绿素b(chlb)、叶绿素a与叶绿素b的和(chla + chlb)以及叶绿素a与叶绿素b的比值(chla∶ chlb)的变化趋势如表 3 所示。从表中可以看出,c hla,chlb和chla + chlb的含量随着毛竹干扰程度的增加出现极显著的下降趋势(P<0.01)。而chla∶ chlb的变化则是随着毛竹干扰程度的增加而有所增大,其中纯竹林的比值显著高于其他2 种干扰程度的比值(P<0.05)。
|
|
毛竹不同干扰程度下叶片各功能性状间相关性分析如表 4 所示。虽然毛竹干扰程度有所不同,但四川山矾幼树叶片Chla与Chlb含量始终呈极显著的正相关(P<0.01),Chlb和Chla + Chlb均与Chla∶ Chlb始终呈极显著的负相关关系(P<0.01),LNC与LPC始终呈显著的正相关关系,同时LNC与LNC∶ LPC和SLA两者之间始终呈显著(P<0.05)或极显著(P<0.01)的正相关关系,LPC与LNC: LPC始终呈极显著的负相关(P<0.01),此结果与赵红洋等(2010)对于科尔沁沙地52 种植物叶片性状变异特征研究中LNC,LPC,LNC∶ LPC与SLA之间的相互关系相一致。而且也与吴统贵等(2010)对于珠江三角洲3 种典型森林类型乔木叶片生态化学计量学的研究以及任书杰等(2007)对于中国东部654 种植物叶片氮磷含量的研究中对于氮磷关系的描述相互照应,同时也证实了磷元素在毛竹不同干扰程度的样地是限制元素。然而叶片氮磷含量与叶绿素含量之间没有存在明显的相关关系。
|
|
近年来对于比叶面积的研究较多,Cornelissen等(2003)的研究表明,在资源不足的环境中或在强光的条件下植物倾向于更小的比叶面积。这可能是由于植物在充足的光照条件下通过减少受光面积、增加叶片厚度防止强光的灼伤,或是优化资源配置将营养元素分配到幼树的其他部位促进生长。这与本试验中四川山矾幼树的适应结果相一致。
通常条件下,植物叶片中的氮含量会随光照条件的增加而有所下降,但当光照和土壤元素供应双重因素影响时,土壤中氮元素的含量对于叶片氮含量会起到决定性的作用。
霍常富等(2008)对于光照和氮交互作用对水曲柳(Fraxinus m and shurica)幼苗生长的研究中发现,叶片氮分配比例随氮供给浓度的增加具有明显增加的趋势。Tripathi等(2006)对于竹林土壤中元素含量的研究中发现竹林存在的地区土壤氮素含量较高的现象,刘西军等(2008)对于安徽省老山自然保护区不同森林类型土壤中的元素含量的研究中也得出了相似的结论。这也与本试验中随毛竹干扰程度增加四川山矾幼树叶片氮含量增加的结果相一致。而对于植物叶片氮磷比作为判断养分供应状况的研究中,生态化学计量学理论提供了较为充分的理论支撑。其中Güeswell(2004)和Koerselman等(1996)针对欧洲无林湿地植物化学计量比的研究中发现,湿地植物叶片氮磷比变化范围在3 ~40 之间,同时他们的研究还确定了判断养分供应情况的叶片氮磷比范围,他们认为叶片氮磷比在大约15 时被认为是临界状况,当氮磷比大于16 时,植物生长受磷的限制较大; 相反,植物生长对N的需求较强烈。本试验中3 种毛竹干扰样地中的氮磷比均大于16,说明了样地内磷是主要限制元素。
许多学者对于植物在干扰条件下叶绿素含量的变化进行了深入的研究。周忆堂等(2008)、孙晓方等(2008)以及李伟等(2006)分别对长春花(Catharanthus roseus)、加拿大一枝黄花(Solidagocanadensis)和三叶漆(Terminthia paniculata)幼苗的光合特征与叶绿素含量在不同光照条件下的变化进行了研究,结果表明: 叶绿素的含量随光照强度的增加而有所下降,但叶绿素的比值则有所升高。高明月等(2011)则对胡杨(Populus euphratica)和新疆杨(P. bolleana)苗期的叶绿素在不同土壤水分条件下的变化也进行了深入的探索,得出了随着田间最大持水量的降低,叶绿素含量呈先升后降再升高的结论。可见叶绿素含量随着干扰程度的增加具有一定的变化规律。这也与本试验所得出的研究结果相一致。也有研究表明: 光合作用反应中心P700 是叶绿素二聚体分子,由110 个Chla与少量的Chlb结合蛋白质组成,而另一个反应中心P680 的Chla∶ Chlb则为30∶1,而捕光复合体(LHC)的Chla∶ Chlb约为1.12∶1(Lambers,2005),在光照充足的情况下叶片中叶绿素倾向于合成更多的反应中心来利用更多的光照,导致Chla∶ Chlb增加,而在光照不充足的条件下叶绿素倾向于合成更多的LHC来吸收更多的光,导致Chla∶ Chlb减小,从而叶绿素比例的大小也可以反映出不同干扰类型下相对光照条件的情况。
植物功能性状间的相关关系不仅与各功能性状间的协同与拮抗的功能有关而且还与各功能性状所处环境中的养分条件密切相关。已有研究证明,有机体C∶ N∶ P比的变化主要是由生物体P含量的变化决定(Vanni et al., 2002),生长快速的有机体通常具有较低的C∶ P和N∶ P比值(Elser et al., 2003;Makino et al., 2003),植物叶片氮磷比率主要受磷元素含量的影响(He et al., 2006;2008)。从本试验中对于叶片氮磷相关性分析来看,LPC与LNC: LPC始终呈极显著负相关(P<0.01)。这与吴统贵等(2010)、任书杰等(2007)的研究得出的结果相似。也有研究表明: 我国土壤全磷量平均约为0.56mg·g -1(Han et al., 2005),而位于南亚热带的鼎湖山森林土壤含磷量为0.15 ~0.3mg·g -1,这说明土壤P库具有随纬度降低而降低的规律(Hedin,2004; Zhang et al., 2005)。另外,我国南亚热带氮沉降量不断增加,土壤中的氮磷比失调,使得P成为生态系统生物生长和重要生态过程的限制因子(He et al., 2002)。本试验地缙云山自然保护区位于亚热带常绿阔叶林带,又一次证明磷元素是毛竹不同干扰程度的样地中的限制元素这一事实。
通过本试验的研究发现,随着毛竹干扰程度的不断增加,四川山矾幼树生境条件发生了明显的变化,四川山矾幼树叶片则通过降低叶片比叶面积与叶绿素含量,增加叶片氮磷含量来适应毛竹对其干扰。同时也证明了缙云山亚热带常绿阔叶林带土壤内磷元素较为缺乏,植物生长主要的限制因子是磷元素的事实。然而相关性分析中叶片氮磷含量与叶绿素含量没有明显的相关关系,具体原因还有待进一步的研究与探索。
| [1] |
高明月,吉小敏,靳开颜.2011.不同水分条件下胡杨和新疆杨苗期叶绿素变化.防护林科技,(2):6-8.( 1) 1)
|
| [2] |
霍常富,王政权,孙海龙,等.2008.光照和氮交互作用对水曲柳幼苗生长、生物量和氮分配的影响.应用生态学报,19(8):1658-1664.( 1) 1)
|
| [3] |
LambersH,ChapinlllFS,PonsTL.2005.植物生理生态学.张国平,周伟军,译.杭州:浙江大学出版社,8-13.( 1) 1)
|
| [4] |
李伟,曹坤芳.2006.干旱胁迫对不同光环境下的三叶漆幼苗光合特性和叶绿素荧光参数的影响.西北植物学报,26(2):266-275.( 1) 1)
|
| [5] |
李媛,陶建平,王永健,等.2007.亚高山暗针叶林林缘华西箭竹对岷江冷杉幼苗更新的影响.植物生态学报,31(2):283-290.( 1) 1)
|
| [6] |
刘青松,齐代华,桂俊,等.2006.四川山矾种群在不同群落中空间分布格局研究.西南农业大学学报:自然科学版,28(3):418-421.( 1) 1)
|
| [7] |
刘西军,黄庆丰,聂昌伟,等.2008.肖坑不同森林类型土壤氮、磷含量研究.安徽农业大学学报,35(1):124-127.( 1) 1)
|
| [8] |
潘晓华,石庆华,郭进耀.1997.无机磷对植物叶片光合作用的影响及其机理的研究进展.植物营养与肥料学报,(3):201-208.( 1) 1)
|
| [9] |
任书杰,于贵瑞,陶波,等.2007.中国东部南北样带654种植物叶片氮和磷的化学计量学特征研究.环境科学,28(12):2665-2673.( 2) 2)
|
| [10] |
孙晓方,何家庆,黄训瑞,等.2008.不同光强对加拿大一枝黄花生长和叶绿素荧光的影响.西北植物学报,28(4):0752-0758.( 1) 1)
|
| [11] |
陶建平,宋利霞.2006.亚高山暗针叶林不同林冠环境下华西箭竹的克隆可塑性.生态学报,26(12):4019-4026.( 1) 1)
|
| [12] |
王微,陶建平,胡凯,等.2007.华西箭竹对岷江冷杉林主要乔木树种幼苗结构及分布格局的影响.林业科学,43(1):1-7.( 1) 1)
|
| [13] |
王永健,陶建平,李媛,等.2007.华西箭竹对卧龙亚高山森林不同演替阶段物种多样性与乔木更新的影响.林业科学,43(2):1-7.( 1) 1)
|
| [14] |
魏辅文,冯祚建,王祖望,等.1999.相岭山系大、小熊猫主食竹类峨热竹的生长发育与环境因子间的相互关系.生态学报,19(5):710-714.( 1) 1)
|
| [15] |
吴统贵,陈步峰,肖以华,等.2010.珠江三角洲3种典型森林类型乔木叶片生态化学计量学.植物生态学报,34(1):58-63.( 2) 2)
|
| [16] |
张林,罗天祥.2004.植物叶寿命及其相关叶性状的生态学研究进展.植物生态学报,28(6):844-852.( 1) 1)
|
| [17] |
张绪成,上官周平.2009.抗旱性不同品种的小麦叶片中光合电子传递和分配对氮素水平的响应.植物生理学通讯,45(1):13-18.( 1) 1)
|
| [18] |
赵红洋,李玉霖,王新源,等.2010.科尔沁沙地52种植物叶片性状变异特征研究.中国沙漠,30(6):1292-1298.( 1) 1)
|
| [19] |
周世强,黄金燕.2000.冷箭竹更新幼龄无性系种群鞭根结构的研究.竹子研究汇刊,19(4):3-11.( 1) 1)
|
| [20] |
周忆堂,马红群,梁丽娇,等.2008.不同光照条件下长春花的光合作用和叶绿素荧光动力学特征.中国农业科学,41(11):3589-3595.( 1) 1)
|
| [21] |
Arnon D I. 1949. Copper enzymes in is olated chloroplasts. Polyphenoloxidase in Beta vulgaris. Plant Physiology, 24(1):1-15.( 1) 1)
|
| [22] |
Bill S,Jarcilene A C. 2003. Interspecific consistency and intraspecific variability of specific leaf area with respect to irradiance and nutrient availability. EcoScience,10(1):74-79.( 1) 1)
|
| [23] |
Cornelissen J H C,Lavorel S,Garnier E,et al. 2003. A hand book of protocols for standardised and easy measurement of plant functional traits worldwide. Australian Journal of Botany,51(4):335-380.( 2) 2)
|
| [24] |
Craine J M,Froehle J,Tilman D G,et al. 2001. The relationships among root and leaf traits of 76 grassland species and relative abundance along fertility and disturbance gradients. Oikos,93(2):274-285.( 1) 1)
|
| [25] |
Denis V,E'ric G,Bill S,et al. 2005. Specific leaf area and dry matter content estimate thickness in laminar leaves. Annals of Botany, 96(6):1129-1136.( 1) 1)
|
| [26] |
Diaz S,Cabido M. 2001. Vive la difference:plant functional diversity matters to ecosystem process-sses. Trends in Ecology&Evolution, 16(11):646-655.( 1) 1)
|
| [27] |
Duren I C van,Pegtel D M. 2000. Nutrient limitations in wet,drained and rewetted fen meadows:evaluation of methods and results. Plant and Soil,220(1):35-47.( 1) 1)
|
| [28] |
Elser J J,Acharya K,Kyle M,et al. 2003. Growth rate-stoichiometry couplings in diverse biota. Ecology Letters,6(10):936-943.( 1) 1)
|
| [29] |
Evans J R, Poorter H. 2001. Photosynthetic acclimation of plants to growth irradiance:the relative importance of specific leaf area and nitrogen partitioning in maximizing carbon gain. Plant Cell and Environment,24(8):755-767.( 1) 1)
|
| [30] |
Güsewell S. 2004. N ∶ P ratios in terrestrial plants:variation and functional significance. New Phytologist,164(2):243-266.( 1) 1)
|
| [31] |
Han W X, Fang J Y, Guo D L,et al. 2005. Leaf nitrogen and phosphorus stoichiometry across 753 terrestrial plant species in China. New Phytologist,168(2):377-385.( 1) 1)
|
| [32] |
He J S,Fang J Y,Wang Z H,et al. 2006. Stoichiometry and large-scale patterns of leaf carbon and nitrogen in the grassland biomes of China. Oecologia,149(1):115-122.( 1) 1)
|
| [33] |
He J S,Wang L,Flynn D F B,et al. 2008. Leaf nitrogen:phosphorus stoichiometry across Chinese grassland biomes. Oecologia,155(2):301-310.( 1) 1)
|
| [34] |
He Y Q,Zhu Y G,Smith S E,et al. 2002. Interactions between soil moisture content and phosphorus supply in spring wheat plants grown in pot culture. Journal of Plant Nutrition,25(4):913-925.( 1) 1)
|
| [35] |
Hedin L O. 2004. Global organization of terrestrial plant nutrient interactions. Proceedings of the National Academy of Sciences of the United States of America,101(30):10849-10850.( 1) 1)
|
| [36] |
Koerselman W,Meuleman A F M. 1996. The vegeta-tion N:P ratio:a new tool to detect the nature of nutrient limitation. Journal of Applied Ecology,33(6):1441-1450.( 1) 1)
|
| [37] |
Makino W,Cotner J B,Sterner R W,et al. 2003. Are bacteria more like plants or animals? Growth rate and resource dependence of bacterial C∶ N∶ P stoichiometry. Functional Ecology,17(1):121-130.( 1) 1)
|
| [38] |
Maroco J P,Breia E,Faria T,et al. 2002. Effects of long-term exposure to elevated CO2 and N fertilization on the development of photosynthetic capacity and biomass accumulation in Quercus suber L. Plant Cell and Environment,25(1):105-113.( 1) 1)
|
| [39] |
Quested H,Eriksson O,Fortunel C,et al. 2007 ,Plant traits relate to whole-community litter quality and decomposition following land use change. Functional Ecology,21(6):1016-1026.( 1) 1)
|
| [40] |
Ren S J,Yu G D,Tao B,et al. 2007. Leaf nitrogen and phosphorus stoichiometry across 654 terrestrial plant species in NSTEC. Environmental Science,28(12):2665-2673.( 2) 2)
|
| [41] |
Tao J P,Song L X,Li Y,et al. 2007. Ramet population structure of Fargesia nitida in different canopy conditions of the subalpine dark coniferous forest in the Wolong Nature Reserve,China. Frontiers of Forestry in China,2(3):278-283.( 1) 1)
|
| [42] |
Taylor A H,Qin Z S. 1992. Tree regeneration after bamboo die-back in Chinese Abies-Betula Forests,Journal of Vegetation Science,3(2):253-260.( 1) 1)
|
| [43] |
Taylor A H,Qin Z S. 1993. Bamboo regeneration after flowering in the Wolong Giant Panda Reserve, China. Biological Conservation, 63(3):231-234.( 1) 1)
|
| [44] |
Taylor A H,Qin Z S,Liu J. 1996. Structure and dynamics of subalpine forests in the Wang La ng Natural Reserve, Sichuan, China. Vegetatio,124(1):25-38.( 1) 1)
|
| [45] |
Taylor A H,Huang J Y,Zhou S Q. 2004. Canopy tree development and undergrowth bamboo dynamics in old-growth Abies-Betula forests in southwestern China:a 12-year study. Forest Ecology and Management,200(1):347-360.( 2) 2)
|
| [46] |
Tripathi S K. ,Sumida A,Shibata H,et al. 2006. Leaf litterfall and decomposition of different above- and belowground parts of birch(Betula ermanii) trees and dwarf bamboo(Sasa kurilensis) shrubs in a young secondary forest in Northern Japan. Biology and Fertility of Soils,43(2):237-246.( 1) 1)
|
| [47] |
Vanni M J, Flecker A S, Hood J M,et al. 2002. Stoichiometry of nutrient recycling by vertebrates in a tropical stream:linking species identity and ecosystem process. Ecology Letters,5(2):285-293. ( 1) 1)
|
| [48] |
Vendramini F,Díaz S,Gurvich D,et al. 2002. Leaf traits as indicators of resource-use strategy in floras with succulent species. New Phytologist,154(1):147-157.( 2) 2)
|
| [49] |
Wang W, Franklin S B, Ren Y, et al. 2006. Growth of bamboo Fargesia qinlingensis and regeneration of trees in a mixed hardwood- conifer forest in the Qinling Mountains,China. Forest Ecology and Management,234(1):107-115.( 1) 1)
|
| [50] |
Wang W, Franklin S B, Cirtain M C. 2007. Seed germination and seedling growth in the arrow bamboo Fargesia qinlingensis. Ecological Research,22(3):467-474.( 1) 1)
|
| [51] |
Wang Y J, Tao J P, Zhong Z C. 2009. Factors influencing the distribution and growth of dwarf bamboo, Fargesia nitida, in a subalpine forest in Wolong Nature Reserve, southwest China. Ecological Research,24(5):1013-1021.( 1) 1)
|
| [52] |
Westoby M. 1998. Aleaf-height-seed(LHS)plant ecology strategy scheme. Plant and Soil,199(2):213-227.( 2) 2)
|
| [53] |
Weiher E,Werf A V, Thompson K, et al. 1999. Challenging theophrastus:A common core list of plant traits for functional ecology. Journal of Vegetation Science,10(5):609-620.( 1) 1)
|
| [54] |
WrightI J,Reich P B,Westoby M,et al. 2004. The worldwide leaf economics spectrum. Nature,428(22):821-827.( 1) 1)
|
| [55] |
Yan E R,Wang X H,Zhou W. 2008. N:P stoichiometry in secondary succession in evergreen broad-leaved forest,Tiantong,East China. Acta Ecologica Sinica ,32(1):13-22.( 1) 1)
|
| [56] |
Yu X H,Tao J P,Li Y,et al. 2006. Ramet population structures of Fargesia nitida in different successional stands of the subalpine coniferous forest in Wolong Nature Reserve. Journal of Integrative Plant Biology,48(10):1147-1153.( 1) 1)
|
| [57] |
Zeng D H, Chen G S. 2005. Ecological stoichiometry:a science to explore the complexity of living systems. Acta Phytoecologica Sinica,29(6):1007-1019.( 1) 1)
|
| [58] |
Zhang C,Tian H Q,Liu J Y,et al. 2005. Pools and distributions of soil phosphorus in China. Global Biogeochemical Cycles,19 ,GB1020. doi:10. 1029 /2004 GB 002296.( 1) 1)
|
| [59] |
Zhao P,Sun G C. 1998. Ecophysiological research on nitrogen nutririon of plant. Acta Ecologica Sinica,17(2):37-41.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

