文章信息
- 邱高翔, 董娟娥, 马希汉, 行冰玉, 张靖一, 雷鸣
- Qiu Gaoxiang, Dong Juan, Ma Xihan, Xing Bingyu, Zhang Jingyi, Lei Ming
- 杜仲雄花提取物的体外抗氧化活性评价
- Evaluation of the Antioxidant Activity of the Extracts from Eucommia Male Flower in vitro
- 林业科学, 2013, 49(3): 63-69
- Scientia Silvae Sinicae, 2013, 49(3): 63-69.
- DOI: 10.11707/j.1001-7488.20130309
-
文章历史
- 收稿日期:2012-07-03
- 修回日期:2012-10-27
-
作者相关文章
2. 西北农林科技大学理学院杨凌 712100
2. College of Sciences, Northwest A&F University Yangling 712100
大量研究表明,经常摄取抗氧化活性物质能够降低许多疾病如癌症、心脑血管疾病、风湿性关节炎、糖尿病以及衰老等的发生概率(Kris-Ethterton et al., 2002)。由于合成抗氧化剂如二丁基羟基甲苯(BHT)有一定毒性和致畸作用,而天然植物包括蔬菜、水果以及传统的中草药等含有许多天然抗氧化活性物质如黄酮、多酚、鞣质和生物碱等,可在一定程度上减少机体的氧化损伤,并且安全无毒,因此,天然抗氧化活性物质的挖掘与开发成为国内外学者研究的热点(刘微微等,2010)。
杜仲(Eucommia ulmoides)是我国珍贵的药用植物,杜仲雄花产量很高,每年约有3 万t 的产花量(付卓锐等,2010)。杜仲雄花中富含绿原酸、桃叶珊瑚苷、京尼平苷酸等活性物质和多种矿质元素、粗蛋白、维生素和氨基酸等营养物质(付卓锐等,2010; 董娟娥等,2005a)。药理试验表明,杜仲雄花对大鼠无毒副作用,说明其作为食品很安全(杜红岩等,2008)。杜仲雄花现已被开发成杜仲雄花茶等产品(付卓锐等,2010; 董娟娥等,2005b),但有关杜仲雄花是否具有抗氧化活性尚无有关报道。本文以杜仲雄花为材料,利用乙醇提取,并依次用石油醚、乙酸乙酯、正丁醇等有机溶剂萃取杜仲雄花提取物中不同极性的活性成分,研究乙醇提取物、石油醚、乙酸乙酯、正丁醇萃取相和萃余相(水相)等各组分群的总酚含量、DPPH 自由基清除率、羟自由基清除率、还原力和抗脂质过氧化能力,并对各部分的抗氧化能力进行评价,以期为杜仲雄花的进一步开发与利用提供理论依据。
1 材料与方法 1.1 材料与仪器 1.1.1 材料杜仲雄花于2011 年3 月中下旬(初花期)采自西北农林科技大学林学院校区杜仲树林。3 月初观察,雄株花蕾形成后采收,避免花粉散落。采集后立即在90 ℃ 的鼓风干燥箱中杀青处理20 min,取出阴干,粉碎过20 目筛,冷藏备用。
1.1.2 试剂DPPH(2,2-Diphenyl-1-picrylhydrazyl)(美国Sigma 公司); Folin-Ciocalteu’s reagent(2N)(上海荔达生物技术有限公司); 铁氰化钾、磷酸、三氯乙酸、FeSO4、硫代巴比妥酸、乙醇、石油醚、乙酸乙酯、正丁醇等均为分析纯; 没食子酸标准品(中国药品生物制品检定所批号110831-200904)。
1.1.3 主要仪器紫外-可见分光光度计(UV-1800,上海美谱达仪器有限公司); 分析天平(AG204,METTLER TOLEDO); 旋转蒸发器(RE52AA,上海亚荣生化仪器厂); 电热鼓风干燥箱(上海试验仪器有限公司,101A 型,工作室尺寸为600 mm × 500 mm × 750 mm; 控温范围300 ℃; 温度波动± 0.5 ℃; 均匀度± 1 ℃; 功率2.4 kW); 离心机(TGL-16 高速台式冷却离心机)。
1.2 试验方法 1.2.1 杜仲雄花提取物样品制备取杜仲雄花干粉4.8 kg,用体积分数为70% 的乙醇水溶液在80 ℃ 回流提取2 次,每次2 h。合并2 次提取液,减压浓缩、回收乙醇,得杜仲雄花乙醇浸提物(乙醇相)400 g。将浸提物用水(4 000 mL)分散均匀后,依次用石油醚、乙酸乙酯、正丁醇萃取; 分别将萃取相和萃余相(水相)减压浓缩后,冷冻干燥,得到石油醚萃取物16.2 g、乙酸乙酯萃取物26.7 g、正丁醇萃取物22.0 g、水相32.2 g,保存于4 ℃ 冰箱中备用。
1.2.2 DPPH 自由基清除活性测定采用Sun 等(2011)的方法。2 mL 杜仲雄花各萃取相的无水乙醇溶液加入2 mL 0.2 mmol·L-1 DPPH-无水乙醇溶液。混匀后在室温下避光放置30 min,测定517 nm波长处吸光度。以2 mL 无水乙醇代替杜仲雄花样品溶液作为空白。清除率的计算公式为:
清除率(%)=${{A_0}-{A_1} \over {A_0}}$× 100。
式中: A0为空白溶液的吸光度; A1为样品溶液的吸光度。
1.2.3 还原力测定采用Amarowicz 等(2010)的方法。取2.5 mL 杜仲雄花各萃取相的样品溶液加入2.5 mL 0.2 mol·L-1 磷酸盐缓冲液(pH6.6)和2.5 mL 10 g·L-1 铁氰化钾溶液,50 ℃水浴中放置20min。迅速冷却后,加入2.5 mL 100 g·L-1 三氯乙酸溶液,混匀后3 000 r·min-1 离心20 min。取上清液2.5 mL,加入2.5 mL 蒸馏水和0.5 mL 1 g·L-1 三氯化铁,反应10 min 后测定700 nm波长处吸光度。空白对照以2.5 mL 蒸馏水代替杜仲雄花样品溶液。
1.2.4 羟自由基清除活性测定采用Nagai 等(2002)的方法。将300 μL 10 mmol·L-1 的FeSO4、300 μL 10 mmol·L-1 的EDTA和300 μL 10 mmol·L-1的2-Deoxyribose 与1.5 mL 0.1 mol·L-1 的磷酸盐缓冲液(pH7.4)混合均匀,分别与300 μL不同质量浓度杜仲雄花各萃取(余)相的样品溶液混合。加入300 μL 10 mmol·L-1 的H2 O2,在37 ℃ 下培养4 h。
再加入1 mL 10 g·L-1 硫代巴比妥酸溶液,混匀后在沸水浴中培养10 min。冷却至室温后,将混合物3 000 r·min-1 离心5 min,取上清液在532 nm波长处测定吸光度。空白以300 μL 蒸馏水代替杜仲雄花提取物样品溶液。清除率的计算公式为:
清除率(%)=${{A_0}-{A_1} \over {A_0}}$× 100。
式中: A0为空白溶液的吸光度; A1为样品溶液的吸光度。
1.2.5 抗脂质过氧化活性测定采用李欣等(2011)的方法。在具塞试管中加入0.4 mL 卵黄悬浮液、0.1 mL 不同质量浓度的杜仲雄花样品溶液、0.4 mL 25 mmol·L-1 FeSO4、3.1 mL 0.1 mol·L-1 磷酸盐缓冲液(pH7.4),混匀于37 ℃ 恒温振荡15 min,取出后加入1 mL 三氯乙酸(质量分数20%),3500 r·min-1 离心10 min,吸取2 mL上清液加入1 mL硫代巴比妥酸(质量分数0.8%),在沸水浴中培养15 min,冷却后,于532 nm 波长处测定吸光度,不加样品管(以0.1 mL 磷酸盐缓冲液代替样品溶液)的吸光度为A,样品管的吸光度为AS。样品的脂质过氧化抑制率计算公式为:
脂质过氧化抵制率(%)=${A-{A_s} \over A}$ × 100。
式中: AS为加入样品液反应后的吸光度平均值; A为空白组的吸光度平均值。
1.2.6 总酚含量测定采用Mariod 等(2010)的方法。取1 mL 不同质量浓度的杜仲雄花萃取相样品溶液,加入5 mL 0.2 mol·L-1 福林酚试剂,反应6 min后加入4 mL 75 g·L-1 Na1CO3溶液,混匀,避光放置3 h,在760 nm 波长处测定吸光度。以没食子酸为标准品,经过上述反应后,以没食子酸的浓度(x,μg·mL-1)和对应的吸光度(y)制作标准曲线。杜仲雄花提取物的总酚含量用每克提取物中所含的没食子酸表示。
标准曲线为: y= 1.045x + 0.017(R2 = 0.998 9)。
1.3 统计方法试验结果用$\bar x$ ± s 表示,采用SPSS 软件统计分析。试验设计为单因素随机区组,多重比较采用邓肯新复极差法。每个试验均重复3 次。
2 结果与分析 2.1 杜仲雄花各萃取相与萃余相的总酚含量杜仲雄花各萃取部分和萃余部分的总酚含量(以每克萃取物中没食子酸含量表示)列于表 1。由表 1 可知,各萃取相均含有酚类成分,且含量差异显著(P< 0.01)。其中,乙醇相含有97.23 mg·g-1 的酚类成分,石油醚相含有105.42 mg·g-1 的酚类成分,说明杜仲雄花中有一部分低极性酚类成分; 乙酸乙酯相和正丁醇相中的总酚含量较高,分别为393.47 mg·g-1和287.33 mg·g-1,说明杜仲雄花中富含大量中等极性的酚类成分; 水相中含有114.74mg·g-1 的酚类成分,说明杜仲雄花中也含极性较大的酚类成分。可见杜仲雄花中的酚类成分结构复杂,从极性到非极性均有分布。
|
|
DPPH 法是20 世纪50 年代发明的,现在已经广泛用于定量测定生物试样、酚类物质和食品的抗氧化能力(刘志东等,2008),已成为评价天然植物抗氧化活性的最好方法之一(Patel et al., 2011)。不同质量浓度的杜仲雄花各组分群对DPPH 自由基的清除率如图 1 所示。
|
图1 杜仲雄花不同萃取相对DPPH 自由基清除活性 Fig.1 Activity of DPPH scavenging free radicalof different extracts from E. male flower |
杜仲雄花各组分群清除DPPH 自由基活性存在较大差异(图 1)。其中,乙酸乙酯相组分群的清除率最大,依次为正丁醇相、水相、乙醇相和石油醚相。乙酸乙酯相对DPPH 的清除率与VC和BHT 接近,可能是由于该组分群中含有中等极性的酚类化合物较多(表 1)。正丁醇相也含有较多中等极性的酚类化合物,也表现出较高的清除DPPH 自由基的能力。水相对DPPH 自由基的清除率显著大于石油醚相,但低于乙酸乙酯相和正丁醇相。
杜仲雄花各萃取相组分群对DPPH 自由基的清除率存在量效关系(图 1)。当质量浓度为0 ~ 0.25mg·L-1 时,各组分群对DPPH 自由基的清除活性随着质量浓度的增大而急剧增强,存在明显的量效关系; 当质量浓度为0.25 ~ 0.70 mg·mL-1 时,清除率随质量浓度的增大而缓慢升高; 当质量浓度大于0.70 mg·mL-1 时,自由基清除活性随质量浓度的增大增强不明显。这说明杜仲雄花各萃取相组分群对DPPH 自由基的清除率不但存在量效关系,而且呈浓度饱和型特征。
质量浓度为0.70 mg·mL-1 的乙酸乙酯相和正丁醇相对DPPH 自由基的清除率分别达到91.55%和80.32%,与VC和BHT 接近。这说明质量浓度为0.70 mg·mL-1 的乙酸乙酯相和正丁醇相对DPPH自由基具有较强的清除活性。水相和石油醚相清除DPPH 自由基的活性也与质量浓度呈正相关,但即使是较高质量浓度(1.40 mg·L-1)的水相和石油醚相的DPPH 自由基清除率也显著低于低质量浓度(0.25 mg·L-1)的乙酸乙酯相和正丁醇相,说明强极性和弱极性的酚类化合物对DPPH 自由基的清除活性低于中等极性的酚类化合物。
综上所述,杜仲雄花各萃取相组分群对DPPH自由基的清除率与其中所含酚类化合物的极性有关,中等极性的酚类化合物清除率较高; 也与酚类化合物的量呈正相关,并呈浓度饱和型特征,0.25mg·mL-1 以上质量浓度的乙酸乙酯和正丁醇相组分群对DPPH 自由基具有较强的清除活性。
2.3 杜仲雄花各组分群的羟自由基清除活性羟自由基是一种强烈的氧化自由基,能够严重破坏人机体内的各类生物大分子如蛋白质和DNA导致细胞损伤,可以引起衰老、癌症和其他疾病的发生(Guo et al., 2011)。因此,对羟自由基的清除被看成是保护机体抵制各种疾病的有效途径之一。本研究采用Fenton 体系作为产生羟自由基的来源,探讨杜仲雄花各组分群对羟自由基的清除活性,结果如图 2 所示。

|
图2 杜仲雄花不同萃取相对羟自由基的清除活性 Fig.2 Activity of hydroxyl scavenging free radical ofdifferent extracts from E. male flower |
杜仲雄花各萃取相组分群清除羟基自由基存在较大差异(图 2)。正丁醇相的清除率最大,依次为乙酸乙酯相、水相、石油醚相和乙醇相。虽然正丁醇相对羟基自由基的清除率最大,但显著低于BHT;石油醚相与乙酸乙酯相对羟基自由基的清除率相近,但乙酸乙酯相略高于石油醚相; 水相和乙醇相对羟基自由基的清除率最低,这可能是由于各个相中酚类化合物成分差异大导致的结果。
杜仲雄花各组分群对羟基自由基的清除率存在量效关系(图 2)。当质量浓度小于0.33 mg·mL-1图 2 杜仲雄花不同萃取相对羟自由基的清除活性Fig. 2 Activity of hydroxyl scavenging free radical ofdifferent extracts from E. male flower时,各组分群对羟基自由基的清除率随着质量浓度的增大而急剧增大,量效关系明显; 当质量浓度为0.33 ~ 0.50 mg·mL-1 时,石油醚相和乙酸乙酯相的清除率随着质量浓度的增大而缓慢升高,但正丁醇相和水相仍然急剧升高; 当质量浓度大于0.75 mg·mL-1 时,随着质量浓度增大,清除羟基自由基活性增强不明显。
当各萃取相的质量浓度为1.00 mg·mL-1 时,乙醇相组分群对羟基自由基清除率最低,水萃取相和石油醚萃取相组分群对羟自由基清除率均比较低;正丁醇相的活性最高(80.47%),但低于BHT(94.67%); 乙酸乙酯相对羟自由基的清除率为61.92%。对比各萃取相组分群中的总酚含量(表 1)发现,各萃取相组分群的总酚含量与对羟自由基的清除活性没有相关性,但仍然是中等极性的酚类化合物清除羟自由基的能力较强。这一现象与杜仲叶抗氧化活性类似(张强等,2011)。
综上所述,杜仲雄花各萃取相组分群对羟自由基的清除率与其中所含酚类化合物的极性有关,含中等极性酚类化合物高的组分群清除率较高; 0.75mg·mL-1 以上质量浓度的正丁醇相组分群对羟基自由基具有较强的清除活性。
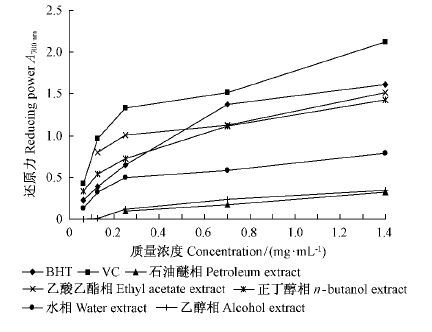
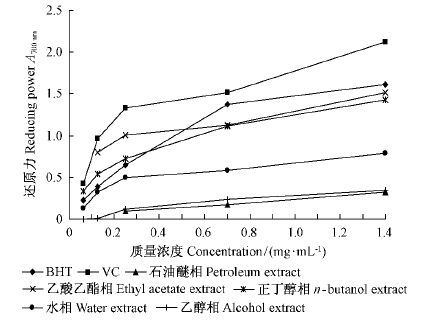
2.4 杜仲雄花各组分群的还原力早期研究表明,植物提取物还原力的大小与其抗氧化能力有关,因此,还原力的测定常常被用来评价抗氧化剂的抗氧化能力(Sun et al., 2010)。杜仲雄花各组分群的还原力如图 3 所示。杜仲雄花各组分群的还原力大小存在较大差异(图 3)。乙酸乙酯相组分群的还原力最强,依次为正丁醇相、水相、乙醇相和石油醚相。乙酸乙酯相的还原力最强,略低于VC和BHT,可能是由于乙酸乙酯相含有大量的中等极性的酚类化合物(表 1)。正丁醇相含有较多的中等极性的酚类化合物,也表现出较高的还原力。水相还原力显著大于石油醚相,可能是由于石油醚中酚类化合物的极性较水相中的小。
|
图3 杜仲雄花不同萃取相的还原力 Fig.3 Reducing power of different extracts from E. male flower |
杜仲雄花各萃取相组分群的还原力也存在量效关系(图 3)。当质量浓度小于0.25 mg·mL-1 时,各组分群的还原力随质量浓度的增大而急剧增强,量效关系明显; 当质量浓度为0.25 ~ 0.70 mg·mL-1 时,还原力随质量浓度的增大而缓慢升高; 当质量浓度大于0.70 mg·mL-1 时,还原力随质量浓度的增大增强不明显; 当质量浓度为1.00 mg·mL-1时,杜仲雄花各组分群的还原力的大小依次为VC >BHT > 乙酸乙酯相> 正丁醇相> 水相> 乙醇相> 石油醚相。
综上所述,杜仲雄花各萃取相组分群的还原力的大小与其中所含酚类化合物的极性有关,含中等极性酚类化合物的组分群还原力较强; 也与酚类化合物的量呈正相关,0.70 mg·mL-1 以上质量浓度的乙酸乙酯相组分群还原力较强,略低于BHT和VC。
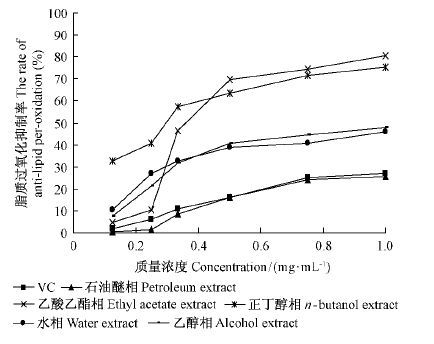
2.5 杜仲雄花各组分群的抗脂质过氧化活性脂质过氧化损伤与肿瘤、衰老、心脑血管病、炎症和辐射损伤等的发生和发展有密切关系(张尔贤等,1996)。本试验以Fe2 + 诱发卵黄磷脂C-2 位上的极低密度脂蛋白(VLDL)和低密度脂蛋白(LDL)过不饱和脂肪酸(PUFA)的过氧化模型来评价杜仲雄花不同萃取部分的抗氧化活性,结果如图 4 所示。
|
图4 杜仲雄花不同萃取相的抗脂质过氧化活性 Fig.4 Activity of anti-lipid per-oxidation of theextracts from in E. male flower |
杜仲雄花各组分群对脂质过氧化抑制作用存在较大差异(图 4)。乙酸乙酯相的抑制率最大,依次为正丁醇相、乙醇相、水相和石油醚相。乙酸乙酯相对脂质过氧化的抑制率最大,远高于VC,可能是由于乙酸乙酯相含有的中等极性酚类化合物较多(表 1)。正丁醇相也含有较多的中等极性酚类化合物,同样表现出较好的抑制率。水相和乙醇相对脂质过氧化抑制率显著大于石油醚相,可能是由于石油醚相中所含有的酚类化合物极性低于水相。正丁醇相和水相均远高于VC,石油醚相略低于VC。
杜仲雄花各萃取相组分群对脂质过氧化抑制率也存在量效关系(图 4)。当质量浓度小于0.50 mg·mL-1 时,各组分群对脂质过氧化抑制率随质量浓度的增大而急剧增大,量效关系明显; 当质量浓度为0.50 ~ 0.75 mg·mL-1 时,抑制率随质量浓度的增大而缓慢升高; 当质量浓度大于0.75 mg·mL-1 时,抑制率随质量浓度的增大增强不明显; 当质量浓度为1.00 mg·mL-1 时,乙酸乙酯相抗脂质过氧化的活性最高(80.67%),正丁醇次之(75.44%),乙醇相、水相和石油醚相较低,分别为47.90%,45.96%和25.49%。乙酸乙酯相和正丁醇相抗脂质过氧化活性均远高于相同质量浓度的VC,说明杜仲雄花可以显著抑制脂质的过氧化损伤作用。
综上所述,杜仲雄花各萃取相组分群对脂质过氧化抑制率与其中所含酚类化合物的极性有关,含中等极性酚类化合物高的组分群抗脂质过氧化能力强; 0.25 mg·mL-1 以上质量浓度的乙酸乙酯相和正丁醇相对脂质过氧化均具有较强的抑制率。
2.6 杜仲雄花不同萃取部分总酚含量与抗氧化活性相关性分析研究表明,杜仲炮制皮、生皮和叶水提取物抗氧化活性与总酚含量呈正相关(Yen et al., 1998)。本研究采用Pearson(皮尔逊)方法考察杜仲雄花不同极性组分群的抗氧化活性(表 2)与其所含酚类化合物(表 1)的相关性,结果见表 3。
|
|
|
|
相关性分析结果(表 3)表明,杜仲雄花不同提取、萃取(余)相的总酚含量与DPPH 自由基清除活性、还原力和脂质过氧化抑制活性之间存在显著的线性相关性,相关系数在5% 水平均大于0.90。这说明杜仲雄花提取物的抗氧化活性与总酚含量呈显著正相关,即总酚含量越高其抗氧化活性越强。而杜仲雄花不同萃取(余)相的总酚含量与羟自由基清除活性之间的相关系数较小(0.639),说明总酚含量与羟自由基清除活性之间呈正相关,但相关性不显著。可能是由于各萃取部分酚类化合物构成差异较大,总酚含量不能准确反映杜仲雄花不同萃取(余)相组分群清除羟自由基的活性,但可表征其对DPPH 自由基清除活性、还原能力和脂质过氧化抑制活性。
3 结论采用4 项评价指标对杜仲雄花不同萃取相组分群的抗氧化活性评价结果发现,乙酸乙酯相和正丁醇相的抗氧化活性较高,其脂质过氧化抑制率高于VC,DPPH 自由基清除率与VC和BHT 接近,说明杜仲雄花作为生产保健产品的原料具有一定的开发利用价值。
杜仲雄花抑制脂质过氧化作用显著,具有一定的降低氧化损伤引起的各种心血管疾病及慢性病风险的潜力(Sevanian et al., 2000)。
杜仲雄花各萃取相组分群总酚含量与还原力、DPPH 自由基清除率和脂质过氧化抑制率呈显著的正相关性,说明酚类成分是杜仲雄花中发挥抗氧化活性的主要成分。
| [1] |
董娟娥, 梁宗锁, 张康健, 等.2005a. 杜仲雄花中次生代谢物合成积累的动态变化.植物资源与环境学报, 14(4) : 7-10.( 1) 1)
|
| [2] |
董娟娥, 张康健, 马希汉, 等.2005b. 绿色杜仲雄花蕾茶的制备方法.中国, ZL200510042883.3.( 1) 1)
|
| [3] |
杜红岩, 李钦, 傅建敏, 等.2008.杜仲雄花茶的食品安全性毒理学.中南林业科技大学学报, 28(2) : 91-92.( 1) 1)
|
| [4] |
付卓锐, 董娟娥, 马希汉.2010.杜仲雄花茶加工中护绿工艺响应面优化.农业机械学报, 41(4) : 145-146.( 2) 2)
|
| [5] |
李欣, 薛治浦, 朱文学.2011.丹参不同部分总酚酸和总黄酮含量分析及其抗氧化活性研究.食品科学, 32(3) : 108-111.( 1) 1)
|
| [6] |
刘微微, 任虹, 曹学丽, 等.2010.天然产物抗氧化活性体外评价方法研究进展.食品科学, 31(17) : 415-416.( 1) 1)
|
| [7] |
刘志东, 郭本恒, 王荫榆.2008.抗氧化活性检测方法的研究进展.天然产物研究与开发, 20(3) : 563-567.( 1) 1)
|
| [8] |
张强, 苏印泉, 张京芳.2011.杜仲叶不同萃取物抗氧化活性比较分析.食品科学, 32(13) : 23-27.( 1) 1)
|
| [9] |
张尔贤, 俞丽君, 周意琳, 等.1996.Fe2 + 诱发脂蛋白 PUFA 过氧化体系及对若干天然产物抗氧化作用的评价.生物化学与生物物理学报, 28(2) : 218-221.( 1) 1)
|
| [10] |
Amarowicz R, Estrella I, Hernández T, et al.2010.Free radical- scavenging capacity, antioxidant activity, and phenolic composition of green lentil(Lens culinaris).Food Chemistry, 121(3) : 705-711.( 1) 1)
|
| [11] |
Guo T, Wei L, Sun J, et al.2011.Antioxidant activities of extract and fractions from Tuber indicum Cooke & Massee. Food Chemistry, 127( 1) 1)
|
| [12] |
Kris-Ethterton P M, Hecker K D, Bonanome A, et al.2002.Bioactive compounds in foods: their role in the prevention of cardiovascular disease and cancer. The American Journal of Medicine, 113(Suppl 9 B) : 71 S-88 S.( 1) 1)
|
| [13] |
Mariod A A, Ibrahim R M, Ismail M, et al.2010.Antioxidant activities of phenolic rich fractions(PRFs) obtained from black mahlab(Monechma ciliatum) and white mahlab(Prunus mahaleb) seedcakes. Food Chemistry, 118(1) : 120-127.( 1) 1)
|
| [14] |
Nagai T, Inoue R, Inoue H, et al.2002.Scavenging capacities of pollen extracts from Cistus ladaniferus on autoxidation, superoxide radicals, hydroxyl radicals, and DPPH radicals. Nutrition Research, 22(4) : 519-526.( 1) 1)
|
| [15] |
Patel D K, Kumar R, Prasad S K, et al.2011.Pedalium murex Linn(pedaliaceae) fruits: a comparative antioxidant act ivity of its different fractions. Asian Pacific Journal of Tropical Biomedicine, 395-400.( 1) 1)
|
| [16] |
Sevanian A, Ursini F. 2000.Lipid peroxidation in membranes andlow- density lipoproteins: similarities and differences. Free Radical Biology & Medicine, 29(3 /4) : 306-311.( 1) 1)
|
| [17] |
Sun J, Jiang Y, Shi J, et al.2010.Antioxidant activities and contents of polyphenol oxidase substrates from pericarp tissues of litchi fruit. Food Chemistry, 119(2) : 753-757.( 1) 1)
|
| [18] |
Sun L, Zhang J, Lu X, et al.2011.Evaluation to the antioxidant activity of total flavonoids extract from persimmon(Diospyros kaki L.)leaves. Food and Chemical Toxicology, 49(10) : 2689-2696.( 1) 1)
|
| [19] |
Yen G C, Hsien C L. 1998.Antioxidant activity of extracts fromdu-zhong(Eucommia ulmoides) toward various lipid peroxidation models in vitro. Journal of Agricultural and Food Chemistry, 46(10) : 3952-3957.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

