文章信息
- 解小娟, 杨晓红, 陈晓阳
- Xie Xiaojuan, Yang Xiaohong, Chen Xiaoyang
- 遮荫对转BADH基因的美丽胡枝子叶片形态和 光合特性的影响
- Effects of Shading on Leaf Shape and Photosynthetic Characteristics of the Transgenic Lespedeza formosa with Expressing BADH Gene
- 林业科学, 2013, 49(3): 33-42
- Scientia Silvae Sinicae, 2013, 49(3): 33-42.
- DOI: 10.11707/j.1001-7488.20130305
-
文章历史
- 收稿日期:2012-08-13
- 修回日期:2012-11-06
-
作者相关文章
2. 华南农业大学林学院 广州 510642
2. College of Forest, Southern China Agricultural University Guangzhou 510642
美丽胡枝子(Lespedeza formosa)是豆科(Leguminosae)胡枝子属植物,具有根系发达、生物量大、枝叶营养丰富、花期长等多方面优点,是良好的水土保持树种和木本饲料植物(胡冬南等,2008;Li et al., 2007)。由于美丽胡枝子是喜光植物(柏明娥等,2007),限制了其在林下空地的栽植。因此,提高美丽胡枝子的耐荫能力,对农林发展具有非常重要的作用。甜菜碱是种季铵类化合物,广泛存在于细菌、植物和动物等生物体中(Rhodes et al., 1993; Chen et al., 2008),被认为是最有效的渗透调节和保护物质,其在植物中的积累有利于提高植物的抗旱、抗盐、抗低温胁迫等能力(Ashraf et al., 2007; Chen et al., 2011)。甜菜碱醛脱氢酶(BADH)是甜菜碱合成的关键酶之一,近年来许多植物转基因的研究结果表明,导入BADH基因可提高植物的耐盐性、耐旱性、耐高温或低温胁迫能力、耐重金属胁迫能力(Fitzgerald et al., 2009)。尽管已经有一些关于甜菜碱影响植物光合系统的研究报道(Papageorgiou et al., 1995; Sulpice et al., 2002; Chen et al., 2008;),但有关转入BADH基因能否影响植物耐荫性方面的研究还少见报道。本试验以转入BADH基因的美丽胡枝子为材料,研究不同遮荫处理对美丽胡枝子叶部形态、光合生理等产生的影响,目的是为了探讨甜菜碱的积累是否可改变植物的耐荫性能及其适应弱光逆境的机制,为培育耐荫性植物新品种提供理论依据。
1 材料与方法 1.1 试验材料供试材料为转入BADH基因的美丽胡枝子T1代的2 个株系。T1 代植株由2 个T0 代转基因株系(16 号、34A)经自交繁殖获得。对T1 代材料进行PCR分子检测,确认BADH基因稳定遗传到T1 代,然后分别从不同T0 代株系的自交T1 代材料中各选取1 个生长表现好的转基因植株和对照用非转基因植株进行扦插扩繁。2 个T1 代转基因株系编号分别为25 号(T0 代16 号自交后代)、34 号(T0 代34A自交后代),这2 个株系材料进行了PCR、Southern检测,确认含有BADH基因。扦插繁殖的植株盆栽后放置于北京农学院组培中心温室大棚外试验基地上。次年春天平茬,待芽萌动后进行遮荫处理。
1.2 试验方法 1.2.1 遮荫处理将栽植在室外的转基因株系和非转基因植株用1 ~3 层的遮荫网进行遮荫处理。用照度计和Li-6400 便携式光合测定仪在一段时间内分别不同时段多次测定室外自然光照及不同遮荫网下的光照强度,推算不同遮荫网下的透光率。试验设计了4 种处理,分别为: 自然光照(无遮荫网,透光率100%); 轻度遮荫(1 层遮荫网,平均透光率75%); 中度遮荫(2 层遮荫网,平均透光率34%);强度遮荫(3 层遮荫网,平均透光率11%)。每种处理材料不少于15 盆。材料在遮荫条件下生长2 个多月后于7 月下旬用Li-6400 便携式光合测定仪进行光合生理测定,于8 月上旬进行叶部形态观测和叶绿素、酶活性、甜菜碱等指标测定。
1.2.2 光合特性测定2011 年7 月,选择晴朗天气,采用Li-6400 便携式光合测定仪进行光响应曲线测定,测定时光合有效辐射依次为1500,1200,1000,800,600,400,200,100,50,25,0μmol·m -2 s -1,每个材料每种处理重复3 次,利用Spass软件通过非直角双曲线模型(Herrick et al., 1999; 陆佩玲等,2001)拟合光响应曲线。其中,非直角双曲线模型为: Pn = [αQ + Pmax- sqrt((αQ + Pmax)2-4αQKPmax)]/(2K)-Rday,式中,Pn为净光合速率(μmol·m -2 s -1),α 为表观量子效率,Pmax为光饱和时的最大净光合速率(μmol·m -2 s -1),Q 为光量子通量密度(μmol·m -2 s -1),K 为光响应曲线曲角,Rday为暗呼吸速率(μmol·m -2 s -1)。通过非线性回归得出Pmax,αQ,K和Rday参数估计值,同时程序给出不同光合有效辐射通量密度下的预测值,根据预测值拟合光合-光响应曲线(R2 >0.97)。光饱和点和光补偿点则是将200 μmol·m -2 s -1 以下的线性方程与非线性模型计算出的Pmax值和X 轴这2 条平行直线相交,与Pmax的交点在X轴上的数值为光饱和点(LSP),与X 轴交点数值即为光补偿点(LCP)。
选择晴朗天气,用Li-6400 便携式光合测定仪对不同遮荫处理的美丽胡枝子植株进行光合日变化测定。时间为8:00—18:00,每小时测定1 次,每个处理选取生长健壮的植株各5 株,每株选取成熟的3 枚功能叶进行测定。
1.2.3 PCR和Southern检测进行BADH基因的PCR检测,引物primerF:5'-CCAGGTCTAGAATGGCGTTCC-3',primerR:5'-TTTTCAAGGAGACTTGTACCA-3'。扩增条件为94 ℃ 变性30s,56 ℃ 退火40s,72 ℃延伸1min40s,共30 个循环;72 ℃延伸10min,4 ℃保存。
用CTAB法提取转基因植株和对照植株的总DNA,用限制性核酸内切酶BamHⅠ进行酶切后经琼脂糖电泳分离,转移到带正电荷的尼龙膜上,用地高辛标记BADH基因片段作为探针,参照杂交试剂盒上的方法进行Southern杂交。
1.2.4 叶形态指标的测定待材料生长3 个月后,于8 月份晴天的早上9:00 采摘不同处理不同株系的美丽胡枝子上部叶,随机取10 片叶子,称其鲜质量,用叶片扫描仪测定叶片的长、宽和叶面积,然后用烘箱烘干(105 ℃ 下杀青30min,然后80 ℃ 连续烘干至恒质量),称量烘干质量。比叶面积(SLA)定义为叶面积与烘干质量的比值,比叶干质量为SLA的倒数值(叶干质量/ 叶面积),单位叶面积鲜质量为叶片鲜质量与叶面积的比值。
1.2.5 相关生理生化指标叶绿素含量测定采用丙酮法。甜菜碱含量的测定采用雷氏盐紫外分光光度计法(杨晓红等,2010)。参照罗晓丽等(2008)、刘凤华等(1997)的方法进行甜菜碱醛脱氢酶(BADH)活性测定,具体方法为:1)BADH的提取:取1g组培苗,液氮下迅速研成粉末,加入10mL酶提取缓冲溶液(100mmol·L -1 Tricine-KOH,pH8.5;2mmol·L -1 EDTA;2mmol·L -1 DTT,0.6mol·L -1 蔗糖)研磨成匀浆,以10000g离心10min,所得上清液再重复离心2 次,收集上清液,加入饱和度至55% 的(NH4)2SO4,得到的沉淀用1.0mL酶悬浮缓冲液(10mmol·L -1 Tris-HCl,pH7.8;1mmol·L -1DTT;10% 甘油)溶解,并在该缓冲液中透析除去硫酸铵即得酶粗提液。2)BADH的活性分析: 在2mL反应体系中,加入1.9mL反应缓冲液(100mmol·L -1 Tris-HCl,pH8.0,0.5mmol·L -1 NAD +,5mmol·L -1 DTT),再加入0.1mL酶溶液,共计2mL。放在紫外分光光度计(型号为LabTech UV-1000)的比色杯中,反应从加入0.1mL的10mmol·L -1 甜菜碱醛开始,测定波长为340nm处的吸收值。以加水(即用加水取代加甜菜碱醛)为空白对照做同样测定。反应在30 ℃ 下进行,时间为30min。酶的比活力(nmol·min -1 mg -1)= ΔOD ×10 -3 /(εmax × C)×10,式中,ΔOD为吸光值每分钟增加的平均值,ε 为摩尔消光系数(6220),C 为测定时加入的酶量。酶量(蛋白质含量)的测定采用考马斯亮蓝法,以牛血清蛋白为标准蛋白。
用DPS软件进行数据的统计分析。
2 结果与分析 2.1 弱光环境下转BADH基因美丽胡枝子T1代实生苗性状分化与分子检转BADH基因的美丽胡枝子T1 代播种苗共有255 株,当播种苗长出2 片真叶时(约3 ~5cm)移栽到花盆中,置于温室大棚的育苗盘铁架下面,育苗盘上有其他盆栽植物,育苗盘下面光照较弱(透光率在20% 以下)。当T1 代美丽胡枝子苗生长到40 ~60cm时,观察到这些植株叶色及茎干颜色明显呈现绿色和黄色性状分化(图 1)。其中表现为黄色性状的有69 株,表现为绿色性状的有186 株,经过卡方检测,符合3∶1的性状分离规律。

|
图1
弱光环境下的转基因美丽胡枝子T1代植株
Fig.1
The T1 generation of transgentic L. formosa plants in low light environment
A: 转基因美丽胡枝子T1 代在弱光环境下的性状分化;
B: 弱光环境下呈现黄色的美丽胡枝子。 A: Trait differentiation from the T1 generation of transgenic L. formosa plants in low light environment; B: The yellow L. formosa in low light environment. |
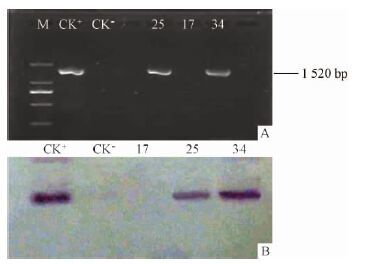
从转BADH基因的美丽胡枝子T1 代中选取3个生长健壮的植株,采取嫩叶提取DNA,用BADH基因的1 对特异性引物进行PCR检测。检测结果显示: 性状为绿色的25 号、34 号扩增出了与质粒DNA相同的1520bp大小的BADH基因的特异性片段,而表现为黄色的17 号植株则没有扩增出特异性片段。Southern杂交的结果与PCR检测结果相同(图 2)。
|
图2
转BADH 美丽胡枝子的PCR( A) 与
Southern( B) 检测
Fig.2
PCR( A) ,Southern( B) detection of BADH in
transgenic L. formosa
M: Marker; CK+: 质粒; CK-: 非转基因植株;25,17,34: 转基因美丽胡枝子T1代株系。 M: Marker; CK+ : Plasmid; CK-: Non-transgenic L. formosa; 25,17,34: T1 lines of transgenic L. formosa. |
由表 1 可以看出,遮荫对转基因和非转基因美丽胡枝子的叶长、叶宽影响较大。转基因和非转基因美丽胡枝子的叶长、叶宽随着遮荫强度的增大呈现先增大后减小的趋势。透光率75% 时,叶长、叶宽增大,但在透光率100%和75% 条件下,非转基因植株和转基因植株叶长、叶宽不存在显著性差异。当透光率为34% 时,叶长、叶宽减小,与自然光下植株相比,非转基因植株叶长降低了39.5%,叶宽减小了46.2% ; 转基因株系25 号和34 号叶长分别降低了12.0%和20.6%,叶宽分别减小了9.3%和22.8%。当透光率为11% 时,供试材料的叶长、叶宽进一步减小,仍然是非转基因植株下降幅度大,转基因植株降幅相对较小。统计分析的结果显示,当透光率为34% 或11% 时,转基因株系与非转基因植株在叶长、叶宽上存在极显著性差异。
|
|
转基因和非转基因美丽胡枝子的比叶面积随着遮荫强度的增大而增大(表 1)。在自然光照和透光率75% 条件下,转基因植株和非转基因植株的比叶面积不存在显著性差异; 透光率为34%,11% 时,2个转基因株系的比叶面积都比非转基因植株小,且存在极显著性差异。比叶面积是单位干质量的叶面积,遮荫后美丽胡枝子的比叶面积增大,说明叶片随着光照的减弱变薄。非转基因植株的比叶面积大于转基因植株,说明非转基因植株的叶片较薄。
转基因植株和非转基因植株的比叶干质量、单位叶面积鲜质量随着遮荫强度的增强而减小。自然光照和透光率为75% 条件下,转基因株系和非转基因植株的比叶干质量、单位叶面积鲜质量不存在差著性差异; 透光率为34%和11% 时,2 个转基因株系的比叶干质量、单位叶面积鲜质量大于非转基因植株,并存在极显著差异(表 1)。
2.3 遮荫对转基因美丽胡枝子的甜菜碱醛脱氢酶活性和甜菜碱含量的影响为了了解遮荫状态下外源BADH基因在植株中的表达,测定了不同遮荫条件下转基因美丽胡枝子株系的甜菜碱醛脱氢酶(BADH)活性和甜菜碱含量。从表 2 中可见,随着遮荫强度的增加,转基因的美丽胡枝子植株的BADH活性和甜菜碱含量呈现上升趋势,而非转基因的美丽胡枝子植株则没有明显的变化。自然光照下,BADH活性和甜菜碱含量较低; 在透光率为75% 条件下,转基因植株BADH活性和甜菜碱含量均有所增加,但增加的幅度较小,且非转基因和转基因植株BADH活性和甜菜碱含量的值不存在显著性差异; 在透光率为34% 的条件下,转基因植株BADH活性和甜菜碱含量分别为非转基因植株的1.5 ~2 倍和1.3 ~1.5 倍; 当透光率为11% 时,转基因植株的BADH活性进一步提高,所积累的甜菜碱也相应增高。在中度、强度遮荫下,2 个转基因株系的BADH活性和甜菜碱含量与非转基因植株相比存在极显著性差异(误差α≤0.001),表明在遮荫条件下,转基因植株可通过提高BADH活性积累较多的甜菜碱。
|
|
非转基因和转基因美丽胡枝子在不同遮荫处理下叶绿素含量的变化如表 3 所示。随着遮荫强度的增加,转基因植株的叶绿素a、叶绿素b的含量呈现增加的趋势; 而非转基因植株的叶绿素a、叶绿素b含量在轻度、中度遮荫后也呈增加趋势,但在强度遮荫(透光率11%)条件下,非转基因植株叶片呈现黄化状态时,测得其叶绿素a的含量只有0.126mg·g -1 FW,为自然光照状态时的9.2%,而叶绿素b的含量只有0.052mg·g -1 FW,为自然光照状态时的11.9%。在自然光照下,转基因植株和非转基因植株的叶绿素a、叶绿素b含量没有显著差异(误差α >0.05)。当透光率75% 时,转基因植株和非转基因植株的叶绿素a含量没有显著差异(误差α >0.05),但叶绿素b含量已经存在显著性差异。当透光率为34% 时,转基因株系25 号和34 号与非转基因植株相比叶绿素a含量分别增加了9.0%和8.1%,叶绿素b含量分别增加了33.8%和34.4%,且转基因株系与非转基因植株在叶绿素a、叶绿素b含量上存在显著差异(叶绿素a误差α =0.036; 叶绿素b误差α =0.043)。在强度遮荫下(透光率11%),尽管从外观上看,转基因株系的叶色比中度遮荫时要略浅些,但由于叶片变得更小、更薄,实际测得的单位鲜质量的叶绿素a、b含量与透光率为34% 时相比差异不大(误差α =0.21)。
|
|
植物叶片中叶绿素a/b的值是判读植物耐荫能力的重要评价指标,其值越小,表明其耐荫能力越强(白伟岚等,1999)。阳性植物的叶绿素a/b值通常大于或者等于3(上海植物生理学会,1985)。非转基因和转基因美丽胡枝子在不同遮荫处理下叶绿素a/b值的变化如表 3 所示。随着遮荫强度的增加,叶绿素a/b值基本呈现减小的趋势。在自然光照下,非转基因和转基因美丽胡枝子叶绿素a/b值大于3,表现出典型的阳生叶片特征,且二者不存在显著性差异; 遮荫处理后,转基因植株与非转基因植株的叶绿素a/b值均小于3。透光率为75% 时,转基因株系的叶绿素a/b值与非转基因植株之间不存在显著性差异(误差α =0.062); 当透光率34%,11% 时,2个转基因株系的叶绿素a/b值与非转基因植株之间就有了极显著性的差异(误差α <0.01)。
2.5 遮荫处理下转基因美丽胡枝子净光合速率的日变化由图 3 可知,转基因和非转基因美丽胡枝子的净光合速率(Pn)随着遮荫强度的增加而减小。自然光照下转基因和非转基因美丽胡枝子的Pn日变化(图 3A)均出现双峰,存在明显的“午休现象”,2个峰值分别出现在11:00和14:00,而转基因植株在“午休”期间的Pn值高于非转基因植株; 当透光率75% 时,转基因和非转基因美丽胡枝子的Pn日变化呈现单峰,最高峰值出现在13:00,转基因植株的Pn值在16:00 后明显大于非转基因植株(图 3B);当透光率为34%,11% 时,转基因和非转基因美丽胡枝子的Pn日变化仍呈现单峰,转基因株系的Pn值在各时刻明显高于非转基因植株,且随着透光率的减小转基因植株的Pn降低幅度与自然光下相比小于非转基因植株(图 3C,D),说明在弱光条件下,转BADH基因的美丽胡枝子的净光合速率大于非转基因植株。

|
图3
不同透光率下转BADH 美丽胡枝子净光合速率日变化
Fig.3
Diurnal variation of Pn of BADH transgenic L. formosa in different light transmittance
A. 自然光照; B. 透光率75% ; C. 透光率34% ; D. 透光率11% 。 A. Natural light; B. Light transmittance 75% ; C. Light transmittance 34% ; D. Light transmittance 11% . |
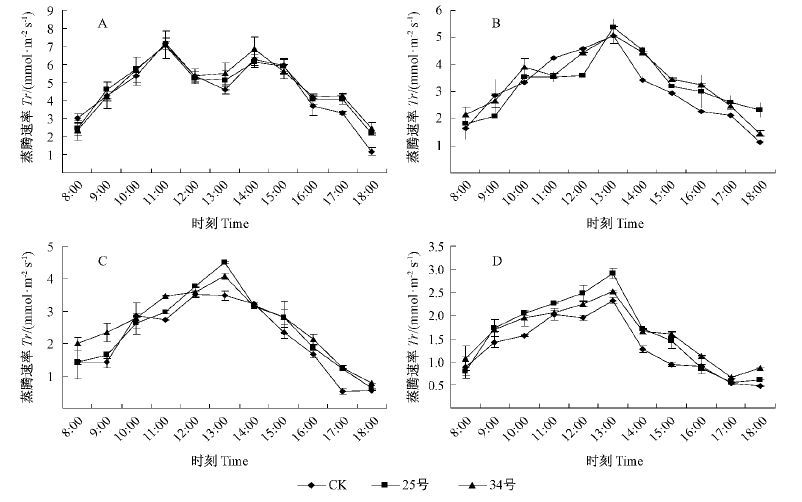
从图 4 可见,转基因和非转基因美丽胡枝子蒸腾速率(Tr)的日变化随着遮荫程度的增强而下降,Tr 与Pn日变化趋势基本一致。在遮荫条件下转基因植株的Tr 降低的幅度小于非转基因植株,即转基因植株的蒸腾速率大于非转基因植株。统计结果也显示,中度、强度遮荫后,转基因和非转基因植株的蒸腾速率存在显著性差异(误差α <0.04),说明在弱光环境下,转基因植株的水分代谢比非转基因植株强。
|
图4
不同透光率下转BADH 美丽胡枝子蒸腾速率日变化
Fig.4
Diurnal variation of transpiration rate(Tr) of BADH transgenic L. formosa in different light transmittance
A.自然光照;B.透光率75%;C.透光率34% ; D.透光率11% 。 A. Natural light; B. Light transmittance 75% ; C. Light transmittance 34% ; D. Light transmittance 11% . |
光饱和时的最大净光合速率、表观量子效率、光饱和点、光补偿点是常用的光合生理指标。由表 4可见,非转基因和转基因株系最大净光合速率(Pmax)随着遮荫强度的增加而减小。自然光照和轻度遮荫下,非转基因和转基因株系的Pmax值不存在显著性差异; 当中度、强度遮荫时,转基因株系25号、34 号和非转基因植株的Pmax值存在极显著性差异(误差α <0.003),转基因美丽胡枝子的Pmax大于非转基因植株,说明转基因美丽胡枝子在弱光条件下光合能力大于非转基因植株。在表观量子效率方面,非转基因美丽胡枝子表观量子效率(AQY)随着遮荫强度的增加呈现先增加后减小的趋势,而转基因美丽胡枝子2 个株系AQY随着遮荫强度的增加呈现增加的趋势。自然光照下和轻度遮荫(透光率为75%)时,非转基因和转基因株系的AQY值差别不大; 当透光率34%,11% 时,非转基因植株的AQY值下降,而转基因株系25 号、34 号的AQY值仍呈上升趋势。表观量子效率反映了植物光合作用的光能利用效率,尤其是对弱光的利用能力(曹雪丹等,2008),可见转基因美丽胡枝子在弱光条件下对光能利用效率高于非转基因植株。
光饱和点(LSP)与光补偿点(LCP)反映了植物对光照条件的要求,体现植物对光的利用能力,一般光补偿点在0 ~10 μmol·m -2 s -1 为阴生植物,阳生植物一般在10 μmol·m -2 s -1 以上(马彦军等,2010)。由表 4 可知,非转基因和转基因美丽胡枝子在自然光和透光率为75% 条件下,其光补偿点都在10 μmol·m -2 s -1 以上,说明美丽胡枝子为阳生植物。转基因与非转基因美丽胡枝子的LCP和LSP均是随着遮荫强度的增加而减小。自然光照下,非转基因植株和转基因株系的LCP和LSP不存在显著性差异; 透光率为75% 时,非转基因植株和转基因株系的LCP不存在显著性差异,但LSP有了显著性差异(误差α =0.045); 在透光率为34%和11% 条件下,转基因株系LCP和LSP小于非转基因植株,且存在显著性差异。
|
|
植物光合器官在2 个水平上适应弱光环境: 结构水平和生化水平,其中叶片结构是植株最为可塑的性状之一(薛伟等,2011)。光照强度长时间显著低于植物光饱和点将产生弱光胁迫,影响植物的形态建成和生理生化过程(Callahan et al., 2002)。遮荫条件下,植物叶形态的适应改变主要表现在叶片的比叶面积增加、叶片厚度降低和比叶质量减少等方面(Lichtenthaler et al., 1981; Dai et al., 2009)。但有些研究表明遮荫对叶片面积大小的影响各不相同,在中等遮荫条件下,耐荫植物的叶片变大,在强度遮荫时叶片变小,而喜光植物不论在什么样的遮荫条件下都减少叶面积(Blackman,1956)。柏明娥等(2007)对美丽胡枝子光合作用特性及影响因子分析的研究结果显示美丽胡枝子属强阳性速生植物。本试验研究结果表明,非转基因和转基因美丽胡枝子随着遮荫强度的增加其叶长、叶宽呈现先增加后减小的趋势,其比叶面积呈增加趋势,比叶干质量和单位叶面积鲜质量呈下降趋势。不遮荫和轻度遮荫时,转基因和非转基因植株在叶形态指标上不存在显著性差异; 但透光率≤34% 时,转基因植株叶长、叶宽、比叶干质量和单位叶面积鲜质量大于非转基因植株,其比叶面积小于非转基因植株。本项研究结果显示叶形态的适应性改变与前人的研究结果一致。在荫蔽逆境下,转基因美丽胡枝子T1 代植株叶色呈现绿色与黄色接近3 ∶1 的性状分化规律,说明所选用的转基因美丽胡枝子T0 代的2 个株系可能是外源基因的单拷贝插入; 杨晓红等(2009)曾测得在盐胁迫下这2 个T0 代株系的甜菜碱含量差异不大,也说明这2 个T0 代株系外源基因插入的拷贝数可能相同。
3.2 遮荫下的叶绿素植物在低光强下会通过形成更多的叶绿素以捕获更多的光能,从而适应阴生环境(Karim et al., 2003; Nyitrai et al., 1994)。叶绿素是植物光合作用的载体,其含量和比例是植物适应和利用环境因子的重要指标(张德顺等,1997; Boardman,1977;Thompson et al., 1992)。植物体内叶绿素的含量既取决于立地条件,又取决于植物品种的特性。一般来说,叶绿素含量高,叶绿素a/b比值小的物种具有较强的耐荫性(张德顺等,1997; Boardman,1977)。本试验中,随着遮荫强度增加,转基因和非转基因的美丽胡枝子叶绿素a、叶绿素b的含量基本呈现上升趋势,叶绿素a/b值逐渐减小,仅强度遮荫下的非转基因植株例外; 这主要是随着遮荫强度的增加,不论是转基因植株还是非转基因植株其叶片形态已经发生了变化,比叶面积增大,比叶干质量下降,叶片进一步变小、变薄,其叶绿素含量因反映的是单位鲜质量时的含量,因此测定过程中随着遮荫强度的增加所用的叶片数量增加造成单位鲜质量的叶绿素a、b含量增加。尽管在测定中观察到: 在中度遮荫下,转基因美丽胡枝子的叶色比轻度遮荫时深,非转基因的美丽胡枝子叶色比轻度遮荫时浅; 当透光率11% 时,转基因美丽胡枝子的叶色从外观上比中度遮荫时浅,但其叶片变得更小、更薄,非转基因植株尽管叶片也变得更小、更薄,但叶色呈现严重的黄化现象,部分叶部已经出现白化现象,因而才会使叶绿素含量急剧下降。在弱光下,转基因美丽胡枝子叶绿素a、b的含量高于非转基因植株,叶绿素a/b值小于非转基因植株,说明转基因美丽胡枝子植株合成叶绿素的能力比非转基因植株强。
3.3 遮荫下的光合特性与甜菜碱已经有许多研究结果都表明,适度遮光可使园艺、园林树种净光合速率日变化曲线由双峰转变为单峰,以缓解植物的光抑制,提高表观量子效率,增强叶片的光合潜力,使最大光能转化率维持在较高的水平上(He et al., 1996; Senevirathna et al., 2008)。在弱光生境下,光补偿点和光饱和点有下降的趋势(睦晓蕾等,1999)。植物光补偿点低,意味着植物在较低的光强下就开始了有机物质的正向增长; 光饱和点低则表明植物光合速率随光量子密度的增大而迅速增加,很快即达到最大效率。因而,较低的光补偿点和饱和点使植物在光照有限条件下以最大能力利用低光量子通量进行最大可能的光合作用,从而提高有机物质的积累,满足其生存生长的能量需要(王雁等,2002)。表观量子效率反映了植物光合作用的光能利用效率,尤其是对弱光的利用能力(曹雪丹等,2008)。本试验中,遮荫使美丽胡枝子的日净光合速率和蒸腾速率由双峰变为单峰,日净光合速率、日蒸腾速率、光补偿点和光饱和点随着遮荫强度增加而降低; 弱光下,转基因的美丽胡枝子的日净光合速率、日蒸腾速率和表观量子效率比非转基因植株高,而光补偿点和光饱和点比非转基因植株低,说明转BADH基因的美丽胡枝子比非转基因植株更能适应弱光逆境。
尽管目前已知甜菜碱与植物光合系统有一定的关系,如: 甜菜碱可以稳定光系统Ⅱ放氧复合体的结构(Papageorgiou et al., 1995),减轻高温胁迫下PSⅡ 放氧复合体的失活(Allakhverdiev et al., 1996); 在转codA基因的藻青菌(Synechococcus)研究中,甜菜碱的积累可以加快盐胁迫下D1 蛋白的修复从而维持较高的PSⅡ放氧活性(Ohnishi et al., 2006); 甜菜碱还能促进干旱/ 盐胁迫下小麦(Triticum aestivum)幼苗对光能的捕获和转换(赵博生等,2001),维持干旱或盐胁迫下番茄(Lycopersicon esculentum)的叶绿体体积,提高色素含量(Mäkelä et al., 2000),加速小麦D1 蛋白的周转速度(Ma et al., 2006),从而提高PSⅡ的活性; 在转codA拟南芥(Arabidopsis thaliana)中,甜菜碱能加快拟南芥PSⅡ的修复来保护其免受光诱导的失活,提高光胁迫下的光合活性(Alia et al., 1999)。此外,甜菜碱还能维持干旱或盐害下植株的Ca2+ -ATPase活性及Hill反应活力,增加叶绿素a与b的比值(Chl a/b),降低类胡萝卜素与叶绿素的比值(Car /Chl),进而维持胁迫条件下的光合功能(惠红霞等,2003; 赵新西等,2005)。但在弱光环境下,关于甜菜碱影响植物的光合系统的研究还少见报道。本文研究中发现,弱光可刺激甜菜碱醛脱氢酶基因的表达,该酶活性随遮荫强度增加而增强,从而使转BADH基因的美丽胡枝子比非转基因植株积累较多的甜菜碱; 弱光下,转基因植株叶绿素合成能力、表观量子效率和蒸腾速率明显比非转基因植株强,而光补偿点和光饱和点明显比非转基因植株低,因而使得转BADH基因植株能够更好地利用弱光环境;此结果表明甜菜碱可提高弱光条件下植物合成叶绿素的能力,降低植物光补偿点和光饱和点,提高植物的净光合速率、表观量子效率和蒸腾速率,使植物适应弱光环境。
| [1] |
柏明娥,洪立兴,朱汤军,等.2007.美丽胡枝子光合作用特性及其影响因子分析.浙江林业科技,27(6):1-5.( 2) 2)
|
| [2] |
白伟岚,任建武,苏雪痕.1999.八种植物耐阴性比较研究.北京林业大学学报,21(3):46-52.( 1) 1)
|
| [3] |
曹雪丹,李文华,鲁周民,等.2008.北缘地区枇杷春季光合特性研究.西北林学院学报,23(6):33-37.( 2) 2)
|
| [4] |
胡冬南,陈晓阳,李伟,等.2008.农杆菌介导BADH基因转化美丽胡枝子的研究.林业科学,44(3):76-79.( 1) 1)
|
| [5] |
惠红霞,许兴,李前荣.2003.外源甜菜碱对盐胁迫下枸杞光合功能的改善.西北植物学报,23(12):2137-2422.( 1) 1)
|
| [6] |
罗晓丽,肖娟丽,王志安,等.2008.菠菜甜菜碱醛脱氢酶基因在棉花中的过量表达和抗冻耐逆性分析.生物工程学报,24(8):1464-1469.( 1) 1)
|
| [7] |
刘凤华,郭岩,谷冬梅,等.1997.转甜菜碱醛脱氢酶基因植物的耐盐性研究.遗传学报,24(1):54-58.( 1) 1)
|
| [8] |
陆佩玲,于强,罗毅,等.2001.冬小麦光合作用的光响应曲线的拟合.中国农业气象,2(2):12-14.( 1) 1)
|
| [9] |
马彦军,曹致中,李毅.2010.绒毛胡枝子光合作用特性及其影响因子分析.草地学报,18(2):183-187.( 1) 1)
|
| [10] |
睦晓蕾,朱雨杰.1999.弱光对甜椒不同品种光合特性的影响.园艺学报,26(5):314-318.( 1) 1)
|
| [11] |
上海植物生理学会.1985.植物生理学实验手册.上海:上海科技出版社.( 1) 1)
|
| [12] |
王雁,苏雪痕,彭镇华.2002.植物耐荫性研究进展.林业科学研究,15(3):349-355.( 1) 1)
|
| [13] |
薛伟,李向义,朱军涛,等.2011.遮荫对疏叶骆驼刺叶形态和光合参数的影响.植物生态学报,35(1):82-90.( 1) 1)
|
| [14] |
杨晓红,陈晓阳,王颖,等.2010.干旱胁迫对转SacB基因、转BADH基因的美丽胡枝子的影响.林业科学,46(7):64-68.( 1) 1)
|
| [15] |
杨晓红,陈晓阳,隗晓丹,等.2009.NaCl胁迫对转甜菜碱醛脱氢酶基因美丽胡枝子生理的影响.安徽农业科学,37(1):67-69.( 1) 1)
|
| [16] |
张德顺,李秀芬.1997.24个园林树种耐阴性分析.山东林业科技,(3):27-30.( 2) 2)
|
| [17] |
赵博生,衣艳君,刘家尧.2001.外源甜菜碱对干旱/盐胁迫下的小麦幼苗生长和光合功能的改善.植物学通报,18(3):378-380.( 1) 1)
|
| [18] |
赵新西,马千全,邹琦,等.2005.根施甜菜碱对盐胁迫下小麦幼苗类囊体膜脂脂肪酸组分和功能的影响.植物生理与分子生物学学报,3l(2):135-142.( 1) 1)
|
| [19] |
Alia,Kondo Y,Sakamoto A,et al. 1999. Enhanced tolerance to Iight stress of transgenic Arabidopsis plants that express the codA gene for a bacterial choline oxidase. Plant Molecular Biology,40(2):279-288.( 1) 1)
|
| [20] |
Allakhverdiev S I,Feyziev Y M,Ahmed A,et al. 1996. Stabilization of oxygen evolution and primary electron transport reactions in photosystem II against heat stress with glycine betaine and sucrose. Journal of Photochemistry and Photobiology,34(2 /3):149-157.( 1) 1)
|
| [21] |
Ashraf M,Foolad M R. 2007. Roles of glycine betaine and proline in improving plant abiotic stress resistance. Environmental and Experimental Botany,59(2):206-216.( 1) 1)
|
| [22] |
Blackman G E. 1956. Influence of light and temperature on leaf growth. Butterworth & Co.(Publishers) ltd. London,151-169.( 1) 1)
|
| [23] |
Boardman N K. 1977. Comparative photosynthesis of sun and shade plants. Annual Review of Plant Physiology,28:355-377.( 2) 2)
|
| [24] |
Callahan H S, Piglucci M. 2002. Shade-induced plasticity and its ecological significance in wild populations of Arabidopsis thaliana. Ecology,83(7):1965-1980.( 1) 1)
|
| [25] |
Chen T H H,Murata N. 2008. Glycinebetaine: an effective protectant against abiotic stress in plants. Trends in Plant Science,13(9):499-505.( 2) 2)
|
| [26] |
Chen T H H,Murata N. 2011. Glycinebetaine protects plants against abiotic stress: mechanisms and biotechnological applications. Plant, Cell and Environment,34(1):1-20.( 1) 1)
|
| [27] |
Dai Y J,Shen Z G,Liu Y,et al. 2009. Effects of shade treatments on the photosynthetic capacity, chlorophyll fluorescence, and chlorophyll content of Tetrastigma hemsleyanum Diels et Gilg. Environmental and Experimental Botany,65(2/3):177-182.( 1) 1)
|
| [28] |
Fitzgerald T L,Waters D L E,Henry R J. 2009. Betaine aldehyde dehydrogenase in plants. Plant Biology,11(2):119-130.( 1) 1)
|
| [29] |
Herrick J D,Thomas R B. 1999. Effects of CO2 enrichment on the photosynthetic light response of sun and shade leaves of canopy sweetgum trees( Liquidambar styraciflua) in a forest ecosystem. Tree Physiology,19(12):779-786.( 1) 1)
|
| [30] |
He J,Chee C W,Coh C J. 1996.“Photoinhibition”of Heliconia under natural tropic condition: the importance of leaf orientation for light interception and leaf temperature. Plant,Cell and Environment,19(11):1238-1248.( 1) 1)
|
| [31] |
Karim A,Fukamachi H,Hidaka T. 2003. Photosynthetic performance of Vigna radiata L. leaves developed at different temperature and irradiance levels. Plant Science,164(4):451-458.( 1) 1)
|
| [32] |
Li Wei, Hu Dongnan, Li Hui,et al. 2007. Polyploid induction of Lespedeza formosa by colchicine treatment. Forestry Studies in China,9(4):283-286.( 1) 1)
|
| [33] |
Lichtenthaler H K,Buschmann C,Döll M,et al. 1981. Photosynthetic activity,chloroplast ultrastructure,and leaf characteristics of high- light and low-light plants and of sun and shade leaves. Photosynthesis Research,2(2):115-141.( 1) 1)
|
| [34] |
Ma Q Q,Wang W,Li Y H,et al. 2006. Alleviation of photoinhibition in drought-stressed wheat(Triticum aestivum) by foliar-applied glycinebetaine. Journal of Plant Physiology,163(2):165-175.( 1) 1)
|
| [35] |
Mäkelä P,Kärkkäinen J,Somersalo S. 2000. Effects of glycinebetaine on chloroplast ultrastructure, chlorophyll and protein content, and RuBPCO activities in tomato grown under drought or salinity. Biologia Plantarum,43(3):471-475.( 1) 1)
|
| [36] |
Nyitrai P,Sarvari E,Keresztes A,et al. 1994. Organization of thylakoid membranes in low light grown maize seedlings: Effect of lincomycin treatment. Journal of Plant Physiology,144(3):370-375.( 1) 1)
|
| [37] |
Ohnishi N,Murata N. 2006. Glycinebetaine counteracts the inhibitory effects of salt stress on the degradation and synthesis of D1 protein during photoinhibition in Synechococcus sp. PCC 7942. Plant Physiology,141(2):758-765.( 1) 1)
|
| [38] |
Papageorgiou G C, Murata N. 1995. The unusually strong stabilizing effects of glycine betaine on the structure and function of the oxygen- evolving photosystemⅡ complex. Photosynthesis Research,44(3):243-252.( 2) 2)
|
| [39] |
Rhodes D, Hanson A D. 1993. Quaternary ammonium and tertiary sulfonium compounds in higher plants. Annual Review of Plant Physiology & Plant Molecular Biology,44:357-384.( 1) 1)
|
| [40] |
Senevirathna A M W K,Stirling C M,Rodrigo V H L. 2008. Acclimation of photosynthesis and growth of banana(Musa sp.) to natural shade in the humid tropics. Experimental Agriculture,44(3):301-312.( 1) 1)
|
| [41] |
Sulpice R, Gibon Y, Cornic G, et al. 2002. Interaction between exogenous glycine betaine and the photorespiratory pathway in canola leaf discs. Physiologia Plantarum,116(4):460-467.( 1) 1)
|
| [42] |
Thompson W A, Kriedemann P E, Craig I E. 1992. Photosynthetic response to 1 ight and nutrients in sun-tolerant and shade-tolerant rainforest trees. Growth, leaf anatomy and nutrient content. Australian Journal of Plant Physiology,19(1):1-18.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

