文章信息
- 李燕利, 薛怀君, 胡春祥, 杨星科
- Li Yanli, Xue Huaijun, Hu Chunxiang, Yang Xingke
- 4种植食性甲虫肠道内纤维素酶活性的比较
- Comparation of Gut Cellulase Activity in Four Herbivorous Beetles
- 林业科学, 2013, 49(1): 161-168
- Scientia Silvae Sinicae, 2013, 49(1): 161-168.
- DOI: 10.11707/j.1001-7488.20130123
-
文章历史
- 收稿日期:2012-02-27
- 修回日期:2012-05-03
-
作者相关文章
2. 中国科学院动物研究所动物进化与系统学院重点实验室 北京 100101
2. Key Laboratory of Zoological Systematics and Evolution, Institute of Zoology, Chinese Academy of Sciences Beijing 100101
地球上每年通过光合作用合成的纤维素约1 000亿吨(杨天赐等,2006)。纤维素是地球上分布最广、最丰富的可再生生物资源,纤维素的利用和转化对于解决目前世界能源危机、粮食短缺、环境污染等问题具有十分重要的意义(顾方媛等,2008;段旭等,2009;Shi et al.,2011)。利用纤维素酶对纤维素进行降解利用是最为有效的方法。近年来,昆虫纤维素酶在工业生产和能源领域的潜在利用价值备受关注(Scharf et al.,2008;Huang et al.,2010;Sun et al.,2010;Willis et al.,2010)。
一些昆虫能够利用纤维素酶消化食物中的纤维素,以获得生长发育所需的营养。昆虫体内共生微生物分泌的纤维素酶最早发现于白蚁和蜚蠊肠内(Cleveland,1924;1934),此后其他昆虫体内也检测到了纤维素酶的存在(蒋书楠等,1996;殷幼平等,1996;2000;杨天赐等,2003;索风梅等,2004;Lee et al.,2005;2006;Wei et al.,2005;2006;Nakonieczny et al.,2006;Kim et al.,2008;黄祥财等,2008;Oppert et al.,2010;Shi et al.,2011)。研究表明:除了昆虫肠内共生微生物产生纤维素酶以外,一些昆虫体内还存在内源的纤维素酶,至少有7个目28个种的昆虫纤维素酶基因已经被发现或克隆(Watanabe et al.,2010;Calderón-Cortés et al.,2010)。
鞘翅目昆虫(甲虫)是生物界最大的类群,目前已记录的种类超过35万种,其中一半以上为植食性,取食各种植物及植物的不同组织和部位(Beutel et al.,2000)。复杂的食性很可能使得其纤维素酶的特性存在很大差异,为进一步寻找和开发高效纤维素酶系提供了丰富的资源。目前对鞘翅目昆虫纤维素酶的研究还很有限,特别是缺乏同种条件下不同昆虫肠道内纤维素酶活性的综合比较研究。蒋书楠等(1996)比较了隶属于不同亚科的3种天牛的纤维素酶的活性;段旭等(2009)比较研究了松墨天牛(Monochamus alternatus)和中国圆田螺(Cipangopaludina chinensis)体内纤维素酶系;Shi等(2011)比较研究了分属于3个目的3种食性不同的昆虫木聚糖酶和纤维素酶活性,其中包括1种天牛;Oppert等(2010)对昆虫纲8个目68个种的植食性昆虫的纤维素酶活性进行了比较研究,其中涉及鞘翅目昆虫7科10种,是迄今为止涵盖类群和种类最多的纤维素酶活性的比较研究。
由于纤维素酶的活性于受到底物浓度、反应时间等诸多因素的限制,检测结果也容易受到蛋白质定量方法等因素的影响,很难和其他人的研究结果直接进行定量比较(Oppert et al.,2010)。因此,在相同反应条件下对不同昆虫肠道内纤维素酶活性的比较研究具有重要意义。本文在不同温度和pH值条件下检测了3种叶甲的成、幼虫及1种天牛幼虫体内纤维素酶的活性,希望在同等条件下客观评价甲虫体内的纤维素酶活性,为寻找高效昆虫源纤维素酶系提供基础。
1 材料与方法 1.1 虫体来源杨叶甲(Chrysomela populi)和二纹柱萤叶甲(Gallerucida bifasciata)成虫及幼虫采于北京门头沟区泗家水,紫榆叶甲(Ambrostoma quadriimpressum)成虫和幼虫采于东北林业大学校园,双条杉天牛(Semanotus bifasciatus)幼虫采于北京植物园。
1.2 试剂来源羧甲基纤维素(CMC)和水杨素(Salicin)均由Sigma公司生产,微晶纤维素(MCC)由Fluka公司生产,其他试剂未有特别说明均为国产分析纯。
1.3 酶液的制备分别取试验用虫10头,冰浴解剖,取出肠道,用0.01 mol·L-1 pH7.4的磷酸缓冲液在冰上充分匀浆后于4 ℃ 10 000 r·min-1离心15 min,上清液即为原酶液,分装后置于-70 ℃冰箱中保存备用。
1.4 纤维素酶活性的测定酶液的蛋白含量测定采用考马斯亮蓝G-250染色法测定(Bradford,1976)。纤维素酶活性的测定采用DNS法(Oppert et al.,2010;Shi et al.,2011),略有改进。本研究在5个温度和7个pH值(共计35个组合)条件下分别对内切β-1,4-葡聚糖酶(Cx酶)、外切β-1,4-葡聚糖酶(C1酶)和β-葡萄糖苷酶的活性进行比较测定。
Cx酶的测定用1%羧甲基纤维素为底物,C1酶的测定用2%微晶纤维素为底物,β-葡萄糖苷酶的测定用2%水杨素为底物。各底物分别用pH值为3,4,5,6,7,8的磷酸二氢钠-柠檬酸缓冲液(0.2mol·L-1)和pH为9的甘氨酸-氢氧化钠缓冲液(0.2 mol·L-1)配制。
取稀释酶液0.1 mL与0.5 mL上述底物充分混匀,分别在30,40,50,60,70 ℃水浴中温育2 h后,加入DNS显色剂2 mL,沸水浴显色5 min,流水冷却,在540 nm下测定OD值,每测定重复3次,取平均值,同时设空白对照。以试验条件下酶液蛋白含量(mg)在单位时间(min)内酶促反应产生的还原糖(葡萄糖)量(μmol)计算酶活性,即μmol·min-1mg-1(Shi et al.,2011)。1.5数据分析温度和pH值对甲虫体内纤维素酶活性影响采用方差分析法,各甲虫纤维素酶最适温度和pH值条件下的活性值采用多重比较分析。所有数据处理均使用统计软件SPSS 18.0。
2 结果与分析 2.1 杨叶甲成虫和幼虫体内纤维素酶活与pH值和温度的关系从图 1可以看出: pH值和温度的变化对杨叶甲成虫3种纤维素酶活性有显著影响。Cx酶、β-葡萄糖苷酶的最适温区为40~60 ℃,最适pH在4~6之间,但C1酶活性在各组合条件下都很低。
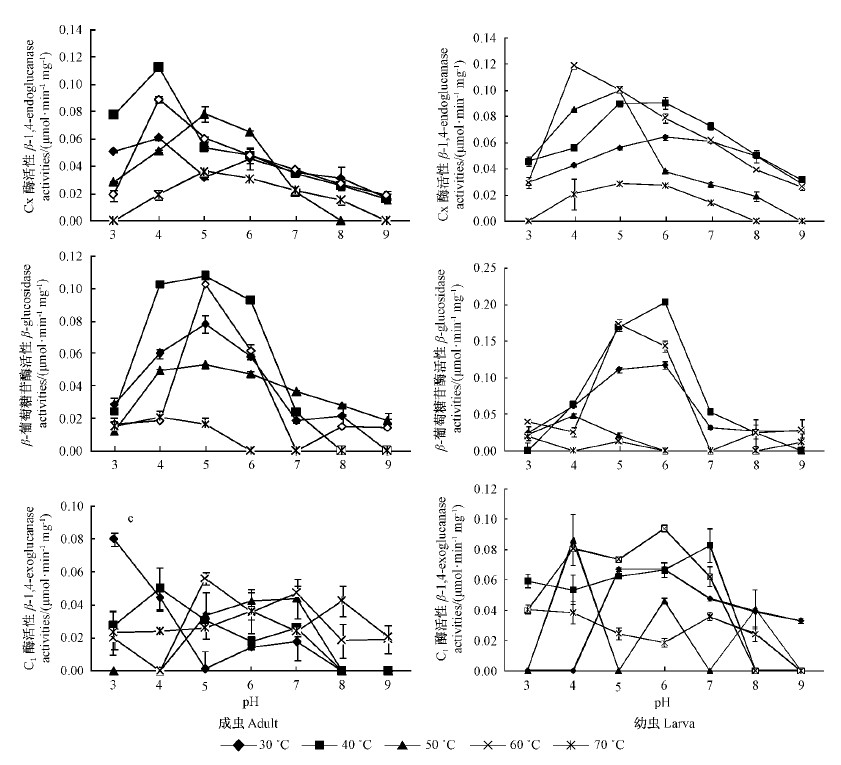 |
图 1 杨叶甲3种纤维素酶酶活性
Fig. 1 Cellulase activities of C. populi
|
杨叶甲幼虫Cx酶最适温区在40~60 ℃,最适pH为4~6,最高酶活性是0.12 μmol·min-1mg-1(pH=4,60 ℃);β-葡萄糖苷酶的最适温区为30~60 ℃,最适pH为5~6;C1酶活性在各个条件下都较低,pH为4~7时有相对高的活性(图 1)。
2.2 紫榆叶甲成虫和幼虫体内纤维素酶活性与pH值和温度的关系图 2表明:对于紫榆叶甲成虫,Cx酶活性最适温区为40~60 ℃,最适pH为5~6;β-葡萄糖苷酶只有在温区30~50 ℃,pH为5~6时有很高酶活性;在pH=3,4,9时,各温区C1酶活性均较低。
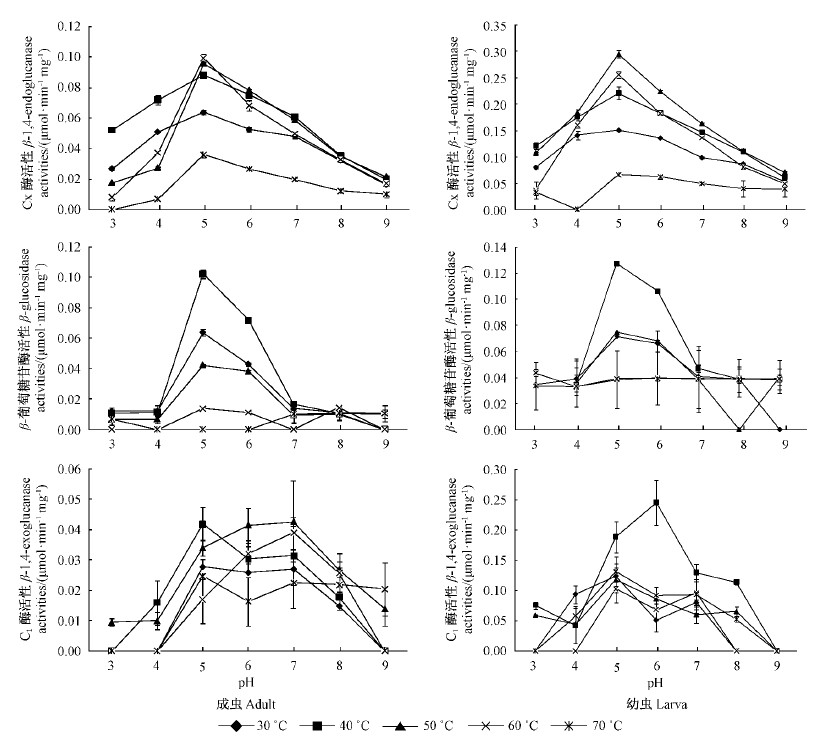 |
图 2 紫榆叶甲3种纤维素酶酶活性
Fig. 2 Cellulase activities of A. quadriimpressum
|
紫榆叶甲幼虫Cx酶最适温区为30~60 ℃,最适pH为4~6(pH=3除外),其中pH=5时酶活性最高,为0.30 μmol·min-1mg-1;β-葡萄糖苷酶在40~ 50 ℃,pH为5~6条件下有很高酶活性;C1酶只有在pH为5,6,7条件下有相对较高的酶活性(图 2)。
2.3 二纹柱萤叶甲成虫和幼虫体内纤维素酶活性与pH值和温度的关系图 3表明:二纹柱萤叶甲成虫Cx酶在最适温区30~40 ℃,pH=4时的活性明显高于其他pH条件;β-葡萄糖苷酶活性很低;C1酶在50 ℃时酶活性较高,且pH=7条件下达到最高值(0.20±0.03 μmol·min-1mg-1)。
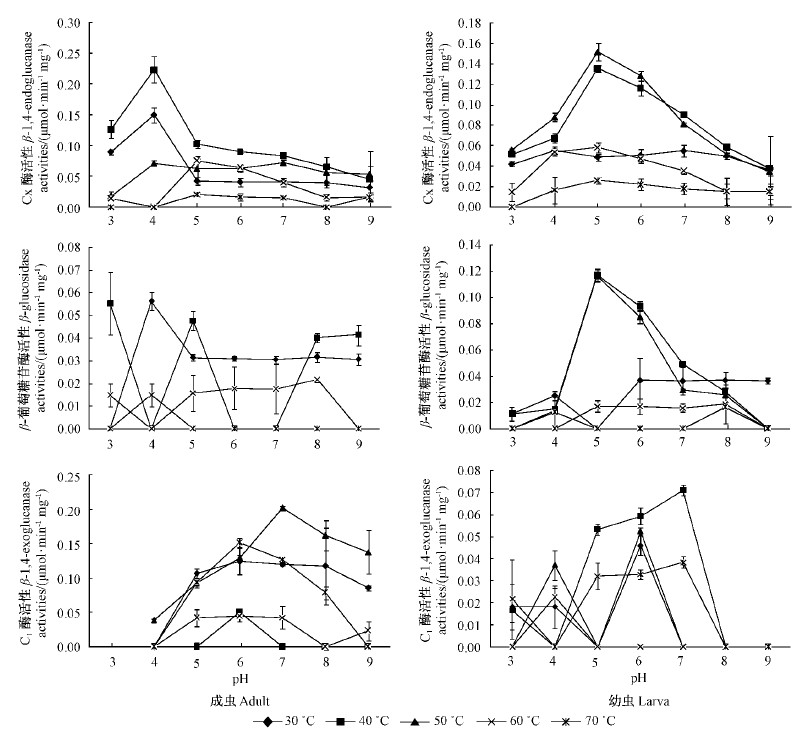 |
图 3 二纹柱萤叶甲3种纤维素酶酶活性
Fig. 3 Cellulase activities of G. bifasciata
|
二纹柱萤叶甲幼虫Cx酶活性最适温区为40 ~50 ℃,最适pH为5~6;β-葡萄糖苷酶活性只有在40~50 ℃温区内,pH为5,6时有很高酶活性,其他pH条件下酶活性均很低;C1酶活性都很低(图 3)。
2.4 双条杉天牛幼虫体内纤维素酶活性与pH值和温度的关系图 4表明:双条杉天牛幼虫体内Cx酶活性很低,在60 ℃温度下pH为5,6,7时较高,最高活性只有0.08 μmol·min-1 mg-1。β-葡萄糖苷酶在所有条件下活性都很低;C1酶在温区30~60 ℃时酶活性很低,在70 ℃下pH为6,7,8,9时C1酶活性逐渐升高,pH=9时达到最高值(0.32 μmol·min-1mg-1)。
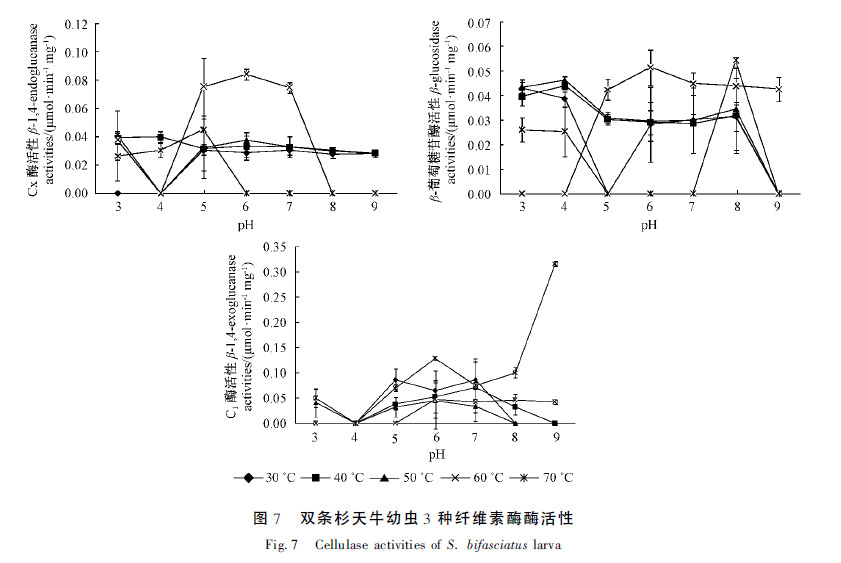 |
图 4 双条杉天牛幼虫3种纤维素酶酶活性
Fig. 4 Cellulase activities of S. bifasciatus larva
|
2因素方差分析结果表明(表 1):温度和pH值对4种甲虫7种虫态的纤维素酶活性均影响显著(P < 0.01),温度和pH值的互作也显著影响纤维素酶的活性(P < 0.01)。
|
|
表 2表明:在各自的最适条件下,4种甲虫7种虫态的Cx酶(df=6,F=157.65,P < 0.01)、β-葡萄糖苷酶(df=6,F=1003.13,P < 0.01)、C1酶活性均存在显著差异(df=6,F=31.97,P < 0.01)。其中,Cx酶活性在紫榆叶甲、二纹柱萤叶甲的成、幼虫间均有显著差异性,杨叶甲成、幼虫间无显著差异,双条杉天牛幼虫酶活性最低,紫榆叶甲幼虫最高;β-葡萄糖苷酶活性在3种叶甲成、幼虫间差异显著,杨叶甲幼虫酶活性最高,双条杉天牛幼虫最低;C1酶活性在杨叶甲成、幼虫间无明显差异,紫榆叶甲、二纹柱萤叶甲成、幼虫间均有显著差异性,双条杉天牛幼虫酶活性最高。
|
|
本文研究的4种甲虫体内均存在完整的纤维素酶系,但各甲虫体内纤维素酶活性不尽相同。3种叶甲类昆虫体内各纤维素酶的最适温区为40~60℃,最适pH范围为4~6,而高温、强碱条件下均未能检测出酶活性。其他一些甲虫也多有类似的规律,例如,赤拟谷盗(Tribolium castaneum)(Rehman,2009)、芫菁(Mylabris pustulata)(Sami et al.,2011)和几种天牛在酸性条件下酶活性较高(殷幼平等,1996;Scrivener et al.,1997;Chen et al.,2002;Lee et al.,2004;索风梅等,2004)。这可能是因为植物中含有的纤维素、半纤维素和木质素等结晶组织需要酸性条件下分解。酸性处理纤维素底物能够产生非结晶末端,使纤维素更容易被分解(Sami et al.,2011)。但不同温度和pH值条件下叶甲科3种甲虫成、幼虫纤维素酶活性的变化似乎没有一致的规律可循,这是否与成、幼虫取食特性的差异有关尚缺乏证据。
本试验发现双条杉天牛幼虫C1酶活性显著高于另外2种酶,且在强碱(pH=9)和高温(70 ℃)条件下活性最高,这跟以往对天牛的研究结果不同。殷幼平等(1996)发现桑粒肩天牛(Aprionagermari)的Cx酶最适pH值为4.4,最适温区为30~ 45 ℃;β-葡萄糖苷酶的活性最适pH值为5.6,最适温区为45~50 ℃;C1酶在各种条件下活性均很弱,最适pH值为4.6~6.4。蒋书楠等(1996)对3种隶属于不同亚科的天牛的纤维素酶活性进行比较分析,同样发现C1酶活性很低。Chen等(2002)研究光肩星天牛(Anoplophora glabripennis)幼虫纤维素酶的特性,结果表明: Cx酶和β-葡萄糖苷酶的最适温度均为40 ℃,最适pH值分别为4.4~5.6和4.8;C1酶活性很低。索风梅等(2004)对松墨天牛(Monochamus alternatus)幼虫的研究结果与双条杉天牛类似,3种纤维素酶中C1酶活性最高,但C1酶、Cx酶和β-葡萄糖苷酶的最适温区分别为35~55 ℃、45~55 ℃和40 ~50 ℃,最适pH值分别为5.0,5.6和5.0。总体来看,不同种类天牛体内各种纤维素消化酶的活性最适温区主要集中在30~50 ℃,最适pH值范围为4.4~5.6,与本研究情况类似。但Shi等(2011)测定了一种未定名天牛体内的Cx酶,发现在pH值为10的条件下仍具有较高活性;很多金龟幼虫肠道呈碱性,碱性肠道环境可以提高有机聚合物的溶解性,促进木质素水解(Biggs et al.,1996;Cazemier et al.,1997;Egert et al.,2003;2005)。昆虫体内这种耐高温耐强碱酶的存在为高效纤维素酶系的开发和利用提供了新的方向。
一些研究认为:昆虫体内酶的活性与其系统地位存在相关性,系统发育关系比食性对昆虫纤维素酶活性的影响更大(Yokoe et al.,1964;Watanabe et al.,2001;Oppert et al.,2010)。本研究中的3种叶甲纤维素酶系组成和活性更为相似,一种可能的解释是它们的亲缘关系更为接近,另外一种可能的原因则是由于食性的差异。这种“酶的活性和系统发育相吻合”规律是否真实存在,并且在什么层次的分类阶元上才能得以体现还需要更进一步的研究工作。本研究通过提取完整的消化道制取酶液,初步检测和比较了几种甲虫体内纤维素酶的活性,而纤维素酶在肠道内的具体分布位置、是否存在共生微生物(纤维素酶的外源性和内源性)等问题还需要进一步研究探讨。
| [1] |
段旭, 张晶晶, 朱静. 2009.松墨天牛和中国圆田螺体内纤维素酶系的比较研究.云南农业大学学报, 24(4): 545-551.( 2) 2)
|
| [2] |
顾方媛, 陈朝银, 石家骥. 2008.纤维素酶的研究进展与发展趋势.微生物学杂志, 28(1): 81-87.( 1) 1)
|
| [3] |
黄祥财, 王国红. 2008.黄粉虫纤维素酶性质的研究.江西植保, 31(2): 67-70.( 1) 1)
|
| [4] |
蒋书楠, 殷幼平, 王中康. 1996.几种天牛纤维素酶的来源.林业科学, 32(5): 441-446.( 3) 3)
|
| [5] |
索风梅, 林长春, 王浩杰, 等. 2004.松墨天牛纤维素酶的研究Ⅰ.纤维素酶性质研究.林业科学研究, 17(5): 583-589.( 3) 3)
|
| [6] | 杨天赐, 莫建初, 程家安. 2001.白蚁消化纤维素机理研究进展.林业科学, 42(1): 110-115. |
| [7] |
杨天赐, 莫建初, 程家安. 2003.黄胸散白蚁纤维素酶的研究.中国森林病虫, 22(6): 4-7.( 1) 1)
|
| [8] |
殷幼平, 曹月青, 何正波. 2000.桑粒肩天牛3种纤维素消化酶的分布.林业科学, 36(6): 82-85.( 1) 1)
|
| [9] |
殷幼平, 程惊秋, 蒋书楠. 1996.桑粒肩天牛纤维素酶的性质研究.林业科技, 32(5): 454-459.( 3) 3)
|
| [10] |
Biggs D R, McGregor P G. 1996. Gut pH and amylase and proteaseactivity in larvae of the New Zealand grass grub(Costelytrazealandica;Coleoptera: Scarabaeidae)as a basis for selectinginhibitors. Insect Biochemistry and Molecular Biology, 26(1): 69-75.( 1) 1)
|
| [11] |
Beutel R G, Haas F. 2000. Phylogenetic relationships of the suborders ofColeoptera(Insecta). Cladistics, 16(1): 103-141.( 1) 1)
|
| [12] |
Bradford M M. 1976. A rapid and sensitive method for the quantitation ofmicrogram quantities of protein utilizing the principle of protein-dyebinding. Analytical Biochemistry, 72(1/2): 248-254.( 1) 1)
|
| [13] |
Calderón-Cortés N, Watanabe H, Cano-Camacho H, et al. 2010. cDNAcloning, homology modelling and evolutionary insights into novelendogenous cellulases of the borer beetle Oncideres albomarginatachamela(Cerambycidae). Insect Molecular Biology, 19(3): 323-336.( 1) 1)
|
| [14] |
Cazemier A E, Op den Camp H J, Hackstein J H P, et al. 1997. Fibredigestion in arthropods. Comparative Biochemistry and PhysiologyA, 118(1): 101-109.( 1) 1)
|
| [15] |
Chen M, Lu M Z, Zhang Z Y. 2002. Characteristics of cellulases fromAnoplophora glabripennis Motsch. (Coleoptera: Cerambycidae).Forestry Studies in China, 4(2): 43-47.(  2) 2)
|
| [16] |
Cleveland L R. 1924. The physiology and symbiotic relationshipsbetween the intestinal protozoa of termites and their host, withspecial reference to Reticulitermes flavipes. The Biological Bulletin, 46(5): 203-227.( 1) 1)
|
| [17] |
Cleveland L R. 1934. The wood-feeding roach Cryptocercus, its protozoa, and the symbiosis between protozoa and roach. Memoirs of theAmerican Academy of Sciences, 17(2): 185-342.( 1) 1)
|
| [18] |
Egert M, Stingl U, Bruun D L, et al. 2005. Structure and topology ofmicrobial communities in the major gut compartments of Melolonthamelolontha larvae(Coleoptera: Scarabaeidae). Applied andEnvironmental Microbiology, 71(8): 4556-4566.( 1) 1)
|
| [19] |
Egert M, Wagner B, Lemke T, et al. 2003. Microbial communitystructure in midgut and hindgut of the humus-feeding larva ofPachnoda ephippiata(Coleoptera: Scarabaeidae). Applied andEnvironmental Microbiology, 69(11): 6659-6668.( 1) 1)
|
| [20] |
Huang S W, Zhang H Y, Marshall S, et al. 2010. The scarab gut: A potential bioreactor for bio-fuel production. Insect Science, 17(3):1-9.( 1) 1)
|
| [21] |
Kim N, Choo Y M, Lee K S, et al. 2008. Molecular cloning andcharacterization of a glycosyl hydrolasefamily 9 cellulase distributedthroughout the digestive tract of the cricket Teleogryllus emma.Comparative Biochemistry and Physiology B, 150(4): 368-376.( 1) 1)
|
| [22] |
Lee K S, Je Y H, Woo S D, et al. 2006. Production of a cellulase insilkworm larvae using a recombinant Bombyx morinucleopolyhedrovirus lacking the virus-encoded chitinase andcathepsin genes. Biotechnology Letters, 28(9): 645-650.( 1) 1)
|
| [23] |
Lee S J, Kim S R, Yoon H J, et al. 2004. cDNA cloning, expression, and enzymatic activity of a cellulase from the mulberry longicornbeetle, Apriona germari. Comparative Biochemistry and PhysiologyB, 139(1): 107-116.( 1) 1)
|
| [24] |
Lee S J, Lee K S, Kin S Ret al. 2005. A novel cellulase gene from themulberry longicorn beetle, Aprion agermari: gene structure, expression, and enzymatic activity. Comparative Biochemistry andPhysiology B, 140(4): 551-560.( 1) 1)
|
| [25] |
Nakonieczny M, Michalczyk K, Kedziorski A. 2006. Midgutglycosidases activities in monophagous larvae of Apollo butterflyParnassius apollo ssp. frankenbergeri. Comptes Rendus Biologies, 329(10): 765-774.( 1) 1)
|
| [26] |
Oppert C, Klingeman W E, Willis J D, et al. 2010. Prospecting forcellulolytic activity in insect digestive fluids. ComparativeBiochemistry and Physiology, Part B, 155(2): 145-154.( 5) 5)
|
| [27] |
Rehman F U, Aslam M, Tariq M I, et al. 2009. Isolation of cellulolyticactivities from Tribolium castaneum(red flour beetle). AfricanJournal Biotechnology, 8(23): 6710-6715.( 1) 1)
|
| [28] |
Sami A J, Anwar M A, Rehman F U, et al. 2011. Digestive cellulosehydrolyzing enzyme activity(endo-β-1, 4-d-glucanase)in the gutand salivary glands of blister beetle Mylabris pustulata. PakistanJournal of Zoology, 43(2): 393-401.( 2) 2)
|
| [29] |
Scharf M E, Tartar A. 2008. Termite digestomes as sources for novellignocellulases. Biofuels, Bioproducts and Biorefining. 2(6): 540-552.( 1) 1)
|
| [30] |
Scrivener A M, Watanabe H, Noda H. 1997. Diet and carbohydratedigestion in theyellow-spotted longicorn beetle Psacothea hilaris.Journal of Insect Physiology, 43(11): 1039-1052.( 1) 1)
|
| [31] |
Shi W B, Ding S Y, Yuan J S. 2011. Comparison of insect gut cellulaseand xylanase activity across different insect species with distinct foodsources. Bioenergy Research, 4(1): 1-10.( 6) 6)
|
| [32] |
Sun J Z, Scharf M E. 2010. Exploring and integrating cellulolyticsystems of insects to advance biofuel technology. Insect Science, 17(3): 163-165.( 1) 1)
|
| [33] |
Watanabe H, Tokuda G. 2001. Animal cellulases. Cellular andMolecular Life Sciences, 58(9): 1167-1178.( 1) 1)
|
| [34] |
Watanabe H, Tokuda G. 2010. Cellulolytic systems in insects. AnnualReview of Entomology, 55: 609-632.( 1) 1)
|
| [35] |
Wei Y D, Lee K S, Gui Z Z, et al. 2006. Molecular cloning, expression, and enzymatic activity of a novel endogenous cellulasefrom the mulberry longicorn beetle, Apriona germari. ComparativeBiochemistry and Physiology B, 145(2): 220-229.( 1) 1)
|
| [36] |
Wei Y D, Lee S J, Lee K S, et al. 2005. N-glycosylation is necessary forenzymatic activity of a beetle(Apriona germari)cellulose.Biochemical and Biophysical Research Communications, 329(1):331-336.( 1) 1)
|
| [37] |
Willis J D, Oppert C, Jurat-Fuentes J L. 2010. Methods for discoveryand characterization of cellulolytic enzymes from insects. InsectScience, 17(3): 184-198.( 1) 1)
|
| [38] |
Yokoe Y, Yasumasu I. 1964. Distribution of cellulose in invertebrates.Comparative Biochemistry and Physiology, 13(4): 323-338.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

