文章信息
- 杨振德, 赵博光
- Yang Zhende, Zhao Boguang
- 苦豆子生物碱对柳蓝叶甲产卵行为的影响
- Effects of Alkaloids from Sophora alopecuroides on Oviposition Behavior of Plagiodera versicolora
- 林业科学, 2013, 49(1): 152-160
- Scientia Silvae Sinicae, 2013, 49(1): 152-160.
- DOI: 10.11707/j.1001-7488.20130122
-
文章历史
- 收稿日期:2012-01-17
- 修回日期:2012-07-17
-
作者相关文章
2. 南京林业大学森林资源与环境学院 南京 210037
2. College of Forestry Resources and Environment, Nanjing Forestry University Nanjing 210037
昆虫的产卵行为源于昆虫内外因子刺激的综合作用(Kennedy,1978)。产卵刺激因子包括外部环境条件、试虫的生理状态、产卵载体的物理性质(如产卵载体的质地和颜色等)以及化学信号,其中植物因素发挥着非常重要的作用,专食性昆虫的寄主识别主要取决于植物叶面上的特殊化合物存在与否(Huang et al.,1993;Thomas et al.,1998;Grant et al.,1994;Cheryl et al.,1999;King et al.,1998)。因此,用非寄主植物粗提物处理寄主植物,可十分有效地防止或减少有害昆虫产卵。
卵块大小(clutch size)是生物成功繁殖的一个基本生活史特征,它对无双亲抚育行为昆虫的环境适合度有重要影响(Withers et al.,1997;Blanckenhorn et al.,2004),由遗传与环境2方面的因素决定(Hancock et al.,1998)。在鸟类上的许多研究表明卵的大小是可以遗传的(Postma et al.,2005;Charmantier et al.,2006)。然而,在昆虫方面研究更多的是关于环境因子(包括寄主的质量、后代的竞争强度、天敌以及雌虫在一生中能搜索到的潜在产卵位点的数量)与卵块大小之间的关系,关于遗传因素对卵块大小影响的研究非常少(Weis et al.,1983;Skinner,1985;Withers et al.,1997;Desouhant et al.,2000;Mitsui et al.,2006)。Bennettova等(1981)的研究表明昆虫卵块大小由幼虫发育早期的食物条件所决定;Blanckenhorn等(2004)则发现卵块大小与成虫的大小成正相关;Agnew等(2000)认为卵块大小是昆虫抱蛋量的函数,或者是自上一次产卵的时间函数,卵块大小的增大是较长寄主搜索时间的结果。
苦豆子(Sophora alopecuroides)是豆科(Leguminosae)槐属(Sophora)植物,主要分布于宁夏、甘肃、青海、新疆等地的荒漠地区,资源相当丰富,药用价值很高,已经载入我国药典。目前已经从苦豆子中分离鉴定出20多种喹诺里西啶(quinolizidine)类生物碱(赵博光等,1984;高红英等,2011;李艳艳等,2005;单晓菊等,2011)。关于苦豆子生物碱对萝卜蚜虫(Lipaphis erysimi)、菜青虫(Pieris rapae)、小菜蛾(Plutella xylostella)、松材线虫(Bursaphelenchus xylophilus)、分月扇舟蛾(Closteraanastomosis)、柳蓝叶甲、椰心叶甲(Brontispalongissima)、乳草蝽(Oncopeltus fasciatus)等害虫的杀虫、拒食活性及其机制已有不少研究(罗万春等,1997a;1997b;2003;陈林,2001;刘缠民等,2002;赵博光,1996;赵博光等,1998;2006;李小平等,2000;刘锦霞等,2003;杨振德等,2005a;2006a;2006b;2007;陈根强等,2011;万传星等,2007)。但关于苦豆子生物碱对害虫产卵行为影响方面的研究较少。
在柳蓝叶甲(Plagiodera versicolora)的研究方面,杨振德等(2005b)对其生物学特性进行了初步研究,发现柳蓝叶甲成虫以I-72杨(Populuseuramericana cv.‘I-72’)成熟叶或老叶为食料时产卵几乎完全被抑制,而以幼叶为食料时几乎每天均能产卵。柳蓝叶甲产卵期较长、产卵量大,对杨树幼苗危害极大。赵博光等(2006)等对柳蓝叶甲生物碱感器进行了定位和电镜观察,杨振德等(2008)研究了柳蓝叶甲对杨树(P. sp)等几种植物气味的触角电位反应。虽然苦豆子生物碱对柳蓝叶甲取食及体内酶系统的影响已经有所报道(杨振德等,2006b;2007),但关于生物碱对柳蓝叶甲产卵行为的影响还没有研究报道。本文就苦豆子生物碱处理对柳蓝叶甲产卵行为及卵块大小的影响进行研究,为对柳蓝叶甲进行有效防治和苦豆子资源的开发利用提供理论依据。
1 材料与方法 1.1 供试药剂苦豆子生物碱提取分离于宁夏和内蒙古产的苦豆子。提取分离方法见文献(赵博光,1980)。采用Waters HPLC仪、C18柱进行测定(李小平等,2000)。总生物碱中主要生物碱含量比例为:槐果碱(sophocarpine),22%;苦参碱(matrine),17%;槐胺碱(sophoramine),5.5%;槐定碱(sophoradine),51%。供试苦豆子生物碱单体槐胺碱、苦参碱、氧化苦参碱(oxymatrine)、槐定碱、苦豆碱、槐果碱均由苦豆子中提取分离制备,由宁夏盐池三鑫生物技术开发有限公司提供,其纯度> 96%。
1.2 试虫来源与饲养柳蓝叶甲成虫采于南京林业大学树木园。饲养容器为25 cm×25 cm×25 cm的玻璃缸,以新鲜的I-72杨嫩叶饲养。每缸内放20头左右的成虫,用保鲜膜封盖上口,其上扎一些小孔,以保证缸内气体新鲜。饲养条件为:温度(27±0.5)℃,光周期12D: 12L。每隔1~2天换1次叶片,并把同一天产下的卵块连同叶片一起剪下,放到培养皿中并用保鲜膜封盖。
卵孵化后,喂以新鲜的杨树叶片。当幼虫发育到蛹并羽化为成虫后,按照羽化日期分别将成虫置于小指型管中进行单头饲养,用保鲜膜封住管口。以新鲜的杨树嫩叶饲养4天后,成虫达到性成熟,选择此阶段的成虫进行测试。
1.3 选择性产卵试验将各生物碱配成浓度为5 mg·mL-1的水溶液(含0.1%吐温-80),调节pH值为7.0,待用。以幼嫩的杨树叶块(2 cm×2 cm正方形叶片)在配制好的生物碱溶液中浸渍1 min,制成生物碱处理叶块,以在含0.1%吐温-80的蒸馏水中浸渍1 min制成无生物碱处理的叶块为对照。在培养皿内放入不锈钢网以防止雌虫把卵产在培养皿壁上。待叶块表面的水分晾干后,将生物碱处理叶块和对照叶块各1个,叶背朝下以细铁丝固定于四周均有不锈钢丝网,直径为9 cm的培养皿产卵装置中,再接入一对正在交配的成虫。另外在产卵装置中设2个均为无生物碱处理的叶块作为参照。各处理均重复10次以上。每天早上8时观察记录成虫取食与死亡情况,统计产卵量后均分别换以新鲜的生物碱处理叶片和对照叶片,连续观察统计12天。
1.4 非选择性产卵试验试验方法参照1.3节,不同的是将2个均用生物碱处理过的叶块置于产卵装置中,再接入1对正在交配的成虫,另外在产卵装置中设2个均为无生物碱处理的叶块作为参照。每天早上8时记录成虫取食与死亡情况,统计产卵量后均分别换以新鲜的生物碱处理叶块和对照叶块。非选择性短期取食试验是在强迫取食1天后每天换以无生物碱处理的新鲜叶块。连续观察统计12天。
1.5 毒力试验参照1.3节的方法制备生物碱处理叶块,处理叶块置于500 mL的大烧杯内,再接入5对正在交配的成虫,用保鲜膜覆盖烧杯口以防虫子逃逸。各处理重复3次,以无生物碱处理的叶块为对照。每天早上8时观察记录成虫死亡情况,并换以新鲜的生物碱处理叶块和对照叶块,连续观察12天。
1.6 指标计算产卵驱避率(oviposition repellent rate,ORR)和产卵抑制率(oviposition inhibitory rate,OIR)由下列公式计算。
选择性产卵试验:
ORR(%)=(A-B)/(A+B)×100%,
OIR(%)=[CK-(C+D)]/CK×100%,
非选择性产卵试验:
OIR(%)=(D-C)/D×100%。
式中,A为产卵装置中非生物碱(含0.1%吐温-80的蒸馏水)处理的叶块上的卵块数,B为生物碱溶液(含0.1%吐温-80)处理的叶块上的卵块数。CK为产卵装置中2个均为蒸馏水(含0.1%吐温-80)处理的叶块上的卵量,C,D分别为产卵装置中生物碱溶液(含0.1%吐温-80)和非生物碱(含0.1%吐温-80的蒸馏水)处理的叶块上的卵量。
死亡率(%)=(死亡虫数/试虫总数)×100%,
校正死亡率(%)=(处理组死亡率-对照组死亡率)/(1-对照组死亡率)×100%。
1.7 数据统计分析统计分析结果均以平均数±标准误表示,方差分析采用邓肯氏新复极差检验法(Duncan’smultiple ranger test,DMRT)。用SPSS软件进行数据处理。
2 结果与分析 2.1 选择性取食条件下苦豆子生物碱对柳蓝叶甲产卵选择与产卵量的影响由表 1可知:在选择性取食条件下,无论是产在生物碱处理叶块还是非生物碱处理叶块上的卵量,苦豆子6种生物碱中均以槐果碱和苦参碱的最少,总产卵量仅为对照产卵量的38.4%;其次是苦豆碱和总碱,其产卵量分别为对照的48.2%和65.5%;抑制效果最差的是槐定碱和氧化苦参碱,产卵量可达对照的94%以上。由表 1还可以看出:柳蓝叶甲很少在不锈钢网上产卵,产在非生物碱处理叶上的卵量明显多于产在生物碱处理叶上的卵量,说明苦豆子生物碱对柳蓝叶甲的产卵具有明显的驱避作用。各生物碱处理间存在显著差异(F=4.277,df=5,34,P=0.004)。
|
|
由表 2可以看出:虽然苦豆子生物碱对柳蓝叶甲的产卵具有较强的抑制作用,槐果碱处理的抑制率可高达61.2%,且各生物碱处理之间对柳蓝叶甲产卵的抑制率有显著的差异(F=4.857,df=5,34,P=0.002),但是各生物碱处理之间对柳蓝叶甲产卵的驱避率没有显著差异(F=0.319,df=6,51,P=0.924)。
|
|
从表 3可以看出:柳兰叶甲产在生物碱处理叶块上的卵块数少于非生物碱处理叶块,而且卵块大小(每块上卵的数量)明显下降。在选择性取食条件下,槐定碱或氧化苦参碱处理后,产于非生物碱处理叶块上的卵块最大,每卵块均超过17粒,与对照(19.7粒)没有显著的差异。而毒力较强的槐果碱或槐胺碱处理后,每块卵块的卵数仅为11粒左右,显著少于对照(F=2.719,df=7,218,P=0.010)。
|
|
由表 4可以看出:柳蓝叶甲成虫交配后长期(12天)强迫取食苦豆子生物碱处理过的叶块后,其产卵受到明显的抑制(F=11.53,df=4,41,P=0.000)。其中,总碱和苦豆碱处理的产卵量平均分别为22.3粒和35粒,是对照的16.3%和25.6%。槐定碱对柳蓝叶甲产卵量的影响较小,柳蓝叶甲取食后产卵量平均为90.7粒,与对照相比也有显著的差异。柳蓝叶甲成虫短期(1天)强迫取食苦豆子生物碱处理过的叶块,对其产卵量也有明显的影响,产卵量显著减少(F=9.781,df=6,72,P=0.000)。其中,取食槐胺碱后,产卵量平均为48.6粒,仅为对照的35.6%。
|
|
由表 5可以看出:在长期强迫取食条件下(12天),除了由于槐胺碱、槐果碱和苦参碱对柳蓝叶甲的毒力较大,试虫中毒死亡率较高而未统计其对产卵的抑制率外,其余生物碱处理对柳蓝叶甲产卵的抑制率均显著高于槐定碱处理的抑制率(F=4.800,df=3,29,P=0.008)。其中,苦豆碱和总碱对柳蓝叶甲产卵的抑制率分别为74.4%和82.2%。在短期强迫取食条件下(1天),各生物碱处理对柳蓝叶甲产卵的抑制率也有显著的差异(F=4.686,df=5,61,P=0.001)。短期强迫取食产卵抑制率虽然总的来说有所降低,但仍然高达31%以上。其中槐胺碱、槐果碱和苦豆碱显著高于槐定碱和总碱,分别高达64.4%,61.1%和62.5%。
|
|
在长期强迫取食条件下,苦豆子生物碱处理柳蓝叶甲不但使其产卵量显著减少,而且还影响所产卵块的大小(F=7.053,df=5,278,P=0.000)。从表 6可以看出:氧化苦参碱、槐定碱和苦豆碱处理后,平均每个卵块的卵数最多,分别达15.2粒、14.7粒和12.7粒,与对照(16.2粒)没有显著的差异(P=0.097 > 0.05)。苦参碱和总碱处理后,平均每个卵块的卵数显著少于对照(P < 0.01)。短期强迫取食苦豆子生物碱,虽然平均每个卵块的卵数有所增加,但与对照相比仍然有明显的差异(F=5.045,df=6,153,P=0.000),其中槐胺碱、槐果碱和苦豆碱处理平均每个卵块的卵数显著少于对照(P <0.01)。
|
|
由表 7可以看出:不同苦豆子生物碱对柳蓝叶甲成虫的毒力不同。在非选择性取食条件下,各生物碱处理对柳蓝叶甲成虫死亡率的影响有显著差异(F=13.559,df=6,14,P=0.000)。由图 1可以看出:槐胺碱、槐果碱和苦参碱对柳蓝叶甲均具有较强的毒力,死亡曲线升高较快。其中,毒力最强的槐胺碱在处理后的第1天柳蓝叶甲的校正死亡率就达15.4%;处理后的第3天柳蓝叶甲成虫出现1个明显的死亡高峰,校正死亡率迅速升高到80.8%;处理后的第6天柳蓝叶甲成虫全部死亡。槐果碱和苦参碱处理的死亡高峰分别出现在第4天和第7天,此时校正死亡率分别为70.7%和59.7%;槐果碱和苦参碱处理第12天后的校正死亡率分别为97.7%和90.5%。相反,柳蓝叶甲用毒力较小的槐定碱或氧化苦参碱处理后的死亡曲线变化均较为平缓,无死亡高峰期出现。其中,槐定碱处理第3天才出现死亡现象,前5天的死亡率均小于4%。氧化苦参碱和槐定碱处理12天后柳蓝叶甲的校正死亡率仅分别为24.6%和28.8%。因此,从死亡曲线的走势可以看出:毒力较强的生物碱处理使试虫很快中毒死亡,而毒力较弱的生物碱处理试虫缓慢中毒死亡。
|
|
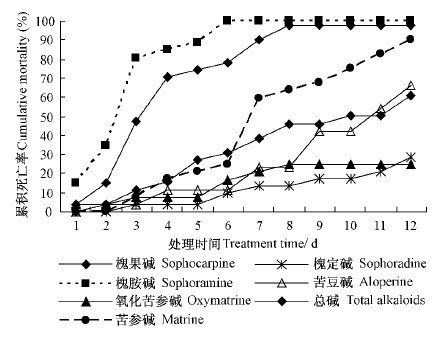 |
图 1 非选择性取食条件下苦豆子生物碱对柳蓝叶甲的累积死亡率
Fig. 1 Cumulative mortality of P. versicolora adults treated
with alkaloids from S. alopecuroids in non-choice test
|
在选择性取食条件下,各生物碱处理对柳蓝叶甲成虫死亡率的影响也有显著差异(F=5.035,df=6,14,P=0.006)。但由于苦豆子生物碱的驱避作用,柳蓝叶甲选择取食未用生物碱处理的叶片,因而取食生物碱处理的叶片减少,中毒较轻,死亡率与在非选择性取食条件下相比明显降低。由图 2可以看出:槐胺碱、槐果碱和苦参碱对柳蓝叶甲的毒力较强,死亡曲线的走势与非选择性取食条件下的相似,但死亡高峰期出现的时间推迟了2~3天。如毒力最强的槐胺碱处理,第3天成虫死亡率仅有22.7%,大大低于非选择性取食条件下的80.8%;死亡高峰期为处理后的第6天,与非选择性取食条件下相比推迟了3天,此时的死亡率也仅为46.0%,明显低于非选择性取食条件下同期的100%。毒力较小的槐定碱或氧化苦参碱处理后的死亡曲线变化均较为平缓。其中,处理1周后,死亡曲线变为水平线,无试虫死亡。氧化苦参碱和槐定碱处理12天后柳蓝叶甲的校正死亡率仅分别为9.3%和19.3%。
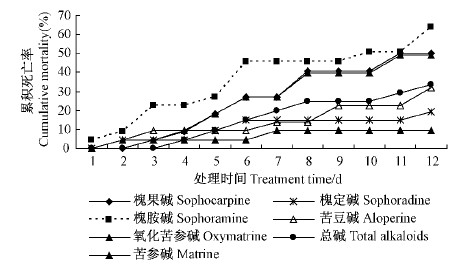 |
图 2 选择性取食条件下苦豆子生物碱对柳蓝叶甲的累积死亡率
Fig. 2 Cumulative mortality of P. versicolora adults treated with
alkaloids from S. alopecuroides in choice test
|
非寄主植物提取物对昆虫产卵行为有明显的影响。如从印楝树(Azadirachta indica)种子油中分离出的印楝素(azadirachtin),对多种植食性昆虫具有产卵抑制作用(文吉辉等,2007)。苦楝(Melia azedarach)、印楝等的提取物在亚致死剂量的条件下能有效地抑制桑天牛(Apriona germari)的产卵行为(赵博光等,2001;2006;嵇保中等,1998)。侯有明等(2002)研究表明印楝素乳油对小菜蛾(Plutella xylostella)成虫产卵亦具有显著的忌避作用。本研究结果表明:苦豆子生物碱对柳蓝叶甲产卵具有明显的驱避与抑制作用。由于这些生物碱几乎是非挥发性的,因此柳蓝叶甲很可能通过接触性的化学感器来感知这些生物碱的存在。赵博光等(2006)研究发现柳蓝叶甲对生物碱的感器是位于下颚须、下唇须顶端的栓锥感器和足跗节顶端的毛状感器。
苦豆子生物碱对柳蓝叶甲产卵的驱避作用与生物碱的毒力及柳蓝叶甲产卵位置选择能力的维持有关。在选择性试验条件下,柳蓝叶甲利用接触性的化学感器感知苦豆子生物碱的存在,而把卵块更多地选择产在非生物碱处理的叶片上。如槐果碱处理对柳蓝叶甲的产卵表现出明显的驱避作用,产在非生物碱处理的叶片上的卵块数是产在生物碱处理的叶片上的3.6倍(表 3)。但是,不同苦豆子生物碱对柳蓝叶甲产卵的驱避作用与生物碱毒力之间的关系不同。如毒力较强的槐果碱和苦参碱对柳蓝叶甲产卵的驱避作用也较强,产卵驱避率高达51%以上;而毒力最强的槐胺碱处理对柳蓝叶甲产卵的驱避作用却相对较弱,产卵驱避率仅为28.6%,也明显低于毒力最弱的氧化苦参碱和槐定碱,后者的产卵驱避率分别为36.8%和38.1%(表 2)。这可能是由于槐胺碱的极强毒力,使试虫迅速中毒,从而影响试虫选择潜在产卵位置的能力;而毒力最弱的氧化苦参碱和槐定碱被试虫取食后,试虫体内的代谢活动受影响较小,因而试虫在相对较长的时间内依然保持相对正常的行为状态,表现出较高的产卵位置选择能力。
苦豆子生物碱对柳蓝叶甲产卵的抑制作用与柳蓝叶甲对生物碱的摄入量及生物碱的毒力有关。非选择性取食条件下的抑制作用明显大于选择性取食条件下的抑制作用。如毒力最弱的槐定碱对柳蓝叶甲产卵的抑制率在非选择性试验条件下为33.6%,明显大于选择性试验条件下的6.4%。这是由于在非选择性取食条件下,柳蓝叶甲被迫取食生物碱处理过的叶片,摄入较多的生物碱,影响体内与卵形成及产卵有关的代谢活动,从而抑制产卵;而在选择性取食条件下,由于苦豆子生物碱的驱避作用,柳蓝叶甲选择取食未经生物碱处理的叶片,因而取食生物碱处理的叶片减少,摄入的生物碱较少,抑制产卵作用较弱。从图 1和图 2的死亡曲线可以看出:毒力较强的槐胺碱、槐果碱和苦参碱处理后,柳蓝叶甲死亡高峰期在选择性取食条件下比非选择性取食条件下推迟了2~3天。这也说明选择性取食条件下,试虫摄入的生物碱相对较少,中毒死亡较慢,有更多的时间产卵,在试验期内产卵更多,因而产卵的抑制作用较弱。杨振德等(2007)的研究表明柳蓝叶甲幼虫取食毒性最强的槐胺碱处理的杨树叶片1 h后,幼虫体内酯酶活性显著升高,随后酶活性迅速下降到低于对照的水平。相反,幼虫取食毒性较弱的槐定碱后,其体内酯酶活性在较长时间内维持在较高的水平。说明苦豆子生物碱通过抑制柳蓝叶甲幼虫体内酯酶和保护酶的解毒功能,导致柳蓝叶甲幼虫体内有毒物质积累,从而对虫体产生伤害作用。本研究表明:柳蓝叶甲成虫取食毒性最强的槐胺碱处理的叶片1天后即出现中毒死亡现象,即使把1天后不死亡的试虫喂以无生物碱处理的叶片,其产卵抑制率依然高达64.4%(表 5)。显然,这种生物碱对柳蓝叶甲成虫产卵的抑制作用主要与生物碱的毒力有关,其毒害机制可能与幼虫相类似。可见,苦豆子生物碱对柳蓝叶甲产卵的抑制与驱避作用是由于苦豆子生物碱对柳蓝叶甲的毒害作用和柳蓝叶甲的化学感器对生物碱作出感受反应的综合结果。
昆虫的卵块大小由遗传与环境2方面的因素决定(Hancock et al.,1998)。有研究表明幼虫发育早期的食物条件(Bennettova et al.,1981)以及成虫产卵位置搜寻时间的长短(Agnew et al.,2000)影响昆虫所产卵块的大小。本研究结果表明:柳蓝叶甲成虫取食氧化苦参碱、苦豆碱或槐定碱等毒力较弱的生物碱后,柳蓝叶甲产卵量虽然明显减少,但所产的卵块大小无明显差异,这与Zhao等(1998)用苦豆碱处理不影响云杉卷叶蛾(Choristioneura fumiferana)卵块大小的结果一致。但是,采用毒力较强的槐胺碱或槐果碱处理柳蓝叶甲雌虫时,产卵量和卵块大小均显著减小。杨振德等(2006)的研究表明毒力较强的槐胺碱对柳蓝叶甲幼虫具有较强拒食作用,拒食率达91.7%,而毒力较弱的槐定碱拒食作用较弱,拒食率仅为35.2%。本研究的观察也发现:苦豆子生物碱对柳蓝叶甲成虫除了具有产卵驱避作用以外,还具有与幼虫类似的拒食作用,槐胺碱拒食作用最强,而槐定碱拒食作用最弱。槐胺碱处理虽然由于其强烈的拒食作用成虫取食较少,但由于槐胺碱的强毒力使试虫在处理后第1天即出现死亡现象,第6天出现死亡高峰,全部死亡;而毒力较弱的槐定碱和氧化苦参碱无明显的死亡高峰期出现(图 2)。当用毒力较强的槐胺碱处理时,柳蓝叶甲在短时间内迅速中毒,这势必严重影响试虫的营养补充和对潜在产卵位置的选择能力,试虫主动搜寻安全产卵位置的时间缩短,因而产卵量和卵块大小均受明显影响。而当毒力最弱的氧化苦参碱和槐定碱被试虫取食后,试虫体内的代谢活动受影响较小,因而试虫在相对较长的时间内依然保持相对正常的行为状态,主动搜寻安全产卵位置的时间较长,表现出较强的产卵位置选择能力。产在非生物碱处理叶上的卵块大于产在生物碱处理叶上的卵块(表 3)也表明产卵位置选择能力强的试虫所产的卵块大于无选择能力或选择能力弱的试虫。这与Agnew等(2000)认为卵块的增大是较长产卵位置搜索时间的结果一致。可见,柳蓝叶甲所产卵块大小可能与柳蓝叶甲成虫的营养补充以及产卵位置的搜寻时间长短有关。
总之,苦豆子不同生物碱对柳蓝叶甲成虫的毒力不同,因而对柳蓝叶甲产卵行为的影响也不同。当用毒力较弱的氧化苦参碱、苦豆碱或槐定碱处理时,柳蓝叶甲雌虫倾向于把卵产在非生物碱处理的叶片上;这些生物碱处理对柳蓝叶甲卵块大小无显著影响,但产卵量明显受抑制。当用毒力较强的槐胺碱或槐果碱处理时,柳蓝叶甲的产卵量和卵块大小均受明显影响。关于苦豆子生物碱对产卵行为的影响机制尚需进一步研究,而这方面研究的深入,在林木害虫的防治方面将具有特别重要的意义。
| [1] |
陈根强, 冯岗, 胡梅, 等. 2011.苦豆子7生物碱对椰心叶甲的生物活性.河南科技大学学报:自然科学版, 32(4): 57-59.( 1) 1)
|
| [2] |
陈林. 2001.苦豆碱及毗虫琳对菜田蚜虫群落的影响.徐州师范大学学报:自然科学版, 19(4): 59-61.( 1) 1)
|
| [3] |
单晓菊, 邸明磊, 陶遵威. 2011.苦豆子化学成分及药理研究进展.中国中医药信息杂志, 18(3): 105-107.( 1) 1)
|
| [4] |
高红英, 李国玉, 王航宇, 等. 2011.新疆苦豆子种子中生物碱类化学成分的研究.石河子大学学报:自然科学版, 29(1): 75-78.( 1) 1)
|
| [5] |
侯有明, 庞雄飞, 梁广文. 2002.印楝素乳油对小菜蛾种群的控制作用.昆虫学报, 45(1): 47-52.( 1) 1)
|
| [6] |
嵇保中, 赵博光. 1998.印楝提取物及双稠哌啶类生物碱对桑天牛存活及生殖的影响.南京林业大学学报, 22(1): 83-86.( 1) 1)
|
| [7] |
李小平, 吴如其, 夏民洲, 等. 2000.苦豆碱、脱氢苦豆碱与松材线虫毒性及结构的关系.南京林业大学学报, 24(4): 78-81.( 2) 2)
|
| [8] |
李艳艳, 冯俊涛, 张兴, 等. 2005.苦豆子化学成分及其生物活性研究进展.西北农业学报, 14(2): 133-136.( 1) 1)
|
| [9] |
刘缠民, 蒋继宏, 黄小花, 等. 2002.苦豆碱及顺式氯氰菊酯对菜田蚜虫群落的毒力研究.动物学杂志, 37(2): 2-5.( 1) 1)
|
| [10] |
刘锦霞, 晃开, 张锐, 等. 2003.苦豆子、铁棒锤生物碱对菜青虫的毒力测定.甘肃科学学报, 15(2): 38-41.( 1) 1)
|
| [11] |
罗万春, 李云寿, 慕立义, 等. 1997a.几种苦豆子生物碱对小菜蛾部分生理指标的影响.昆虫知识, 34(4): 212-215.( 1) 1)
|
| [12] |
罗万春, 李云寿, 赵善欢, 等. 1997b.苦豆子生物碱对萝卜蚜的毒力及其对几种酯酶的影响.昆虫学报, 40(4): 357-365.( 1) 1)
|
| [13] |
罗万春, 张强. 2003.苦豆子生物碱对小菜蛾体内部分杀虫剂代谢酶活性的影响.昆虫学报, 46(1): 122-125.( 1) 1)
|
| [14] |
万传星, 白红进, 张利莉. 2007.苦豆子生物碱对乳草蝽的杀虫活性.塔里木大学学报, 19(4): 11-13.( 1) 1)
|
| [15] |
文吉辉, 侯茂林, 卢伟, 等. 2007.印楝素的杀虫活性及其对烟粉虱的驱避作用.昆虫知识, 44(4): 491-496.( 1) 1)
|
| [16] |
杨振德, 赵博光, 巨云为, 等. 2008.柳蓝叶甲对几种植物气味的触角电位反应.南京林业大学学报:自然科学版, 32(1): 75-78.( 1) 1)
|
| [17] |
杨振德, 朱麟, 赵博光, 等. 2005a.苦豆草生物碱对分月扇舟蛾的取食、生长和繁殖的抑制作用.林业科学, 41(4): 106-111.( 1) 1)
|
| [18] |
杨振德, 朱麟, 赵博光, 等. 2005b.柳蓝叶甲的生物学特性室内观察.昆虫知识, 42(6): 647-650.( 1) 1)
|
| [19] |
杨振德, 朱麟, 赵博光, 等. 2006a.苦豆草生物碱对分月扇舟蛾体内消化酶和保护酶活性的影响.北京林业大学学报, 28(1): 80-83.( 2) 2)
|
| [20] |
杨振德, 朱麟, 赵博光, 等. 2006b.苦豆草生物碱对柳蓝叶甲的拒食作用.林业科学, 42(7): 52-55.( 2) 2)
|
| [21] |
杨振德, 朱麟, 赵博光, 等. 2007.苦豆草生物碱对柳蓝叶甲体内消化酶、酯酶和保护酶活性的影响.西北林学院学报, 22(1): 81-83.( 3) 3)
|
| [22] |
赵博光, 李小平, 陈小平. 2001.印楝提取物对桑天牛产卵量及卵孵化率的影响.林业科学, 37(1): 96-100.( 1) 1)
|
| [23] |
赵博光, 林宏达, 郑斯竹. 2006.柳蓝叶甲生物碱感器的定位及电镜观察.南京林业大学学报:自然科学版, 30(5): 21-24.( 4) 4)
|
| [24] |
赵博光, 刘秀华. 1984.苦豆子中几种生物碱的薄层定量及积累动态.中草药, 5(12): 31-32.( 1) 1)
|
| [25] |
赵博光, 吴如其, 李小平. 1998.苦豆碱防治松材线虫病的林间试验.林业科学, 34(6): 113-117.( 1) 1)
|
| [26] |
赵博光. 1980.苦豆草生物碱的研究.药学学报, 15(3): 182-183.( 1) 1)
|
| [27] |
赵博光. 1996.苦豆碱对松材线虫的杀虫活性.林业科学, 32(3):243-247.( 1) 1)
|
| [28] |
Agnew K, Singer M C. 2000.Does fecundity drive the evolution of insectdiet? Oikos, 88(3): 533-538.( 3) 3)
|
| [29] |
Bennettova B, Fraenkel G. 1981.What determines the number ofovarioles in a fly ovary? J Insect Physiol, 27(6): 403-410.( 2) 2)
|
| [30] |
Blanckenhorn W U, Heyland A. 2004.The quantitative genetics of twolife history trade-offs in the yellow dung fly in abundant and limitedfood environments. Evol Ecol, 18(4): 385-402.( 2) 2)
|
| [31] |
Charmantier A, Perrins C, Mccleery, et al. 2006.Evolutionary responseto selection on clutch size in a long-term study of the mute swan. AmNat, 167(3): 453-465.( 1) 1)
|
| [32] |
Cheryl R F, Scriber J M. 1999.Florida red bay(Persea borbonia)leafextracts deter oviposition of a sympatric generalist herbivore, Papilioglaucus(Lepidoptera: Papilionidae). Chemoecology, 9(3): 127-132.( 1) 1)
|
| [33] |
Desouhant E, Debouzie D, Ploye H, et al. 2000.Clutch sizemanipulations in the chestnut weevil, Curculio elephas: fitness ofoviposition strategies. Oecologia, 122(4): 493-499.( 1) 1)
|
| [34] |
Grant G G, Langevin D. 1994.Oviposition responses of fourChoristoneura(Lepidoptera: Tortricidae)species to chemical andphysical stimuli associated with host and non-host foliage. EnvironEntomol, 23(2): 447-456.( 1) 1)
|
| [35] |
Hancock M A, Hughes J M, Bunn S E. 1998.Infuence of genetic andenvironmental factors on egg and clutch sizes among populations ofParatya australiensis Kemp(Decapoda: Atyidae)in uplandrainforest streams, south-east Queensland. Oecologia, 115(4): 483-491.( 2) 2)
|
| [36] |
Huang X, Renwick J A A. 1993.Differential selection of host plants bytwo Pieris species: the role of oviposition stimulants and deterrents.Entomol Exp Appl, 68(1): 59-69.( 1) 1)
|
| [37] |
Kennedy J S. 1978.The concepts of olfactory “arrestment” and“attraction”. Physiol Entomol, 3(2): 91-98.( 1) 1)
|
| [38] |
King B H, Crowe M L, Blackmore M D. 1998.Effects of leaf age onoviposition and offspring fitness in the imported willow leaf beetlePlagiodera versicolora(Coleoptera: Chrysomelidae). J InsectBehav, 11(1): 23-35.( 1) 1)
|
| [39] |
Mitsui H, Takahashi K H, Kimura M T. 2006.Spatial distributions andclutch sizes of Drosophila species ovipositing on cherry fruits ofdifferent stages. Popul Ecol, 48(3): 233-237.( 1) 1)
|
| [40] |
Postma E, Van Noordwijk A J. 2005.Gene flow maintains a largegenetic difference in clutch size at a small spatial scale. Nature, 433: 65-68.( 1) 1)
|
| [41] |
Skinner S W. 1985.Clutch size as an optimal foraging problem forinsects. Behav Ecol Sociobiol, 17(3): 231-238.( 1) 1)
|
| [42] |
Thomas D, Städler E. 1998.Oviposition of carrot fly(Psila rosae)inresponse to foliage and leaf surface extracts of host plants.Chemoecology, 8(1): 39-49.( 1) 1)
|
| [43] |
Weis A E, Price P W, Lynch M. 1983.Selective pressures on clutch sizein the gall maker Asteromyia carbonifera. Ecology, 64(4): 688-695.( 1) 1)
|
| [44] |
Withers T M, Harris M O. 1997.The influence of clutch size on survivaland reproductive potential of Hessian fly. Entomol Exp Appl, 83(2): 205-212.( 2) 2)
|
| [45] |
Zhao B G, Grant G G, Langevin D, et al. 1998.Deterring andinhibiting effects of quinolizidine alkaloids on spruce budworm(Lepidoptera: Tortricidae)oviposition. Physiol & Chem Ecol, 27(4): 984-992.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

