文章信息
- 马健, 刘振宇, 吕全, 梁军, 严东辉, 张星耀, LüQuan
- Ma Jian, Liu Zhenyu, Liang Jun, Yan Donghui, Zhang Xingyao
- SA及H2O2在杨树与溃疡病菌互作中的表达差异
- Differential Expression of SA and H2O2 between Susceptible and Resistant Poplars Challenged by Botryosphaeria dothidea
- 林业科学, 2013, 49(1): 107-113
- Scientia Silvae Sinicae, 2013, 49(1): 107-113.
- DOI: 10.11707/j.1001-7488.20130116
-
文章历史
- 收稿日期:2011-12-20
- 修回日期:2012-08-10
-
作者相关文章
2. 山东农业大学植物保护学院 泰安 271018
2. College of Plant Protection, Shandong Agricultural University Tai'an 271018
杨树(Populus)溃疡病(Botryosphaeria dothidea)是我国杨树的主要枝干病害(张星耀等,2003;苏晓华等,2003;理永霞等,2011)。杨树溃疡病互作体系的研究大多集中在某一水平或某一状态下的互作机理研究,对于杨树溃疡病抗病信号转导系统的作用机制了解的还不多。随着研究技术与方法的进步,国外学者对烟草(Nicotiana tabacum)、拟南芥(Arabidopsis thaliana)等草本植物与病原菌互作的信号转导系统进行了许多研究,并建立了这些植物防御病原菌的作用模型(Vlot et al.,2008),这些研究证明水杨酸(SA)与过氧化氢(H2O2)是植物抗病反应中的重要信号分子,SA受体蛋白(SA bindingprotein,SABP)与过氧化氢酶(catalase,CAT)具有高度的同源性,已有研究证明在烟草等植物体内SABP具有CAT活性,SABP与SA结合后其CAT活性被抑制,从而提高植物体内H2O2水平,激活抗病相关基因的表达,进而表现出抗性(Chen et al,1991;Averyanov,2009)。
SA和H2O2在植物防御反应中作用的研究大多限于农作物方面,对树木与病原菌互作中的研究不多。Davis等(2002)研究表明,SA可以诱导松树(Pinus spp.)等木本植物中防御基因的表达,说明SA可能在林木防御系统中也扮演着重要角色。目前,研究多关注杨树SA信号转导途径,结果表明外施SA可以诱导杨树抗病基因的表达(Koch et al.,2000),这与烟草中的研究结果保持一致(Uknes et al.,1993)。另外,研究表明杨树内源SA含量远高于烟草和拟南芥中的含量(Koch et al.,2000)。因此,有必要对杨树抗病信号转导系统进行深入研究,本文选择毛白杨(Populus tomentosa)和北京杨(P.×beijingensis)为试验材料,通过研究其SA与H2O2含量的变化、SABP基因的克隆及基因表达、CAT活性变化在不同杨树中的表达差异,阐述SA,H2O2信号分子及SABP是否存在于杨树与溃疡病菌互作系统中,为进一步明确杨树-溃疡病菌互作中的信号传导机制的研究提供依据。
1 材料与方法 1.1 供试杨树、菌株及接种供试杨树为毛白杨(自然状态下感病指数为0~6.0)、北京杨自然状态下感病指数45.1以上,(杨俊秀等,1990;王颖等,1996)的1年生盆栽扦插杨树苗。
供试菌株为本实验室从北京杨溃疡病斑上分离并保存的杨树溃疡病病原菌,经单胞培养鉴定,致病力中等菌株。菌株在27 ℃条件下于PDA平板上暗培养7天,无菌条件下用灭菌打孔器在菌落边缘取直径为5 mm的菌饼作为接种体备用。
针刺菌饼接种:茎部接种部位用75%乙醇擦拭消毒,再用无菌水擦拭2遍,用灭菌解剖针轻刺梅花型针眼,相距约3 mm,然后将有菌丝一面朝向针眼贴紧,外被湿灭菌药棉,用保鲜膜包扎固定接种点。每树种设2个处理:针刺接种灭菌PDA培养基(CK);针刺接种溃疡病菌。实施处理后0(无针刺),6,12,24,48,72和96 h分别对离病斑0.5 cm处树皮进行取样,每处理每时间点重复3次。取后迅速投入液氮中,并保存于-80 ℃冰箱中备用。
1.2 水杨酸(SA)含量的测定采用Verberne的方法对样品中的SA含量进行测定(Verberne et al.,2002)。称取1 g样品,加入抗氧化剂和适量的80%甲醇,低温下研磨成匀浆。置于0~4 ℃抽提,12 000 r·min-1离心取上清液。沉淀用80%甲醇再次提取2次,合并上清液。将上清液平均分成2份,分别用于游离水杨酸(Freesalicylic acid,FSA)和总水杨酸(Total salicylic acid,TSA)的测定。上清液浓缩至水相,反复冻融,离心,加入PVP除去色素,抽滤。1份滤液加入等体积的2 mmol·L-1 HCl,混匀后转入试管,封口,80 ℃温浴1 h,使总水杨酸中结合态的水杨酸酸解为游离水杨酸,以测出其中总水杨酸的含量。然后在2份滤液中分别加入2 mL 5%三氯乙酸,用3 ml乙酸乙酯(V):环己烷(V)=1: 1抽提3次,合并有机相,真空干燥。以1.5 mL 70%甲醇溶解沉淀,5 mL 70%甲醇平衡C18小柱后,样品过柱,用3 mL 70%甲醇洗脱小柱,收集洗脱液。洗脱液真空干燥,250 uL流动相初始液溶解沉淀,过0.45 μm微孔滤膜,然后用高效液相色谱(HPLC)检测样品中SA含量。
HPLC仪器型号为Waters2695,sunfire C18柱,流速0.8 mL·min-1,保留时间10.943 min。
1.3 H2O2含量的测定参考Patterson等(1984)的方法,稍有改动。取1 g样品加3 mL冷丙酮磨成匀浆,12 000 r·min-1离心,上清液定容,反应液中含0.1 mL 20%(V/V)TiCl4的浓盐酸、0.2 mL浓氨水和1 mL上清液生成的过氧化物-Ti复合物,用丙酮洗5次,丙酮挥发后溶于3 mL 1 mol·L-1硫酸中,410 mm下测光吸收值,按同样程序制H2O2标准曲线。
1.4 过氧化氢酶(CAT,EC 1.11.1.6)活性测定酶活性测定方法参考中国科学院上海植物生理研究所(1999)的过氧化氢酶测定方法,稍有改动。分别称取不同处理的材料(1 g),CAT提取液加入0.2 mol·L-1磷酸缓冲液(pH 7.8)。再分别加入少许石英砂和聚乙烯吡咯烷(PVPP),冰浴研磨成匀浆,4℃ 18 000 r·min-1,离心25 min,取上清液,即酶提取液。以1 min下降1个OD值为CAT酶活力单位。
1.5 基因克隆与Real-time PCR分析 1.5.1 总RNA的提取和cDNA第一链的合成RNA提取试剂盒(Bioteke公司)提取样品的总RNA,TaKaRa的反转录试剂盒反转录成cDNA,方法按照说明书进行。将所获得的RNA和cDNA分别储存于-80 ℃和-20 ℃备用。
1.5.2 杨树SABP基因克隆本试验根据EMBLBank上已发表的毛果杨(P. trichocarpa)SABP基因序列(Accession numbers: CM000338)设计该基因ORF序列的引物,上游引物S1(GGATCCCTACAAGTACCGTCCAT)和下游引物S2(CACGTTGAGACGAGATGCTAGCT),以反转录产物为模板,进行的PCR扩增。PCR反应体系为25 μL,包含10×buffer2.5 μL,dNTP(2.5 mmol·μL-1)1.5 μL,上、下游引物(10 μmol·μL-1)各1 μL,Taq聚合酶(5 U·μL-1)1 μL,总cDNA(1 μg·μL-1)1 μL,ddH2O至25 μL。反应程序为94 ℃预变性5 min,94 ℃变性30 s,58 ℃退火40 s,72 ℃延伸50 s,30个循环后72 ℃延伸10 min。
PCR产物应用pEASY-T3 Cloning Vector(TransGen Biotech,Beijing,China),连接,转化获得序列,序列测序(Invitrogen).
1.5.3 RT-PCR引物设计与筛选杨树SABP的序列(Genebank no: JQ248571)和NCBI上登陆的杨树β-Tubulin(Accession numbers: CM000337.1)作为内参,分别利用软件Primer 5.0设计荧光定量PCR引物,见表 1。
|
|
以反转录获得的cDNA稀释20倍作模板,按下列组份配制PCR反应液(表 2)。
|
|
本次试验使用TAKARA公司SYBR® Premix Ex TaqTM(Perfect Real Time)试剂。Real-Time PCR反应程序为: 95 ℃预变性30 s;接下来是40个循环,95 ℃变性5 s,60 ℃退火34 s;每个样品3次重复,PCR反应结束后进行熔解曲线分析。
1.6 目的基因的序列分析利用DNAstar,Primer Premier 5.0软件对目的基因cDNA编码氨基酸序列进行分析;用NCBI数据库中的Blast软件将目的基因编码的氨基酸序列与NCBI中的序列进行比对和相似性搜索;进而利用ClustalX和GeneDoc进行多序列同源性比对和聚类分析。
2 结果与分析 2.1 不同杨树接种B. dothidea后SA和H2O2含量变化 2.1.1 接种后SA含量变化在接种B. dothidea后,通过HPLC测定结合态与游离态SA含量变化结果如图 1,2。毛白杨和北京杨接种后游离态水杨酸含量均升高,抗病毛白杨游离态SA从6 h开始逐渐升高,72 h达到峰值(P < 0.000 1),然后96 h开始下降;北京杨游离态SA接种后24 h开始缓慢上升,达到最高,上升幅度比毛白杨小24.54倍;而在未接种B. dothidea的对照中,毛白杨和北京杨的内源游离态SA含量变化都不大。这说明SA含量的变化是由于接种B. dothidea引起的,就游离态水杨酸含量而言,毛白杨比北京杨上升幅度大且时间早,这一点与对照有明显区别。
 |
图 1 游离态水杨酸含量变化
Fig. 1 Changes on free salicylic acid content
*表示同一时间内,北京杨和毛白杨之间的差异,*为P < 0.05, **为P < 0.001,***为P < 0.000 1。
Asterisks indicate statistically significant differences (*=P < 0.05,**=P < 0.001,***= P < 0.000 1 Student's t test) between levels in P.× beijingensis and P.tomentosa for each time point.
下同。The same below. |
 |
图 2 结合态水杨酸含量变化
Fig. 2 Changes on combined salicylic acid content
|
接种B. dothidea后毛白杨和北京杨中结合态SA含量均有上升的趋势,其中毛白杨接种24 h后水杨酸含达到最高值(P < 0.001),北京杨接种后变化不明显,在对照中毛白杨和北京杨的结合态水杨酸含量变化不显著(图 2)。
2.1.2 接种B.dothidea后不同杨树中H2O2含量的差异接种B.dothidea后,2种杨树H2O2含量先上升后下降,但两者之间的变化的波幅存在明显的差异,毛白杨显著高于北京杨。毛白杨72 h时达到高峰(P < 0.000 1),北京杨48 h时达到高峰,H2O2含量分别为306.99和737.52 mol·g-1,比相应CK分别增加3.08和10.03倍,而对照毛白杨和北京杨H2O2含量变化不大(图 3)。
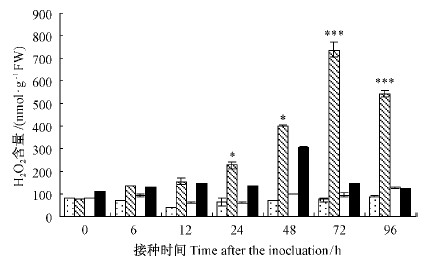 |
图 3 过氧化氢含量的变化
Fig. 3 Changes on H2O2 content
|
将克隆的杨树SABP基因在NCBI上注册,GenBank登录号分别是JQ248571(P.tomentosa PtSABP)和JQ248572(P.×beijingensis PbSABP)。对该基因推导的氨基酸序列进行Protparam程序预测分析,该基因ORF序列约1 462 bp,共编码487个氨基酸,PtSABP和PtSABP相对分子质量分别为56 111.28和56 065.21,理论等电点为6.56。NtSABP(Nicotiana tabacum SABP GenBank no.AAC48918.1)相对分子质量为56 366.72,理论等电点为6.50。使用GeneDoc软件分析烟草的SABP蛋白氨基酸与所克隆的毛白杨和北京杨序列推测的氨基酸进行比较(图 4),黑色区域为高度保守的相同氨基酸序列,灰色区域为部分相同氨基酸序列,白色区域为差异的氨基酸序列。毛白杨和北京杨SABP基因编码的氨基酸与烟草有非常高的同源性,与烟草氨基酸同一性为90%,属于Catalase _ likesuperfamily。
 |
图 4 北京杨与毛白杨SABP氨基酸序列的比对分析
Fig. 4 Multiple sequence alignment of SABP of P.tomentosa and P.× beijingensis
毛白杨(P.tomentosa PtSABP)、北京杨(P.× beijingensis PbSABP)与烟草(Nicotiana tabacum NtSABP) SABP氨基酸的序列比对 分析,黑色区域为高度保守的相同氨基酸序列,灰色区域为部分相同氨基酸序列。Multiple sequence alignment of deduced amino acid sequences of PtSABP (P.tomentosa SABP) and PbSABP (P.× beijingensis SABP) and the protein sequence of Nicotiana tabacum SABP (NtSABP).Identical residues are shaded in black and similar residues in gray. |
接种B.dothidea后,毛白杨SABP表达量相对于北京杨变化显著。SABP在毛白杨接种溃疡病菌后表达量都处于上调趋势,6 h时表达量上升(t=6.734,P=0.03),为对照的3.80倍,随后12,24 h表达量下降,但48 h时表达量迅速上升并达到较高值(t=11.923,P=0.000 1),为对照的11.10倍,而后表达受到抑制,表达量逐渐降低;在北京杨中SABP的表达量72 h前变化不明显,96 h时北京杨SABP表达量没有受到抑制,仍然呈现上升趋势(t=6.324,P=0.003),为对照的3.80倍(图 5)。
 |
图 5 接种溃疡病菌后不同抗性品种中SABP基因表达差异
Fig. 5 Expression of SABP of poplar cultivars susceptible (P.× beijingensis) and tolerant (P.tomentosa) after B.dothidea inoculation
|
从表 1可知:未接种溃疡病菌的毛白杨和北京杨CAT活性在所测定时间内无显著变化,始终维持在一个较低而平稳的水平。
|
|
接种溃疡病菌后2种杨树CAT活性变化明显。其中,毛白杨CAT活性呈先上升后下降的趋势,接种后48 h,毛白杨CAT活性增强并达到峰值,活性为47.33 μmol·mg-1 min-1,是对照的13.60倍(P < 0. 000 1),随后迅速下降,以至低于对照;而北京杨接种后CAT活性呈上升趋势,96 h达到峰值,为19.86 μmol·mg-1 min-1,是对照的3.92倍(P < 0. 000 1);毛白杨与北京杨相比较,CAT活性在接种后12~48 h表现极显著性(P < 0.000 1),48 h后毛白杨CAT活性降低,而北京杨则持续上升。说明过氧化氢酶在杨树抗溃疡病菌过程中存在一定的差异。
3 结论与讨论杨树与溃疡病菌的互作机制是一个十分复杂的过程,不仅包含寄主在形态、细胞、生理生化和分子等水平的变化过程,还包含着各种信号的传递过程。目前,杨树与溃疡病菌互作的研究主要集中在组织病理学、病理生理学以及病理化学上(梁军等,2005),对其抗病信号转导机制的研究较少。在寄主与病原菌互作中,水杨酸与过氧化氢信号途径能被病原菌所激活,可以作为信号传导分子诱导一系列编码防御反应蛋白基因的表达,从而表现出抗性(Chen et al.,1993;Zhang et al.,2011;War et al.,2011)。对烟草、拟南芥等草本植物研究表明:在植物体内似乎存在一条有效的SA信号感知/信号转导机制(Zhao et al.,2009),当植株被病原菌感染时,SA生物合成系统被诱导激活,SA水平急剧上升,进而植株体内具有足够量的SA激活信号转导途径,最终导致植株抗病能力增强。在自然状态下这些植株体内SA水平非常低,而杨树内源SA水平远高于烟草、拟南芥等草本植物的SA含量,SA与H2O2信号途径是否在杨树防御反应中起着重要作用需要深入研究(Glazebrook,2001)。
本试验结果表明:接种溃疡病菌后,毛白杨和北京杨树皮中SA和H2O2含量均升高(图 1~3)。毛白杨接种后72 h时游离SA含量达到峰值,此时CAT活性降低,同时伴随着H2O2含量的增加,这与烟草中的变化相一致(Averyanov,2009)。Chen等(1993)证明烟草中的SA结合蛋白(SA bindingprotein,SABP)与CAT高度同源,SABP与SA结合后阻碍了其CAT活性,提高H2O2水平,H2O2或它的衍生物活性氧可激活抗病反应途径中的抗病相关基因的表达。在本研究中,通过对PtSABP和PbSABP2个基因RT-PCR分析表明:接种后毛白杨SABP基因的表达在12~24 h时受到抑制,使CAT含量降低,同时由于SA与已有的SABP结合抑制了其CAT活性,从而促使24 h后H2O2含量的显著升高。在北京杨接种溃疡病菌后SA含量变化不显著,毛白杨在接种后SA含量增加快速,可能是毛白杨比北京杨具有敏感的信号启动机制。未接种溃疡病菌的毛白杨和北京杨SA,H2O2,CAT在所测定时间内无显著变化,始终维持在较低而平稳的水平,推测SABP参与杨树的抗病过程,而且表明杨树溃疡病的抗性似乎与杨树体内SA与H2O2的积累情况有关,毛白杨相对于北京杨变化显著,本试验间接证明SA与H2O2的信号作用在毛白杨中得到充分表现,而北京杨则几乎不表现这种效应,说明接种溃疡病能激活毛白杨的SA与H2O2信号转导途径。推测毛白杨被B. dothidea侵染后,SA被诱导激活,使杨树体内具有足够量的SA激活信号转导途径,而H2O2作为胞内的中间信号因子,通过水杨酸的原初受体SABP的表达来平衡H2O2的含量,使外界信号在传递过程中逐渐被放大,进而在转录水平上启动和调控一些特殊防卫基因的表达,最终导致毛白杨抗病能力增强。
但是抗病作用机制会随寄主与病原菌的不同而存在着交叉和分歧,以构成复杂的信号网络。笔者的试验发现:毛白杨接种后游离SA含量增高,结合态SA含量也升高,24 h时达到峰值,所以游离SA在诱导条件下的含量升高不只来自苯丙烷代谢途径和结合态SA的转化,有可能是在植物体内与SA合成相关的基因被启动,在SA信号传导途径的上游可能还存在某些机制起作用,这样H2O2在杨树-溃疡病菌抗病信号系统中就不仅仅是起到第二信使的作用,可能杨树受到溃疡病菌浸染的氧化迸发初期阶段,CAT分解H2O2,生成氧分子,触发了苯甲酸生成SA,导致结合态水杨酸增加;另一方面,可能是SA激发SAMT(水杨酸甲酯转移酶)基因表达(Hippauf et al.,2010),使SA转化为水杨酸甲酯(MeSA,一种结合态水杨酸),从而使结合态SA含量增加,而水杨酸结合蛋白2(SABP2)基因的表达又可以促使MeSA向SA的转化(Park et al.,2007;Tripathi et al.,2010)。因此,杨树-溃疡病互作体系中H2O2是否只是扮演第二信使的角色以及是否存在MeSA转移SA的过程,还有需进一步深入研究。
| [1] |
苏晓华, 张冰玉, 黄秦军, 等. 2003.我国林木基因工程研究进展和关键领域.林业科学, 39(5): 111-118.( 1) 1)
|
| [2] |
理永霞, 张星耀, 严东辉, 等. 2011.杨树接种Botryosphaeria dothidea溃疡病菌后蛋白质表达差异分析.南京林业大学学报:自然科学版, 2011, 35(4): 1-6.( 1) 1)
|
| [3] |
梁军, 姜俊清, 刘会香, 等. 2005.我国杨树与溃疡病菌互作的病理学研究.林业科学研究, 18(2): 214-221.( 1) 1)
|
| [4] |
王颖, 胡景江, 朱玮, 等. 1996.杨树溃疡病寄主诱导抗病性的研究.西北林学院学报, 11(1): 1-4.( 1) 1)
|
| [5] |
杨俊秀, 李武汉, 符毓秦.等. 1990.抗溃疡病杨树种类的调查研究.西北林学院学报, 5(4): 1-10.( 1) 1)
|
| [6] |
张星耀, 骆有庆. 2003.中国森林重大生物灾害.北京:中国林业出版社.( 1) 1)
|
| [7] |
中国科学院上海植物生理研究所. 1999.现代植物生理学实验指南.北京:科学出版社.( 1) 1)
|
| [8] |
Averyanov A. 2009. Oxidative burst and plant disease resistance. FrontBiosci(Elite Ed), 1: 142-152.( 2) 2)
|
| [9] |
Chen Z, Klessig D F. 1991. Identification of a soluble salicylicacidbindingprotein that may function in signal transduction in the plantdisease-resistance response. Proc Natl Acad Sci U S A, 88: 8179-8183.( 1) 1)
|
| [10] |
Chen Z, Silva H, Klessig D F. 1993. Active oxygen species in theinduction of plant systemic acquired resistance by salicylic acid.Science, 262(5141): 1883-1886.( 2) 2)
|
| [11] |
Davis J M, Wu H G, Cooke J E K, et al. 2002. Pathogen challenge, salicylic acid, and jasmonic acid regulate expression of chitinasegene homologs in pine. Mol. Plant Microbe Interact, 15(4), 380-387.( 1) 1)
|
| [12] |
Glazebrook J. 2001. Genes controlling expression of defense responses inArabidopsis—2001 status. Curr Opin Plant Biol, 4(4): 301-308.( 1) 1)
|
| [13] |
Hippauf F, Michalsky E, Huang R, et al. 2010. Enzymatic, expressionand structural divergences among carboxylO-methyltransferases aftergene duplication and speciation in Nicotiana. Plant Mol Biol, 72(3): 311-330.( 1) 1)
|
| [14] |
Koch J R, Creelman R A, Eshita S M, et al. 2000.Ozone sensitivity inhybrid poplar correlates with insensitivity to both salicylic acid andjasmonic acid. The role of programmed cell death in lesionformation. Plant Physiol, 123(2), 487-496.( 2) 2)
|
| [15] |
Park S W, Kaimoyo E, Kumar D, et al. 2007. Methyl salicylate is acritical mobile signal for plant systemic acquired resistance.Science, 318(5847): 113-116.( 1) 1)
|
| [16] |
Patterson B D, Macrea E A, Ferguson I B. 1984. Estimation of hydrogenperoxide in plant extracts using titanium(IV). AnalyticalBiochemistry, 139 : 487-492.( 1) 1)
|
| [17] |
Tripathi D, Jiang Y L, Kumar D. 2010. SABP2, a methyl salicylateesterase is required for the systemic acquired resistance inducedbyacibenzolar-S-methyl in plants. FEBS Lett, 584(5): 3458-3463.( 1) 1)
|
| [18] |
Uknes S, Dincher S, Friedrich L, et al. 1993.Regulation ofpathogenesis-related protein-1a gene expression in tobacco. PlantCell(2), 5, 159-169.( 1) 1)
|
| [19] |
Vlot A C, Klessing D F, Park S W. 2008. Systemic acquired resistance:the elusive signals. Curr Opin Plant Biol, 11: 436-442.( 1) 1)
|
| [20] |
Verberne M C, Brouwer N, Delbianco F, et al. 2002. Method for theextraction of the volatile compound salicylic acid from tobacco leafmaterial. Phytochem Anal, 13(1): 45-50.( 1) 1)
|
| [21] |
War A R, Paulraj M G, War M Y, et al. 2011. Role of salicylic acid ininduction of plant defense system in chickpea(Cicer arietinum L.).Plant Signal Behav, 6(11): 1789-1792.( 1) 1)
|
| [22] |
Zhang W P, Jiang B, Lou L N, et al. 2011. Impact of salicylic acid onthe antioxidant enzyme system and hydrogen peroxide production inCucumis sativus under chilling stress. Z Naturforsch C, 66:413-422.( 1) 1)
|
| [23] |
Zhao N, Guan J, Forouhar F T, et al. 2009. Two poplar methylsalicylate esterases display comparable biochemical properties butdivergent expression patterns. Phytochemistry, 70(1): 32-39.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

