文章信息
- 张会慧, 张秀丽, 李鑫, 许楠, 孙广玉
- Zhang Huihui, Zhang Xiuli, Li Xin, Xu Nan, Sun Guangyu
- 盐胁迫下桑树叶片D1蛋白周转和叶黄素循环对PSⅡ的影响
- Role of D1 Protein Turnover and Xanthophylls Cycle in Protecting of Photosystem Ⅱ Functions in Leaves of Morus alba under NaCl Stress
- 林业科学, 2013, 49(1): 99-106
- Scientia Silvae Sinicae, 2013, 49(1): 99-106.
- DOI: 10.11707/j.1001-7488.20130115
-
文章历史
- 收稿日期:2012-02-29
- 修回日期:2012-06-11
-
作者相关文章
盐胁迫会抑制植物的光合碳同化能力(Chen et al.,2004;Kao et al.,2001),气孔、非气孔因素均是重要限制因素(Brugnoli et al.,1991;Seemann et al.,1986),而非气孔限制中PSⅡ反应中心的活性被认为是盐胁迫下比较脆弱的环节之一(张会慧等,2012a)。盐胁迫诱导的PSⅡ活性下降与PSⅡ电子受体侧的损伤有关(惠红霞等,2004;朱新广等,1999),也有研究认为盐胁迫对PSⅡ反应中心的伤害主要是由于PSⅡ反应中心的电子供体侧的损伤引起(任丽丽等,2009)。总之,盐胁迫会导致PSⅡ反应中心中放氧复合体(OEC)活性降低,使其提供的电子数量减少,PSⅡ受体侧PQ库容量降低、QA向QB的电子传递受阻(Sharkey et al.,1982),光合电子传递链中电子传递给O2的机率增大,活性氧(ROS)爆发(陈健妙等,2010),加剧PSⅡ反应中心的伤害,使植物即使在正常光照条件下也极易发生光抑制,甚至光破坏和光氧化。但植物在长期的进化过程中形成了一系列防御机制来保护PSⅡ的正常生理功能,如降低叶片对光能的捕获(葛江丽等,2007)、通过光呼吸和Mehler反应等生化机制防止强光和CO2缺乏下发生的光抑制(颉敏华等,2009)、PSⅡ蛋白磷酸化的的状态转换来调节2个光系统之间的激发能分配(赵莉等,2010),增加依赖于叶黄素循环和D1蛋白周转有关的能量耗散机制等(Pieters et al.,2003;Ebbert et al.,2005)。
笔者前期的研究发现,桑树(Morus alba)对中性盐胁迫具有极强的抵御能力,低于100 mmol·L-1NaCl胁迫下桑树叶片的PSⅡ反应中心的活性基本不会受到抑制(张会慧等,2011a;2012b),初步分析认为这可能与桑树叶片具有完善的光保护机制有关,而D1蛋白周转功能和叶黄素循环为主的非辐射能量耗散机制可能发挥重要的作用,但并没有直接证据。深入讨论叶黄素循环和D1蛋白周转对盐胁迫下桑树叶片PSⅡ功能的影响十分必要。叶黄素循环和D1蛋白周转在植物逆境下的光破坏防御机制中发挥重要的作用(王倩等,2010),叶黄素循环中的紫黄质(V)在光下脱环氧化经环氧玉米黄质(A)形成玉米黄质(Z),在暗处及弱光下A和Z重新环氧化生成V,A和Z含量与能量耗散呈明显的正相关(Eskling et al.,1997),A,Z的形成有利于耗散过剩的激发能(Demmig-Adams,1990)。D1蛋白作PSⅡ反应中心的重要组成部分,它不仅能为PSⅡ反应中心电子传递辅助因子提供结合位点,维持PSⅡ反应中心结构的稳定,而且还与原初电荷分离和传递有关,在PSⅡ反应中心中起着非常重要的作用。在逆境条件下,D1蛋白可以快速合成,周转十分迅速,半衰期大约为10 min,并且新合成的D1蛋白可以快速重新组装在已经失活的PSⅡ反应中心中,因此,D1蛋白快速周转在维持植物正常的PSⅡ生理功能中发挥着重要的作用(Aro et al.,1994)。并且有研究认为植物叶片中的叶黄素循环对PSⅡ反应中心D1蛋白具有保护效应,逆境下植物的叶黄素循环可有效的防止D1蛋白的降解(郑洁等,2010),但D1蛋白周转对叶黄素循环是否具有保护作用目前尚无明确的报道。硫酸链霉素(SM)能够抑制叶绿体蛋白的合成,因此能够抑制D1蛋白的合成和周转(Jiang et al.,2003),二硫苏糖醇(DTT)可以抑制催化V脱环氧化的酶是紫黄质脱环氧化酶(violaxanthin de-epoxidase,VDE)活性,从而抑制叶黄素循环脱环氧化组分的生成及依赖叶黄素循环的热耗散(Horton et al.,1994;姜闯道等,2003)。本文分别用DTT和SM抑制剂抑法研究了盐胁迫下桑树叶片中D1蛋白周转和叶黄素循环对桑树叶片PSⅡ功能的影响,并且讨论D1蛋白周转和叶黄素循环之间的关系,拟揭示D1蛋白周转和叶黄素循环在桑树耐盐中的作用,以期为桑树的耐盐栽培提供理论依据。
1 材料与方法 1.1 试验材料及处理试验于2011年9月在东北林业大学植物生理实验室进行。供试桑树品种为1年生实生苗“青龙”,由黑龙江省蚕业研究所提供,苗木株高约0.5 m。试验材料生长在温度25/23 ℃(光/暗)、光照强度400μmol·m-2 s-1、光周期12/12 h(光/暗)、相对湿度75%的光照培养箱中,不受外界气候因素的限制。为探讨盐胁迫对桑树叶片PSⅡ功能的影响,尽量减少盐离子和抑制剂在植物根部吸收及茎部的运输阻力和离子在下部叶片中的富集,使盐离子和抑制剂直接到达待测定植物的功能叶片,试验采用离体叶片法,用剪刀剪取长势相对一致植株枝条上的第3片完全展开叶,立即将叶柄立即放入分别装有100 mmol·L-1NaCl溶液以及分别含有浓度为10 mmol·L-1 SM,5mmol·L-1 DTT的100 mmol·L-1 NaCl溶液三角瓶中,分别标记为(NaCl,NaCl+SM和NaCl+DTT),以蒸馏水为对照(CK),每个处理3片叶片重复。处理时桑树的叶片不浸入到溶液中。为防止在剪切过程中叶柄木质部导管中进入空气,在溶液中将桑树叶柄再剪掉一小段,以保证木质部导管水柱的连续。将材料放入设定温度25/23 ℃(光/暗)、光照强度400 μmol·m-2 s-1、光周期12/12 h(光/暗)、相对湿度75%的光照培养箱培养24 h,盐离子和各种抑制剂充分进入桑树的叶片后进行叶绿素荧光参数和及其动力学曲线的测定。
1.3 测定参数和方法 1.3.1 叶绿素荧光和PSⅡ反应中心吸收光能分配参数的测定将每个处理的的3片桑树叶片经过0.5 h暗适应后采用便携式脉冲调制荧光仪FMS-2(Hansatch公司,英国)参照Hu等(2007)方法测定初始荧光(Fo)、最大荧光(Fm)、PSⅡ最大光化学效率(Fv/Fm)、电子传递速率(ETR)、光化学淬灭系数(qP)和非光化学淬灭系数(qN)、非光化学淬灭(NPQ),并计算叶片中的过剩光能(1-qP)/NPQ;然后按Hendrickson等(2004)和Zhou等(2007)的方法将PSⅡ反应中心吸收的光能去向按四部分表示(如图 1所示),即:用于光化学反应的量子产额(ФPSⅡ)、依赖于类囊体膜两侧质子梯度和叶黄素循环的量子产额(ФNPQ)、基本的荧光量子产额和热耗散的量子产额(Фf,D)以及失活PSⅡ反应中心的热耗散量子产额(ФNF),其中各部分参数的计算方法为:
 |
图 1 DTT和SM对盐胁迫下桑树叶片Fo,Fm,Fv/Fm和ETR的影响
Fig. 1 Effect of DTT and SM on Fo,Fm,Fv/Fm and ETR in leaves of M.alba under NaCl stress
|
ФPSⅡ=[1-(Fs/Fm ')]·[(Fv/Fm)/(Fv/FmM)]、ФNPQ=[(Fs/Fm ')-(Fs/Fm)]·[(Fv/Fm)/(Fv/FmM)]、Фf,D=(Fs/Fm)·[(Fv/Fm)/(Fv/FmM)],
ФNF=1-[(Fv/Fm)/(Fv/FmM)],其各部分的总和计为1,即: ФNF+ФPSⅡ+ФNPQ+Фf,D=1,式中FmM表示桑树叶片在未发生光抑制时的最大荧光。
1.3.2 叶绿素荧光动力学曲线的测定将每个处理的3片桑树叶片经过0.5 h暗适应,利用Mini调制式掌上叶绿素荧光仪(FluorPen FP 100max,捷克)测定各处理叶片的OJIP曲线,得到OJIP曲线上J点的相对可变荧光强度(VJ)、QA被还原的最大速率(Mo)、QA被氧化还原次数(N)、荧光曲线与Fm所围面积(Area)。叶片的测定部位选择从叶基部数第3与第4叶脉之间,距离主叶脉2 cm左右处。
1.4 数据处理方法运用Excel和SPSS软件对测定数据进行统计分析,图中数据为3次重复的平均值±标准差(SE),并采用单因素方差分析(One-way ANOVA)和最小显著差异法(LSD)比较不同数据组间的差异。
2 结果与分析 2.1 DTT和SM对桑树叶片叶绿素荧光参数的影响由表 1可知:在非盐胁迫条件下,DTT对桑树叶片叶绿素荧光特性的影响较小,仅有Fm有显著的降低,而Fo,Fv/Fm和ETR均没有发生明显的变化,与DTT不同,CK+SM处理使用桑树叶片的Fm和ETR分别降低了11.75%(P < 0.05)和10.97%(P< 0.05),但桑树叶片的Fo和Fv/Fm未达显著差异水平。说明在非盐胁迫下DTT和SM对桑树叶片的叶绿素荧光参数影响较小,均未使桑树叶片发生光抑制。
|
|
由图 1可知: 100 mmol·L-1 NaCl胁迫下明显降低了桑树叶片的Fm,Fv/Fm和ETR,但Fo却无明显变化,NaCl+DTT处理与NaCl胁迫下桑树叶片的各叶绿素荧光参数之间均无明显差异,但NaCl+SM处理不但进一步降低桑树叶片的Fm,Fv/Fm和ETR,而且使桑树叶片的Fo也明显增加,其中NaCl+SM处理桑树叶片的Fo高于CK34.73%(P > 0.05),Fm,Fv/Fm和ETR分别低于CK47.21%(P < 0.01)、37.76%(P < 0.01)和88.38%(P < 0.01)。100 mmol·L-1 NaCl处理虽然降低叶片的光化学效率,但桑树叶片的光抑制程度明显较低,而SM和DTT进一步加剧了盐胁迫对桑树叶片PSⅡ的伤害,使叶片发生了光抑制。
2.3 DTT和SM对盐胁迫下桑树叶片qP,qN,NP和(1-qP)/NPQ的影响由图 2可知: 100 mmol·L-1 NaCl胁迫使桑树叶片的qP,qN和NPQ均有小幅度的降低,但均未达显著差异水平,NaCl+DTT和NaCl+SM处理进一步降低了桑树叶片的qP,qN和NPQ,特别是NaCl+SM处理桑树叶片的各参数变化幅度明显大于NaCl+DTT处理,其中NaCl+SM处理桑树叶片qP,qN和NPQ分别低于CK81.38%(P < 0.01)、78.28%(P <0.01)和87.32%(P < 0.01),并且NaCl+SM处理桑树叶片qP,qN和NPQ分别低于NaCl和NaCl+DTT处理。NaCl处理使桑树叶片中过剩光能(1-qP)/NPQ有小幅度的增加,但NaCl+DTT和NaCl+SM处理下桑树叶片的(1-qP)/NPQ分别为NaCl处理的1.95倍和4.80倍。
 |
图 2 DTT和SM对盐胁迫下桑树叶片qP,qN, NP和(1-qP)/NPQ的影响
Fig. 2 Effect of DTT and SM on qP,qN,NPQ and (1-qP)/NPQ in leaves of M.alba under NaCl stress
|
由图 3可知: 100 mmol·L-1 NaCl胁迫下桑树叶片的VJ,Mo和N均没有发生明显变化,而Area呈显著的降低趋势,NaCl+DTT和NaCl+SM处理使桑树叶片的VJ,Mo明显升高,也极显著降低了桑树叶片的Area,特别是NaCl+SM处理的变化幅度明显大于NaCl+DTT处理,其中NaCl+SM处理桑树叶片的VJ,Mo分别高于NaCl处理59.60%(P <0.01)和26.18%(P > 0.05),N为NaCl处理的4.58倍,而Area低于NaCl处理81.80%(P < 0.01)。
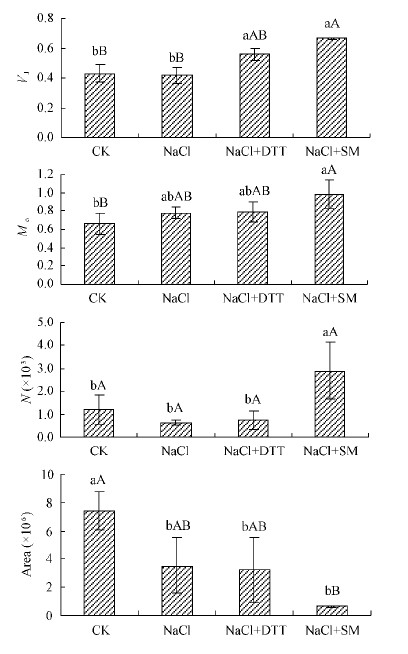 |
图 3 DTT和SM对盐胁迫下桑树叶片QA-氧化还原状态的影响
Fig. 3 Effect of DTT and SM on QA- oxidation in leaves of M.alba under NaCl stress
|
由图 4可知: 100 mmol·L-1 NaCl胁迫使桑树叶片PSⅡ反应中心吸收的光能用于光化学反应的量子产额(ФPSⅡ)有小幅度的降低,失活PSⅡ反应中心的热耗散量子产额(ФNF)和依赖于类囊体膜两侧质子梯度叶黄素循环的量子产额(ФNPQ)所占比例有小幅度的增加,而基本的荧光量子产额和热耗散的量子产额(Фf,D)所占比例没有发生明显变化。NaCl+DTT和SM+NaCl处理进一步降低了桑树叶片的ФPSⅡ,也显著降低桑树叶片的ФNPQ,并且SM+NaCl处理的变化幅度明显大于NaCl+DTT处理,NaCl+DTT和SM+NaCl处理下桑树叶片的Фf,D却呈增加趋势,NaCl+DTT处理下桑树叶片的ФNF与NaCl处理无明显差异,但SM+NaCl处理下桑树叶片的ФNF却显著增加,分别为NaCl和NaCl+DTT处理的6.24和4.92倍。
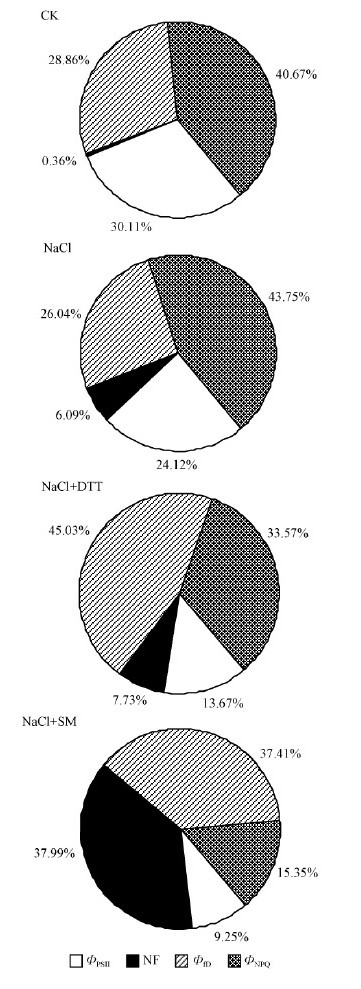 |
图 4 DTT和SM对盐胁迫下桑树叶片能量分配参数的影响
Fig. 4 Effect of DTT and SM on parameters of energy flux
ratios in leaves of M. alba under NaCl stress
|
在非盐胁迫下,DTT和SM对桑树叶片的叶绿素荧光参数影响较小,均未使桑树叶片发生光抑制,而盐处理(100 mmol·L-1 NaCl)明显降低了桑树叶片的Fm,Fv/Fm和ETR,降低了PSⅡ光化学活性。NaCl+DTT处理下没有明显改变NaCl胁迫下的各叶绿素荧光参数,表明盐胁迫抑制叶黄素循环,但桑树叶片发生了明显的光抑制;NaCl+SM处理不但降低桑树叶片的Fm,Fv/Fm和ETR,而且Fo明显增加,表明抑制D1蛋白的周转会使盐胁迫下桑树叶片发生明显的光抑制,其结果会造成PSⅡ光合电子传递链上的电子传递受阻,PSⅡ反应中心受到严重的破坏。qP和qN是叶绿素荧光的2种淬灭形式,qP在一定程度上反映了PSⅡ反应中心的开放程度和PSⅡ反应中心的活性,qN反映了PSⅡ反应中心的热耗散情况(张会慧等,2012c;金微微等,2011)。本试验中的NaCl+DTT和NaCl+SM处理均显著降低了盐胁迫下桑树叶片的qP,qN和NPQ,说明通过抑制叶黄素循环和D1蛋白周转均会降低PSⅡ反应中心的开放程度和PSⅡ反应中心的活性,这与图 1中Fm,Fv/Fm和ETR的变化结果相吻合,并且降低了桑树叶片耗散过剩光能的能力,导致叶片中的过剩光能(1-qP)/NPQ成倍增加,特别是抑制D1蛋白周转后对盐胁迫下桑树叶片PSⅡ功能的破坏程度大于抑制叶黄素循环。
为了进一步分析抑制D1蛋白周转和叶黄素循环后盐胁迫对PSⅡ的作用位点,利用快速叶绿素荧光诱导动力学分析的方法(张会慧等,2011b)测定了荧光动力学的OJIP曲线。VJ表示在OJIP曲线上J点所关闭反应中心的数量或QA的还原量,即QA-的积累量,Mo表示相对荧光的初始斜率,可以用来表示QA被还原的相对速率(李鹏民等,2005;Strasser et al.,1995)。本试验结果表明:盐胁迫下桑树叶片的VJ,Mo和N均没有显著变化,即PSⅡ受体侧QA到QB电子传递没有受到影响,而Area显著降低,即PSⅡ电子受体库包括QA,QB和PQ等容量降低(马飞等,2011),这说明NaCl引起桑树叶片电子传递速率降低的主要原因是由于PQ库容量降低造成的。NaCl+DTT处理的VJ高于NaCl处理,而NaCl+SM处理的VJ,Mo和N却明显高于NaCl处理,而且极显著地降低了桑树叶片的Area。D1蛋白上的酪氨酸残基(TryZ)是P680被激发后形成存在电子空穴的P680+的直接电子供体(蔡霞等,2003),并且D1蛋白中的第190位组氨酸(His)位点与Mn原子或次级电子供体相结合,而第215和272位His位点是与非血红素Fe-QA-QB复合物形成配体的主要结合部位(匡廷云,2003)。因此,SM可以通过抑制D1蛋白周转降低QA和QB等电子传递体与D1蛋白的结合程度,加剧QB的还原程度,这不但降低电子传递链上的电子传递(图 1),也使PQ库容量降低(图 3)。每个PQ库大约含6个PQ分子,PQ既是电子传递体又是质子传递体,PQ被还原时从类囊体膜外侧吸收质子,被氧化时则向膜内侧释放质子,形成膜内外的质子梯度,以推动ATP的形成。PQ库容量的降低势必会降低PQ在类囊体膜两侧建立质子梯度(△pH)的能力。因此,抑制D1蛋白的周转不但降低叶绿体中ATP合成的动力,而且也会限制依赖于△pH的叶黄素循环,因此,在提高桑树叶片耐盐性方面D1蛋白的正常周转是叶黄素循环发挥正常功能的保证。
定量研究PSⅡ反应中心吸收光能的分配,可以深入分析逆境胁迫下植物光合机构的受抑制或损伤程度,而且可以定量研究逆境下植物叶片中的各种保护功能的作用大小(Demmig-Adams,1996;Kramer et al.,2004)。目前多数的研究者将植物叶片PSⅡ反应中心吸收光能的最终去向分为用于光化学反应的量子产额(ФPSⅡ)、依赖于类囊体膜两侧质子梯度和叶黄素循环的量子产额(ФNPQ)、基本的荧光量子产额和热耗散的量子产额(Фf,D)以及失活PSⅡ反应中心的热耗散量子产额(ФNF)4个部分,这4部分基本包含了PSⅡ反应中心吸收光能的全部去向(Hendrickson et al.,2005)。NaCl胁迫并没有明显改变桑树叶片PSⅡ反应中心吸收的光能的分配,吸收光能用于光化学反应的量子产额(ФPSⅡ)降低幅度较小,其原因可能是由于盐胁迫诱导的桑树叶片依赖于类囊体膜两侧质子梯度叶黄素循环的量子产额(ФNPQ)在提高桑树叶片的耐盐性方面发挥重要的作用,并没有造成PSⅡ反应中心的大量失活。NaCl+DTT处理降低桑树叶片的ФPSⅡ,也显著降低桑树叶片的ФNPQ,说明DTT通过抑制盐胁迫下桑树叶片的叶黄素循环而降低了叶片的PSⅡ生理活性。NaCl+DTT处理下桑树叶片失活反应中心的热耗散量子产额(ФNF)所占比例却没有明显增加,没有造成大量的反应中心失活,这主要是由于Фf,D的比例增加所致,即NaCl+DTT处理下桑树叶片主要通过将PSⅡ反应中心吸收的光能大部分以无效的荧光和热能形式耗散。NaCl+SM处理进一步破坏了桑树叶片以叶黄素循环以主的非辐射能量耗散机制,虽然将过剩的激发能分配给Фf,D一部分,但仍不足以有效地将过剩激发能耗散,导致叶片中过剩光能大量积累(图 2)。当PSⅡ中存在过剩激发能时会与细胞内氧分子产生活性氧(ROS),ROS不但会攻击PSⅡ造成氧化伤害,使PSⅡ反应中心失去电荷分离的能力,而且会造成D1蛋白的降解和PSⅡ反应中心失活(Krieger-Liszkay et al.,2008),本试验中NaCl+SM处理下桑树叶片失活PSⅡ反应中心的热耗散量子产额(ФNF)所占比例剧增验证这一观点。因此,DTT会通过破坏盐胁迫下桑树叶片依赖于叶黄素循环的能量耗散机制,造成PSⅡ反应中心的功能降低,而SM在抑制D1蛋白的周转的同时也会限制依赖于叶黄素循环的非辐射能量耗散功能。
4 结论桑树叶片在100 mmol·L-1 NaCl胁迫PSⅡ反应中心的活性受抑制程度较小,桑树叶片具有完善的光破坏防御机制,在非盐胁迫下抑制D1蛋白周转和叶黄素循环对桑树叶片的PSⅡ功能影响较小,但抑制D1蛋白周转和叶黄素循环均可加剧盐胁迫下桑树叶片的PSⅡ反应中心的伤害。D1蛋白周转和叶黄素循环在保护盐胁迫下桑树叶片PSⅡ正常生理功能中发挥重要的作用;D1蛋白周转在桑树叶片盐胁迫下的光破坏防御中的作用大于叶黄素循环,并且抑制D1蛋白的周转会导致盐胁迫下桑树叶片以叶黄素循环为主的非辐射能量耗散机制受到破坏,这也是D1蛋白周转对PSⅡ的保护作用大于叶黄素循环的原因之一。
| [1] |
蔡霞, 王水才, 贺俊芳, 等. 2003.温度升高对PSⅡ中CP47和CP47/D1/D2/Cytb559 Chla能量传递的影响.西北植物学报, 23(7): 1134-1137.( 1) 1)
|
| [2] |
陈健妙, 郑青松, 刘兆普, 等. 2010.两种麻疯树苗对盐胁迫的生理生态响应.生态学报, 30(4): 933-940.( 1) 1)
|
| [3] |
葛江丽, 石雷, 谷卫彬, 等. 2007.盐胁迫条件下甜高粱幼苗的光合特性及光系统Ⅱ功能调节.作物学报, 33(8): 1272-1278.( 1) 1)
|
| [4] |
惠红霞, 许兴, 李守明. 2004.盐胁迫抑制枸杞光合作用的可能机理.生态学杂志, 23(1): 529.( 1) 1)
|
| [5] |
姜闯道, 高辉远, 邹琦, 等. 2003.二硫苏糖醇处理导致大豆叶片两光系统间激发能分配失衡.植物生理与分子生物学学报, 29(6): 561-568.( 1) 1)
|
| [6] |
颉敏华, 张继澍, 郁继华, 等. 2009.D1蛋白周转和叶黄素循环在青花菜叶片强光破坏防御中的作用.中国农业科学, 42(5):1582-1589.( 1) 1)
|
| [7] |
金微微, 王炎, 张会慧, 等. 2011.茉莉酸甲酯对干旱及复水下烤烟幼苗叶绿素荧光特性的影响.应用生态学报, 22(12):3157-2162.( 1) 1)
|
| [8] |
匡廷云. 2003.光合作用原初光能转化过程的原理与调控.江苏科学技术出版社.( 1) 1)
|
| [9] |
李鹏民, 高辉远, Reto J. Strasser. 2005.快速叶绿素荧光诱导动力学分析在光合作用研究中的应用.植物生理与分子生物学学报, 31(6): 559-566.( 1) 1)
|
| [10] |
马飞, 徐婷婷, 陈立同, 等. 2011.低温胁迫下二倍体杂交种高山松光系统Ⅱ功能稳定性研究.西北植物学报, 31(6):1174-1179.( 1) 1)
|
| [11] |
任丽丽, 任春明, 张伟伟, 等. 2009.短期NaCl胁迫对野生大豆和栽培大豆叶片光合作用的影响.大豆科学, 28(2): 239-242.( 1) 1)
|
| [12] |
王倩, 高雪, 彭建云, 等. 2010.盐诱导的依赖叶黄素循环的热耗散提高了小麦的耐盐性.植物生理学通讯, 46(10): 1020-1024.( 1) 1)
|
| [13] |
张会慧, 张秀丽, 朱文旭, 等. 2011a.桑树叶片光系统Ⅱ对NaCl和Na2CO3胁迫的响应.北京林业大学学报, 33(6): 15-20.( 1) 1)
|
| [14] |
张会慧, 张秀丽, 许楠, 等. 2011b.外源钙对干旱胁迫下烤烟幼苗光系统Ⅱ功能的影响.应用生态学报, 22(5): 1195-1200.( 1) 1)
|
| [15] |
张会慧, 张秀丽, 胡彦波, 等. 2012a.碱性盐胁迫对桑树幼苗叶片叶绿素荧光和激发能分配的影响.经济林研究, 30(1): 6-12.( 1) 1)
|
| [16] |
张会慧, 张秀丽, 李鑫, 等. 2012b. NaCl和Na2CO3胁迫对桑树幼苗生长和光合特性的影响.应用生态学报, 23(3): 625-631.( 1) 1)
|
| [17] |
张会慧, 金微微, 毛卫佳, 等. 2012c.水杨酸对干旱下烤烟幼苗膜质和叶绿素荧光特性的影响.中国沙漠, 32(1): 117-121.( 1) 1)
|
| [18] |
赵莉, 郑晓媛, 孙广玉. 2010.弱光桑树幼苗形态结构和光合特性对光强的适应性.经济林研究, 28(3): 84-89.( 1) 1)
|
| [19] |
郑洁, 周慧芳, 陈蔚涛, 等. 2010.柑橘叶片中叶黄素循环对PSⅡ反应中心D1蛋白的保护效应.植物生理学通讯, 46(1):42-46.( 1) 1)
|
| [20] |
朱新广, 张其德. 1999.NaCl对光合作用影响的研究进展.植物学通报, 16(4): 332-338.( 1) 1)
|
| [21] |
Aro E M, McCaffery S, Andenson J M. 1994.Recovery fromphotoinhibition in peas(Pisum sativum L.)acclimated to varyinggrowth irradiances: role of D1 protein turnover. Plant Physiology, 104(3): 1033-1041.( 1) 1)
|
| [22] |
Brugnoli E, Lauteri M. 1991.Effects of salinity on stomatalconductance, photosynthetic capacity, and carbon isotopediscrimination of salt-tolerant(Gossypium hirsutum L.)and saltsensitive(Phaseolus vulgaris L.)C3 non-halophytes. PlantPhysiology, 95(2): 628-635.( 1) 1)
|
| [23] |
Chen H X, Li W J, An S Z, et al. 2004.Characterization of PSⅡphotochemistry and thermostability in salt-treated Rumex leaves.Journal of Plant Physiology, 161(3): 257-264.( 1) 1)
|
| [24] |
Demmig-Adams B. 1990.Carotenoids and photoprotection in plants. arole for the xanthophyll zeaxanthin. Biochim Biophys Acta, 1020(1): 1-24.( 1) 1)
|
| [25] |
Demmig-Adams B, Adams W W, Barker D H, et al. 1996.Usingchlorophyll fluorescence to assess the fraction of absorbed lightallocated to thermal dissipation of excess excitation. PlantPhysiology, 98(2): 253-264.( 1) 1)
|
| [26] |
Ebbert V, Adams Ⅲ W W, Mattoo A K, et al. 2005.Up-regulation of aphotosystem Ⅱ core protein phosphatase inhibitor and sustained D1phosphorylation in zeaxanthin-retaining, photoinhibited needles ofoverwintering Douglas fir. Plant, Cell and Environment, 28(2):232-240.( 1) 1)
|
| [27] |
Eskling M, Arvidsaon P O, Akerlund H E. 1997.The xanthophyllcycle, its regulation and components. Plant Physiology, 100(4):806-816.( 1) 1)
|
| [28] |
Hendrickson L, Furbank R T, Chow W S. 2004.A simple alternativeapproach to assessing the fate of absorbed light energy usingchlorophyll fluorescence. Photosynthesis Research, 82(1):73-81.( 1) 1)
|
| [29] |
Hendrickson L, Britta Frster, Pogson B J, et al. 2005.A simplechlorophyll fluorescence parameter that correlates with the ratecoefficient of photoinactivation of Photosystem Ⅱ. PhotosynthesisResearch, 84(1): 43-49.( 1) 1)
|
| [30] |
Hu Y B, Sun G Y, Wang X C. 2007.Induction characteristics andresponse of photosynthetic quantum conversion to changes inirradiance in mulberry plants. Journal of Plant Physiology, 164(8):959-968.( 1) 1)
|
| [31] |
Horton P, Ruban AV, Walters R G. 1994.Regulation of light harvestingin green plants: indication by non-photochemical quenching ofchlorophyll fluorescence. Plant Physiology, 106(2): 415-420.( 1) 1)
|
| [32] |
Jiang C D, Gao H Y, Zou Q. 2003.Effects of streptomycin treatment onchlorophyll fluorescence parameters and xanthophyll de-epoxidationlevel in maize leave. Journal of Plant Physiology and MolecularBiology, 29(3): 221-226.( 1) 1)
|
| [33] |
Kao W Y, Tsai H C, Tsai T T. 2001.Effect of NaCl and nitrogenavailability on growth and photosynthesis of seeding of a mangrovespecies, Kandelia candel(L.)Druce. Journal of Plant Physiology, 158(7): 841-846.( 1) 1)
|
| [34] |
Kramer D M, Johnson G, Kiirats O, et al. 2004.New fluorescenceparameters for the determination of QA redox state and excitationenergy fluxes. Photosynthesis Research, 79(2): 209-218.( 1) 1)
|
| [35] |
Krieger-Liszkay A, Fufezan C, Trebst A. 2008.Singlet oxygenproduction in photosystemII and related protectionmechanism.Photosynthesis Research, 98(1): 551-564.( 1) 1)
|
| [36] |
Pieters A J, Tezara W, Herrera A. 2003.Operation of the xanthophyll cycle and degradation of D1 protein in the inducible CAM plant, Talinum triangulare, under water deficit. Annals of Botany, 92(3):393-399.( 1) 1)
|
| [37] |
Seemann J R, Sharkey T D. 1986.Salinity and nitrogen effects onphotosynthesis, ribulose-1, 5-bisphosphate carboxylase andmetabolite pool sizes in Phaseolus vulgaris L. Plant Physiology, 82(2): 555-560.( 1) 1)
|
| [38] |
Sharkey T D, Badger M R. 1982.Effects of water stress onphotosynthetic electron transport, photophosphorylation, andmetabolite levels of Xanthium strumarium mesophyll cells. Planta, 156(3): 199-206.( 1) 1)
|
| [39] |
Strasser R J, Srivastava A, Govindjee. 1995.Polyphasic chlorophyll afluorescence transient in plants and cyanobacteria. PhotochemPhotobiology, 61(1): 32-42.( 1) 1)
|
| [40] |
Zhou Y H, Lam H M, Zhang J H. 2007.Inhibition of photosynthesisand energy dissipation induced by water and high light stresses inrice. Journal of Experimental Botany, 5(58): 1207-1217. ( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

