文章信息
- 莫文娟, 傅建敏, 乔杰, 雷莉莉, 李芳东, 袁德义, 邱乾栋
- Mo Wenjuan, Fu Jianmin, Qiao Jie, Lei Lili, Li Fangdong, Yuan Deyi, Qiu Qiandong
- 泡桐属植物亲缘关系的ISSR分析
- ISSR Study on Genetic Relationship of Genus Paulownia
- 林业科学, 2013, 49(1): 61-67
- Scientia Silvae Sinicae, 2013, 49(1): 61-67.
- DOI: 10.11707/j.1001-7488.20130110
-
文章历史
- 收稿日期:2012-03-13
- 修回日期:2012-06-08
-
作者相关文章
2. 中南林业科技大学国家林业局经济林育种与栽培重点实验室 长沙 410004
2. Key Laboratory of Non-Wood Forest Product of State Forestry Administration Central South University of Forestry and Technology Changsha 410004
泡桐属(Paulownia)属于玄参科(Scrophulariaceae),原产于我国的落叶乔木。除个别种(白花泡桐P. fortunei)分布到越南、老挝外,其他各种均为我国所特有,分布于全国24个省、市、自治区,在河南省境内垂直分布达1 400 m,云南省内,达3 000 m,是重要的速生用材和绿化树种之一。我国具有完整的泡桐属植物种群的这一优势为选育良种、实现泡桐生产良种化提供了有利条件。泡桐属植物经过漫长的自然迁移、种间杂交和反复回交等出现了大量的表型过渡性杂种群集(hybrid swarm),从而形成了丰富的泡桐属种质资源。关于泡桐属植物的分类研究,有较多研究根据外部形态特征对其进行深入探讨(苌哲新等,1989;陈志远,1995;1983;1986;蒋建平,1990;龚彤,1976);龚本海(1994)在蛋白质水平上作过分析;马浩等(2001)利用RFLP技术分析泡桐属15个植物种类的叶绿体DNA,将其分为毛泡桐(P. tomentosa)组、南方泡桐(P. australis)组和白花泡桐组;卢龙斗等(2001)还利用RAPD技术分析泡桐属的7个种,将其分为2个类群,认为白花泡桐与川泡桐(P. fargesii)亲缘关系最近,且二者与山明泡桐( P. lamprophylla)、楸叶泡桐(P. catalpifolia)、南方泡桐归为1个类群,毛泡桐与兰考泡桐(P. elongata)亲缘关系也较近,二者在系统演化上比较原始,归为1个类群。上述所得结论有一定差别,各种类之间的关系仍然存在较多争议(蒋建平,1990;陈志远,1983;竺肇华,1981)。
ISSR(inter simple sequence repeats,即简单重复序列区间)是利用人工合成的17~24个核苷酸重复序列作为引物,在引物的3’端或5’端加上2~4个随机的简并核苷酸,用于扩增SSR之间的DNA序列,而不是SSR本身(Zietkiewicz et al.,1994)。与SSR相比,ISSR操作简单,因为不需要预先获知序列信息;与AFLP相比,其成本低,因为不需要酶切;与RAPD相比,ISSR拥有更高的重复性和可靠性,由于重复序列在基因组中是变异最快的成分,又由于ISSR的引物比RAPD的引物(10碱基)更长,可以使用更高的退火温度从45 ℃直到60 ℃(付燕等,2009;王永清等,2010)。所以近年来,I SSR技术已在落叶松属( Larix)(Arcade et al.,2000)、假山毛榉属(Nothofagus)(Mattioni et al.,2002)、壳斗科(Fagaceae)(Chokchaichamnankit et al.,2008)、松属(油松组)[Pinus(Sect. Pinus)](洑香香等,2011)、牧豆树属(Prosopis)(Elmeer et al.,2011)等多种用材树种上得到了广泛应用,证明其结果稳定可靠,是研究用材树种亲缘关系、遗传多样性和种质资源鉴定的有效手段。目前对泡桐属植物的亲缘关系和多样性还缺乏较深入的研究,需要采用更多的分子技术手段对其进行研究。
本研究利用ISSR技术对所搜集的21份泡桐属代表植物(种、变种及变型)进行了较全面的研究,旨在从分子水平上为泡桐属植物的亲缘关系,目前存在争议的建始泡桐(P. jianshiensis)、鄂川泡桐(P. albiphloea)与成都泡桐( P. albiphloea var. chengtuensis)三者间的关系,宜昌泡桐(P. ichangensis)与兰考泡桐、川泡桐与白花泡桐的关系等及其分类处理提供更多的依据,同时找到一些特异性条带可转化为SCAR(sequence-characterized amplified region)标记,为研究泡桐属的遗传关系和遗传多样性及育种奠定基础。
1 材料与方法 1.1 植物材料圆冠泡桐采自国家林业局泡桐研究中心的郑州基地,其余材料采集自江西九江共青城的“泡桐基因库与育种群体建立技术研究”苗木育种基地,包括21个泡桐种、变种及变型材料。每份材料选取5~8个个体新鲜嫩叶,用70%乙醇清洗表面,用无菌去离子水冲洗干净,存放至-70 ℃超低温冰箱保存待用。供试泡桐材料的名称、来源见表 1。所有材料经河南农业大学兼国家林业局泡桐研究中心特聘专家李荣幸教授鉴定。文中对泡桐材料的研究所用的编号均对应表 1的编号。
|
|
采用乌云塔娜等(2003)改良的CTAB法提取泡桐叶片中的基因组DNA,纯化DNA,然后经琼脂糖电泳及紫外分光光度法检测DNA浓度与纯度,稀释为20 ng·μL-1,-20 ℃保存备用。
1.2.2 ISSR分析所用的100个ISSR引物参照加拿大哥伦比亚大学(UBC)公布的序列,由上海生物工程技术服务有限公司合成。试验采用的泡桐ISSR-PCR最佳反应体系参照了李芳东等(2011)和莫文娟等(2011)的体系,即20 μL体系中含1×buffer、40 ng模板DNA、Mg2+ 1.5 mmol·L-1、dNTPs 0.30 mmol·L-1、随机引物0.40 μmol·L-1、1 U Taq DNA聚合酶。PCR扩增在PE-9600型PCR仪上进行。反应程序参照袁德义等(2008): 94 ℃预变性5 min;94 ℃变性45 s,46~58 ℃退火1 min,72 ℃延伸2 min,38个循环;然后72 ℃延伸7 min;4 ℃保温。最后通过1.5%的琼脂糖凝胶电泳检测其扩增产物。
1.3 数据分析将重复性好且清晰的条带进行记录(有无条带分别记为“1”和“0”),再转换成相应的格式,根据Nei和Li的方法计算Dice相似系数,建立相似矩阵,通过NTSYS - pc(Rohlf,2000)软件进行数据分析。采用POPGENE 32软件(Ferguson et al.,2004)获得相关数据,并结合MEGA3.1软件(He et al.,2003)基于UPGMA(unweighted pair-group method with arithmetic mean)法绘制泡桐间亲缘关系树状图。
2 结果与分析 2.1 ISSR-PCR扩增结果及多态性分析从100条ISSR引物中最终筛选出9条扩增产物清晰且多态性高的引物,用于泡桐属21份材料的PCR扩增(表 2)。同样条件的扩增重复1次,得到了基本相同的结果,说明了扩增的重复性和稳定性。共扩增出的85个条带中有74条具多态性,每个引物扩增的多态性条带数(number of polymorphic bands)为7~13条,各引物多态带百分率(percentage of polymorphic bands,PPB)在62.50%~100%之间,平均为87.05%(表 2)。其中引物P807,P811和P834的多态带百分率最高都达到了100%,而引物P815的多态带百分率最低62.50%。部分引物扩增图谱见图 1。
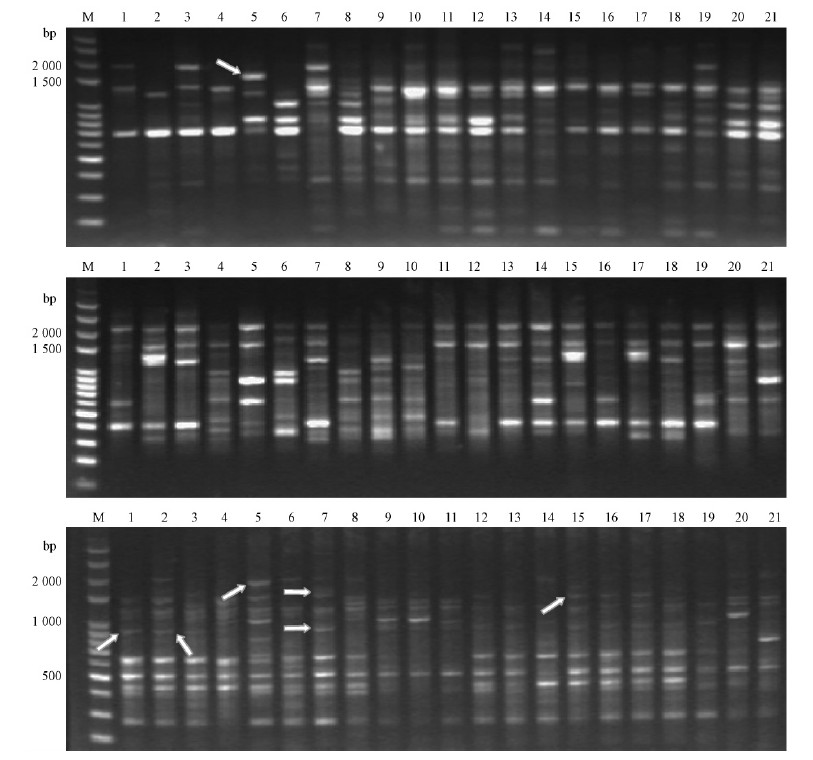 |
图 1 引物834,811 和807 对泡桐属21 份材料的扩增图谱
Fig. 1 The ISSR-PCR amplification results of 21 Paulownia accessions with primers of 834,811 and 807
箭头所指为特异性条带。Arrow heads to specific bands. |
|
|
利用POPGENE软件计算Nei’s的遗传一致度和遗传距离(表 3),结合MEGA3.1软件基于UPGMA法绘制泡桐属种质间亲缘关系树状图(图 2)。从表 3看出,21份泡桐属材料间的遗传一致度的变化范围为0.36~0.75,表明遗传基础较宽。其中南方泡桐1与南方泡桐3具有最高的遗传一致度(0.75),说明其亲缘关系最近;亮叶毛泡桐与卾川泡桐,建始泡桐与圆冠泡桐具有最低的遗传一致度(0.36),说明其亲缘关系最远,彼此间存在较大的遗传差异。
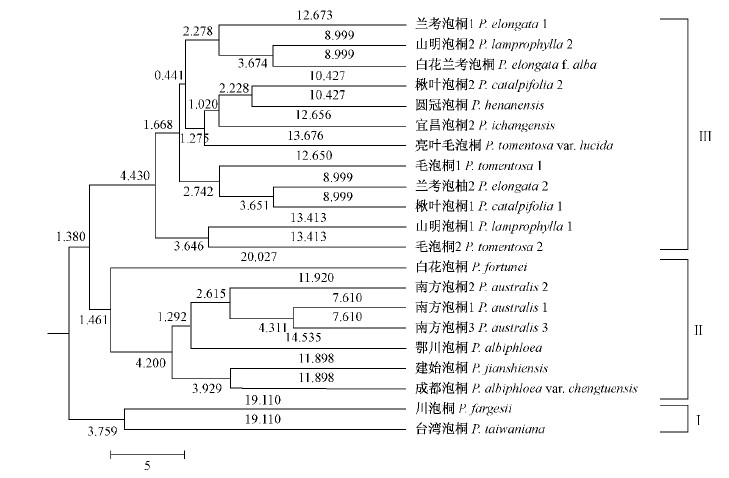 |
图 2 泡桐属21份材料的聚类结果
Fig. 2 The dendrogram of cluster analysis for 21 Paulownia accessions
|
|
|
对供试的21份泡桐材料进行UPGMA聚类分析,可将其分为3大类群,分别命名为类群Ⅰ、类群Ⅱ、类群Ⅲ(图 2):类群Ⅰ包括台湾泡桐、川泡桐;类群Ⅱ包括白花泡桐、南方泡桐2、南方泡桐1、南方泡桐3、卾川泡桐、建始泡桐、成都泡桐;类群Ⅲ包括兰考泡桐1、兰考泡桐2、山明泡桐2、山明泡桐1、白花兰考泡桐、楸叶泡桐2、楸叶泡桐1、圆冠泡桐、宜昌泡桐、亮叶毛泡桐、毛泡桐1、毛泡桐2。
3 结论与讨论对兰考泡桐、山明泡桐、白花兰考泡桐、楸叶泡桐、圆冠泡桐、亮叶毛泡桐、毛泡桐、白花泡桐、川泡桐间的遗传关系及亲本来源分析,基本上与形态学、细胞学、同工酶的研究结果一致,不仅提供了进一步的相关分子理论依据,而且还分别得到了川泡桐、白花泡桐和毛泡桐的ISSR特异条带。同时本研究对泡桐属的建始泡桐、鄂川泡桐、成都泡桐之间的关系提供了相关分子数据作为理论依据,但有待进一步验证。而对宜昌泡桐与兰考泡桐、川泡桐和白花泡桐之间关系的探讨,提出了与以往研究结果不一致的观点,有待进一步试验验证。对已经获得的ISSR特异条带,有进一步转化为SCAR标记的试验计划。
3.1 泡桐属植物的遗传关系对泡桐属植物的聚类分析(图 2)得出:川泡桐和台湾泡桐在类群Ⅰ的最外群,说明二者与其他泡桐在DNA上有较大的遗传差异;且川泡桐扩增出ISSR特异条带P807-2 000bp,P834-1 700 bp(图 1箭头所示),表明其出现了一定的分化。
类群Ⅲ中兰考泡桐、白花兰考泡桐聚为一个亚群(图 2),说明二者的亲缘关系密切。根据蒋建平(1990)主编的《泡桐栽培学》,白花兰考泡桐是根据花冠颜色而定的;试验结果得出白花兰考泡桐与兰考泡桐聚为一组(图 2),它们间的遗传一致度为0.62(表 3),也说明它们的亲缘较近,本研究在DNA水平上支持白花兰考泡桐为兰考泡桐的变型这一观点。山明泡桐是毛泡桐与兰考泡桐的杂交种,目前已在同工酶(龚本海,1994;梁作侑等,1996)、形态特征与地理分布(陈志远等,2000)上得以证明。本研究通过ISSR分析聚类显示山明泡桐与兰考泡桐聚在一起,山明泡桐1与毛泡桐2聚在一起(图 2),进一步在DNA水平上支持这一观点。类群Ⅲ中另一个亚群包括楸叶泡桐、圆冠泡桐、宜昌泡桐、亮叶毛泡桐,其中楸叶泡桐和圆冠泡桐优先聚在一起,说明其亲缘关系很近,二者均与毛泡桐聚为一类(图 2),本研究为楸叶泡桐为毛泡桐演变而来的新种(陈志远等,2000)这一观点提供了依据。圆冠泡桐与楸叶泡桐2间的遗传一致度(表 3)为0.69,与楸叶泡桐1间的遗传一致度(表 3)为0.65,与毛泡桐1间的遗传一致度为0.61,说明楸叶泡桐对圆冠泡桐形成提供的遗传份额较大,这与张存义等(1995)从形态特征上报道圆冠泡桐的亲本为楸叶泡桐(母本)和毛泡桐(父本)的结论有一致性,并进一步提供了分子方面的依据。根据蒋建平(1990)主编的《泡桐栽培学》亮叶毛泡桐是根据叶片毛的多少和有无而定的,通过聚类分析(图 2),本研究在分子水平上支持亮叶毛泡桐为一个独立的变种且与毛泡桐有亲缘关系这一观点,与陈志远等(2000)的观点一致。类群Ⅲ中第3亚群兰考泡桐与毛泡桐聚在一组,对于毛泡桐是兰考泡桐的亲本之一这一观点(中国林学会泡桐文集编委会,1982;陈志远等,2000),本研究在DNA水平上提供一定的理论基础支持。
3.2 建始泡桐、鄂川泡桐、成都泡桐的关系的探讨聚类分析(图 2)显示鄂川泡桐、建始泡桐与成都泡桐的亲缘关系较近。陈志远等(2000)认为建始泡桐是川泡桐与白花泡桐的杂交种,本研究在DNA水平仅提供一定的理论基础,认为建始泡桐的可能亲本是卾川泡桐、南方泡桐、白花泡桐,还有待进一步试验研究。有报道(陈志远等,2000)称卾川泡桐是南方泡桐和兰考泡桐的杂交种,本研究在DNA水平上仅提供一定的理论基础,即卾川泡桐的亲本之一可能是南方泡桐,但还待进一步试验验证。
3.3 宜昌泡桐与兰考泡桐、川泡桐和白花泡桐的关系的探讨宜昌泡桐的分类地位历来存在争议:一种观点认为宜昌泡桐为兰考泡桐的变异类型(中国林业科学研究院泡桐组,1980);有观点认为它是川泡桐和白花泡桐杂交种(陈志远等,2000),胡惠蓉等(1995)综合它们的花粉特征并结合地理分布也得出了相同的结论,而马浩等(2001)RFLP分析的结果将宜昌泡桐与白花泡桐、川泡桐聚为一组,也支持了这一观点。本研究运用ISSR技术对四者的遗传关系进行研究,聚类分析结果(图 2),宜昌泡桐既不与兰考泡桐聚在一个亚群中,也不与白花泡桐、川泡桐聚在同一个大组中,这表明四者间的亲缘关系较远,与上述观点不一致,有待进一步试验探讨。
3.4 泡桐属种的特异条带将进一步转化为SCAR标记泡桐属植物外部形态相似,非专业人员很难正确区分各个种或变种,最早人们主要以花冠颜色、叶背绒毛的稀疏为依据,但这些特征不稳定,应用上非常困难。本研究9个引物所扩增的9个特异条带的组合可以用于快速鉴别毛泡桐、川泡桐、白花泡桐和兰考泡桐4个种,其中白花泡桐扩增的特异带P810-950 bp、P855-850 bp均已经在后续试验中的不同种源和形态变异类型材料中扩增出,下一步通过克隆、测序、设计引物,将其转化成更稳定的SCAR标记,以利于更快速、准确地鉴定泡桐属植物材料。而毛泡桐、川泡桐等扩增出的特异带,虽然它们都在本研究的毛泡桐1、毛泡桐2、川泡桐中扩增出各自的特有条带,但要将其确定为种或变种的特异标记,还需通过更多的毛泡桐和川泡桐的相应材料进一步研究验证。
| [1] |
苌哲新,史淑兰.1989.中国泡桐属新植物.河南农业大学学报,23(1):53-58.( 1) 1)
|
| [2] |
陈志远.1995.泡桐属1新种.华中农业大学学报,14(2):191-194.( 1) 1)
|
| [3] |
陈志远.1983.泡桐属(Paulownia)花粉形态学的初步研究.武汉植物学研究,1(2):143-146.( 2) 2)
|
| [4] |
陈志远.1986.泡桐属(Paulownia)分类管见.华中农业大学学报,5(3):261-265.( 1) 1)
|
| [5] |
陈志远,姚崇怀,胡惠蓉,等.2000.泡桐属的起源、演化与地理分布.武汉植物研究,18(4):325-328.( 7) 7)
|
| [6] |
洑香香,赵虎,王玉.2011.松属近缘种形态和分子鉴定及其亲缘关系探讨.林业科学,47(10):51-58.( 1) 1)
|
| [7] |
龚彤.1976.中国泡桐属植物的研究.植物分类学报,14(2):38-50.( 1) 1)
|
| [8] |
龚本海.1994.泡桐属植物SOD同工酶和可溶性蛋白质分析.华中农业大学学报,13(5):527-529.( 2) 2)
|
| [9] |
胡惠蓉,陈志远.1995.泡桐研究进展.北京:中国林业出版社,226-230,239-243,220-225.( 1) 1)
|
| [10] |
付燕,罗楠,杨芩,等.2009.枇杷属植物遗传多样性的ISSR反应体系的建立和优化.果树学报,26(2):180-185.( 1) 1)
|
| [11] |
蒋建平.1990.泡桐栽培学.北京:中国林业出版社.( 4) 4)
|
| [12] |
梁作侑,陈志远.1996.泡桐属植物CAT、AWYI、ADH同工酶研究.武汉:华中农业大学硕士学位论文.( 1) 1)
|
| [13] |
卢龙斗,谢龙旭,杜启艳.2001.泡桐属七种植物的RAPD分析.广西植物,21(4):335-338.( 1) 1)
|
| [14] |
李芳东,袁德义,莫文娟.等.2011.白花泡桐种源遗传多样性的ISSR分析.中南林业科技大学学报,31(7):1-7( 1) 1)
|
| [15] |
马浩,张冬梅,李荣幸,等.2001.泡桐属植物种类的RFLP分析.植物研究,21(1):136-139.( 2) 2)
|
| [16] |
莫文娟,袁德义,李芳东,等.2011.白花泡桐种源的遗传多样性和遗传分化研究.植物研究,31(5):585-591( 1) 1)
|
| [17] |
乌云塔娜,张党权,谭晓风.2003.梨不同DNA提取方法的效果研究.中国生物工程杂志,23(7):98-101.( 1) 1)
|
| [18] |
王永清,付燕,杨芩,等.2010.枇杷属植物遗传多样性的ISSR分析.林业科学,46(4):49-57.( 1) 1)
|
| [19] |
袁德义,何小勇,莫文娟,等.2008.朱砂根ISSR反应体系的建立与优化.浙江林业科技,28(4):60-62.( 1) 1)
|
| [20] |
张存义,赵裕后.1995.泡桐属一新天然杂种---圆冠泡桐.植物分类学报,33(5):503-505.( 1) 1)
|
| [21] |
中国林学会泡桐文集编委会.1982.泡桐文集.北京:中国林业出版社,1-10.( 1) 1)
|
| [22] |
中国林业科学研究院泡桐组.1980.泡桐研究.北京:农业出版社,7-28.( 1) 1)
|
| [23] | 中国科学院中国植物志编辑委员会.1979.中国植物志:67卷.北京:科学出版社,33-40. |
| [24] |
竺肇华.1981.泡桐属植物的分布中心及区系成分的探讨.林业科学,19(3):271-280.( 1) 1)
|
| [25] |
Arcade A,Anselin F,Rampant P F,et al.2000.Application of AFLP,RAPD and ISSR markers to genetic mapping of European and Japanese larch.Theor Appl Genet,1 00(2):299-307.( 1) 1)
|
| [26] |
Chokchaichamnankit P,Chulalaksananukul W,Phengklai C,et al.2008.Species and genetic diversity of Fagaceae in Northern Thailand based on ISSR markers.Journal of Tropical Forest Science,20(1):8-18.( 1) 1)
|
| [27] |
Elmeer K,Almalki A.2011.DNA finger printing of Prosopis cineraria and Prosopis juliflora using ISSR and RAPD techniques.American Journal of Plant Sciences,2:527-534.( 1) 1)
|
| [28] |
Ferguson M E,Burow M D,Schulze S R,et al.2004.Microsatellite identification and characterization in peanut (A.hypogaea L.).Theoretical and Applied Genetics,108(6):1064-1070.( 1) 1)
|
| [29] |
He G H,Meng R H,Newman M,et al.2003.Microsatellites as DNA markers in cultivated peanut (Arachis hypogaea L.).BMC Plant Biology,3:3.( 1) 1)
|
| [30] |
Mattioni C,Casasoli M,Gonzalez M,et al.2002.Comparison of ISSR and RAPD markers to characterize three Chilean Nothofagus species.Theor Appl Genet,104(6/7):1064-1070.( 1) 1)
|
| [31] |
Rohlf F J.2000.Statistical power comparisons among alternative morphometric methods.Am J Phys Anthropol,111(4):463-478.( 1) 1)
|
| [32] |
Zietkiewicz E,Rafalski A,Labuda D.1994.Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification.Genomics,20(2):176-183.( 1) 1)
|
 2013, Vol. 49
2013, Vol. 49

