文章信息
- 张亚波, 吴盼盼, 王鹏, 刘剑, 徐天森, 王浩杰, 舒金平
- Zhang Yabo, Wu Panpan, Wang Peng, Liu Jian, Xu Tiansen, Wang Haojie, Shu Jinping
- 一株绿僵菌的鉴定及其生物学特性
- Identification and Biological Characteristics of A Metarhizium pingshaense Strain Isolated from Melanotus cribricollis Larva
- 林业科学, 2012, 48(12): 134-140.
- Scientia Silvae Sinicae, 2012, 48(12): 134-140.
-
文章历史
- 收稿日期:2011-12-17
- 修回日期:2012-03-01
-
作者相关文章
筛胸梳爪叩甲(Melanotus cribricollis)是浙江笋用林内昆虫的优势种群,其幼虫(即金针虫)是笋期主要害虫之一,在湖州市的德清和安吉、杭州市的余杭和临安等重要竹区的早园竹(Phyllostachys praecox)林中,鲜笋带虫率可达62%,种笋受害率更是高达80%以上,严重制约了当地竹产业的健康发展(徐天森,2004)。由于金针虫营地下生活,防治一直是竹笋生产管理的难点。化学防治会导致竹笋等森林食品及环境污染,曾造成上海市场拒收浙江某县的早园竹笋,致使以“生态、绿色”为标签的笋产业有崩溃的可能。因此,寻求安全、高效、环境友好的竹林叩甲的防治方法显得尤为重要。
绿僵菌(Metarhizium spp.)是一种分布广泛、寄主多样的昆虫病原真菌,由Sorokin根据Metchnikof确定的金龟子虫霉(Entomophthoro anisopliae)转属而建立(Tulloch,1976),有关属种的数目及描述,由于不同研究者所采用的标本并非同一模式,在描述中其形态特征均有小的改动,致使该属的研究中出现了许多争议(金玉荣等,2009)。平沙绿僵菌(M. pingshaense)是郭好礼等(1986)从甘蔗金龟子(Alissonotum sp.)幼虫上分离并定名。因为平沙绿僵菌的ITS序列和形态与金龟子绿僵菌(M. anisopliae)相似,Huang等(2005)认为平沙绿僵菌为金龟子绿僵菌的同种异名。Bischoff等(2009)认为ITS序列不适于作为绿僵菌属真菌的分类依据,并基于多基因系统发育分析的结果及平沙绿僵菌分生孢子常常大于金龟子绿僵菌的特点,重新启用了平沙绿僵菌。
绿僵菌属真菌已广泛用于多种农林害虫的防治(程美真等,1995;Roberts et al., 2004;詹儒林等,2007;何学友等,2008)。大量研究表明:同一种绿僵菌不同来源的菌株其生物学特性及致病力都存在明显差异(陈祝安等,1997;1998;孙家宝等,2007;Ansari et al., 2009)。因此,一种生防菌株在生产和应用前,系统掌握其生物学特性具有重要意义。本研究以筛胸梳爪叩甲幼虫高毒力生防菌株WP08为研究对象(王鹏等,2010),利用形态学结合分子生物学方法对其进行鉴定,并分别测定了不同培养基、温度、pH值等对其生长及产孢的影响,为该菌株的开发和应用提供理论依据。
1 材料与方法 1.1 供试菌株绿僵菌WP08菌株[王鹏等(2010)文中菌株名称WP为误写]从筛胸梳爪叩甲幼虫僵虫上分离,已提交至中国科学院微生物菌种保藏中心(CGMCC No.4226) 专利保存。
1.2 培养基和试剂培养基为PDA、PPDA、SDA和SMAY(张永军等,2001)。Taq DNA聚合酶购自TaKaRa公司;PCR引物合成及序列测定由上海生工生物工程有限公司完成。
1.3 寄生菌的分离和观察取染病的叩甲幼虫僵虫,用灭菌手术刀刮取孢子粉放入无菌水中,充分摇匀后分别稀释10,100,1 000倍,将稀释后孢子粉悬浊液涂布绿僵菌选择性培养基的表面,于25 ℃恒温箱倒置培养。3天后开始观察菌落形态。
1.4 分子生物学鉴定1) EF-1α-5′序列的PCR扩增及测序 将菌株WP08接种PPDA平板,25 ℃下培养14天,刮取孢子,液氮研磨后,利用CTAB法提取总DNA。以之为模板,采用引物EF1T (5′-ATGGGTAAGGARGACAAGAC-3′)与EF2T (5′-GGAAGTACCAGTGATCATGTT-3′)进行PCR扩增(Rehner et al., 2005)。PCR反应体系共25.0 μL,其中DNA模板1.0 μL ( < 1 μg),EF1T (10 pmol·μL-1) 0.3 μL,EF1T (10 pmol·μL-1)0.3 μL,10×Buffer缓冲液(无Mg2+)2.5 μL,Mg2+ (25 mmol·L-1)1.5 μL,dNTP(2.5 mmol·L-1)1.5 μL,Taq聚合酶(2.5 U·μL-1)0.15 μL,dd H2O 17.75 μL。PCR扩增条件:94 ℃ 5 min,94 ℃ 40 s、54 ℃ 40 s、72 ℃ 30 s共30个循环,72 ℃ 10 min。PCR产物用1.0%的琼脂糖电泳检测。由上海生工生物工程技术有限公司测序。
2) 序列分析 将获得的EF-1α基因5′序列提交GenBank数据库,同时在GenBank数据库中进行Blast分析,找出与之有最大相似性的几个序列,并下载其他几种代表绿僵菌的相关序列(表 1)(Bischoff et al., 2009)。将下载的序列分别和本研究中的序列用ClustalX 1.81进行多序列对齐排列,然后用BioEdit软件手工修改,利用Phylip3.5通过距离分析法构建系统树。
|
|
1) 分生孢子悬浮液的配制 在无菌条件下,挑取少量分生孢子粉,加10 mL的0.05%吐温-80溶液配制成孢子悬浮液,振荡混匀后用血球计数板测定悬浮液中分生孢子的浓度,并适当调整至108个·mL-1。
2) 不同培养基上菌落的形态特征 各取1 μL孢子悬浮液分别点接于PDA、PPDA、SMAY和SDA培养基平板上,置于25 ℃恒温培养14天(QHX-300BS-Ⅲ,上海新苗医疗器械制造有限公司),观察记录菌落特征。每个处理3个重复。
3) 不同温度对WP08菌株菌丝生长及产孢的影响 设15,20,25,30 ℃共4个处理,每个处理5个重复,取5 μL孢子悬液滴入培养基中央,用十字交叉法每2天测量1次菌落直径。14天后用5 mm的打孔器从培养皿中心依次打孔至菌落边缘,然后放入小烧杯中,加0.1%吐温-80的无菌水20 mL,搅拌均匀后用血球计数板测定孢子数。每个处理3个重复。
4) 不同温度对WP08菌株孢子萌发的影响 在具有PPD液体培养基(PPDA培养基除去琼脂)的凹玻片上滴入50 μL孢子悬液,将凹玻片放在垫有湿润滤纸的培养皿中,分别置于15,20,25,30 ℃恒温培养箱中培养,每隔12 h观察1次。每个处理3个重复。
5) 不同时间紫外光对孢子萌发的影响 将孢子悬液滴在PPDA培养基上,用无菌的涂布器将孢子涂布在培养基上。放在超净工作台(VS-840K-U苏净安泰)距18 W紫外灯50 cm处分别照射0,5,10,15,20,30 min,25 ℃恒温培养,每隔8 h观察孢子萌发率。每个处理3个重复。
6) 不同pH值对孢子萌发的影响 向载有40 μL PPD液体培养基和孢子悬液的凹玻片中,滴入10 μL已经测定pH值的缓冲液(李亚玲,2007),使得液体培养基的pH值达到3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0等8个梯度。放在垫有湿润滤纸的培养皿中25 ℃恒温培养,统计12 h和24 h后的孢子萌发率。每个处理3个重复。
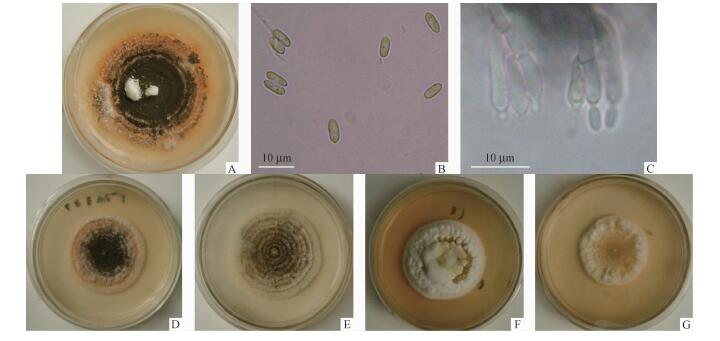
2 结果与分析 2.1 致病菌的形态特征致病菌在PPDA培养基25 ℃培养,培养初期菌丝白色,随菌落逐渐扩大,中央产生绿色分生孢子层(图 1-A,B,C),培养至后期该类型菌株分生孢子层颜色变灰。在显微镜(蔡司生物显微镜Primo Star)下观察菌丝分枝,具隔,无色光滑,宽1.5~2.5 μm;小梗密生整齐,分生孢子梗与菌丝近似,宽2.0~3.0 μm,分枝顶端具2~4个柱形的产孢细胞,大小为(7.2~15.5) μm×(2.0~3.0) μm,分生孢子团块牢固、排列整齐,分生孢子长椭圆形,链状排列,分生孢子链连接点基本在同一中心轴上;单个分生孢子无色,两端钝圆,大小为(6.0~8.0) μm×(2.2~3.1) μm(图 1)。菌落、菌丝、产孢细胞和分生孢子等形态特征与郭好礼(1986)和Bischoff等(2009)描述的平沙绿僵菌基本一致,因而可将这些菌株鉴定为平沙绿僵菌。
|
图 1 绿僵菌WP08菌株形态特征(A-C)及在不同培养基上的菌落形态(D-G) Fig.1 Morphological feature of spores and colony morphology on the different media for strain WP08 A:主要培养特征Cultural characters of strain WP08; B:分生孢子Conidiospora; C:产孢子小梗Conidiophore;D: PPDA; E: PDA; F: SMAY; G: SDA. |
采用CTAB法分别提取致病菌的总DNA,对菌株的EF-1α基因5′序列进行扩增,获得一条717 bp片段。将该序列输入到GenBank数据库中进行Blast分析,返回的序列中平沙绿僵菌CBS 257.90(EU248850),平沙绿僵菌ARSEF 7929(EU248850) 与本研究的最大序列相似性为100%,紧随其后的25个序列均为平沙绿僵菌。将表 1中其他绿僵菌的EF-1α-5′序列用距离分析法构建系统树(图 2),在系统树中可以发现WP08菌株与平沙绿僵菌聚到了一起,与其他种明显分开。该结果正好与形态学鉴定结果相一致,进而在分子水平上也支持WP08菌株为平沙绿僵菌。
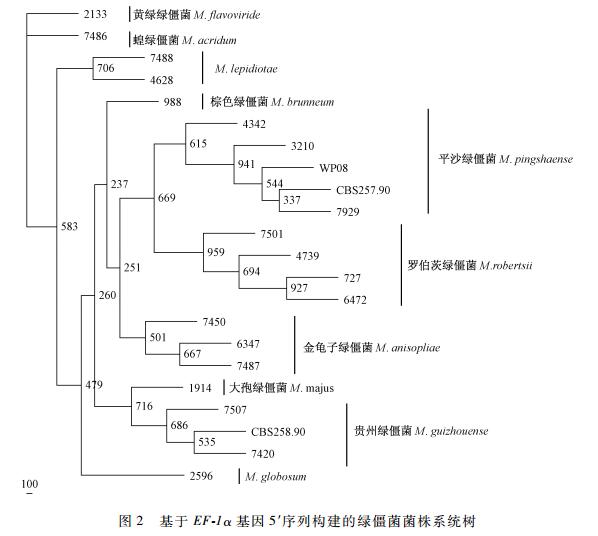
|
图 2 基于EF-1α基因5′序列构建的绿僵菌菌株系统树 Fig.2 Evolution tree of the different Metarhizium strains based on the 5′ end of EF-1α sequences |
1) 不同培养基上菌落的形态特征WP08菌株在PDA培养基上菌落初为白色,菌丝稀疏,以后逐渐扩大,其上产生稀疏、暗绿色的分生孢子层并呈环状分布;在PPDA培养基上菌落边缘白色,菌丝浓密,中央产生暗绿色、厚而密的分生孢子层;在SDA培养基上菌落白色,呈棉絮状,无明显分生孢子层,培养至后期菌落中央分散有零星状孢子堆;在SMAY培养基上菌落白色,次生菌丝发达,无明显分生孢子层。该菌株在PDA或PPDA培养基上培养至后期,分生孢子层颜色均变得更暗,最终呈橄榄色(图 1-D,E,F,G)。
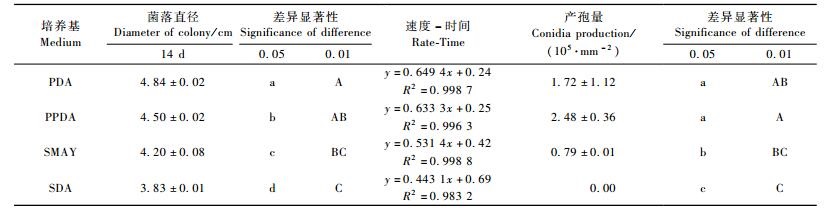
2) 不同培养基对WP08菌株菌丝生长及产孢的影响在4种培养基上WP08菌株菌丝均生长良好,在PDA培养基上菌落生长最快,显著大于其他3种培养基上的菌落直径,其次为PPDA培养基,SDA培养基最差。WP08菌株在PPDA培养基上产孢量最高,其次为PDA培养基,SDA培养基最差,产孢量极少,无法统计(表 2)。
|
|
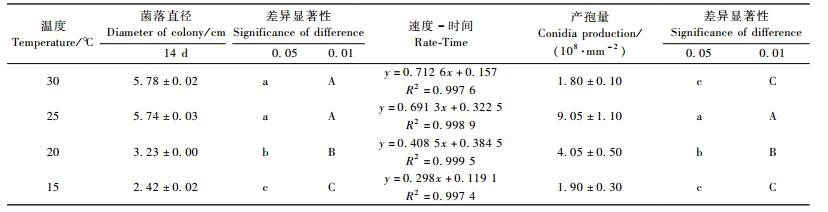
3) 不同温度对WP08菌株菌丝生长及产孢的影响该菌株具有较宽的温度生长范围,在测试的温度范围内(15~30 ℃)均可生长,但不同温度下该菌株营养生长量和产孢量明显不同。WP08菌株在25~30 ℃条件下营养生长量较好,生长速度与时间呈较好的线性关系(R2>0.90),30 ℃下菌株的斜率最大,说明生长速度最快;其次为25 ℃条件下,两者之间营养生长差异不显著;在15和20 ℃条件下,菌落生长显著缓慢。WP08菌株25 ℃条件下产孢量最高,极显著高于30,20和15 ℃条件下的产孢量。其次为20 ℃条件下产孢量,30 ℃产孢量最低(表 3),说明25~30 ℃有利于该菌株的营养生长,25 ℃有利于产孢,温度过高过低均不利于产孢。
|
|
4) 不同温度对WP08菌株孢子萌发的影响在4个温度梯度下的孢子萌发率表明:温度对孢子萌发具有明显的影响,虽然4个温度下孢子均可以萌发,但是在25 ℃和30 ℃条件下12 h的孢子萌发率均在96%以上,显著高于其他温度下孢子萌发率,且两者之间孢子萌发率差异不显著。15 ℃条件下萌发率最低(表 4)。
|
|
5) 紫外光对WP08菌株孢子萌发的影响绿僵菌孢子经紫外光照射不同时间后,其萌发结果表明:随着照射时间的延长紫外光对孢子的萌发具有明显的抑制作用,且延迟了起始萌发时间。对照处理6 h开始萌发,24 h孢子萌发率达到97.5%;紫外光照射5~15 min的处理12 h开始萌发,20 min的处理24 h以后孢子才有少量开始萌发;各处理24 h的孢子萌发率均明显低于对照处理(图 3)。
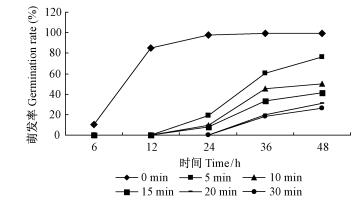
|
图 3 不同紫外光照射时间下的孢子萌发率 Fig.3 Effect of time exposed to UV light on spore germination rate of WP08 |
6) 不同pH对孢子萌发的影响该菌株分生孢子适宜在中性条件下萌发,pH值为7的情况下孢子萌发率最高,12 h和24 h后萌发率为73.3%和98%。随着pH值的升高和降低,孢子萌发率都逐渐降低,在pH值为3的情况下,24 h孢子尚未萌发(图 4)。
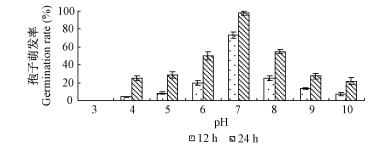
|
图 4 不同pH值下的孢子萌发率 Fig.4 Effect of different pH media on spore germination rate of WP08 |
关于绿僵菌的分类一直是众多学者研究的热点,单纯依靠形态特征来对绿僵菌属种进行分类,很难将绿僵菌相近的种区分开来,利用分子生物学的研究技术解决了绿僵菌属近缘种的分类疑题。Tulloch(1976)将绿僵菌划分为金龟子绿僵菌、黄绿绿僵菌和白色绿僵菌(M.album)3个种,金龟子绿僵菌分为2个变种。Drive等(2000)共测定了121株绿僵菌菌株的ITS1-5.8S-ITS2 rDNA序列,并构建了系统发育树,得到一个具有10个明显分支的进化树,但是,其研究未把在我国发表的4个绿僵菌新种即戴氏绿僵菌(M.taii)、柱孢绿僵菌(M.cylindrospore)、贵州绿僵菌和平沙绿僵菌包含在内,Huang等(2005)对上述来自中国且未被Drive等(2000)研究的种进行系统发育研究,认为平沙绿僵菌与金龟子绿僵菌应为同物异名,取消了平沙绿僵菌。但是,Bischoff等(2009)认为仅仅以ITS来分析绿僵菌的系统发育非常有限,不能有效区分绿僵菌的近缘种,他采用EF-1α, RPB1, RPB2和β-tubulin多基因进化的方法结合形态学特征对金龟子绿僵菌及其近缘种进行了详尽的研究,重新对金龟子绿僵菌及其近缘种进行了划分,是继Driver等(2000)后最为全面的研究。他取消了金龟子绿僵菌变种的划分,并认为绿僵菌属一共包含13个种,其中重新启用了平沙绿僵菌。菌株WP08为本实验室在2008年分离,利用形态学特征结合ITS序列分析曾将其鉴定为金龟子绿僵菌小孢变种[M.anisopliae(Metsch.)Sorok in var.anisopliae Tulloch](王鹏等,2010),后因金龟子绿僵菌及其近缘种的重新划分,且ITS序列在绿僵菌分类上的局限性,笔者认为有必要对该菌株进行重新研究。本研究通过测定WP08菌株的EF-1α的序列并构建了系统树,结果表明该菌株与平沙绿僵菌聚到一起,形态学与分子生物学2种方法鉴定结果相一致,进一步证明了该菌株为平沙绿僵菌。目前普遍认为EF-1α的序列在形态学研究的基础上可以有效地区分绿僵菌的近缘种。
营养和温度对昆虫病原真菌菌株生长和产孢都有很大影响。供试的4种培养基中,PDA培养基上WP08菌株菌丝生长最快,略高于PPDA培养基(表 2)。但是,其菌丝密度和产孢量低于PPDA培养基。在林间实际应用过程中主要以分生孢子作为感染源,最适培养基的标准取决于产孢量的大小,因此,在菌落生长速率相当的情况下,PPDA是WP08菌株的最适培养基。pH值为7的情况下孢子萌发率最高。随着照射时间的延长紫外光对孢子的萌发具有明显的抑制作用,并且延迟了开始萌发的时间。
适于WP08菌株菌丝生长的温度条件很宽,在15~30 ℃范围内(因夏季林间10~20 cm土壤的温度低于30 ℃,故未对30 ℃以上的温度进行研究),菌丝生长随温度的升高而加快。林华峰(2006)研究绿僵菌大孢变种和绿僵菌小孢变种2个菌株的生物学特性,认为最适宜生长和产孢的温度为25 ℃。王宝辉等(2009)研究绿僵菌MS01菌株的生物学特性,认为25~30 ℃适合营养生长,最适温度为26 ℃,产孢最适温度为25~28 ℃。本试验中的WP08菌株鉴定为平沙绿僵菌,其生物学特性尚不明确,该菌株在25和30 ℃下菌丝生长和孢子萌发率差异不显著,虽然30 ℃菌落扩张速度比较快,但是菌落以气生菌丝为主,在大面积的菌落之中只有少量孢子产生,表明30 ℃已经不利于菌株的生殖生长。王鹏(2010)在研究不同温度条件下WP08菌株对筛胸梳爪叩甲幼虫的致病力时发现,25 ℃条件下与30 ℃条件下的试虫累计死亡率曲线和LT50比较接近,30 ℃条件下筛胸梳爪叩甲幼虫死亡率略高,与本试验的生物学特性研究结果相符,说明30 ℃条件下菌丝生长较快、孢子开始萌发时间早、萌发率高等因素有利于该菌株感染其寄主。在研究过程中发现15~20 ℃条件下孢子萌发率不足40%,而在实际环境中筛胸梳爪叩甲幼虫活动高峰期10~20 cm土温平均值为20 ℃,因此如何提高绿僵菌在低温下的营养生长和孢子萌发率将成为下一步研究工作的重点。
| [] | 陈祝安, 冯惠英, 潘玲聪. 1998. 不同来源绿僵菌对稻水象甲生物测定. 吉林农业大学学报, 20(增刊): 132. |
| [] | 陈祝安, 黄基荣. 1997. 不同来源绿僵菌对云斑金龟蛴螬致病力评价. 微生物学通报, 24(2): 81–83. |
| [] | 程美真, 张玉琢, 陈祝安, 等. 1995. 绿僵菌防治豆田蛴螬小区试验. 中国生物防治, 11(4): 165–167. |
| [] | 郭好礼, 叶柏龄, 岳莹玉. 1986. 绿僵菌属的三个新种. 真菌学报, 5(3): 177–184. |
| [] | 何学友, 蔡守平, 余培旺, 等. 2008. 金龟子绿僵菌MaY'I'TR. 04菌株对松墨天牛成虫的致病力.昆虫学报, 51(1): 102–107. |
| [] | 金玉荣, 殷宏, 罗建勋. 2009. 生防绿僵菌研究进展. 安徽农业科学, 37(5): 2060–2062. |
| [] | 李亚玲. 2007. 嗜热真菌热稳定纤维素酶分离纯化及基因的克隆与表达. 山东农业大学博士学位论文, 54-55. |
| [] | 林华峰, 李世广, 张磊, 等. 2006. 绿僵菌大孢变种的生物学特征及其对蛴螬的毒力研究. 应用生态学报, 17(2): 351–353. |
| [] | 孙家宝, 邓勋, 宋小双. 2007. 金龟子绿僵菌的生物学特性及毒力测定. 中国林副特产(3): 17–19. |
| [] | 孙家宝, 邓勋, 宋小双. 2007. 金龟子绿僵菌的生物学特性及毒力测定. 中国林副特产(3): 17–19. |
| [] | 王宝辉, 郑建伟, 黄大庄, 等. 2009. 绿僵菌MS01菌株的生物学特性及在不同温湿度下对光肩星天牛幼虫的致病力. 林业科学, 45(9): 158–162. DOI:10.11707/j.1001-7488.20090927 |
| [] | 王鹏, 张亚波, 舒金平, 等. 2010. 金龟子绿僵菌小孢变种对筛胸梳爪叩甲幼虫致病力的生物测定. 中国生物防治, 26(3): 274–279. |
| [] | 徐天森. 2004. 中国竹子主要虫害. 北京, 中国林业出版社: 26-27-45-50. |
| [] | 詹儒林, 覃伟权, 宋妍, 等. 2007. 海南椰心叶甲病原菌金龟子绿僵菌的分离、鉴定及其生防潜力. 生态学报, 27(4): 1558–1562. |
| [] | 张永军, 王中康, 殷幼平, 等. 2001. 球孢白僵菌的生物学特性及对小麦蚜虫的毒力. 西南农业大学学报, 23(2): 144–146. |
| [] | Ansari M A, Evans M, Butt T M. 2009. Identification of pathogenic strains of entomopathogenic nematodes and fungi for wireworm control. Crop Protection, 28(3): 269–272. DOI:10.1016/j.cropro.2008.11.003 |
| [] | Bischoff J F, Rehner S A, Humber R A. 2009. A multilocus phylogeny of the Metarhizium anisopliae lineage. Mycologia, 101(4): 512–530. DOI:10.3852/07-202 |
| [] | Driver F, Milner R J, Trueman W H. 2000. A taxonomic revision of Metarhizium based on a phylogenetic analysis of rDNA sequence data. Mycological Research, 104(2): 134–150. DOI:10.1017/S0953756299001756 |
| [] | Huang B, Humber R A, Li S, et al. 2005. Further notes on the molecular taxonomy of Metarhizium.. Mycotaxon, 94: 181–187. |
| [] | Rehner S A, Buckley E. 2005. A Beauveria phylogeny inferred from nuclear ITS and EF1-α sequences: evidence for cryptic diversification and links to Cordyceps teleomorphs. Mycologia, 97(1): 84–98. |
| [] | Roberts D W, St Leger R J. 2004. Metarhizium spp., cosmopolitan insect-pathogenic fungi: mycological aspects. Advances in Applied Microbiology, 54: 1–70. DOI:10.1016/S0065-2164(04)54001-7 |
| [] | Tulloch M. 1976. The genus Metarhizium.. Transactions of the British Mycological Society, 66(3): 407–411. DOI:10.1016/S0007-1536(76)80209-4 |
 2012, Vol. 48
2012, Vol. 48