文章信息
- 柏新富, 卜庆梅, 谭永芹, 朱建军
- Bai Xinfu, Bu Qingmei, Tan Yongqin, Zhu Jianjun
- 植物4种水势测定方法的比较及可靠性分析
- Comparison and Analysis of Four Methods Used in Measuring the Plant Water Potential
- 林业科学, 2012, 48(12): 128-133.
- Scientia Silvae Sinicae, 2012, 48(12): 128-133.
-
文章历史
- 收稿日期:2011-11-14
- 修回日期:2012-11-06
-
作者相关文章
水势是植物细胞和组织的重要水分生理参数之一,水势大小影响着植物的代谢、生长发育及抗逆性,也是合理灌溉的生理指标(李德全等, 1990)。目前国内在教学、科研中植物水势的测定主要采用小液流法、压力势法、热电偶法和木质部压力探针法。小液流法和压力室法测定水势简便易行,但2种方法都存在难以克服的弊端(王军等, 1997)。热电偶法测定水势具有应用范围广、使用样品量少等优点,被广泛用于水势的测定(荆家海等, 1986; Wilson et al., 1999; 付爱红等, 2010; Martínez et al., 2011)。依据热电偶测定露点的原理设计生产的露点水势仪(dew point potential meter)在测定方法上有活体原位测定法和叶圆片离体测定法2种,国际上2种方法均有研究者采用,但以叶圆片离体测定法使用较多(Hirasawa et al., 1998; Itani et al., 1999; Londersa et al., 2005; Ribeiro et al., 2009; Martinez et al., 2011)。有研究者在使用露点水势仪-离体叶圆片法测定植物水势时出现了低于-10 MPa(占东霞等, 2011)、-16 MPa(杨丽娟等, 2009)、甚至低于-50 MPa(庄丽等, 2006)的超低值。普通植物包括荒漠植物胡杨(Populus euphratica)等水势能够达到如此之低,还是对水势仪的使用和测定方法存在问题值得探讨与商榷。木质部压力探针(xylem pressure probe)技术是目前唯一可以直接测定木质部负压的方法(Benkert et al., 1995; 刘小芳等, 2008),但由于测定技术要求较高,国内仅朱建军等(2005)和柏新富等(2009)进行过实际测定。本文对几种常用的水势测定方法:小液流法、压力室法、露点水势仪活体原位测定法(原位法)和露点水势仪离体叶圆片测定法(叶圆片法)等的测定结果及特点进行比较分析,并对叶圆片法测定存在的问题进行探讨,为植物水势测定方法的选择提供参考。
1 材料与方法 1.1 试验材料选择鲁东大学校园内自然生长的连翘(Forsythia suspensa)、国槐(Sophora japonica)、红叶石楠(Photinia fraseri),以及溶液培养的陆地棉(Gossypium hirsutum)为试验材料。
1.2 测定方法1) 小液流法和压力室法参照邹琦(2000)的方法进行。2) 原位测定法和叶圆片法利用美国Wescor公司生产的HR-33-T-R型露点水势仪测定。原位测定法将L-51A-SF活体叶片水势测定计固定在叶片上(叶片局部用氧化铝粉轻轻打磨,去除蜡质和角质层),平衡30 min后开始测定;叶圆片法用打孔器取叶圆片并迅速放入C-52-SF样品室内,平衡一定时间后测定。
1.3 结果统计所有测定均重复5次,结果以“平均值±标准差”计。用Origin软件作图、SPSS进行统计分析。
2 结果与分析 2.1 4种方法对不同植物水势测定结果的比较利用4种水势测定方法(其中叶圆片法采用30,60 min 2种平衡时间)同时对连翘、国槐、红叶石楠和陆地棉植株水势的测定结果如图 1。叶圆片法测定结果显著低于其他3种方法,特别是上午水势较高时,叶圆片法(平衡30 min)测定的水势的绝对值为其他3种方法测定结果的约2倍,且叶圆片法2种平衡时间之间也存在明显差异(P < 0.05)。而小液流法、压力室法和原位测定法三者的测定结果总体上差异不大,只是小液流法测定的红叶石楠水势和连翘中午水势、陆地棉上午水势略高于其他2种方法的测定结果。

|
图 1 不同测定方法对4种植物水势的测定结果 Fig.1 Results of water potential measurements with different methods on four plants PC:压力室法Pressure chamber;PS:原位测定法Probe in situ;LD-30:叶圆片法,平衡30 min Leaf discs,equilibrium 30 minutes;LD-60:叶圆片法,平衡60 min Leaf discs,equilibrium 60 minutes;CM:小液流法The method of V.S. Chardakov数据柱上方的标记字母不同表示差异显著(P < 0.05) Significant differences (P < 0.05) were denoted with different letters. |
为了进一步比较4种水势测定方法的特点,在室内稳定环境条件下(温度26.5~27 ℃、相对湿度34.8%~35%、人工光照110~120 μmol·m-2s-1),以水培陆地棉为材料(其中叶圆片法平衡时间为120 min),对其1天中的水势变化(每隔2 h测定1次)进行测定(表 1)。由子室内环境较为稳定,不同时间的测定结果较为接近,但叶圆片法平衡120 min的测定结果的绝对值仍高于其他测定方法9.99%~23.60%。另外,对不同测定方法变异系数的计算显示,压力势法为4.54%~18.90%、原位测定法为2.95%~8.12%、叶圆片法为4.05%~11.01%、小液流法为4.52%~10.60%,说明压力室法测定的误差相对较大。
|
|
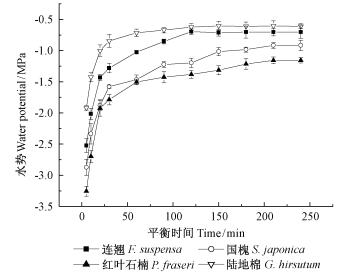
针对叶圆片法的测定结果(绝对值)偏大,且不同平衡时间测定结果存在明显差异的问题,研究者在利用叶圆片法测定水势时的平衡时间差异较大,平衡时间较短的有10~15 min(陈宗良等, 2007; 徐洪文等, 2008),多为30~60 min(胡继超等, 2004; 泮进明等, 2004; Londersa et al., 2005; 毛舒燕等, 2009),较长的时间为2 h(Itani et al., 1999; Ribeiro et al., 2009)和3 h(Hirasawa et al., 1998),最长的为4 h(付爱红等, 2010),还有研究取不同平衡时间多次测定结果的平均值作为叶片水势(刘静等, 2009)。本试验取4种植物的叶片采用叶圆片法在不同平衡时间测定其水势,结果如图 2。叶圆片法测定的水势绝对值在30 min以内呈直线快速升高,在30~120 min内上升速度变缓,平衡120 min以后连翘和水培陆地棉测定值达到平稳,国槐和红叶石楠在平衡240 min后才达到稳定。用叶圆片法测定水势时,平衡时间对测定结果影响很大,平衡时间在30 min以内的测定结果由于随平衡时间的不同变化太大而不具有参考价值,平衡时间在30~120 min测定结果随平衡时间的不同变幅减小,只有平衡时间达到120~210 min以上测定结果才趋于稳定(水势越低的植物需要的平衡时间越长)。但平衡时间过长,由于组织代谢的变化(叶圆片内淀粉水解等),也会影响水势测定结果的准确性(Bennett et al., 1986),因此,可以认为叶圆片法不能准确测定植物的实际水势值。
|
图 2 叶圆片法测定植物水势随平衡时间的变化 Fig.2 Variations of water potentials with equilibrium time with the leaf disc hygrometry |
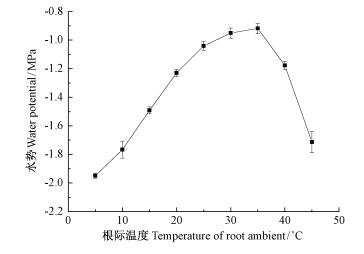
原位测定法具有不毁损植物材料和可连续测定的优点,本试验利用原位测定法连续测定水培陆地棉叶片水势随根际环境溶液渗透势(在Hoagland培养液中添加NaCl或PEG6000改变溶液渗透势)和根际环境温度(将植株根系浸入盛有Hoagland培养液的大烧杯中,再将大烧杯置于低温恒温水浴中,通过设定低温恒温水浴的温度改变植株根际环境温度)的变化。结果显示:NaCl和MA(甘露醇)诱导的根际环境溶液渗透势的降低均会引起叶片水势的下降,但在相同渗透势下,NaCl导致的叶片水势降低幅度更大(图 3)。根际环境温度变化导致的陆地棉叶片水势变化表现为:在5~35 ℃范围内叶片水势随着温度的升高而升高,当温度超过35 ℃时叶片水势急剧降低(图 4)。这种对同株植物多位点连续测定的结果只有利用活体原位测定法才能够得到,它能够真实地反映植株的水势变化情况。

|
图 3 陆地棉叶片水势随环境溶液渗透势的变化 Fig.3 Changes in water potential in leaves of cotton in response to changes in ambient osmotic potential |
|
图 4 陆地棉叶片水势随根际环境温度的变化 Fig.4 Changes in leaf water potential in leaves of cotton in response to changes in temperature of root ambient |
植物组织水势测定的小液流法是根据植物组织与环境溶液之间水分移动方向由水势差决定的原理,把植物组织放在已知浓度的外界溶液中,通过外界溶液的浓度变化情况来确定植物组织的水势。小液流法原理清晰、不需复杂的仪器设备、简便易行,至今国内大专院校植物生理学实验教学中仍普遍采用,科研工作中也在使用(关宏斌等, 2000; 王春虎等, 2006; 范苏鲁等, 2011)。但小液流法测水势由于被测量植物组织切口处受伤细胞内的可溶性内含物进入外界溶液,改变了样品测量管中溶液的浓度,影响测量的准确性(王军等, 1997),同时小液流法测水势的效率较低,限制了它在科学研究中的实际应用价值。
压力室法是通过测定木质部导管中的负压来测定水势的。在水分的散失和供应处于平衡状态时,叶细胞的水势等于导管中液柱的负压和导管汁液的渗透势之和,由于导管汁液渗透势的绝对值很小,一般认为木质部导管负压的大小基本上等于枝叶的水势。当叶柄或枝条被切断时,导管中的液柱在张力的作用下将从切口处迅速回缩到导管内部,同时张力消失。此时将叶子或带叶小枝切口朝外密封于压力室中,用高压气体给室内叶片逐渐加压,可使叶肉细胞重新排出水分,并进入导管中。当导管中的液体刚好回到原切口位置时,所施加的压力恰好与完整导管中的原始负压相等,这一压力值称作平衡压,平衡压标加负号就等于枝叶的水势(王万里, 1984)。压力室测水势的方法具有操作方便、测定快速等优点(李德全等, 1990),而且还可测出植物材料的压力容积曲线,并根据曲线的性质推出植物水分状况的多种参数及细胞壁的弹性特点等,目前在国际上被广泛运用(Mengel et al., 1982; Navarro et al., 2007; Parent et al., 2010; Johnson et al., 2011)。但压力室法对测量对象的外形、硬度有一定的要求,根或幼嫩枝条、叶片等软组织难以被测量,同时测量过程中水分散失过多,且测定结果也会因观察者的不同而有差异(Bahadur et al., 1995; 王军等, 1997)。因此,压力室法测定需严格防止材料的水分散失并避免不同观察者的差异,否则可能会使测量结果出现较大的误差。
活体原位测定法和离体叶圆片法都是利用热电偶精确测定样品室内水汽的露点温度的原理来测定组织水势的。将材料密闭在样品室内,样品室上方连有热电偶,样品室内材料的水分蒸发到样品室内,当达到水分平衡时,样品室中的相对湿度或露点温度与材料的水势线性相关,通过准确测出露点温度,即可求出材料的水势(龚明等, 1989)。两者的区别在于离体叶圆片法通过打取叶圆片放入样品室内进行测定,活体原位测定法则是将样品室固定在与植物体相连的叶片上进行测定。虽然目前2种方法都有不少研究者在使用,但叶圆片法具有无法弥补的缺点,一是叶圆片在打孔取样时造成周围细胞破损,细胞浆的污染改变了组织水势;二是叶片蜡质、角质层的存在和气孔因黑暗而关闭,热电偶和叶圆片之间的水分交换主要通过叶圆片周围的伤口部位进行,加之操作过程中伤口部位水分蒸发造成的破损细胞浆浓缩,将导致水势测定严重失真。有研究者用叶圆片法测定得到的植物组织低于-16 MPa(杨丽娟等, 2009)甚至-50 MPa(庄丽等, 2006)的超低水势值都是该方法无法弥补的缺点的实际体现。也有不少研究者通过延长平衡时间来弥补这些不足(Hirasawa et al., 1998; 付爱红等, 2010),但是在数小时的平衡时间内,叶圆片被密封在样品室内,由于组织代谢和缺氧等引起的变化必然会影响测定结果的准确性(Martinez et al., 2011),同时数小时的平衡时间也大大降低了测定效率。而活体原位测定法由于不用打叶圆片且测定时叶片处于正常状态,从而避免了叶圆片法的上述缺点。目前已有不少研究者在使用原位法测定叶片水势(Shackel et al., 1985; Campbell et al., 1999; 邓勋飞等, 2005; 徐林娟等, 2006),但该方法对测定技术要求较高,还需进一步的完善和普及。
综上所述,植物水势测定的小液流法操作简单,但由于被测量植物组织切口处受伤细胞内的可溶性内含进入外界溶液,改变了样品测量管中溶液的浓度,影响测量的准确性,而且测定效率较低。压力势法操作也较为简单,但对测量对象的外形、硬度有一定的要求,且测量过程中水分易散失,同时其结果会随观察者的不同而有差异,测量误差相对较大,但在样品重复数较多的情况下,其结果还是较为准确可靠。离体叶圆片法因受损细胞浆、角质、蜡质等的影响,平衡时间较短的测定结果与实际值相差很大,而平衡时间较长时又会由于组织代谢的变化而影响测定结果的准确性,因此,叶圆片法不能准确测定植物的实际水势值。活体原位测定法具有测定结果准确可靠、对植物没有损毁、可进行同一植株同一位点的连续测定、对测定对象没有严格要求、便于研究水势与环境因子及水势与其他生理指标之间的关系等优点,可用于除了针叶植物外各种有叶植物的水势测定,其不足之处是对测定技术要求相对较高。
| [] | 柏新富, 朱建军, 卜庆梅, 等. 2009. 盐胁迫对大豆根系木质部压力和Na+吸收的影响. 生态学报, 29(12): 6506–6511. DOI:10.3321/j.issn:1000-0933.2009.12.024 |
| [] | 陈宗良, 罗喜娜, 杨特武, 等. 2007. 不同施肥水平对水稻生育进程中功能叶光合性能及水势变化的影响. 华中农业大学学报, 26(6): 759–765. |
| [] | 邓勋飞, 张后勇, 何勇, 等. 2005. 水稻叶水势与不同水分处理定量关系研究. 浙江大学学报:农业与生命科学版, 31(5): 581–586. |
| [] | 范苏鲁, 苑兆和, 冯立娟, 等. 2011. 干旱胁迫对大丽花生理生化指标的影响. 应用生态学报, 22(3): 651–657. |
| [] | 付爱红, 陈亚宁, 李卫红. 2010. 温带荒漠区不同灌溉条件下的胡杨、俄罗斯杨水势变化分析. 科学通报, 55(6): 504–511. |
| [] | 龚明, 丁念诚, 刘友良. 1989. 用露点法和湿度法测定叶片水势及其组分. 植物学通报, 6(3): 182–187. |
| [] | 关宏斌, 王晓兰. 2000. 吉兰泰与乌梁素海两地盐土植物水势的测定及探讨. 内蒙古师大学报:自然科学(汉文)版, 29(1): 55–58. |
| [] | 胡继超, 姜东, 曹卫星, 等. 2004. 短期干旱对水稻叶水势、光合作用及干物质分配的影响. 应用生态学报, 15(1): 63–67. |
| [] | 荆家海, 肖庆德. 1986. 利用热电偶湿度计测定水势. 植物生理学通讯(1): 51–53. |
| [] | 李德全, 邹琦, 程炳篙. 1990. 测定植物组织水势的压力室法. 山东农业科学(3): 46–48. |
| [] | 刘静, 贺康宁, 韩磊. 2009. 黄土高原西部高寒区引进树种银水牛果叶水势研究. 水土保持研究, 16(5): 194–198. |
| [] | 刘小芳, 张岁岐, 杨晓青. 2008. 压力探针技术原理及其在植物水分关系研究中的应用. 干旱地区农业研究, 26(4): 172–179. |
| [] | 毛舒燕, 刘东焕, 姜闯道, 等. 2009. 水分胁迫条件下草莓克隆分株间水分调控及其对光合功能的影响. 生态学报, 29(12): 6446–6457. DOI:10.3321/j.issn:1000-0933.2009.12.017 |
| [] | 泮进明, 张颖萍, 苗香雯. 2004. 水势测定仪操作方法研究. 电子测量与仪器学报, 18(4): 51–62. |
| [] | 王春虎, 赵新亮, 王勇军, 等. 2006. 农大108等玉米品种幼苗阶段根水势的测定及抗旱性研究. 种子, 26(1): 34–36. |
| [] | 王军, 孟祥增. 1997. 热电偶水势测定仪. 传感器技术, 16(5): 41–45. |
| [] | 王万里. 1984. 压力室在植物水分状况研究中的应用. 植物生理学通讯(3): 52–57. |
| [] | 徐洪文, 宋凤斌. 2008. 两种基因型玉米苞叶水势比较研究. 华北农学报, 23(5): 181–184. DOI:10.7668/hbnxb.2008.05.039 |
| [] | 徐林娟, 邓勋飞, 陶国富, 等. 2006. 番茄NFT栽培系统中基于叶水势的合理供水研究. 浙江大学学报:农业与生命科学版, 32(3): 313–317. |
| [] | 杨丽娟, 王海洋, 严涛, 等. 2009. 10种重庆乡土植物幼苗耐旱性研究. 西南师范大学学报:自然科学版, 34(5): 121–128. |
| [] | 占东霞, 庄丽, 李卫红, 等. 2011. 准噶尔盆地南缘"丰收林"胡杨水势. 生态学杂志, 30(4): 643–649. |
| [] | 朱建军, 柏新富, 张萍, 等. 2005. 盐胁迫下大麦根系木质部压力的自调节现象. 植物生理与分子生物学学报, 31(1): 97–102. |
| [] | 庄丽, 陈亚宁, 李卫红, 等. 2006. 渗透胁迫条件下植物茎叶水势的变化—以塔里木河下游胡杨为例. 中国沙漠, 26(6): 1002–1008. |
| [] | 邹琦. 2000. 植物生理学实验指导. 北京, 中国农业出版社: 21-24. |
| [] | Bahadur R, Tripathi R P. 1995. Sampling procedure for measurement of xylem-water potential by pressure-chamber technique. The Indian Journal of Agricultural Sciences, 65(11): 803–831. |
| [] | Benkert R, Zhu J J, Zimmermann G, et al. 1995. Long-term xylem pressure measurements in the liana Tetrastigma voinerianum by means of the xylem pressure probe. Planta, 196(4): 804–813. DOI:10.1007/BF01106777 |
| [] | Bennett J M, Cortes P M, Lorens G F. 1986. Comparison of water potential components measured with a thermocouple psychrometer and a pressure chamber and the effects of starch hydrolysis. Agronomy Journal, 78(2): 239–244. DOI:10.2134/agronj1986.00021962007800020005x |
| [] | Campbell C S, Mclnnes K J. 1999. Response of in situ leaf psychrometer to cuticle removal by abrasion. Agronomy Journal, 91(5): 859–862. DOI:10.2134/agronj1999.915859x |
| [] | Hirasawa T, Nakahara M, Izumi T, et al. 1998. Effects of pre-flowering soil moisture deficits on dry matter production and ecophysiological characteristics in soybean plants under well irrigated conditions during grain filling. Plant Prod Sci, 1(1): 8–17. DOI:10.1626/pps.1.8 |
| [] | Itani J, Oda T, Numao T. 1999. Studies on mechanisms of dehydration postponement in Cassava leaves under short-term soil water deficits. Plant Prod Sci, 2(3): 184–189. DOI:10.1626/pps.2.184 |
| [] | Johnson D M, McCulloh K A, Meinzer F C, et al. 2011. Hydraulic patterns and safety margins, from stem to stomata, in three eastern US tree species. Tree Physiol, 31(6): 659–668. DOI:10.1093/treephys/tpr050 |
| [] | Londersa E, Ceustersa J, Vervaekea I, et al. 2005. Organic acid analysis and plant water status of two Aechmea cultivars grown under greenhouse conditions: implications on leaf quality. Scientia Horticulturae, 105(2): 249–262. DOI:10.1016/j.scienta.2005.01.033 |
| [] | Martínez E M, Cancela J J, Cuesta T S, et al. 2011. Review. Use of psychrometers in field measurements of plant material: accuracy and handling difficulties. Spanish Journal of Agricultural Research, 9(1): 313–328. |
| [] | Mengel K, Arneke W W. 1982. Effect of potassium on the water potential, the pressure potential, the osmotic potential and cell elongation in leaves of Phaseolus vulgaris. Physiologia Plantarum, 54(4): 402–408. DOI:10.1111/ppl.1982.54.issue-4 |
| [] | Navarro A, Baona S, Olmos E, et al. 2007. Effects of sodium chloride on water potential components, hydraulic conductivity, gas exchange and leaf ultrastructure of Arbutus unedo plants. Plant Science, 172(3): 473–480. DOI:10.1016/j.plantsci.2006.10.006 |
| [] | Parent B, Suard B, Serraj R, et al. 2010. Rice leaf growth and water potential are resilient to evaporative demand and soil water deficit once the effects of root system are neutralized. Plant, Cell & Environment, 33(8): 1256–1267. |
| [] | Ribeiro R V, Machado E C, Santos M G, et al. 2009. Photosynthesis and water relations of well-watered orange plants as affected by winter and summer conditions. Photosynthetica, 47(2): 215–222. DOI:10.1007/s11099-009-0035-2 |
| [] | Shackel K A, Brinckmann E. 1985. In situ measurement of epidermal cell turgor, leaf water potential, and gas exchange in Tradescantia virginiana L. Plant Physiology, 78(1): 66–70. DOI:10.1104/pp.78.1.66 |
| [] | Wilson K L, Carlson T Y, Bunce J A. 1999. Feedback significantly influences the simulated effect of CO2 on seasonal evapotranspiration from two agricultural species. Global Change Biology, 5(8): 903–917. DOI:10.1046/j.1365-2486.1999.00280.x |
 2012, Vol. 48
2012, Vol. 48

