文章信息
- 杨玲, 沈海龙, 张振全, 张军保, 张鹏
- Yang Ling, Shen Hailong, Zhang Zhenquan, Zhang Junbao, Zhang Peng
- 发育和冷层积过程中色木槭种子发芽能力与ABA含量的变化
- Changes in Endogenous Abscisic acid Content and Germination Ability of Acer mono Seeds during Seed Development and Cold Stratification
- 林业科学, 2012, 48(12): 116-121.
- Scientia Silvae Sinicae, 2012, 48(12): 116-121.
-
文章历史
- 收稿日期:2011-09-02
- 修回日期:2012-03-05
-
作者相关文章
2. 福建省林木种苗总站 福州 350003
2. General Administration of Tree Seeds and Seedlings of Fujian Province Fuzhou 350003
色木槭(Acer mono)又名色树、色木(东北)、五角槭、水色树等,属槭树科(Aceraceae)槭属(Acer)植物,落叶乔木,树高15~20 m,胸径可达30 cm,自然分布于我国东北、华北与长江流域中下游,朝鲜半岛、蒙古、东西伯利亚、日本亦有分布,为槭属树种中分布最为广泛的种(陈嵘,1937;高风华,2009)。色木槭树势优美,枝叶浓密,叶形秀丽,嫩叶红色,入秋变成橙黄或红色,是理想的行道树、城市绿化和庭园观赏树种,同时也是我国具有重要开发价值的药用、材用经济树种(李世全,1978;Kim et al., 1991;郭天亮等,2003)。
目前关于槭树属植物繁殖研究以有性繁殖为主。高风华(2009)曾对色木槭开花习性与幼果发育进行了观察和研究。色木槭种子具有休眠特性,种子播种前需要1~5 ℃低温湿沙层积处理(武禄光,1987;胡兴无等,2008)。种皮透水性不是色木槭种子休眠的主要原因,种子内含有的发芽抑制物质是导致色木槭种子休眠的主要原因(张军保等,2008)。低温(0~5 ℃)层积90天可解除色木槭种子休眠,层积过程中内源乙烯发生了规律性的变化,应用外源乙烯利,GA3,6-BA可不同程度地缩短低温层积日期,其中乙烯利最为有效(武禄光,1986)。色木槭种子经低温层积解除休眠的过程中过氧化物酶(POD)活性及其同工酶谱发生明显的变化(武禄光,1987)。稳定的冬季气温升高可以提高抗氧化酶活性,改善色木槭种子萌发以促进其更新(Qin et al., 2010)。使用0.3 g·L-1 ABT生根粉处理色木槭半木质化嫩茎段30 min,在1/2珍珠岩+1/2河沙扦插基质中扦插,可使插穗生根率达90%(李广祥等,2004)。顾地周等(2008)通过组织培养手段采用嫩茎节培养法成功获得色木槭的再生植株。Park等(2005)利用低温贮藏的方法实现了色木槭悬浮培养细胞的长期种质资源保存。
内源激素变化对种子胚发育过程中的代谢具有重要影响。脱落酸(ABA)、赤霉素(GA)、细胞分裂素(CTK)是与种胚发育密切相关的因子(曹帮华等,2006)。在种子休眠和萌发过程中GA和(或)ABA起决定性作用(Hilhorst et al., 1992;Hilhorst,1995)。ABA可促进储藏蛋白积累,防止提前萌发,促进胚胎耐干燥性的形成,诱导离体胚中与脱水有关的mRNA和蛋白质的合成(金建平等,1995;赵永华等,2001;孙歆等,2005)。已知种子成熟过程中ABA的合成和对ABA的敏感性与种子休眠的起始有关(Le Page-Degivry et al., 1990;Barrero et al., 2010)。本文对色木槭种子发育和冷层积解除休眠过程中种子发芽能力和种子内源ABA含量变化进行研究,为了解色木槭种子休眠和萌发过程中的激素调控作用奠定基础,为生产中进一步改进色木槭播种育苗方法、提高苗木产量提供理论依据。
1 材料与方法 1.1 试验材料采自黑龙江省山河屯林业局东方红林场,选取5株生长良好色木槭母树采集种子。
1.2 试验方法1) 种子采集 自花后60天开始,每20天采集1次种子,选取发育良好、大小均一的种子立即进行试验或投入液氮速冻后贮藏于-70 ℃冰柜中备用。成熟种子在开花120天以后、种子开始脱落前进行采集,采集后在室内(20±5)℃自然风干2个月。用于冷层积处理的种子平均千粒质量为53.99 g,平均含水量为15.56%。
2) 种子质量测定 种子质量以鲜种子千粒质量表示。种子千粒质量依据《国际种子检验规程》规定的百粒法测定。测定重复3次。
3) 种子含水量测定 采用烘干称质量法[(103±2) ℃、(17±1) h]进行测定,测定重复3次。种子含水量以烘干前种子质量为背景计算。
种子含水量(%)=(测定样品烘干前质量-测定样品烘干后质量)×100/测定样品烘干前质量
4) 种子发芽能力测定 种子发芽能力用种子发芽率和活力指数表示。种子发芽试验参照石柏林等(2006)年的方法,利用沙床进行种子发芽试验,每发芽盒内放置100粒种子,于25 ℃恒温培养箱中黑暗条件下进行萌发。试验重复3次。定期记录种子发芽情况,并统计种子发芽率。活力指数VI=Gi×S,其中Gi为发芽指数,S为种子胚根伸出种皮长度(mm)。
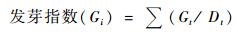
|
式中:Gt为浸种后第t日的发芽数;Dt为相应的发芽日。
5) 种子冷层积处理和取样 将花后120天并于室内自然风干后的成熟种子去掉种翅后用清水浸泡12 h,后用0.5% KMnO4消毒30 min,混湿沙(种子和沙的体积比为1:3,含水量约80%),装入塑料盒中(盖上扎孔,以透气),置于2~5 ℃冷层积,试验重复2次。每隔5天翻动检查1次(有利通气),并补充水分以保持种沙湿润。从冷层积第5天开始每隔20天取种样1次。将种样表面砂粒洗去后用滤纸吸干表面水分,立即用液氮冷冻。随后真空冷冻干燥20 h,密封保存于-80 ℃冰箱中。
6) ABA含量的测定 (1) 提取与纯化 准确称取冻干样品1 g,加入预冷的80%甲醇水溶液10 mL,在弱光下冰浴研磨,置4 ℃冰箱中浸提过夜。然后4 ℃,5 000 g离心10 min,收集上清液,残渣加入预冷的80%甲醇水溶液反复浸提2次,合并上清液,真空冷冻浓缩至干,0.1 mol·L-1醋酸铵(pH9.0)8 mL复溶,4 ℃,15 000 g离心20 min,上清液依次经过聚乙烯聚吡咯烷酮(PVPP)和二乙基氨基乙基交联葡聚糖凝胶(DEAE Sephades A-25) 柱,以Sep-Pak C18柱收集内源激素,用50%甲醇洗脱,真空冷冻浓缩至干,以流动相进行复溶,过0.45 μm滤膜后进样。
(2) 测定仪器和条件 采用Ailent1100高效液相色谱仪进行内源激素的测定,重复3次。条件:色谱柱Spherisorb C18 (4.6 mm×250 mm,0.5 μm),柱温35 ℃。流动相:甲醇、水和2%乙酸,恒流1 mL·min-1,梯度洗脱条件参照刘华英(2003)的方法。进样量为10 μL,紫外分光光度检测波长为254 nm。根据保留时间定性,外标峰面积法定量。标准样品脱落酸(ABA)为Sigma公司产品,用甲醇溶解,配25 mL浓度为0.06 g·L-1的溶液,用棕色瓶保存在5~6 ℃下备用。甲醇为色谱纯,水为超纯水,其余试剂为国产分析纯。
7) 数据处理和分析 采用Excel 2003软件进行数据处理和绘图,采用DPS (Data Processing System;唐启义等,2002)数据处理系统进行方差分析、Duncan多重比较和相关性分析。图表中数据均为3次重复平均值。
2 结果与分析 2.1 发育过程中种子发芽能力和内源ABA变化1) 种子质量和含水量变化 种子发育过程中的种子质量和含水量变化及多重比较结果见图 1。在花后60~100天期间,色木槭种子质量(用鲜种子千粒质量来表示)随着发育时间延长而增大,从花后100~120天时,种子质量显著减小(P < 0.05,花后120天的种子质量比花后100天时减小了42.28%);在花后60~120天期间,种子含水量随着发育时间的延长呈持续下降趋势,至花后120天(脱落前)时种子含水量降至最低(32.60%)。在花后60~100天期间,种子重量与种子含水量呈显著负相关关系(R=-0.97)。说明花后60~100天,色木槭种子尚未完成发育过程,仍在进行着营养物质的积累,从花后100天以后,种子完成营养物质的积累,进入迅速脱水阶段。

|
图 1 色木槭种子发育过程中的千粒质量和含水量变化 Fig.1 Changes of fresh mass and moisture content of Acer mono seeds during seed development Duncan多重比较结果如图所示,数据点上不同小写字母表示种子千粒质量在α=0.05水平上差异显著,不同大写字母表示种子含水量在α=0.05水平上差异显著。Means within a data point of seed fresh mass followed by different lowercase letters are significantly different from each other at α=0.05 level of significance using the Duncans Multiple Range Test. Same as a data point of seed moisture content followed by different capital letters.下同。The same below |
2) 种子发芽能力变化 种子发育过程中的种子活力指数和发芽率变化及多重比较结果见图 2。在花后60~120天,色木槭种子的活力指数随着发育时间延长而增大(P < 0.05),至花后120天时,种子活力指数最大(13.80);种子发芽率亦随着发育时间的延长表现出增高趋势(P < 0.05),至花后120天(脱落前)时种子发芽率最高(32.7%)。相关分析结果表明:色木槭种子发育过程中,种子活力指数与种子发芽率呈显著正相关关系(R=0.91),与种子含水量呈显著负相关关系(R=-0.95);种子发芽率与种子含水量相关性不显著(R=-0.80);种子活力指数和种子发芽率与种子千粒质量的相关性均不显著(R=-0.17和0.11)。
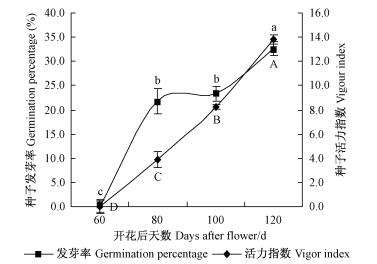
|
图 2 色木槭种子发育过程中种子活力指数和发芽率变化 Fig.2 Changes of germination percentage and vigor index of A. mono seeds during seed development |
3) 内源ABA含量变化 种子发育过程中的种子内源ABA含量变化及多重比较结果见图 3。在花后60~120天,色木槭种子内源ABA含量呈持续增加趋势,但增加的比例随着发育时间的延长逐渐减小。开花后60天时,ABA含量为50.00 ng·g-1DM;至开花后80天时,ABA含量增加为98.80 ng·g-1DM,是花后60天的1.98倍;随后的20天发育期内,ABA含量增加了1.57倍,为155.17 ng·g-1DM;至开花后120天达到最高值(216.44 ng·g-1DM,是开花后100天的1.40倍)。相关分析结果表明:种子发育过程中,种子内ABA含量与种子含水量呈显著负相关关系(R=-0.93),与种子活力指数呈极显著正相关关系(R=1.00),与种子发芽率呈显著正相关关系(R=0.92),但与种子千粒质量相关关系不显著(R=-0.13)。
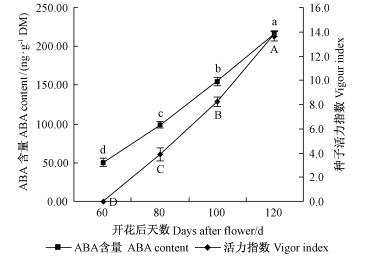
|
图 3 色木槭种子发育过程中ABA含量和种子活力指数变化 Fig.3 Changes of ABA content and vigor index of A. mono seeds during seed development |
1) 种子质量和含水量变化 冷层积过程中种子质量和含水量变化及多重比较结果见图 4。冷层积过程中的色木槭种子含水量保持在60.19%~66.10%之间,与对照(层积0天)相比无显著性差异(P>0.05);冷层积过程中种子的干物质质量则呈持续减小趋势(P < 0.05)。冷层积开始的最初20天内,种子干物质质量显著减少(P < 0.05),由层积开始的0.39 g·g-1减少到0.35 g·g-1(减少了10.26%);冷层积20~80天期间,色木槭种子干物质质量的变化虽未达到显著水平(P>0.05),但表现出持续减小的趋势,至冷层积80天时,种子干物质质量与层积0天相比减少了17.95%(P < 0.05)。相关分析结果表明,冷层积过程中,种子含水量与种子干物质质量之间的负相关关系不显著(R=-0.45)。
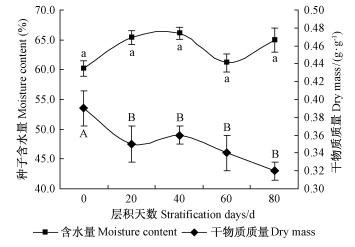
|
图 4 冷层积过程中色木槭种子含水量和干物质质量变化 Fig.4 Changes of moisture content and dry mass of A. mono seeds during cold stratification |
2) 种子发芽能力变化 低温冷层积处理可以提高色木槭种子发芽率(图 5)。冷层积处理80天时,色木槭种子发芽率可达75.5%,是刚采收种子发芽率(32.7%)的2.31倍(P < 0.01)。相关分析结果表明:冷层积过程中,种子发芽率与种子干物质质量呈显著负相关关系(R=-0.89),与种子含水量正相关关系不显著(R=0.30)。
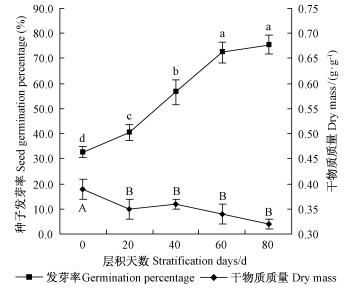
|
图 5 冷层积过程中色木槭种子发芽率和干物质质量变化 Fig.5 Changes of germination percentage and dry mass of A. mono seeds during cold stratification |
3) 内源ABA含量变化 种子冷层积过程中的种子内源ABA含量变化及多重比较结果见图 6。冷层积过程显著降低色木槭种子内源ABA的含量,随着冷层积时间的延长,ABA含量下降的比例逐渐增加。冷层积开始后的第20天,种子内源ABA含量下降了20.28%(层积开始时ABA含量为205.20 ng·g-1DM,层积20天时ABA含量为163.58 ng·g-1DM);层积第40天时,ABA含量下降了39.65%(为123.83 ng·g-1DM)。层积60天时,种子内源ABA含量下降了47.17%(为108.40 ng·g-1DM);至冷层积80天时,种子内源ABA含量下降至最低值,约为层积开始时的1/2(为103.02 ng·g-1DM,比层积开始时的水平下降了49.80%)。相关分析结果表明:冷层积过程中,种子内源ABA含量与种子发芽率呈极显著的负相关关系(R=-0.97),与种子干物质质量呈显著正相关关系(R=0.80),与种子含水量的负相关关系不显著(R=-0.41)。

|
图 6 冷层积过程中色木槭种子中ABA含量变化 Fig.6 Changes of ABA content in A. mono seeds during cold stratification |
激素平衡理论通过萌发促进物质赤霉素(GAs)和抑制物质脱落酸(ABA)的协同作用来解释种子休眠(Wareing et al., 1971)。关于GAs和(或)ABA合成或敏感性受损的突变体植株的研究(Hilhorst et al., 1992;Hilhorst,1995)支持了种子休眠和萌发过程中GAs和(或)ABA起决定性作用的激素理论。关于乙烯缺陷型突变体萌发特性的研究证明了ABA和GAs控制休眠的重要作用可能与其信号转导途径有关(Steber et al., 2001)。已知种子成熟过程中ABA的合成和对ABA的敏感性与种子休眠的起始有关(LePage-Degivry et al., 1990;Barrero et al., 2010)。TaABF1是小麦(Triticum aestivum)种子中特有的涉及ABA敏感性和种子休眠的转录因子(Rikiishi et al., 2010)。本文的研究结果表明:伴随着色木槭种子的脱水过程,种子内源ABA含量持续增加,虽然种子发芽能力也在持续增强,但最高种子发芽率仅有32.7%,说明内源ABA含量的增加与色木槭种子休眠起始有密切关系。
在吸胀胚的休眠调控中,ABA的合成起主要作用(Ali-Rachedi et al., 2004)。后熟作用可以抵消种子内形成的休眠,在吸胀时使ABA分解,最终通过GAs的产生来刺激萌发和ABA分解(Grappin et al., 2000;Jacobsen et al., 2002;Ali-Rachedi et al., 2004)。大麦(Hordeum vulgare)休眠胚在吸胀过程中ABA合成,而在非休眠胚中ABA水平被降低(Jacobsen et al., 2002)。拟南芥(Arabidopsis thaliana)休眠种子比非休眠种子具有较高的ABA含量。拟南芥休眠种子吸胀后,仍具有较高水平的ABA,经过冷层积或硝酸盐处理后休眠种子内ABA水平才降低到接近非休眠种子水平(Ali-Rachedi et al., 2004)。本研究发现:随着冷层积时间的延长,种子发芽率从刚采收时的30%左右提高到75%,而种子内源ABA水平则随着冷层积时间的延长显著下降。说明在吸胀的色木槭胚的休眠调控中内源ABA的合成起主要作用,冷层积处理抑制了胚内ABA合成能力,促进了种子的萌发。
应用外源乙烯利可有效缩短色木槭种子低温层积日期、促进种子萌发(武禄光,1986)。推测是乙烯利释放的乙烯抑制了胚内ABA的合成,促进种子的萌发。乙烯促进种子萌发并拮抗种子中ABA的作用在其他植物种子也有证明(Zhang et al., 2008;Linkies et al., 2011)。如在番茄(Lycopersicon esculentum cv. ‘Lichun’)种子萌发期间,乙烯响应因子TSRF1的过量表达增强了萌发过程中的ABA敏感性,促进了子叶扩展和胚根伸长(Zhang et al., 2008)。但关于乙烯调节ABA相关的种子萌发过程的分子机制和相应的响应因子的研究还需要继续深入。
本文的研究结果揭示了ABA在色木槭种子休眠和胚吸胀后冷层积萌发过程中的调控作用,为进一步改进色木槭播种育苗方法、提高苗木产量提供了理论依据。
| [] | 曹帮华, 蔡春菊. 2006. 银杏种子后熟生理与内源激素变化的研究. 林业科学, 42(2): 32–37. |
| [] | 陈嵘. 1937. 中国树木分类学. 上海: 中华农学会. |
| [] | 高风华. 2009. 色木槭开花习性与幼果发育的观察与研究. 吉林林业科技, 38(6): 1–2, 15. |
| [] | 顾地周, 丛小力, 姜云天, 等. 2008. 色木槭的组织培养与快速繁殖. 植物生理学通讯, 44(2): 314. |
| [] | 郭天亮, 李春志, 李素林, 等. 2003. 五角枫防火林带营造技术. 林业科技开发, 17(6): 55. |
| [] | 国际种子检验协会(ISTA). 1999. 国际种子检验规程. 北京, 中国农业出版社. |
| [] | 胡兴无, 杨淑玲, 李殿波. 2008. 色木槭绿化用大规格苗木的培育. 特种经济动植物(7): 23. |
| [] | 金建平, 林鹿. 1995. 黄皮种子发育中后期ABA含量的动态变化. 中山大学学报:自然科学版, 34(1): 130–132. |
| [] | 李广祥, 刘玉波. 2004. 色木槭嫩枝扦插试验初报. 吉林林业科技, 33(3): 9–11. |
| [] | 李世全. 1978. 秦岭巴山天然药物志. 西安, 陕西科学技术出版社: 311-312. |
| [] | 刘华英. 2003. 柑橘体细胞胚发生的细胞学及生理生化特性研究. 湖南农业大学博士学位论文. |
| [] | 石柏林, 吴家森, 钟泰林. 2006. 6种槭树属植物种子特性及其发芽试验. 浙江林业科技, 26(3): 38–40. |
| [] | 孙歆, 雷韬, 袁澍, 等. 2005. 脱水素研究进展. 武汉植物研究, 23(3): 299–304. |
| [] | 唐启义, 冯光明. 2002. 实用统计分析及其DPS数据处理系统. 北京, 科学出版社. |
| [] | 武禄光. 1986. 乙烯对色木械种子体眠萌发的调节作用. 种子(Z1): 33–36. |
| [] | 武禄光. 1987. 过氧化物酶在色木械种子休眠向萌发转变中的作用. 东北林业大学学报, 15(16): 8–13. |
| [] | 张军保, 张振全, 沈海龙, 等. 2008. 色木槭种皮透水性与种子浸提液生物效应的研究. 安徽农业科学, 36(20): 8571–8574. DOI:10.3969/j.issn.0517-6611.2008.20.072 |
| [] | 赵永华, 杨世林, 刘惠卿, 等. 2001. 西洋参种子休眠解除与磷酸戊糖途径关系的研究. 中草药, 32(3): 259–261. |
| [] | Ali-Rachedi S, Bouinot D, Wagner M H, et al. 2004. Changes in endogenous abscisic acid levels during dormancy release and maintenance of mature seeds: studies with the Cape Verde Islands ecotype, the dormant model of Arabidopsis thaliana. Planta, 219(3): 479–488. |
| [] | Barrero J M, Millar A A, Griffiths J, et al. 2010. Gene expression profiling identifies two regulatory genes controlling dormancy and ABA sensitivity in Arabidopsis seeds. Plant Journal, 61(4): 611–622. DOI:10.1111/tpj.2010.61.issue-4 |
| [] | Grappin P, Bouinot D, Sotta B, et al. 2000. Control of seed dormancy in Nicotiana plumbaginifolia: post-imbibition abscisic acid synthesis imposes dormancy maintenance. Planta, 210(2): 279–285. DOI:10.1007/PL00008135 |
| [] | Hilhorst H W M. 1995. A critical update on seed dormancy. I. Primary dormancy. Seed Sci Res, 5(2): 61–73. |
| [] | Hilhorst H W M, Karssen C M. 1992. Seed dormancy and germination: the role of abscisic acid and gibberellins and the importance of hormone mutants. Plant Growth Regul, 11(3): 225–238. DOI:10.1007/BF00024561 |
| [] | Jacobsen J V, Pearce D W, Poole A T, et al. 2002. Abscisic acid, phaseic acid and gibberellin contents associated with dormancy and germination in barley. Physiol Plant, 115(3): 428–441. DOI:10.1034/j.1399-3054.2002.1150313.x |
| [] | Kim C M, Jung D L, Sheo H J. 1991. A study on the ingredients in the sap of Acer mono Max. and Betula costata T. in Mt. Jiri Area-On the components of mineral and sugar. Journal of the Korean Society of Food and Nutrition, 20(5): 479–482. |
| [] | LePage-Degivry M T, Barthe P, Garello G. 1990. Involvement of endogenous abscisic acid in onset and release of Helianthus annuus embryo dormancy. Plant Physiol, 92(4): 1164–1168. DOI:10.1104/pp.92.4.1164 |
| [] | Linkies A, Leubner-Metzger G. 2011. Beyond gibberellins and abscisic acid: how ethylene and jasmonates control seed germination. Plant Cell Report, 31(2): 253–270. |
| [] | Park Y G, Kwon G S, Tay D. 2005. Cryopreservation for gene conservation of Acer mono Max. Propagation of Ornamental Plants, 5(2): 78–83. |
| [] | Qin J H, Liu Q. 2010. Oxidative metabolism-related changes during germination of mono maple (Acer mono Maxim.). seeds under seasonal frozen soil. Ecological Research, 25(2): 337–345. |
| [] | Rikiishi K, Matsuura T, Maekawa M. 2010. TaABF1, ABA response element binding factor 1, is related to seed dormancy and ABA sensitivity in wheat (Triticum aestivum L.). Journal of Cereal Science, 52(2): 236–238. DOI:10.1016/j.jcs.2010.05.012 |
| [] | Steber C M, McCourt P. 2001. A role for brassinosteroids in germination in Arabidopsis. Plant Physiol, 125(2): 763–769. DOI:10.1104/pp.125.2.763 |
| [] | Wareing P F, Saunders P F. 1971. Hormones and dormancy. Annu Rev Plant Physiol, 22: 261–288. DOI:10.1146/annurev.pp.22.060171.001401 |
| [] | Zhang H B, Yang Y H, Zhang Z J, et al. 2008. Expression of the ethylene response factor gene TSRF1 enhances abscisic acid responses during seedling development in tobacco. Planta, 228(5): 777–787. DOI:10.1007/s00425-008-0779-0 |
 2012, Vol. 48
2012, Vol. 48

