文章信息
- 宋丽文, 李兴鹏, 张健, 陈越渠, 左彤彤
- Song Liwen, Li Xingpeng, Zhang Jian, Chen Yuequ, Zuo Tongtong
- 针叶树小蠹对非寄主挥发物的嗅觉识别和行为反应研究评述
- Review on Olfactory Recognition and Behavioral Responses of Conifer Bark Beetles to Nonhost Volatiles
- 林业科学, 2012, 48(12): 93-100.
- Scientia Silvae Sinicae, 2012, 48(12): 93-100.
-
文章历史
- 收稿日期:2012-01-09
- 修回日期:2012-04-23
-
作者相关文章
小蠹虫是鞘翅目(Coleoptera)象甲科(Curculionidae)小蠹亚科(Scolytinae)昆虫的总称,全世界约有220属,6 000种左右(Wood,1986)。我国已知500余种,120余种普遍发生(赵玉民等,2011),其中云杉八齿小蠹(Ips typographus)、落叶松八齿小蠹(I. subelongatus)、红脂大小蠹(Dendroctonus valens)、纵坑切梢小蠹(Tomicus piniperda)等种类发生面积较大。小蠹虫是林木害虫的一个重要类群,对北半球的针叶树损害极为严重。风灾、干旱、洪水和食叶害虫等因素影响树势之后可以加重小蠹虫的危害,导致其常常暴发成灾,不仅造成严重的经济和生态损失(Wermelinger,2004;Gilbert et al., 2005),同时也使被害森林由重要的碳库变成主要的碳源,大大增加生态系统中CO2的释放量(Kurz et al., 2008;戈峰,2011)。
大多数小蠹虫为寡食性,只取食和侵害一些亲缘关系较近的寄主种类(Wood,1982;Kelley et al., 1998)。小蠹虫适宜寄主随机分布在整个混交林中,在其扬飞扩散寻找寄主的过程中,最常遇到的是非寄主或不适宜的寄主及其气味。小蠹虫对寄主的搜索是一个复杂的过程,由于体能限制(Atkins,1966)和减少遭遇天敌或恶劣天气等不利因素影响的需要(Dahlsten,1982;Huber et al., 1999),小蠹虫必须及时对寄主和非寄主植物刺激信号产生一系列的行为反应,尽快定位寄主(Byers et al., 2000)。在这个过程中,避开非寄主可能是基于特定的寄主特性和(或)对非寄主刺激信号的不均衡性综合反应。非寄主挥发物不仅对接受者(如小蠹虫)有利,对释放者(如非寄主或同域竞争种)也有利,既可以增加小蠹虫发现寄主的机率,又可以避免小蠹虫对非寄主植物的危害。因此,非寄主挥发物具有互益素的功能(Zhang et al., 2004)。
扬飞扩散并寻找寄主的过程是小蠹虫生活史中最危险的阶段,死亡率达到80%甚至更高(Borden,1997;Schlyter et al., 1999),因此,寄主选择过程是小蠹虫生存最关键的时期,其最终的行为反应是嗅觉对多种有行为活性的化合物对抗性平衡的结果(Baker,2008)。从宏观水平上,生物个体利用感觉信息趋利避害,非寄主挥发物可以对针叶树小蠹虫产生驱避作用而对另一些生物具有引诱效果,这种生态权衡(ecological trade-off)也要受到自然选择的作用。从这个意义上来讲,研究信息化合物权衡的进化背景是一个相当重要的课题(Agrawa,2011),而对于单个植物挥发物及它们对植食性昆虫影响的研究也是昆虫-植物协同进化研究的重要内容(Dyer,2011)。因此,对针叶树小蠹非寄主挥发物的研究不仅会推动生理学和生态学的发展,同时也将有助于生物进化理论的研究。近年来,以欧美科学家为主的一些研究团队对针叶树小蠹非寄主挥发物的生物学功能和应用技术等方面开展了一系列研究。
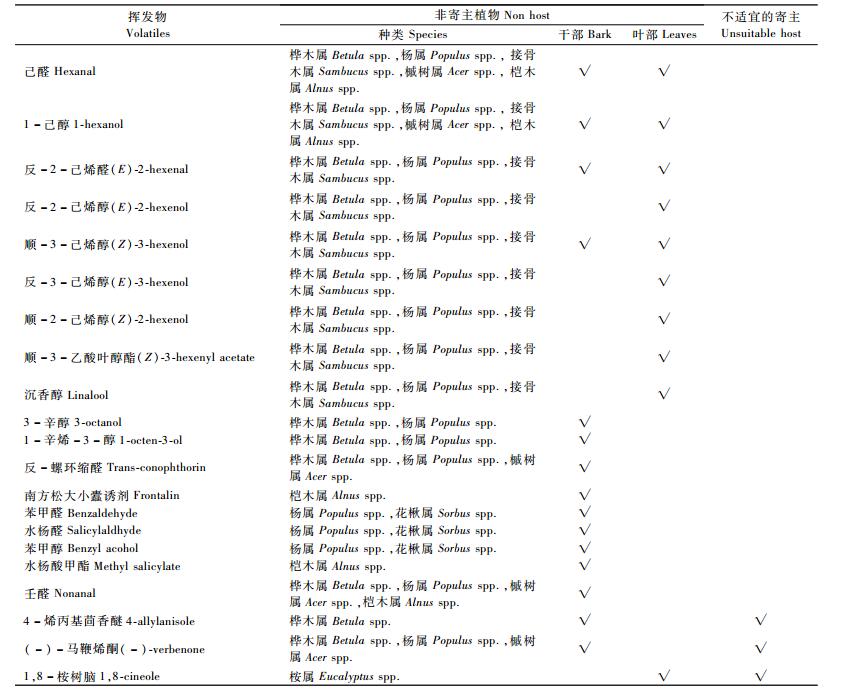
1 针叶树小蠹非寄主挥发物的范畴和作用针叶树小蠹非寄主挥发物包括阔叶树挥发物和不适宜寄主的挥发物(表 1)。根据Borden(1997)和Schlyter等(1999)对针叶树小蠹寄主选择过程的分析,针叶树小蠹通过气味信号寻找寄主的过程主要包含了3个水平的选择,即生境、种类及树木个体。每个水平的选择对小蠹虫能否找到适宜的寄主都至关重要。对针叶树小蠹而言,阔叶树叶部挥发物(即绿叶挥发物)从生境水平指示非寄主的存在,阔叶树皮的挥发物指明了非寄主树种,而不适宜寄主的挥发物从个体水平上发挥作用(Zhang et al., 2004)。
|
|
阔叶树挥发物一般可分为醇、醛、酯、酮、吡嗪、萜类及芳香族化合物。昆虫可利用的信息化合物一般是相对分子质量小于250、沸点小于340 ℃的化合物,因此在树木-昆虫关系中发生作用的挥发性化合物大多限于≤16碳的醇、醛、酮类、≤15碳的萜类化合物、≤14碳的酸和酯类及≤12碳的苯丙素(Zhang et al., 2004)。作为一类化学信息物质,阔叶树挥发物在针叶树小蠹搜寻寄主的过程中会在生境水平上发挥驱避作用,因此小蠹虫需要识别并避开多种非寄主阔叶树普遍释放的挥发物,而不是某种非寄主的特定挥发物(Reddy et al., 2004)。
作为针叶树小蠹非寄主研究对象,最常见的是桦木属、杨属和槭树属的树木。针叶树挥发物以单萜类化合物为主,而阔叶树挥发物更多的是绿叶挥发物(green leaf volatiles,GLV),如顺-3-己烯基醋酸酯、顺-3-己烯醇(Zhang et al., 1999)、3-辛醇和1-辛烯-3-醇等(Zhang et al., 2000),它们在针叶树挥发物中的含量非常少。同时,研究表明:阔叶树的干部也会释放绿叶挥发物,在桦木属和杨属的干部挥发物中发现的3-辛醇、1-辛烯-3-醇、2-甲基-3-丁烯-2-醇及反-螺环缩醛(Zhang et al., 2000;2002)同样可以抑制小蠹虫对信息素的反应。
1.2 不适宜寄主释放的挥发物小蠹虫不仅要在生境水平上避开非寄主,同时,还要从寄主个体水平上判断并找到最适宜的寄主个体。研究表明:被小蠹虫侵害的寄主树木可以释放出马鞭烯酮和4-烯丙基茴香醚等信息化学物质(Borden,1997)。对于针叶树小蠹,马鞭烯酮可以作为非适宜寄主的信号,指示被入侵的寄主坑道密度已饱和(Byers et al., 1989;Schlyter et al., 1989),而4-烯丙基茴香醚可能是指示寄主树已陈旧、饱和或抵抗力很强的化学信号(Haynes et al., 1994)。研究表明:受虫害的云杉(Picea spp.)大量产生的单萜类物质1,8-桉树脑,可以抑制云杉八齿小蠹对聚集信息素的反应(Andersson et al., 2010)。
另外,同域发生的其他种小蠹的信息素成分也可以做为非适宜寄主的信号,抑制一些小蠹虫对聚集信息素的反应(Byers,1995),这也是小蠹虫避免或减少种间竞争的一种策略。Poland等(1998)通过行为生测证明2个同域种的聚集信息素可以抑制红翅大小蠹(D. rufipennis)对聚集信息素的反应。
值得注意的是,非寄主的叶部和干部挥发物1-辛烯-3-醇同时也是几种小蠹虫的抗聚集信息素(Klimetzek et al., 1989;Pureswaran et al., 2004),而2-甲基-3-丁烯-2-醇不仅存在于阔叶树挥发物中,也是北美多种松树的主要挥发物(Zhang et al., 2000),同时还是云杉八齿小蠹和地中海区松小蠹(Ips erosus)雄虫产生的主要聚集信息素成分之一(Bakke et al., 1977;Baader,1989)。另外,为大家所熟知的针叶树小蠹聚集信息素南方松大小蠹(D. frontalis)诱剂(frontalin)和抗聚集信息素马鞭烯酮,也被发现存在于阔叶树挥发物中(Huber et al., 1999)。虫害云杉产生的1,8-桉树脑也是桉树(Eucalyutus spp.)叶的主要次生代谢产物之一(McLean et al., 2008)。这种现象可以被认为是自然选择过程中化学生态的一种权衡(Agrawa,2011)。在复杂的森林环境中,单一化合物通常不能绝对定义为任何信息源,各种信息化合物的特定组合方式及比例经常是小蠹虫识别信号的关键因素(Bruce et al., 2005),因此,对不适宜寄主释放的挥发物嗅觉识别的研究不仅具有理论意义,同时也是开展行为生测与应用研究的基础环节。
2 针叶树小蠹虫对非寄主挥发物的嗅觉识别对于昆虫,气味混合物可以存在于种群和单一神经元2个水平上(Lei et al., 2008)。一般认为,气味分子从气味源顺风向传播,空气流动使其产生结构复杂的气缕(odor plume)(Carde et al., 2008),小蠹触角和下颚须上的气味感受器接受气缕携带的气味分子,并由嗅觉感受基因进行编码。当一种气味分子与一个气味感受器结合时,相应的神经元向大脑的嗅觉中枢发送神经信号,在那里各种气味被综合分析(Silbering et al., 2008)。相应地,从电生理水平上主要用2种方法来衡量小蠹虫对信息化合物的嗅觉识别,一是用触角电位仪(electroantennogram,EAG)或气相色谱-触角电位联用仪(coupled gas chromatography-electroantennographic detection,GC-EAD)测定整根触角在受到相应气味刺激时电位信号的变化。另一种是用单细胞记录(sing-cell recording,SCR;也有写作single-sensillum recording,SSR)或气相色谱-单细胞记录联用仪(coupled gas chromatography-single cell recording,GC-SCR)测定单个嗅觉感受神经元的电生理反应,深入分析感觉神经元对具有活性的信息化学物质反应的多样性和特异性。
Zhang等(2000;2001) GC-EAD测试表明:云杉八齿小蠹和重齿小蠹(I. duplicatus)的触角都对反-螺环缩醛、1-己醇、顺-3-己烯-1-醇、3-辛醇和1-辛烯-3-醇产生稳定的反应。另外,纵坑切梢小蠹和横坑切梢小蠹(Tomicus minor)的越冬代成虫也同样对这些非寄主挥发的六碳和八碳醇产生反应,但这2种切梢小蠹对反-螺环缩醛没有GC-EAD反应(Schlyter et al., 2000),而对不适宜寄主释放的马鞭烯酮有强烈反应(Schlyter et al., 1988;1995;Byers et al., 1989)。Huber等(1999)发现反-螺环缩醛可以引起北美5种小蠹的GC-EAD反应,另外,从新北界的被子植物提取的非寄主皮挥发物,包括苯甲醛、水杨醛、苯甲醇、壬醛、南方松大小蠹诱剂(Borden et al., 1998;Huber et al., 1999)等对黑山大小蠹(D. ponderosae)等几种北美的针叶树小蠹也有触角电位活性(Huber et al., 2000),但是,这些氧化芳香族化合物和六至九碳醛未引起几种受测欧亚小蠹的触角电位活性(Zhang,2000)。GC-EAD测试中,非寄主的叶部挥发物(绿叶挥发物、香叶基丙酮)和干部挥发物(八碳醇和反-螺环缩醛)、马鞭烯酮(不适宜寄主信号)、顺式-马鞭草烯醇(其他小蠹虫的信息素成分)都会引起落叶松八齿小蠹的电生理反应(Zhang et al., 2007)。
利用GC-SCR技术,Tømmerås(1989)和Tømmerås等(1989)发现豚草条棘胫小蠹(Trypodendron lineatum)和云杉八齿小蠹的一些细胞只对非寄主挥发物产生反应。Guerrero等(1997)报道了Tomicus destruens对非寄主桉树皮中的苯甲醇有SCR反应。Andersson等(2009)第一次用SSR记录了小蠹虫个体的嗅觉感受神经元对非寄主挥发物的感知力,试验筛选了云杉八齿小蠹150个嗅觉感器对信息素、寄主挥发物和非寄主挥发物的反应,产生强烈反应的106个嗅觉感受神经元中,近1/4对非寄主挥发物产生反应,进一步说明以针叶树为食的昆虫感知阔叶树挥发物的重要性,反映了非寄主挥发物在生态和进化中的重要意义。单细胞记录的结果也证明了针叶树小蠹对非寄主挥发物在电生理和行为水平上反应的一致性。在行为生测中,3种绿叶挥发物1-己醇、反-2-己烯醇和顺-3-己烯醇单独使用都可以降低信息素对云杉八齿小蠹的诱集量,且降低水平相近。但这3种绿叶挥发物的组合对云杉八齿小蠹聚集的抑制效果并未增强,这种现象,被称为“冗余”(redundancy)(Zhang et al., 2004)。在SSR测试中,云杉八齿小蠹唯一一个对这3种绿叶挥发物敏感的嗅觉感受神经元对这3种绿叶挥发物的敏感度也相近,表明云杉八齿小蠹在生理水平上不能区别这3种挥发物,正说明了行为生测中的冗余现象(Andersson et al., 2009)。
一般来说,嗅觉感受神经元具有一定的特异性,只对一种或几种化合物产生反应,但也有一些嗅觉感受神经元具有一定广谱性。反之,每种化合物通常会激活不止一种嗅觉感受神经元。通常认为,大多数小蠹虫触角上的嗅觉细胞(或嗅觉感受神经元)按功能可划分为以下几种类型:1) 高度特化型,如类加州十齿小蠹(I. paraconfusus)和波缝重齿小蠹(I. pini)的一些嗅觉细胞只对小蠹二烯醇的一种异构体产生特异性反应;2) 信息素敏感型,可以同时对其他增效剂或驱避剂产生反应,如南方松大小蠹的诱剂细胞,这种细胞至少有2种受体,每一种对应南方松大小蠹诱剂的一种异构体;3) 多功能型,对寄主挥发物产生反应,同时也在一定程度上对信息素有反应(Byers,1995)。欧洲和北美对非寄主挥发物的研究又揭示了第4种嗅觉感受细胞的存在——非寄主挥发物敏感型细胞(Zhang et al., 2000;Andersson et al., 2009)。
3 针叶树小蠹虫对非寄主挥发物的行为反应与电生理反应的结果一致,在野外行为生测中,已经证明有20多种小蠹可以对非寄主挥发物产生反应(Zhang et al., 2004)。
作为最常见的非寄主挥发物,绿叶挥发物可以抑制一些针叶树小蠹对信息素和寄主挥发物的反应,如:1-己醇和己醛可降低南方松大小蠹、南部松齿小蠹(I. grandicollis)和美东最小齿小蠹(I. avulsus)对各自信息素的聚集反应(Dickens et al., 1992),顺-3-己烯-1-醇、反-2-己烯-1-醇和1-己醇能明显降低二齿星小蠹(Pityogenes bidentatus)对其聚集信息素顺式-马鞭草烯醇和诱杀烯醇的聚集反应(Zhang et al., 2000)。绿叶挥发物的醛类和酯类没有显著降低纵坑切梢小蠹信息素的诱集量,但其他有电生理活性的绿叶醇类的组合却显著地抑制了纵坑切梢小蠹信息素的诱集作用(Zhang et al., 2000),Poland等(2000)对纵坑切梢小蠹北美种群的试验也得出了同样的结论。另外,非寄主树皮的挥发物,如芳香族化合物,也同样可以影响小蠹虫的聚集行为。Guerrero等(1997)用高速率释放(700 mg·d-1)的苯甲醇成功减轻了T. destruens对寄主的危害。壬醛、安息香醛、苯甲醇和1-辛醇的多种组合都可以影响黑山大小蠹对信息素的反应(Borden et al., 1998)。Poland等(2009)证明在美国中西部地区,1-辛烯-3-醇可以成功地趋避波缝重齿小蠹。
1-己醇、顺-3-己烯-1-醇、3-辛醇和1-辛烯-3-醇可以抑制重齿小蠹(Zhang et al., 2001)和纵坑切梢小蠹(Poland et al., 2004)的聚集,反-螺环缩醛、六碳及八碳醇类绿叶挥发物可以显著抑制云杉八齿小蠹对聚集信息素的反应(Zhang et al., 2004)。Wilson等(1996)利用1-己醇+顺-2-己烯-1-醇+反-3-己烯-l-醇+顺-3-己烯-1-醇成功地减少了黑山大小蠹对悬挂引诱剂的寄主小干松(Pinus contorta var. latifolia)的危害。
作为针叶树小蠹普遍应用的一种抗聚集信息化合物,马鞭烯酮是在行为生测中常用的成分之一。Fettig等(2008)利用马鞭烯酮和8种阔叶树挥发物成功地减少了西松大小蠹(D. brevicomis)对小干松的危害,并降低了树木的死亡率。Fettig等(2009a)对西松大小蠹的防治试验表明:单独使用马鞭烯酮很难有效减轻其对小干松的危害,建议联合使用高释放速率的马鞭烯酮和其他信息化合物,并结合综合管理措施。Andersson等(2010)证明1,8-桉树脑可以抑制云杉八齿小蠹对聚集信息素的反应。宋丽文(2011)通过田间行为生测证明马鞭烯酮、反-螺环缩醛、顺-3-己烯-1-醇3种化合物的单组分都显著抑制了落叶松八齿小蠹对聚集信息素的反应。
另外,行为生测也证明了小蠹虫对同域竞争种信息素的反应,美云杉毛小蠹(Dryocoeles affaber)的信息素(+)-exo-和(+)-endo-brevicomin(7-乙基-5-甲基-6,8-二氧双环[3.2.1]辛烷)可以降低同域竞争种红翅大小蠹高达87%的诱集量,而另一个同域种大云齿小蠹(I. tridens)的聚集信息素成分小蠹二烯醇也可以降低红翅大小蠹85%的诱捕量(Poland et al., 1998)。
4 非寄主挥发物在林业生产中的应用与前景从理论与实践相结合的角度,对于小蠹虫寄主选择过程的研究是开发信息化合物防控小蠹虫技术的关键环节(Schlyter et al., 1999),对非寄主挥发物的研究进一步推动了小蠹虫综合管理水平的提高。近年来,欧洲和北美先后在2个方向上开展了非寄主挥发物应用技术研究与开发。一种是单独使用非寄主挥发物作为驱避剂,美国用飞机喷洒马鞭烯酮防治黑山大小蠹及甲基环己烯酮(methylcyclohexenone,MCH)防治黄杉大小蠹(D. pseudotsugae)均获成功(Gilletter et al., 2009a;2009b)。另一种方法是聚集信息素引诱剂与非寄主挥发物驱避剂联合使用的“推-拉”策略(push-pull tactic),美国加利福尼亚用这种方法成功地控制了类加州十齿小蠹的暴发(Cook et al., 2007)。另外,Borden等(2006)在黑山大小蠹防治中证明:马鞭烯酮与信息素结合应用的“推-拉”策略要优于单纯用信息素(“拉”)的效果。在大量试验和实践的基础上,马鞭烯酮已经被注册为黑山大小蠹和南方松大小蠹的生物农药(Fettig et al., 2009b),为非寄主挥发物在林业生产中的应用迈出了至关重要的一步。
小蠹虫对非寄主的识别是一个复杂的生理生化和化学生态过程,迄今,在该领域虽已开展了很多工作,获得一些令人鼓舞的研究结果,但仍有许多疑点尚待进一步揭示。关于进一步研究的方向,Zhang等(2004)提出了混交林中寄主与非寄主挥发物的自然释放速率与动态变化,不同非寄主挥发物及其混合物的作用测试,改变非寄主挥发物的释放方式以增加有效抑制范围,鉴定并分析林分中其他有机体挥发物的功效,非寄主嗅觉信号与其他感觉综合作用分析,通过电生理技术研究单个感觉神经元的多样性和特异性及中枢神经系统的整合,天敌对非寄主挥发物的反应等内容。根据多年对小蠹虫信息化合物应用技术的研究及实践工作的经验,笔者建议在加强国际合作、开展应用基础研究的基础上,在林业实践层面上加强以下2个方面的研究。
1) 小蠹虫信息化合物的释放和行为反应都受地理位置和寄主种类以及当时当地生态环境等因素所影响(Miller et al., 1996;Song et al., 2011),非寄主挥发物的效果也同样存在差异(Borden et al., 2006)。我国对小蠹虫信息化合物的研究开展较晚,可喜的是在与欧美专家合作的基础上,多种针叶树小蠹信息素的应用基础研究发展较快。目前,在吉林、青海、山西、北京等地都有成功应用于林业生产的范例。而小蠹非寄主挥发物领域的研究在我国才刚刚起步(崔丽贤等,2010;孟祥志等,2011;宋丽文,2011;周琦等,2011),应结合以往信息素的成功经验,加强“推-拉”策略与其他综合防治措施的综合应用技术研究,推动非寄主挥发物在针叶树小蠹综合管理中的应用。
2) 试验与应用证明:非寄主挥发物用于针叶树小蠹综合管理,其结果科学而可靠。而信息化合物尤其适合大面积范围内应用,因此,在应用层面更应该考虑景观水平的规划(Witzgall et al., 2010)。地理信息系统(geographic information system,GIS)可以从地区尺度上获取和评价昆虫种群数据,分析其时空动态,因此,应该利用GIS,加强在景观水平上应用非寄主挥发物开展针叶树小蠹防控工作的研究。
气温升高、降水格局的变化、灾害天气频发等全球气候变化,使害虫防控成为一项日益严峻的挑战(戈峰,2011)。包括非寄主挥发物在内的信息化合物,作为大范围内开展害虫可持续管理的有效手段(Witzgall et al., 2010),势必会在减轻全球气候变化的影响,促进生态安全和粮食安全的过程中发挥重要作用。只有在化学家、昆虫学家和植物(包括森林)保护工作者的通力合作下,才能为可持续害虫管理提供生产上急需的、适用的技术方案。
| [] | 崔丽贤, 张真, 黄大庄. 2010. 非寄主挥发物对针叶树小蠹虫作用的研究进展. 林业科学研究, 23(6): 895–904. |
| [] | 戈峰. 2011. 应对全球气候变化的昆虫学研究. 应用昆虫学报, 48(5): 1117–1122. DOI:10.7679/j.issn.2095-1353.2011.185 |
| [] | 孟祥志, 徐光花, 刘志洲, 等. 2011. 针叶树小蠹对非寄主植物挥发物的行为反应及其应用. 东北林业大学学报, 39(8): 106–109. |
| [] | 宋丽文. 2011. 两种小蠹虫寄主选择机制研究. 长春: 东北师范大学博士学位论文. |
| [] | 赵玉民, 王艳军, 陈国发, 等. 2011. 小蠹聚集信息素研究与应用的进展. 内蒙古林业科技, 37(3): 55–60. |
| [] | 周琦, 严善春, 张真. 2011. 云杉八齿小蠹对寄主、非寄主植物的嗅觉反应及发生机理. 林业科技, 36(3): 19–22. |
| [] | Agrawa A A. 2011. New synthesis—trade-offs in chemical ecology. Journal of Chemical Ecology, 37(1): 230–231. |
| [] | Andersson M N, Larsson M C, Blazenec M, et al. 2010. Peripheral modulation of pheromone response by inhibitory host compound in a beetle. Journal of Experimental Biology, 213(19): 3332–3339. DOI:10.1242/jeb.044396 |
| [] | Andersson M N, Larsson M C, Schlyter F. 2009. Specificity and redundancy in the olfactory system of the bark beetle Ips typographus: Sing-cell responses to ecologically relevant odors. Journal of Insect Physiology, 55: 556–567. DOI:10.1016/j.jinsphys.2009.01.018 |
| [] | Atkins M D. 1966. Behavioral variation among Scolytids in relation to their habitat. Canadian Entomologist, 98(3): 285–288. DOI:10.4039/Ent98285-3 |
| [] | Baader E J. 1989. Pityogenes spp. (Col., Scolytidae): investigations on semiochemicals and their application in forest protection. Journal of Applied Entomology, 107(1): 1–31. |
| [] | Baker T C. 2008. Balanced olfactory antagonism as a concept for understanding evolutionary shifts in moth sex pheromone blends. Journal of Chemical Ecology, 34(7): 971–981. DOI:10.1007/s10886-008-9468-5 |
| [] | Bakke A, Fryen P, Skattebl L. 1977. Field response to a new pheromonal compound isolated from Ips typographus.. Naturwissenschaften, 64(2): 98. DOI:10.1007/BF00437364 |
| [] | Borden J H. 1997. Disruption of semiochemical-mediated aggregation in bark beetles//Carde R T, Minks A K. Pheromone Research: New Directions. Chapman and Hall, New York, 421-438. |
| [] | Borden J H, Birmingham A L, Burleigh J S. 2006. Evaluation of the push-pull tactic against the mountain pine beetle using verbenone and non-host volatiles in combination with pheromone-baited trees. The Forestry Chronicle, 82(4): 579–590. DOI:10.5558/tfc82579-4 |
| [] | Borden J H, Wilson I M, Gries R, et al. 1998. Volatiles from the bark of trembling aspen, Populus tremuloides Michx. (Salicaceae) disrupt secondary attraction by the mountain pine beetle, Dendroctonus ponderosae Hopkins (Coleoptera: Scolytidae). Chemoecology, 8(2): 69–75. DOI:10.1007/PL00001806 |
| [] | Bruce T J A, Wadhams L J, Woodcock C M. 2005. Insect host location: a volatile situation. Trends in Plant Science, 10(6): 269–274. DOI:10.1016/j.tplants.2005.04.003 |
| [] | Byers J A. 1995. Host tree chemistry affecting colonization in bark beetles//Carde R T, Bell W J. Chemical Ecology of Insects 2. Chapman & Hall, New York, 154-213. |
| [] | Byers J A, Lanne B S, Lofqvist J. 1989. Host-tree unsuitability recognized by pine shoot beetles in flight. Experientia, 45: 489–492. DOI:10.1007/BF01952042 |
| [] | Byers J A, Zhang Q H, Birgersson G. 2000. Strategies of a bark beetle, Pityogenes bidentatus, in an olfactory landscape. Naturwissenschaften, 87(11): 503–507. DOI:10.1007/s001140050768 |
| [] | Carde R T, Willis M A. 2008. Navigational strategies used by insects to find distant, wind-borne sources of odor. Journal of Chemical Ecology, 34(7): 854–866. DOI:10.1007/s10886-008-9484-5 |
| [] | Cook S M, Khan Z R, Pickett J A. 2007. The use of pushpull strategies in integrated pest management. Annual Review of Entomology, 52: 375–400. DOI:10.1146/annurev.ento.52.110405.091407 |
| [] | Dahlsten D L. 1982. Relationship between bark beetles and their natural enemies//Mitton J B, Sturgeon K B. Bark Beetles in North American Conifers: A System for the Study of Evolutionary Biology. University of Texas Press, Austin, 140-182. |
| [] | Dickens J C, Billings R F, Payne T L. 1992. Green leaf volatiles interrupt aggregation pheromone response in bark beetles infecting pines. Experientia, 48(5): 523–524. DOI:10.1007/BF01928180 |
| [] | Dyer L A. 2011. New synthesis—back to the future: New approaches and directions in chemical studies of coevolution. Journal of Chemical Ecology, 37(7): 669. DOI:10.1007/s10886-011-9979-3 |
| [] | Fettig C J, Dabney C P, Mckelvey S R, et al. 2008. Nonhost angiosperm volatiles and verbenone protect individual ponderosa pines from attack by western pine beetle and red Turpentine Beetle (Coleoptera: Curculionidae, Scolytinae). West J Appl For, 23(1): 40–45. |
| [] | Fettig C J, McKelvey S R, Borys R R, et al. 2009b. Efficacy of verbenone for protecting ponderosa pine stands from western pine beetle (Coleoptera: Curculionidae: Scolytinae) attack in California. Forest Entomology, 102(5): 1846–1858. |
| [] | Fettig C J, McKelvey S R, Dabney C P, et al. 2009a. Response of Dendroctonus brevicomis to different release rates of nonhost angiosperm volatiles and verbenone in trapping and tree protection studies. Journal of Applied Entomology, 133(2): 143–154. DOI:10.1111/jen.2009.133.issue-2 |
| [] | Gilbert M, Nageleisen L M, Franklin A, et al. 2005. Post-storm surveys reveal large-scale spatial patterns and influences of site factors, forest structure and diversity in endemic bark-beetle populations. Landscape Ecology, 20: 35–49. DOI:10.1007/s10980-004-0465-y |
| [] | Gillette N E, Mehmel C J, Webster J N, et al. 2009b. Aerially applied methylcyclohexenone-releasing flakes protect Pseudotsuga menziesii stands from attack by Dendroctonus pseudotsugae.. Forest Ecology and Management, 257(2): 1231–1236. |
| [] | Gillette N E, Erblgin N, Webster J N, et al. 2009a. Aerially applied verbenone-releasing laminated flakes protect Pinus contorta stands from attack by Dendroctonus ponderosae in California and Idaho. Forest Ecology and Management, 257: 1405–1412. DOI:10.1016/j.foreco.2008.12.017 |
| [] | Guerrero A, Feixas J, Pajares J, et al. 1997. Semiochemically induced inhibition of behaviour of Tomicus destruens (Woll) (Coleoptera: Scolytidae). Naturwissenschaften, 84: 155–157. DOI:10.1007/s001140050369 |
| [] | Haynes J L, Strom B L, Roton L M, et al. 1994. Two pheromones of coniferophagous bark beetles found in the bark of nonhost angiosperms. Journal of Chemical Ecology, 25(4): 805–816. |
| [] | Huber D P W, Gries R, Borden J H, et al. 2000. A survey of antennal responses by fiver species of coniferophagous bark beetles (Coleoptera: Scolytidae) to bark volatiles of six species of angiosperm trees. Chemoecology, 10(3): 103–113. DOI:10.1007/PL00001811 |
| [] | Huber D P W, Gries R, Borden J H, et al. 1999. Two pheromones of coniferophagous bark beetles found in the bark of nonhost angiosperms. Journal of Chemical Ecology, 25(4): 805–816. DOI:10.1023/A:1020892700653 |
| [] | Kelley S T, Farrel B D. 1998. Is specialization a dead end? The phylogeny of host use in Dendroctonus bark beetles (Scolytidae). Evolution, 6(52): 1731–1743. |
| [] | Klimetzek D, Khler J, Krohn S, et al. 1989. Das pheromone-system des waldreben-borkenkfers, Xylocleptes bispinus. Journal of Applied Entomology, 107(1-5): 304–309. DOI:10.1111/jen.1989.107.issue-1-5 |
| [] | Kurz W A, Dymond C C, Stinson G, et al. 2008. Mountain pine beetle and forest carbon feedback to climate change. Nature, 452(7190): 987–990. DOI:10.1038/nature06777 |
| [] | Lei H, Vickers N. 2008. Central processing of natural odor mixtures in Insects. Journal of Chemical Ecology, 34(7): 915–927. DOI:10.1007/s10886-008-9487-2 |
| [] | McLean S, Brandon S, Boyle R R, et al. 2008. Development of tolerance to the dietary plant secondary metabolite 1, 8-cineole by the Brushtail Possum (Trichosurus vulpecula). Journal of Chemical Ecology, 34(5): 672–680. DOI:10.1007/s10886-008-9463-x |
| [] | Miller D R, Borden J H, Slessor K N. 1996. Enantiospecific pheromone production and profiles for populations of pine engraver, Ips pini (Say) (Coleoptera: Scolytidae), in British columbia. Journal of Chemical Ecology, 22(11): 2157–2172. DOI:10.1007/BF02040100 |
| [] | Poland T M, Borden J H. 1998. Disruption of secondary attraction of the spruce beetle, Dendroctonus rufipennis, by pheromones of two sympatric species. Journal of Chemical Ecology, 24(1): 151–166. DOI:10.1023/A:1022349214966 |
| [] | Poland T M, Haack R A. 2000. Pine shoot beetle, Tomicus piniperda (Coleoptera: Scolytidae), responses to common green leaf volatiles. Journal of Applied Entomology, 124(2): 63–69. DOI:10.1046/j.1439-0418.2000.00448.x |
| [] | Poland T M, DeGroot P, Burke S, et al. 2004. Semiochemical disruption of the Pine Shoot Beetle, Tomicus piniperda (Coleoptera: Scolytidae). Environmental Entomology, 33(2): 221–226. DOI:10.1603/0046-225X-33.2.221 |
| [] | Poland T M, Pureswaran D S, Ciaramitaro T M, et al. 2009. 1-octen-3-ol is repellent to Ips pini (Coleoptera: Curculinidae: Scolytinae) in the midwestern United States. Canadian Entomologist, 141(2): 158–160. DOI:10.4039/n09-002 |
| [] | Pureswaran D S, Gries R, Borden J H. 2004. New repellent semiochemicals for three species of Dendroctonus (Coleoptera: Scolytidae). Chemoecology, 14(2): 67–75. DOI:10.1007/s00049-003-0260-2 |
| [] | Reddy G V P, Guerrero A. 2004. Interactions of insect pheromones and plant semiochemicals. Trends in Plant Science, 9(5): 253–261. DOI:10.1016/j.tplants.2004.03.009 |
| [] | Schlyter F, Birgersson G. 1999. Forest beetles//Hardie R J, Minks A K. Pheromones of Non-Lepidopteran Insects Associated with Agricultural Plants, CAB International, Wallingford, UK, 113-148. |
| [] | Schlyter F, Byers J A, Lofqvist J, et al.1988. Reduction of attack density of the bark beetles Ips typographus and Tomicus piniperda on host bark by verbenone inhibition of attraction to pheromone and host kairomone//Payne T L, Saarenmaa H. Intergrated Control of Scolytid Bark Beetles. Proceedings of the IUFRO Working Party on Bark Beetles Symposium. Blacksburg: Virginia Tech Press, 53-68. |
| [] | Schlyter F, Birgersson G, Leufven A. 1989. Inhibition of attraction to aggregation pheromone by verbenone and ipsenol: Density regulation mechanisms in bark beetle Ips typographus.. Journal of Chemical Ecology, 15: 2263–2277. DOI:10.1007/BF01014114 |
| [] | Schlyter F, Lofqvist J, Jakus R. 1995. Green leaf volatiles and verbenone modify attraction of European Tomicus, Hylurgops, and Ips bark beetles//Hain F P, Salom S M, Ravlin F F, et al. Behavior, Population Dynamics and Control of Forest Insects. Proceedings of A Joint IUFRO Working Party Conference. Feb. 1994. Ohi State Univ, OARDC, Wooster, 29-44. |
| [] | Schlyter F, ZhangQ H, Anderson P, et al. 2000. Electrophysiological and behavioural responses of Tomicus piniperda and Tomicus minor (Coleoptera: Scolytidae) to non-host leaf and bark volatiles. The Canadian Entomologist, 132(6): 965–981. DOI:10.4039/Ent132965-6 |
| [] | Silbering A F, Okada R, Ito K, et al. 2008. Olfactory information processing in the drosophila antennal lobe: Anything goes?. Journal of Neuroscience, 28(49): 13075–13087. DOI:10.1523/JNEUROSCI.2973-08.2008 |
| [] | Song L W, Zhang Q H, Chen Y Q, et al. 2011. Field responses of the Asian larch bark beetle, Ips subelongatus, to potential aggregation pheromone components: disparity between two populations in northeastern China. Insect Science, 18(3): 311–319. DOI:10.1111/ins.2011.18.issue-3 |
| [] | Tømmerås B Å, Mustaparta H. 1989. Single cell responses to pheromones, host and non-host volatiles in the ambrosia beetle Trypodendron lineatum. Entomologia Experimentalis et Applicata, 52(2): 141–148. DOI:10.1111/eea.1989.52.issue-2 |
| [] | Tømmerås B Å. 1989. Host selection by odourous compounds from host and non-host trees in bark beetles. Fauna Norv Ser B, 36: 75–79. |
| [] | Wermelinger B. 2004. Ecology and management of the Spruce bark beetle, Ips typographus-a review of recent research. Forest Ecology and Management, 202(1-3): 67–82. DOI:10.1016/j.foreco.2004.07.018 |
| [] | Wilson I M, Borden J H, Gries R, et al. 1996. Green leaf volatiles as antiaggregants for the mountain pine beetle, Dendroctonus ponderosae Hopkins (Coleoptera: Scolytidae). Journal of Chemical Ecology, 22(10): 1861–1875. DOI:10.1007/BF02028509 |
| [] | Witzgall P, Kirsch P, Cork A. 2010. Sex pheromones and their impact on pest management. Journal of Chemical Ecology, 36(1): 80–100. DOI:10.1007/s10886-009-9737-y |
| [] | Wood D L. 1982. The role of pheromones, kairomones and allomones in the host selection and colonization of bark beetles. Annu Rev Entomol, 27: 411–446. DOI:10.1146/annurev.en.27.010182.002211 |
| [] | Wood S L A. 1986. A reclassification of the genera of Scolytidae (Coleoptera). Great Basin Naturalist Memoirs, 10: 2–3. |
| [] | Zhang Q H. 2000. Nonhost volatiles and their roles in the host selection of conifer bark beetles. Introductory Paper (No. 2), Chemical Ecology, Department of Crop Sciences, Swedish University of Agricultural Sciences: 32. |
| [] | Zhang Q H, Birgersson G, Zhu J W, et al. 1999. Leaf volatiles from nonhost deciduous trees: variation by tree species, season, and temperature and electrophysiological activity in Ips typographus. Journal of Chemical Ecology, 25(8): 1923–1943. DOI:10.1023/A:1020994119019 |
| [] | Zhang Q H, Liu G T, Schlyter F, et al. 2001. Olfactory responses of Ips duplicatus from Inner Mongolia, China to monhost leaf and bark volatiles. Journal of Chemical Ecology, 27(5): 995–1009. DOI:10.1023/A:1010395221953 |
| [] | Zhang Q H, Schlyter F. 2004. Olfactory recognition and behavioural avoidance of angiosperm nonhost volatiles by conifer-inhabiting bark beetles. Agricultural and Forest Entomology, 6: 1–19. DOI:10.1111/afe.2004.6.issue-1 |
| [] | Zhang Q H, Schlyter F, Birgersson G. 2000. Bark volatiles from nonhost angiosperm trees of spruce bark beetle, Ips typographus (L.) (Coleoptera: Scolytidae): Chemical and electrophysiological analysis.. Chemoecology, 10: 69–80. DOI:10.1007/s000490050010 |
| [] | Zhang Q H, Schlyter F, Chen G F, et al. 2007. Electrophysiological and behavioral responses of Ips subelongatus to semiochemicals from its hosts, non-hosts, and conspecifics in China. Journal of Chemical Ecology, 33(2): 391–404. DOI:10.1007/s10886-006-9231-8 |
| [] | Zhang Q H, Tollasch T, Schlyter F, et al. 2002. Enantiospecific antennal response by bark beetles (Coleoptera: Scolytidae) to the spiroacetal E-conophthorin. Journal of Chemical Ecology, 28(9): 1839–1852. DOI:10.1023/A:1020569303433 |
 2012, Vol. 48
2012, Vol. 48