文章信息
- 肖向红, 马建章, 苗慧敏, 申屠德君, 张晶钰, 柴龙会
- Xiao Xianghong, Ma Jianzhang, Miao Huimin, Shentu Dejun, Zhang Jingyu, Chai Longhui
- 电刺激后东北林蛙皮肤分泌物及其抗微生物肽组分的动态恢复
- Dynamics of Skin Secretion and Antimicrobial Peptides of the Frog Rana dybowskii after Electronic Stimulation
- 林业科学, 2012, 48(12): 71-76.
- Scientia Silvae Sinicae, 2012, 48(12): 71-76.
-
文章历史
- 收稿日期:2012-03-26
- 修回日期:2012-07-12
-
作者相关文章
两栖类在长期进化过程中为防御环境病原微生物等有害因子对机体的侵害,逐渐建立了通过皮肤分泌抗微生物肽(antimicrobial peptides,AMPs)抵御外来微生物侵袭的天然免疫防御体系(Beutler,2004)。近20年来,全球两栖类种群数量急剧减少,不少物种几乎濒临灭绝(Stuart et al., 2004;Mendelson et al., 2006)。相对于其他动物,两栖类有着独特的生理特征和生活史,对环境的变化更为敏感,但两栖类机体又有着较为完善的固有性和适应性免疫系统,其数量剧降颇令人费解。现在普遍认为是多种环境因素的共同作用导致了两栖类种群数量的减少(Rollins-Smith,2009;Blaustein et al., 2011),这些因素包括栖息环境的破坏(Hayes et al., 2010)、气候变化(Rohr et al., 2010)、紫外线增强(Pahkala et al., 2001)、外来物种入侵(Alford et al., 2001)和病原微生物感染导致的疾病暴发(Crawford et al., 2010; Daszark et al., 1999)。
抗微生物肽作为先天免疫系统的重要组分,在每个物种都表现出高度的多样性,尤其是包括东北林蛙(Rana dybowskii)在内的蛙科动物(Brogden,2005)。相关研究已经通过cDNA克隆和ESI-MS/MS技术在东北林蛙皮肤分泌物中发现了13种抗菌肽(Jin et al., 2009)。不同种类抗菌肽的抗菌活性有较大差异,其抗菌谱也明显不同,如Protegrins类抗菌肽具有多种活性,显示了其功能的多效性和广谱性(Bellm et al., 2000);而Magainins类抗菌肽活性则比较单一,显示了其功能的高效性和专一性(Magainins,1987)。然而,当两栖类面临外界环境因子刺激,其皮肤颗粒腺以全分泌方式外排分泌物后,分泌物及其抗菌肽组分的恢复规律和生物学意义尚不清楚。本研究选择东北林蛙,利用外加刺激排空储存于皮肤颗粒腺内的分泌物,在刺激后不同时间收集颗粒腺重新合成的分泌物,以期探讨林蛙皮肤分泌物及其抗菌肽组分的恢复规律。
1 材料与方法 1.1 材料与仪器试验材料:东北林蛙于2008年10月采自黑龙江省通河林业局龙口林场,400只,成年雄性健康个体,体重17.0±0.8 g。
试验仪器:Ultrospec 2100 pro,高效液相色谱仪(Waters 600E),双极刺激器,LGJ-18型冷冻干燥机,RM6420B生物信号采集系统,LTQ VELOS(Thermo Finnigan,San Jose,CA)
1.2 试验方法 1.2.1 皮肤分泌物收集与处理将400只东北林蛙随机分为8组,每组50只。将各组第1天收集的皮肤分泌物(为电刺激前储存于腺体的分泌物)作为对照,标记为对照组(即第1天组)。将分别间隔1,2,3,4,5,6,7,10,20天(2个电刺激间隔时间)收集的皮肤分泌物(为电刺激后腺体的新分泌物)作为各试验组,分别标记为第2,3,4,5,6,7,11,21天组(第8天组因个体死亡而数据缺失)。
皮肤分泌物收集方法:采用温和电刺激收集东北林蛙皮肤分泌物。试验前用去离子水冲洗蛙后置冰浴托盘中,RM6420B生物信号采集系统电刺激蛙背部皮肤收集分泌物。多点电刺激(30 V,15 mA,3 s)蛙背部皮肤及耳后腺(Duda et al., 2002;Zairi et al., 2005)。每组5个样品,10只蛙的分泌物组成一个样品,去离子水用量为50 mL;测定其OD值后冻干,-20 ℃保存备用。
1.2.2 皮肤分泌物的高效液相分离皮肤分泌物冻干粉15 mg,0.1%TFA水溶液600 μL溶解,12 000 r·min-1离心10 min,取上清反相高效液相分离(RP-HPLC),分离柱waters C18;洗脱液体积配比为0.1%TFA水:甲醇:乙腈=90:5:5,洗脱速度0.5 mL·min-1,上样体积20 μL,洗脱时间45 min,检测波长λ=216 nm。记录各洗脱峰保留时间和峰面积。
1.2.3 皮肤分泌物抑菌试验皮肤分泌物冻干粉15 mg,0.1%TFA水溶液100 μL溶解,采用琼脂板扩散法测定各皮肤分泌物组分对大肠杆菌(Escherichia coli ATCC25922)和金色葡萄球菌(Staphylococcus aureus ATCC25923)的抑菌活性。
1.2.4 皮肤分泌物组分峰的质谱分析和测序对收集的组分峰进行ESI-MS/MS分析及序列测定,得到的原始质谱图用BIOWORKS软件比对,搜索相关数据库,获得多肽鉴定结果。
1.2.5 数据处理试验数据均以mean±SD表示,用SPSS 16.0软件进行分析。不同时间分泌物的恢复率和对2种细菌的抑菌活性采用单因素方差分析,P < 0.05表示差异显著。
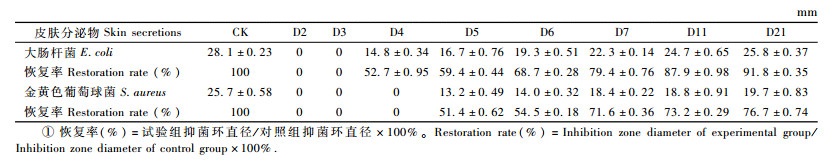
2 结果与分析 2.1 不同刺激间隔时间皮肤分泌物OD值比较以对照组东北林蛙皮肤分泌物OD280值为参照,比较各试验组皮肤分泌物的恢复率(相对含量)(%)(图 1)。第2次电刺激后,第2天组OD280值迅速降至0.05±0.013,仅为对照组的1.69%,第3,4天组略有回升趋势,恢复率仅为3.85%和7.04%,均较对照组有极显著降低(P < 0.01,n=5),从第5天组开始OD280值迅速回升至0.91±0.051,恢复率为33.91%;第6,7天组的恢复率分别为50.21%和58.81%,且第7,11,21天组(58.81%,61.93%,65.29%)间差异不显著(P>0.05,n=5)。
|
图 1 以对照组为参照各试验组东北林蛙皮肤分泌物量的变化 Fig.1 The dynamic of R. dybowskii skin secretions expression from experimental groups with control group as a reference D2,D3,……,D21:第2,3,……,21天收集的分泌物 The secretions collected on the second, third, …, twenty first day. |
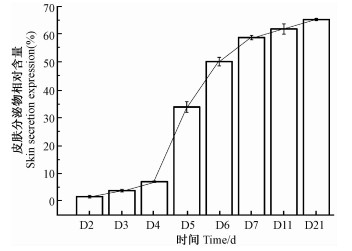
各试验组在216 nm处获得的皮肤分泌物HPLC图谱见图 2。各试验组分泌物HPLC的总峰面积恢复也呈S型,与OD值的恢复相比,第2~4天组HPLC洗脱峰总面积的恢复明显高于OD值的恢复,第5天开始两者的关系则相反。各试验组的洗脱峰总面积分别为对照组的9.88%,16.30%,18.77%,27.79%,31.83%,54.83%,52.62%,50.75%(表 1)。
|
图 2 各组东北林蛙皮肤分泌物的HPLC图谱 Fig.2 The RP-HPLC profiles of R. dybowskii skin secretions from experimental groups A:对照组CK;B—H:第2,3,4,5,7,11,21天组 Day 2, 3, 4, 5, 7, 11, 21 group, respectively. |
|
|
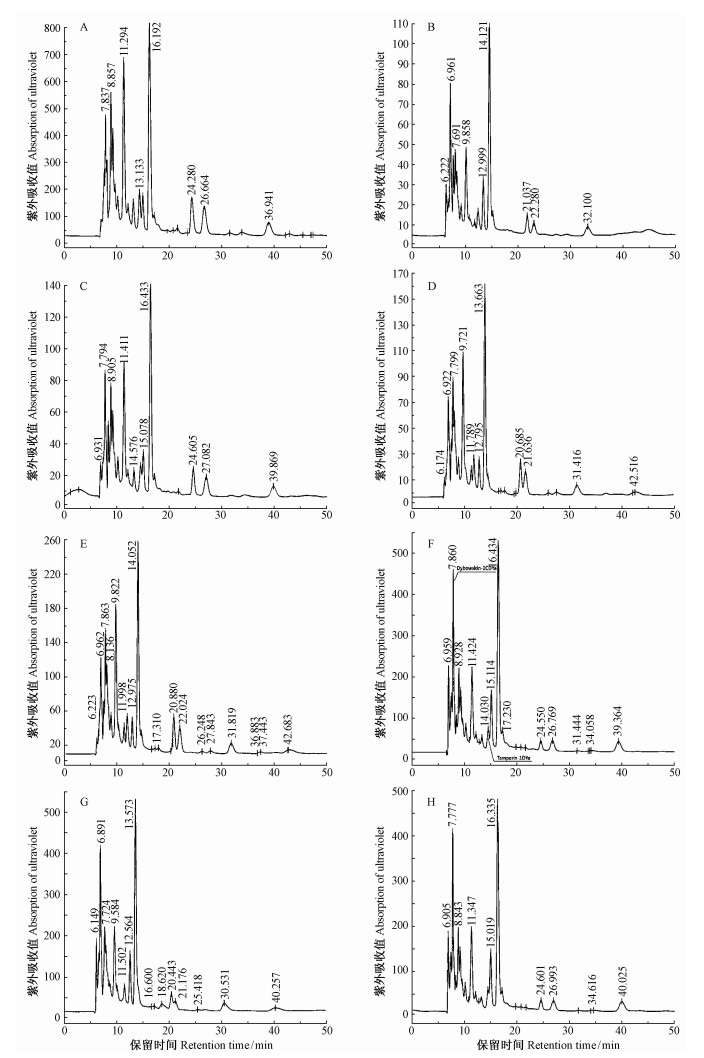
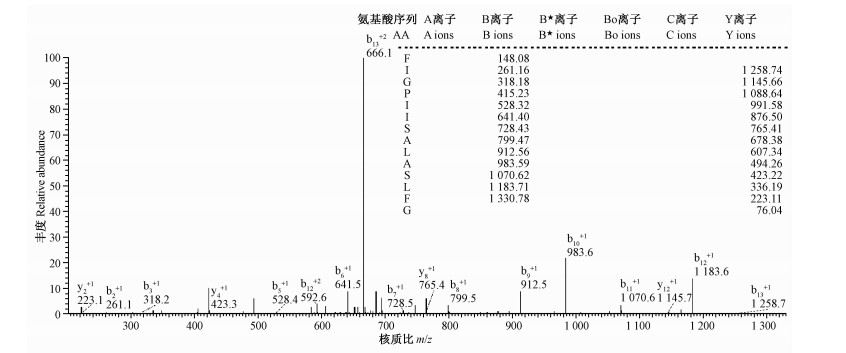
由各洗脱峰面积可知:每个组分的恢复速率都有较大差异,如第7天组中保留时间为7.86 min的波峰为对照组的107.55%,而该组中保留时间为24.55 min的波峰仅为对照组的14.0%。第7天组中保留时间为7.86 min和14.03 min的组分峰的恢复速率较快且高于对照组的相应峰。将以上组分峰进行ESI-MS/MS质谱测序(图 3,4),搜库结果分别为Dybowskin-1CDYa:IIPLPLGYFAKKT和Temperin-1DYa:FIGPIISALASLFG。
|
图 3 Dybowskin-1CDYa(保留时间为7.86 min)组分峰质谱鉴定 Fig.3 Mass spectrometry analysis of the component peak (Elution time is 7.86 min) y,b:肽键断裂点Breaking point of peptide bond;y型离子包括肽的C端,b型离子包括肽的N端。y-type ions include C-terminal,b-type ions include N-terminal.下同The same below. |
|
图 4 Temperin-1DYa(保留时间为14.03 min)组分峰质谱鉴定 Fig.4 Mass spectrometry analysis of the component peak (Elution time is 14.03 min) |
大肠杆菌和全黄色葡萄球菌的抑菌活性检测显示:第2天组对大肠杆菌抑菌活性降至0,第4,5,6,7,11,21天组的大肠杆菌抑菌活性逐渐恢复至对照组(第1天组)的52.7%,59.4%,68.7%,79.4%,87.9%,91.8%(表 2)。对金黄色葡萄球菌的抑菌活性在第2,3,4天组均为0,第5,6,7,11,21天组抑菌活性逐渐恢复至对照组的51.4%,54.5%,71.6%,73.2%,76.7%。表明电刺激后2~4天,东北林蛙皮肤分泌物的抑菌活性丧失,但分泌物抑菌活性随刺激间隔时间延长逐渐恢复,其对大肠杆菌抑菌活性的恢复较金黄色葡萄球菌显著(P<0.05,n=3)。
|
|
栖息环境复杂多样,且皮肤裸露、表面光滑湿润、渗透性强,对环境变化极为敏感,这为环境中病原微生物的入侵提供了良好条件。在长期进化过程中,两栖类为适应生态环境变化并与环境病原微生物抗衡,逐渐建立了非特异性防御机制,其皮肤分泌的抗微生物肽在两栖类先天免疫防御中扮演着重要角色,极大地提高了机体的适应和生存能力(武正军等,2004;Rollins-Smith et al., 2009)。环境中大量微生物与两栖类体表细胞直接接触,通过进行物质、能量、信息交换,以及对宿主的免疫、应激刺激、生物拮抗等作用,在定性、定量、定位等方面形成了相对稳定的微生态平衡(Rollins-Smith et al., 2005)。但当两栖类机体受到其他环境因子刺激时,应激刺激就会打破这种生态平衡,储存在其皮肤颗粒腺体内的物质就会以全分泌形式释放到体表,使机体表现出与刺激种类无关的非特异性防御反应,而刺激强度又是影响机体应激反应的关键因素(Olff,1999;Louise et al., 2005)。现有研究主要通过电刺激(Jin et al., 2009)、淋巴囊注射去甲肾上腺素和甲醇萃取皮肤组织(Michael et al., 1992)等方法获取两栖类皮肤分泌物。其中电刺激法比较温和,对机体的伤害较小,机体对该刺激的防御应答也更接近自然状态下其对环境因子的反应(Michael et al., 1992),故本研究采用电刺激方式释放和收集东北林蛙皮肤分泌物。
本研究中,电刺激后第2~21天的皮肤分泌物由最初抑制状态逐渐呈现恢复的变化趋势,且第5~7天皮肤分泌物OD值迅速增加,随后明显减缓(图 1),第7,11,21天组间差异不显著(P>0.05,n=5)。表明两栖类在发生应激反应后的1~3天,机体免疫防御能力较低;7天后机体处于相对缓慢的恢复状态,此时分泌量和所含抗微生物肽浓度可能是东北林蛙抵御外来微生物侵袭的一个恢复阈值。以上结果显示:如果两栖类在受到微生物侵袭或体表损伤后的1~3天内再次受到有害环境因子的胁迫,由于其机体先天免疫能力低下可能会对其生存造成较大威胁;第7天时机体先天免疫能力恢复到相对稳定状态,可以有效地进行自身防御。
通过OD值变化还发现:刺激间隔大于6天以上的分泌物OD值仅恢复至最初水平的53.5%~ 64.0%(图 1),而高效液相图谱显示的部分组分(图 2)以及分泌物的抑菌活性则恢复至最初水平的70.0%~91.8%(表 2),说明分泌物中各多肽组分的恢复时间并非完全同步。恢复较快的组分经ESI-MS/MS鉴定为Dybowskin-1CDYa(Jin et al., 2009)和Temperin-1DYa (Tu et al., 2012),2组分均有较强的抑菌活性。而有抑菌活性的肽类恢复速率高于皮肤总分泌物的恢复速率,说明分泌物中抗微生物肽的恢复优先于其他组分,这可能是两栖类动物机体为适应外界刺激所采取的一种防御性机制。
| [] | 武正军, 李义明. 2004. 两栖类种群数量下降原因及保护对策. 生态学杂志, 23(1): 140–146. |
| [] | Alford R A, Dixon P M, Pechmann J H. 2001. Ecology: Global amphibian population declines. Nature, 412: 499–500. DOI:10.1038/35087658 |
| [] | Bellm L, Lehrer R I, Ganz T. 2000. Protegrins: New antibiotics of mammalian origin. Expert Opin Investig Drugs, 9(8): 1731–1742. DOI:10.1517/13543784.9.8.1731 |
| [] | Beutler B. 2004. Innate immunity: an overview. Mol Immunol, 40(12): 845–859. DOI:10.1016/j.molimm.2003.10.005 |
| [] | Blaustein A R, Han B A, Relyea R A, et al. 2011. The complexity of amphibian population declines: Understanding the role of cofactors in driving amphibian losses. Ann N Y Acad Sci, 1223: 108–119. DOI:10.1111/j.1749-6632.2010.05909.x |
| [] | Brogden K A. 2005. Antimicrobial peptides: Pore formers or metabolic inhibitors in bacteria?. Nat Rev Microbiol, 3(3): 238–250. DOI:10.1038/nrmicro1098 |
| [] | Crawford A J, Lips K R, Bermingham E, et al. 2010. Epidemic disease decimates amphibian abundance, species diversity, and evolutionary history in the highlands of central Panama. Proc Natl Acad Sci USA, 107(31): 13777–13782. DOI:10.1073/pnas.0914115107 |
| [] | Daszak P L, Berger A A, Cunningham A D, et al. 1999. Emerging infectious diseases and amphibian population declines. Emerg Infect Dis, 5: 735–748. DOI:10.3201/eid0506.990601 |
| [] | Duda T F Jr, Vanhoye D, Nicolas P. 2002. Roles of diversifying selection and coordinated evolution in the evolution in the evolution of amphibian antimicrobial peptides. Mol Biol Evol, 19: 858–864. DOI:10.1093/oxfordjournals.molbev.a004143 |
| [] | Hayes T B, Falso P, Gallipeau S, et al. 2010. The cause of global amphibian declines: a developmental endocrinologist's perspective. J Exp Biol, 213(6): 921–933. DOI:10.1242/jeb.040865 |
| [] | Jin L L, Li Q, Song S S, et al. 2009. Characterization of antimicrobial peptides isolated from the skin of the Chinese frog, Rana dybowskii. Comp Biochem Physiol, 154(2): 174–178. DOI:10.1016/j.cbpb.2009.05.015 |
| [] | Louise A, Rollins-Smith J M C. 2005. Antimicrobial peptide defenses against chytridiomycosis, an emerging infectious disease of amphibian populations. Developmental & Comparative Immunology, 29: 589–598. |
| [] | Magainins Z M. 1987. Magainins, a class of antimicrobial peptides from Xenopus skin: isolation, characterization of two active forms, and partial cDNA sequence of a precursor. Proceedings of the National Academy of Science of USA, 84: 5449–5453. DOI:10.1073/pnas.84.15.5449 |
| [] | Mendelson J R, Lips K R, Gagliardo R W, et al. 2006. Biodiversity. confronting amphibian declines and extinctions. Science, 313(5783): 48. DOI:10.1126/science.1128396 |
| [] | Michael J T, Stone D J, Bowie J H. 1992. A novel method for the release and collection of dermal, glandular secretions from the skin of frogs. J Pharmacol Toxicol Methods, 28: 199–200. DOI:10.1016/1056-8719(92)90004-K |
| [] | Olff M. 1999. Stress, depression and immunity: the role of defense and copingstyles. Psychiatry Research, 85(1): 7–15. DOI:10.1016/S0165-1781(98)00139-5 |
| [] | Pahkala M, Laurila A, Merila J. 2001. Carry-over effects of ultraviolet-B radiation on larval fitness in Rana temporaria. Proc Biol Sci, 268(1477): 1699–1706. DOI:10.1098/rspb.2001.1725 |
| [] | Rohr J R, Raffel T R. 2010. Linking global climate and temperature variability to widespread amphibian declines putatively caused by disease. Proc Natl Acad Sci USA, 107(18): 8269–8274. DOI:10.1073/pnas.0912883107 |
| [] | Rollins-Smith L A. 2009. The role of amphibian antimicrobial peptides in protection of amphibians from pathogens linked to global amphibian declines. Biochim Biophys Acta, 1788(8): 1593–1599. DOI:10.1016/j.bbamem.2009.03.008 |
| [] | Rollins-Smith L A, Ramsey J P, Reinert L K, et al. 2009. Immune defenses of Xenopus laevis against Batrachochytrium dendrobatidis. Front Biosci (Schol Ed), 1: 68–91. DOI:10.2741/s8 |
| [] | Rollins-Smith L A, Reinert L K, O'Leary C J, et al. 2005. Antimicrobial peptide defenses in amphibian skin. Integr Comp Biol, 45(1): 137–142. DOI:10.1093/icb/45.1.137 |
| [] | Stuart S N, Chanson J S, Cox N A, et al. 2004. Status and trends of amphibian declines and extinctions worldwide. Science, 306: 1783–1786. DOI:10.1126/science.1103538 |
| [] | Tu C T, Han B, Yao Q Y, et al. 2012. Curcumin attenuates Concanavalin A-induced liver injury in mice by inhibition of Toll-like receptor (TLR) 2, TLR4 and TLR9 expression. Int Immuno Pharmacol, 12: 151–157. DOI:10.1016/j.intimp.2011.11.005 |
| [] | Zairi A, Belaid A, Gahbiche A, et al. 2005. Spermicidal activity of dermaseptins. Contraception, 72(6): 447–453. DOI:10.1016/j.contraception.2005.06.055 |
 2012, Vol. 48
2012, Vol. 48