文章信息
- 刘晓娟, 朱丽娟, 杨秋生, 栗燕
- Liu Xiaojuan, Zhu Lijuan, Yang Qiusheng, Li Yan
- 根域限制对牡丹叶片碳代谢的影响
- Effects of Root Restriction on Carbohydrate Metabolism in Tree Peony (Paeonia suffruticosa) Leaves
- 林业科学, 2012, 48(12): 53-57.
- Scientia Silvae Sinicae, 2012, 48(12): 53-57.
-
文章历史
- 收稿日期:2011-12-13
- 修回日期:2012-03-21
-
作者相关文章
2. 郑州师范学院 郑州 450044;
3. 郑州航空工业管理学院 郑州 450015
2. Zhengzhou Normal University Zhengzhou 450044;
3. Zhengzhou Institue of Aeronautical Industry Management Zhengzhou 450015
根域限制在植物育苗和栽培中较为普遍,特别是在果树栽培种更为常见。根域限制下植物生长活力低,新梢生长、枝条伸长和直径增粗受抑制,叶面积减少,干质量和鲜质量降低(Mataa et al., 1998;Rieger,1994;Robbins et al., 1998)。牡丹(Paeonia suffruticosa)是我国著名的观赏花卉和备选国花。牡丹苗至少要生长3年以上才能开花(Shu et al., 2009),其最佳观赏时期是在青壮年期(10~40年)(李嘉珏等,2011)。目前牡丹种植产业以大田种植为主,牡丹在大田里生长良好,花大色艳,而盆栽时,根系生长受限,生长趋于缓慢,花蕾小且常败育(刘志敏等,2008)。杨天仪(2007)发现根域限制降低光合产物在地上部分营养器官的分配比例,增加了在根系和果实2种库器官的分配比例。谢兆森等(2008;2009)发现葡萄(Vitis amuresis)根域限制后,用于营养生长的养分减少,用于生殖生长的养分增加,使果实获得更多的养分,显著提高果实品质。这说明根域限制下植物碳水化合物的代谢和分配发生了变化。碳水化合物是影响植物生长发育最重要的因素,碳代谢决定植物的源库关系并控制着碳在各种植物器官中的分区和分布,是植物生长、产量等方面的基础(Slewinski et al., 2010)。本文研究根域限制对牡丹叶片碳代谢的影响,探索根域限制影响牡丹的机制,为牡丹盆栽提供理论和技术支持。
1 材料与方法 1.1 材料与处理试验于2009年10月—2011年11月在河南农业大学毛庄科教园区和林学院生理生化实验室进行。以在中原地区长势最好的‘洛阳红’(8年生)牡丹为试材。2009年10月下旬选择株高、长势一致的分株苗80株,盆栽40株作为处理,大田栽培40株作为对照。盆栽与大田栽培所用基质一致(80%的园土,15%河沙,5%的鸡粪)。塑料花盆,盆高40 cm,直径35 cm。共分10行8列,对照和处理相间排列,株行距为80 cm×100 cm,花盆底部1/3置于地面以下防止倒伏。每年在开花前、开花后和入冬前分3次进行施肥,遇干旱时适当浇水。分别在2010年和2011年的叶萌发期(3月22号前后)、展叶期(3月29号前后)、叶旺盛生长期(4月5号前后)、开花前期(4月11号前后)、盛花期(4月18号前后)、开花后期(4月25号前后)和叶片放大期(5月2号前后)取样。于晴天的9:00—13:00选取牡丹上部花枝下数第2复叶的顶部小叶测光合速率,之后采下整片复叶作为样品,用清水洗净,经液氮处理后贮存于-70 ℃超低温冰箱中备用。每次取样,盆栽和大田牡丹各取5株。
1.2 测定项目及试验方法净光合速率Pn用美国PPystem公司生产的CIRAS-2光合仪测定,叶绿素含量测定采用无水乙醇和丙酮1:1 (V/V)混合遮光冷浸法。以叶旺盛生长期、盛花期和叶片放大期3个时期的叶片为代表,用叶形纸称质量法测定叶面积。
碳水化合物的测定按照张志良等(2009)的方法。取牡丹叶片在110 ℃烘箱内杀青15 min,调温至70 ℃过夜。干叶片磨碎后称取50 mg样品,倒入10 mL刻度离心管,加入4 mL 80%乙醇,80 ℃水浴中不断搅拌40 min,冷却后离心,收集上清液,其残渣加2 mL 80%乙醇重复提取2次,合并上清液;在上清液中加入10 mg活性炭,80 ℃脱色30 min,用80%乙醇定容至10 mL,过滤后取滤液测定可溶性总糖、蔗糖、葡萄糖和果糖。淀粉的测定:将植物提取液的残渣用1 mol·L-1的盐酸8 mL洗入25 mL三角瓶中,摇匀后烘箱105 ℃加热3.5 h,冷却后加10%NaOH 3 mL中和,蒸馏水定容至50 mL过滤,蒽酮比色法测可溶性总糖。淀粉含量计算公式为C=AN×0.9/W(W为样品干质量;A为标准曲线查得的糖量;N为样品提取液占样品反应液的倍数)。
蔗糖磷酸合成酶(SPS,EC 2.4.1.14))、酸性转化酶(AI,EC 3.2.1.26)、中性转化酶(NI,EC 3.2.1.26)活性的测定参照米国全(2011)的方法。
1.3 数据处理与分析数据是平均值±SE(n=3~5),用SPSS统计分析软件(Ver.12.0)进行独立样本t-检测来分析盆栽和大田栽培之间的差异。
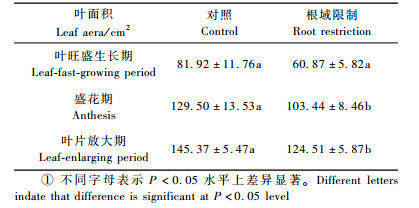
2 结果与分析 2.1 根域限制对牡丹叶片Pn、叶绿素含量和叶面积的影响根域限制和对照牡丹叶片中叶绿素含量都随叶片的生长而增加。盛花期之前,根域限制下牡丹叶片的叶绿素含量低于对照。在叶萌发期、展叶期和开花前期,显著低于对照(P < 0.05)。在开花后期高于对照,但差异不显著(图 1)。
|
图 1 根域限制对牡丹叶片叶绿素含量和净光合速率的影响 Fig.1 Effect of root restriction on Pn in the leaves of tree peony 柱状图上aa,ab和AB分别表示差异不显著,在P < 0.05,P < 0.01水平上差异显著 aa, ab and AB above the standard error bars indicate that difference is not significant, difference is significant at P < 0.05, P < 0.01 levels, respectively. |
根域限制和对照牡丹的Pn都随着叶片的生长而增加,都在盛花期达到最高值后下降。根域限制下牡丹的Pn增加幅度不明显,对照牡丹的Pn变化幅度明显。在叶旺盛生长期、开花前期、盛花期、开花后期、叶片放大期,根域限制的Pn值分别是对照的59.54%, 61.81%, 48.83%, 43.87%, 32.64%,与对照差异极显著(图 1)。叶旺盛生长期之前,根域限制对叶面积无影响。在盛花期和叶片放大期,叶面积低于对照,且差异显著(表 1)。
|
|
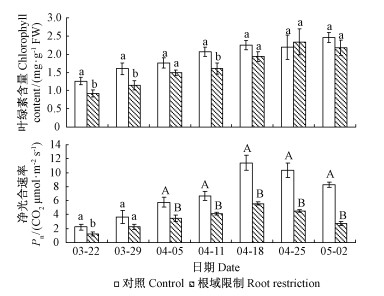
盛花期之前,根域限制和对照牡丹叶片中的蔗糖、己糖、淀粉含量基本都随着叶片的增大而增加。在叶萌发期、展叶期、叶旺盛生长期、开花前期和叶片放大期这5个时期,根域限制牡丹叶片的蔗糖含量低于对照,分别是对照的39.99%,47.35%,58.79%,79.87%,69.51%,且差异显著;在盛花期和开花后期,蔗糖的含量高于对照,分别是对照的117.92%和118.28%。展叶期、叶旺盛生长期、开花前期、盛花期、开花后期、叶片放大期,己糖含量分别是对照的85.28%,75.11%,85.39%,71.88%,77.82%,77.15%,显著低于对照。与开花前期相比,根域限制牡丹叶片中己糖含量在盛花期增加29.43%,对照则增加53.74%(图 2)。
|
图 2 根域限制对牡丹叶片碳水化合物含量的影响 Fig.2 Effects of root restriction on the carbohydrate content in the leaves of tree peony |
淀粉是植物碳水化合物存储的主要形式,当库需求增加时,淀粉水解为植物提供能量。对照牡丹就表现出这样的趋势,在盛花期,淀粉含量降低,水解变成蔗糖运到花器官供开花所用。根域限制下淀粉含量一直增加,开花后期达到最高。叶萌发期、展叶期、叶旺盛生长期、开花前期、叶片放大期,淀粉含量低于对照,分别是对照的71.54%,61.01%,56.23%,49.83%,62.40%,且差异显著;在盛花期和开花后期,淀粉含量高,与对照差异不显著(图 2)。
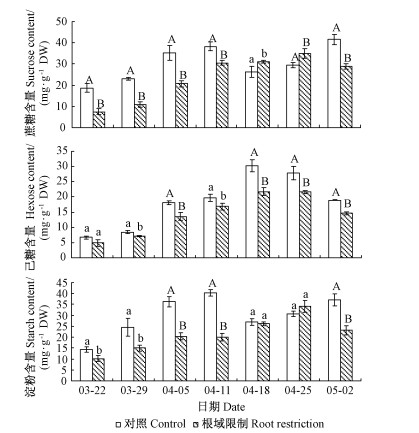
2.3 根域限制对牡丹叶片蔗糖代谢酶活性的影响转化酶只不可逆地把蔗糖转化成葡萄糖和果糖,为组织提供碳源。快速生长的组织总是有较高水平的AI活性,NI的活性要比AI活性低很多,且随着组织的生长没有任何明显的改变(张明方,2002)。由图 3可知:根域限制下,牡丹叶片AI的活性最高值出现在开花前期,说明这个时期是其旺盛生长期;对照AI活性的最高值出现在盛花期,这与该时期库强较大、蔗糖水解迅速并运输到库器官紧密联系。在叶萌发期、展叶期、叶旺盛生长期、盛花期、开花后期、叶片放大期,根域限制牡丹叶片的AI活性分别是对照的56.17%,65.67%,69.67%,61.49%,78.68%,68.76%,且差异显著。根域限制牡丹叶片的NI活性总体都低于对照。无论根域限制还是对照,与AI相比,NI的活性较低,可看出AI是牡丹叶片蔗糖的主要水解酶。
|
图 3 根域限制对牡丹叶片蔗糖代谢酶活性的影响 Fig.3 Effects of root restriction on sucrose metabolizing enzymes in tree peony leaves |
SPS是控制碳合成蔗糖的关键酶(Goldschmidt et al., 1996),对光合产物尤其是蔗糖和淀粉的分配起着关键作用。由图 3可知:在所测定的所有时期,根域限制下牡丹叶片中的SPS活性都低于对照,且差异显著(图 3)。
3 结论与讨论高等植物源叶的光合作用为库器官的代谢提供动力,并且维持植物生长和发育。根部的生长是光合碳同化的一个主要代谢库,对根部的限制降低了库强,影响源库比(Barrett et al., 1995)。源库之间的不平衡会导致地上部分生长量减少,对光合碳同化有明显的负作用(Paul et al., 2001)。根域限制抑制牡丹根系的生长,导致叶面积减少(表 1),显著地降低牡丹的光合速率。库强的大小是决定光合速率高低的主要因素,如果库活力有限,就会形成信号来下调光合作用(Paul et al., 2001),根域限制下牡丹的Pn显著低于对照,说明与对照相比,其库强小。
根域限制对叶绿素含量的影响有不同的研究结果。Izaguirre-Mayorala等(1999)发现根域限制增加豇豆(Vigna unguiculata)和大豆(Glycine max)叶片中的叶绿素含量。潘静娴(2001)发现根域限制使甜瓜(Cucumis mele)叶绿素含量增加。而Hawver(1997)等发现盆栽减少了树木叶片叶绿素的含量。Campostrin等(2002)发现叶绿素含量不能反映根域限制对木瓜(Choenomeles speciosa)的影响,指出叶绿素含量不适合作为衡量根域限制逆境的一个生理指标。根域限制下的牡丹,仅在叶萌发期、展叶期和盛花期低于对照,其余时间则无显著差异,所以叶绿素含量不能解释根域限制下牡丹Pn下降的原因。
蔗糖是长距离运输主要的光合产物,蔗糖在叶片中的累积代表植株生殖发育时可获得的同化物少(Westgate et al., 1989)。淀粉是植物叶片碳水化合物存储的主要形式,当需求增加,淀粉水解为蔗糖,为植物提供能量。蔗糖只有转化为己糖(葡萄糖和果糖)后才能由源器官输送到库器官,进入细胞内进行代谢,否则会出现蔗糖的累积(张明方,2002)。盛花期和开花后期根域限制牡丹叶片中蔗糖和淀粉含量高于对照,蔗糖和淀粉在叶片中的累积,说明其花器官所获得的同化物少,同时也说明其库强小,拉动蔗糖由“源”到“库”运输的动力不足。与蔗糖含量相对应的己糖含量,对照牡丹在盛花期出现迅速增加,这可就与开花需要大量的碳水化合物有关,而根域限制下牡丹叶片己糖含量在盛花期增加较少,说明其库强小。与对照相比,根域限制下牡丹叶片中的碳水化合物向外运输被利用的少且相对缓慢。
根域限制降低了植物的光合速率(Iersel, 1997, Barrett et al., 1995;Ronchi et al., 2006;Shi et al., 2008)。Rieger(1994)和Yong等(2010)发现根域限制下光合速率的降低与气孔导度下降有关。Thomas等(1991)研究发现:在CO2充足的情况下,根域限制降低了棉花(Gossypium hirsutum)叶片中Rubisco的活性,同时对“源-库”的平衡产生影响。当小容器生长的棉花移植到更大的容器时,Rubisco再生能力增加,表明根域限制抑制光合作用是可逆的,但同时指出光合速率的降低与气孔导度的下降无关。有学者从碳水化合物供应和需求之间的不平衡进行解释,认为在根域限制下,库强减小,拉动光合产物从“源”到“库”的动力不足,叶片光合产物蔗糖、淀粉等碳水化合物含量显著升高,对光合作用产生反馈抑制作用(Goldschmidt et al., 1992)。Peterson等(1991)认为随着根部的生长,根部物质量的增加会加剧根部空间的缩小,从而使根系可获得的氧气减少,影响光合产物的运转,使光合产物在叶片中累积,光合产物对光合作用的反馈机制,使光合速率下降。由此可知:在开花期间,根域限制牡丹叶片中蔗糖和淀粉的累积也是其光合速率下降的原因。
SPS活性是反映植物叶片源强的一个重要指标,根域限制下,牡丹叶片中SPS的活性显著低于对照,说明根域限制抑制牡丹的源强。SPS与转化酶协同控制蔗糖长途运输与库组织蔗糖代谢(Park et al., 2008)。转化酶活性的高低反映库强的大小。库需要不断的蔗糖“流”来维持代谢,转化酶通过水解蔗糖来保持着源和库之间的蔗糖梯度。SPS和AI是植物感应系统中的一个部分,通过调节库的大小来调控光合作用(Nguyen-Quoc et al., 2001)。根域限制下,牡丹SPS和AI活性降低,源和库的活力都受到限制,源库之间的信息流与物质流降低,从而影响着碳代谢的中间产物,最终以光合速率下降、叶面积减少等形式表现出来。
Xie等(2009)指出根域限制下葡萄果实(库)中总糖含量提高,AI活性明显高于对照,中性转化酶的活性也高于对照。杨天仪(2007)指出限制降低光合产物在地上部分营养器官的分配比例,增加其在根系和果实2种库器官的分配。研究发现逆境条件下,植物会自动调节,将营养优先供应生殖器官(Westgate et al., 1989)。本研究发现:根域限制下牡丹叶片(源)中AI活性显著低于对照,降低了叶片中蔗糖分解和使用,这是否说明根域限制下牡丹的碳水化合物会优先供应开花所用,还需要进一步的验证。
总之,根域限制下牡丹植株的源与库的活力都受到抑制,使营养物质不能有效的运转和利用。短期的根域限制影响碳代谢中间产物的变化以及对主要代谢酶的调节,但长期的根域限制,则可能导致基因或者内源激素的改变,因此,还需要对根域限制对牡丹内源激素和分子水平上的影响进行更深入的研究。
| [] | 李嘉珏, 张西方, 赵孝庆, 等. 2011. 中国牡丹. 北京, 中国大百科全书出版社. |
| [] | 刘志敏, 孔德政, 李永华, 等. 2008. 盆栽和地栽'洛阳红'牡丹根系的碳氮代谢动态. 林业科学, 44(9): 162–164. DOI:10.11707/j.1001-7488.20080929 |
| [] | 米国全, 刘丽英, 金宝燕. 2011. 弱光对不同生态型黄瓜幼苗光合速率及蔗糖代谢相关酶活性的影响. 华北农学报, 26(1): 146–150. DOI:10.7668/hbnxb.2011.01.030 |
| [] | 潘静娴, 黄丹枫, 王世平, 等. 2001. 根域体积对甜瓜幼苗生长及光合特性的影响. 西北植物学报, 21(4): 637–643. |
| [] | 谢兆森, 李勃, 许文平, 等. 2008. 根域限制对葡萄果实发育和主要营养物质含量的影响. 植物生理学通讯, 44(5): 927–930. |
| [] | 杨天仪. 2007. 根域限制葡萄树氮素与碳素代谢机制研究. 上海交通大学博士学位论文. http://d.wanfangdata.com.cn/Thesis_Y1415561.aspx |
| [] | 张明方, 李志凌. 2002. 高等植物中与蔗糖代谢相关的酶. 植物生理学通讯, 38(3): 289–295. |
| [] | 张志良, 瞿伟菁, 李小方. 2009. 植物生理学实验指导. 北京, 高等教育出版社. |
| [] | Barrett D J, Gifford R M. 1995. Acclimation of photosynthesis and growth by cotton to elevated CO2: interactions with severe phosphate deficiency and restricted rooting volume. Australian Journal of Plant Physiology, 22(6): 955–963. DOI:10.1071/PP9950955 |
| [] | Campostrini E, Yamanishi O K, Maldonado J F, et al. 2002. Influence of root restriction on chlorophyll and carotenoids concentrations in leaves of four papaya (carica papaya L.) genotypes. Agronomia, 36(1/2): 1–6. |
| [] | Goldschmidt E E, Huber S C. 1992. Regulation of photosynthesis by end-product accumulation in leaves of plants storing starch, sucrose, and hexose sugars. Plant Physiology, 99(4): 1443–1448. DOI:10.1104/pp.99.4.1443 |
| [] | Hawver G. 1997. Influence of root restriction and drought stress on container-grown trees: impacts on plant growth and physiology. MS thesis, Cornell University. |
| [] | Iersel M. 1997. Root restriction effects on growth and development of Salvia (Salvia splendens). Hortscience, 32(7): 1186–1190. |
| [] | Izaguirre-Mayorala M L, Mallorca M S. 1999. Responses of Rhizobium-inoculated and nitrogen-supplied Phaseolus vulgaris and Vigna unguiculata plants to root volume restriction. Australian Journal of Plant Physiology, 26(6): 613–623. DOI:10.1071/PP99014 |
| [] | Mataa M, Tominaga S. 1998. Effects of root restriction on tree development in ponkan mandarin (Citrus reticulata Blanco). Journal of the American Society for Horticultural Science, 123(4): 651–655. |
| [] | Nguyen-Quoc B, Foyer C H. 2001. A role for 'futile cycles' involving invertase and sucrose synthase in sucrose metabolism of tomato fruit. Joumal of Experimental Botany, 52(358): 881–889. DOI:10.1093/jexbot/52.358.881 |
| [] | Park J Y, Canam T Y, Kang K, et al. 2008. Over-expression of an Arabidopsis family A sucrose phosphate synthase (SPS) gene alters plant growth and fibre development. Transgenic Research, 17(2): 181–192. DOI:10.1007/s11248-007-9090-2 |
| [] | Paul M J, Foyer C H. 2001. Sink regulate of photosynthesis. Journal of Experimental Botany, 52(360): 1383–1400. DOI:10.1093/jexbot/52.360.1383 |
| [] | Peterson T A, Reinsel M D, Krizek D T. 1991. Tomato (Lycopersicon esculentum Mill. cv. 'Better Bush') plant response to root restrictio. Journal of Experimental Botany, 42(10): 1241–1249. DOI:10.1093/jxb/42.10.1241 |
| [] | Rieger M. 1994. Responses of young peach trees to root confinement. Journal of the American Society for Horticultural Science, 119(2): 223–228. |
| [] | Robbins N S, Pharr D M. 1988. Effect of restricted root growth on carbohydrate metabolism and whole plant growth of Cucumis sativus L. Plant Physiology, 87(2): 409–413. DOI:10.1104/pp.87.2.409 |
| [] | Ronchi C P, Damatta F M, Batista K D, et al. 2006. Growth and photosynthetic down-regulation in Coffea arabica in response to restricted root volume. Functional Plant Biology, 33(11): 1013–1023. DOI:10.1071/FP06147 |
| [] | Shi K, Ding X T, Dong D K. 2008. Root restriction-induced limitation to photosynthesis in tomato (Lycopersicon esculentum Mill) leaves. Scientia Horticulturae, 117(3): 197–202. DOI:10.1016/j.scienta.2008.04.010 |
| [] | Shu Q Y, Wischnitzki E, Liu Z A, et al. 2009. Functional annotation of expressed sequence tags as a tool to understand the molecular mechanism controlling flower bud development in tree peony. Physiologia Plantarum, 135(4): 436–449. DOI:10.1111/ppl.2009.135.issue-4 |
| [] | Slewinski T L, Braun D M. 2010. Current perspectives on the regulation of whole-plant carbohydrate partitioning. Plant Science, 178(4): 341–349. DOI:10.1016/j.plantsci.2010.01.010 |
| [] | Thomas R B, Strain B R. 1991. Root restriction as a factor in photosynthetic acclimation of cotton seedlings grown in elevated carbon dioxide. Plant Physiology, 96(2): 627–634. DOI:10.1104/pp.96.2.627 |
| [] | Westgate M E, Grant D L T. 1989. Water deficits and reproduction in maize: response of the reproductive tissue to water deficits at anthesis and mid-grain fill. Plant Physiology, 91(3): 862–867. DOI:10.1104/pp.91.3.862 |
| [] | Xie Z S, Li B, Forney C F, et al. 2009. Changes in sugar content and relative enzyme activity in grape berry in response to root restriction. Scientia Horticulturae, 123(1): 39–45. DOI:10.1016/j.scienta.2009.07.017 |
| [] | Yong J W H, Letham D S, Wong S C, et al. 2010. Effects of root restriction on growth and associated cytokinin levels in cotton (Gossypium hirsutum). Functional Plant Biology, 37(10): 974–984. DOI:10.1071/FP10009 |
 2012, Vol. 48
2012, Vol. 48