文章信息
- 李清清, 叶建仁, 朱丽华, 吴小芹
- Li Qingqing, Ye Jianren, Zhu Lihua, Wu Xiaoqin
- 黑松未成熟胚的体细胞胚胎发生和植株再生
- Somatic Embryogenesis and Plantlet Regeneration from Immature Zygotic Embryos of Pinus thunbergii
- 林业科学, 2012, 48(12): 39-44.
- Scientia Silvae Sinicae, 2012, 48(12): 39-44.
-
文章历史
- 收稿日期:2012-02-27
- 修回日期:2012-03-31
-
作者相关文章
黑松(Pinus thunbergii),常绿高大乔木,优良造林树种和园林绿化树种。原产日本及朝鲜半岛东部沿海地区,我国山东、江苏、安徽等省普遍栽种。近年来由于黑松极易感染松材线虫病,常出现严重感病大量死亡现象。由于种苗繁殖手段所限,选育的抗病黑松种苗短期内难以满足大面积造林需求。体细胞胚胎发生具有数量多、速度快、结构完整、再生率高,不受自然条件制约等优点(Gupta et al., 1993),在苗木快速繁殖、种质资源保存、基因转导和人工种子等方面具有重要的意义(吴涛等,2007)。
国内外许多学者已经通过体细胞胚胎发生成功获得20多种松属(Pinus)树种体细胞胚或体细胞胚再生植株(吴丽君,2008),其中火炬松(Pinus taeda)、花旗松(Pseudotsuga menziesii)和辐射松(Pinus radiata)等树种体细胞胚发生已应用于规模化生产(张守攻等,2004)。Maruyama等(2005)以黑松未成熟的合子胚为外植体,胚性愈伤组织诱导率为2%,每培养皿成熟的体细胞胚达到900个,体细胞胚萌发率为60%,其中85%转化为植株,建立了较为稳定的体细胞胚胎发生植株再生体系。国内尚无关于黑松体细胞胚胎发生和植株再生的研究报道。
本文以黑松未成熟合子胚为外植体,研究基本培养基、2, 4-D和6-BA浓度对黑松胚性愈伤组织诱导的影响,探讨ABA、PEG对体细胞胚成熟与植株再生的影响。该研究可为抗病黑松快速大规模繁殖提供一条新途径,为抗病黑松的种质资源保存、基因转化、体胚苗的工厂化生产提供可行技术。
1 材料与方法 1.1 外植体材料的获取黑松未成熟的球果来源于山东烟台,2010年6月底到8月中旬每周采集1次,选用8株优树,每株采集4个球果,确定6月29日、7月13日、7月20日、7月27日、8月3日和8月17日共6个采集期,采集后立即保存于4 ℃冰箱备用。
1.2 外植体的处理方法将黑松球果的珠鳞剥离后取出种子,放入灭菌的小三角瓶中,在超净工作台上用无菌纱布包好,75%乙醇进行表面消毒30 s,再用0.1%HgCl2灭菌4 min,无菌水冲洗4次后用无菌滤纸吸去纱布表面的水分,最后用镊子剥去种壳和内种皮,取雌配子体水平放置于诱导培养基上,用封口膜封住培养皿。
1.3 胚性愈伤组织的诱导方法胚性愈伤组织诱导培养基设置为DCR(Gupta et al., 1985)、LP(Pullman et al., 2005)、1/2EM(Maruyama et al., 2005),2, 4-D浓度设置为1,2,4 mg·L-1,6-BA浓度设置为0.5,1,2 mg·L-1,采用L9(34)正交试验,共9个处理。所有处理添加30 g·L-1麦芽糖,1 g·L-1肌醇,450 mg·L-1谷氨酰胺(Gln),500 mg·L-1水解酪蛋白(CH),250 mg·L-1 2-(N-吗啡啉)乙磺酸(MES),6 g·L-1琼脂粉,pH5.8。每个处理接外植体20个,重复3次。暗培养,8周左右统计胚性和非胚性愈伤组织诱导率。
1.4 胚性愈伤组织维持与增殖方法将诱导的胚性愈伤组织转入DCR基本培养基,附加2 mg·L-1 2, 4-D、1 mg·L-1 6-BA、15 g·L-1麦芽糖、1 g·L-1肌醇、450 mg·L-1谷氨酰胺、500 mg·L-1水解酪蛋白、250 mg·L-1 MES和6 g·L-1琼脂粉,pH5.8,暗培养,对胚性愈伤组织进行维持与增殖培养,继代时挑取新分化的愈伤组织,每2~3周继代1次。取新分化的胚性愈伤组织用醋酸洋红和伊文思蓝染色进行细胞学观察,并在显微镜(Leica DM LB2)下观察并拍照。
1.5 体细胞胚的成熟培养体细胞胚成熟培养的基本培养基为DCR,ABA浓度设置为10,25,30 mg·L-1,PEG浓度设置为0,25,50 g·L-1,添加60 g·L-1麦芽糖、250 mg·L-1MES、450 mg·L-1谷氨酰胺、500 mg·L-1水解酪蛋白、8 g·L-1肌醇、8 g·L-1琼脂粉和2 g·L-1活性炭(AC),暗培养,70天左右统计体细胞胚数量。
1.6 体细胞胚的萌发与植株再生将诱导的成熟体细胞胚水平置于萌发培养基DCR上进行萌发,附加2 g·L-1AC,20 g·L-1麦芽糖,8 g·L-1琼脂,pH5.8。先暗培养5天左右,再光照培养15天左右,统计体细胞胚的正常萌发率。然后将萌发的体细胞胚转入WPM基本培养基,附加1.0 mg·L-1IBA、0.2 mg·L-1NAA、15 g·L-1蔗糖、0.1 g·L-1肌醇、6 g·L-1琼脂,光照培养1个月后,统计植株转化率。最后将再生植株转入WPM培养基进行壮苗培养,附加珍珠岩、15 g·L-1蔗糖、0.1 g·L-1肌醇,光照培养2个月。
1.7 再生植株的移栽待再生植株根伸长2 cm以上后进行移栽,移栽前3天逐渐将封口膜揭开,使幼苗适应外界的环境,移栽时将幼苗根部的珍珠岩小心洗掉,移栽在珍珠岩、土和河砂构成体积比1:1:1的基质中。移苗1个月内注意保持空气湿度、温度和基质湿度的稳定。1个月后统计移栽成活率。
1.8 培养条件和数据处理培养温度(23±1) ℃,光强36 μmol·m-2s-1,每日光照16 h。胚性愈伤组织诱导率(%)=胚性愈伤组织数/接种外植体数×100%,非胚性愈伤组织诱导率(%)=非胚性愈伤组织数/接种外植体数×100%,每克愈伤组织形成体细胞胚数(个·g-1)=体细胞胚个数/愈伤组织鲜质量,萌发率(%)=萌发正常体胚个数/接种体细胞胚个数×100%;植株转化率(%)=生根的植株数/萌发正常体胚个数×100%,成活率(%)=成活株数/移栽株数×100%。数据采用Excel和SPSS17.0处理。
2 结果与分析 2.1 胚性愈伤组织的诱导将7月27日采集的黑松未成熟种子接种于上述9个处理的诱导培养基上诱导愈伤组织,其余采集期的种子用于其他试验。试验结果:胚性愈伤组织的诱导率,6月29日、7月13日、7月20日和8月17日的为0,8月3日的为1.67%。
愈伤组织诱导过程的观察结果:有的未成熟种子诱导初期含1个或多个合子胚的白色透明的黏性组织从雌配子体的珠孔端伸出(图 1-1),8周左右在珠孔周围增殖形成块状的白色、透明的具有黏性胚性愈伤组织(图 1-2);有的未成熟种子诱导初期雌配子体珠孔端或者雌配子体表面形成结构紧实的物质,8周左右形成黄色或褐色不透明、结构紧实没有粘性的非胚性愈伤组织(图 1-3)。本试验9个处理中得到的胚性愈伤组织诱导率和非胚性愈伤组织诱导率都很低(表 1),只有在4 mg·L-12, 4-D+2 mg·L-16-BA的DCR培养基上诱导出2个胚性愈伤组织(编号为E1和E2),胚性愈伤组织诱导率为3.33%。对愈伤组织诱导率进行方差分析,结果表明,3个因素对愈伤组织诱导率的显著值分别是0.781,0.202,0.487,都大于0.05,因此培养基、2, 4-D和6-BA对愈伤组织诱导率都没有显著影响,但相比较而言,影响次序是2, 4-D>6-BA>培养基,2, 4-D浓度对愈伤组织诱导率影响较大。

|
图 1 黑松体细胞胚胎发生 Fig.1 Somatic embryogenesis in Pinus thunbergii 1.诱导初期;2.胚性愈伤组织;3.非胚性愈伤组织;4.胚性愈伤组织增殖前;5.胚性愈伤组织增殖后;6.胚性胚柄细胞团;7.胚性愈伤组织在成熟培养基上不同时间的状态:A.1天;B.20天;C.30天;D.40天;E.50天;F.70天;8.萌发的体细胞胚;9.体细胞胚再生植株;10.移栽的体细胞胚再生植株 1. Initial induction; 2. Embryonic callus; 3. Non-embryonic callus; 4. Before embryogenic callus proliferation; 5. After embryogenic callus proliferation; 6. Embryonic suspensor mass; 7. Embryogenic callus cultured on mature medium for different days: A.1 d; B.20 d; C.30 d; D.40 d; E.50 d; F.70 d; 8. Germination of somatic embryo; 9. Plant regeneration of somatic embryo; 10. Transplanting somatic embryo plant regeneration. |
|
|
将诱导的胚性愈伤组织转接在维持与增殖培养基上,每2~3周继代1次。前3次继代,胚性愈伤组织增殖速度很慢,到第5次继代增殖速度开始加快,此后进入稳定增殖状态。继代时将块状的胚性愈伤组织分成2~3块(图 1-4),2~3周后块状的胚性愈伤组织增殖变大(图 1-5)。取少量的胚性愈伤组织用醋酸洋红和伊文思蓝双染色法进行细胞学观察,胚性胚柄团由长的胚柄细胞和圆的胚性细胞组成(图 1-6),通常胚性细胞被醋酸洋红溶液染成红色,胚柄细胞被伊文思蓝溶液染成蓝色。
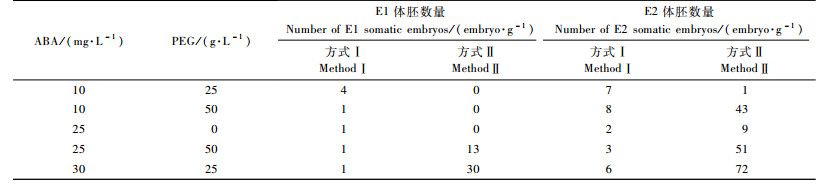
2.3 体细胞胚的形成与成熟取生长良好的2个胚性细胞系E1和E2的胚性愈伤组织转入不含激素的DCR培养基上培养8~10天,然后转入成熟培养基上进行成熟培养,其中成熟阶段转接方式分为方式Ⅰ和方式Ⅱ2种。方式Ⅰ是直接用镊子夹取生长良好的胚性细胞系E1和E2的胚性愈伤组织于固体成熟培养基上;方式Ⅱ是取胚性细胞系E1和E2生长良好的胚性愈伤组织,转入20 mL不含激素DCR液体培养基中,用手剧烈震荡形成良好的悬浮体系,然后用1 mL移液枪将悬浮液转移到底部放有抽纸的无菌滤纸上,水分吸干后,再将带有培养物的滤纸放在成熟培养基上。
胚性愈伤组织在不含激素的DCR培养基上培养8~10天继续增殖,形态无明显变化。方式Ⅰ中胚性愈伤组织在成熟培养基上增殖很慢,愈伤表面逐渐形成不同发育阶段的体细胞胚;方式Ⅱ中分散培养物在成熟培养基上30天左右增殖成块状的愈伤组织,愈伤组织表面也是逐渐形成不同发育阶段的体细胞胚(图 1-7A-F),70天左右形成成熟的体细胞胚(图 1-7F)。统计不同处理的体细胞胚数量(表 2),结果表明:方式Ⅱ获得体胚的数量和质量都比方式Ⅰ高,因此可以采用方式Ⅱ进行黑松体胚成熟研究。在2种试验方式中,E2获得的体胚数量比E1多;在方式Ⅱ中,30 mg·L-1ABA +25 g·L-1 PEG组合获得的体胚数量最多,其次是25 mg·L-1 ABA +50 g·L-1 PEG组合,没有PEG处理中也获得了数量较少的成熟体胚,但ABA和PEG的组合更有利于提高体胚的数量。因此研究黑松体胚成熟的最佳组合为30 mg·L-1 ABA +25 g·L-1 PEG,每克愈伤组织体细胞胚数达72个。
|
|
体细胞胚在萌发培养基上暗培养5天后,体胚子叶由黄色变为淡绿色,光照后子叶墨绿色,逐渐张开;胚轴伸长,基部有微小红色根尖(图 1-8)。然后将萌发的体细胞胚转入WPM培养基中,1个月后长出初生针叶,嫩白色根长1 cm左右,形成再生植株。从表 3看出,不同成熟培养基上E2获得体细胞胚的萌发率和植株转化率不同,在30 mg·L-1ABA +25 g·L-1 PEG的成熟培养基上产生体胚的萌发率和植株转化率高,分别为63.8%和43.5%,高质量的黑松体胚能提高体胚的萌发率和植株转化率。
|
|
最后将再生植株转入WPM珍珠岩培养基中,珍珠岩可形成空隙,培养液充在珍珠岩中,有利于根吸收营养,促进植株生长和根的进一步伸长,2个月后再生植株白色根伸长2 cm左右(图 1-9)。
2.5 再生植株的移栽移栽后体细胞胚苗(图 1-10)较幼嫩,针叶的光合作用和根系的吸收营养能力较弱,因此需注意后期的管理,基质要保持较高的湿度,1个月体胚苗成活率为50%。
3 结论与讨论诱导胚性愈伤组织是体细胞胚胎发生的关键,影响胚性愈伤组织诱导的重要因素包括:外植体的年龄和生理状态、基因型、基本培养基、植物激素的种类和浓度、碳源及温度条件等(郑仁华,2008)。一般来说,用未成熟合子胚诱导体胚比用成熟合子胚容易,而用合子胚又比用实生苗的幼嫩组织容易(Liao et al., 1995);针叶树愈伤组织的诱导一般以未成熟合子胚为外植体,合子胚的发育阶段胚性对愈伤组织的诱导很重要(申晓辉等,2005;Yildirim et al., 2006);随着合子胚发育与成熟,诱导率逐渐降低,子叶前期合子胚最适合胚性愈伤组织的诱导(江波等,2004);不同采集期的合子胚胚性愈伤组织诱导率不同(王伟达等,2009)。本试验以黑松未成熟合子胚为外植体,胚性愈伤组织诱导率很低,仅为3.33%。
体细胞胚胎发生最常用的基本培养基为MS,DCR,LM,GD,SH,LP以及各种改良的MS培养基等(逯昀等,2010)。Zhang等(2007)用DCR、BM和MSG培养基进行白皮松(Pinus bungeana)体细胞发生,结果表明DCR培养基最好。本试验选用DCR、LP和1/2EM 3种培养基,只有在DCR培养基上诱导出胚性愈伤组织,说明DCR培养基较适合黑松胚性愈伤组织的诱导。胚性愈伤组织的诱导一般在含有较高浓度的生长素和细胞分裂素的固体培养基上进行,常用的激素有2, 4-D,NAA,6-BA和KT,2, 4-D对诱导胚性愈伤组织的产生必不可少,且2, 4-D对胚性愈伤组织的影响大于6-BA(王高,2009),2, 4-D和6-BA组合对胚性愈伤组织的诱导率比单用2, 4-D高(Zhang et al., 2007; 郑仁华,2008)。Salajova等(2005)用2, 4-D和6-BA组合及NAA和6-BA组合都获得了欧洲黑松(Pinus nigra)胚性愈伤组织。本试验只在4 mg·L-12, 4-D +2 mg·L-16-BA组合获得了黑松胚性愈伤组织。
体细胞胚的形成与成熟是植株再生的关键,体细胞胚形成与基因型、激素种类和浓度、培养基渗透压等有关。ABA被认为是针叶树体胚形成的关键因子,其作用主要是促进体细胞胚成熟,防止裂生多胚及畸形胚的产生,抑制体细胞胚早成熟萌发(崔凯荣等,2000)。不同品种、不同基因型,体胚成熟所需的ABA浓度不同。Harry等(1991)在红云杉(Picea rubens)体胚成熟培养中需要相对高浓度ABA来维持正常的发育,抑制早熟萌发;而Attree等(1990)在白云杉(Picea glauca)和黑云杉(Picea mariana)体胚的成熟培养则需要较低浓度ABA。ABA不但会影响日本落叶松(Larix kaempferi)成熟体细胞胚的数量,而且还影响到体细胞胚的后期萌发能力(汪小雄等,2010)。本试验中E2获得的体细胞胚数量大于E1,说明基因型对体细胞胚成熟有影响;30 mg·L-1 ABA获得的体细胞胚数量最多,说明ABA浓度对体细胞胚成熟也有影响。
渗透压对针叶树体细胞胚的发育有重要的作用,通常利用糖类、肌醇和聚乙二醇(PEG)作渗透剂,提高培养基的渗透压。大量研究表明,ABA和PEG的组合更有利于提高体胚的数量与质量。本试验没有PEG处理中也获得了数量较少的成熟体胚,但ABA和PEG的组合获得体胚的数量和质量比单用ABA高。Pullman等(2003)研究表明,5 mg·L-1 ABA+13%PEG获得的火炬松(Pinus taeda)体细胞胚数量和质量最高。Yildirim等(2006)研究表明,80 μm ABA+3.75%PEG是土耳其红松(Pinus brutia)体细胞胚成熟的最合适配方。本文黑松体细胞胚成熟最佳组合30 mg·L-1ABA +25 g·L-1 PEG,每克愈伤组织体细胞胚数达72个。
体细胞胚的萌发与植株再生条件的调节有利于提高体细胞胚的产量和植株再生率。齐力旺等(2004)在萌发培养基中附加低浓度的IBA和NAA明显促进华北落叶松(Larix principis-rupprechtii)体细胞胚根的发生。本试验研究发现植株再生培养基附加1.0 mg·L-1IBA、0.2 mg·L-1NAA有利于促进根的发生。在30 mg·L-1 ABA +25 g·L-1 PEG的成熟培养基上产生体胚的萌发率和植株转化率高,分别为63.8%和43.5%,高质量的黑松体胚能提高体胚的萌发率和植株转化率。此外本试验还用WPM珍珠岩培养基进行再生植株壮苗,2个月再生植株根伸长2 cm左右。珍珠岩可形成空隙,培养液充在珍珠岩中,有利于根吸收营养,促进植株生长和根的进一步伸长。
本试验通过对黑松未成熟合子胚的诱导成功获得胚性愈伤组织,胚性愈伤组织经过体细胞胚成熟、萌发与植株再生等过程,成功获得了成熟的体细胞胚和再生植株,并移栽成活。
| [] | 崔凯荣, 戴若兰. 2000. 植物体细胞胚发生的分子生物学. 北京, 科学出版社. |
| [] | 江波, 杨映根, 郭奕明. 2004. 松柏类植物体细胞胚胎发生的研究进展. 植物学通报, 21(4): 495–505. |
| [] | 逯昀, 孙景梅, 侯佳. 2010. 华山松胚性愈伤组织的诱导研究. 北方园艺(11): 155–157. |
| [] | 齐力旺, 韩一凡, 韩素英. 2004. 麦芽糖、NAA及ABA对华北落叶松体细胞胚成熟及生根的影响. 林业科学, 40(1): 52–58. DOI:10.11707/j.1001-7488.20040109 |
| [] | 申晓辉, 蒋相宁, YillSung Park, 等. 2005. 红松体细胞胚胎培养技术体系的建立. 成都大学学报, 24(1): 11–14. |
| [] | 汪小雄, 杨映根. 2010. 日本落叶松体细胞胚胎发生的研究. 安徽农业科学, 38(4): 2118–2121, 2180. |
| [] | 王高. 2009. 红松体细胞胚胎发生及超低温保存技术研究. 上海交通大学硕士学位论文. http://book.hzu.edu.cn/1219164.html |
| [] | 王伟达, 李成浩, 杨静莉, 等. 2009. 杂种落叶松未成熟胚的体细胞胚发生和植株再生. 林业科学, 45(8): 34–38. DOI:10.11707/j.1001-7488.20090806 |
| [] | 吴丽君. 2008. 湿地松、火炬松离体培养植株再生技术的研究. 南京林业大学博士学位论文. http://d.wanfangdata.com.cn/Thesis/Y1296065 |
| [] | 吴涛, 陈少瑜, 陈芳, 等. 2007. 思茅松胚性愈伤组织的诱导. 中南林业科技大学学报, 27(5): 74–76. |
| [] | 张守攻, 邱宏伟, 韩素英, 等. 2004. 落叶松树种的体细胞胚胎发生与规模化技术体系. 中国生物工程杂志, 24(6): 28–33. |
| [] | 郑仁华. 2008. 杉木优良无性系组培快繁及体胚发生试验研究. 厦门大学博士后论文. http://book.hzu.edu.cn/1193767.html |
| [] | Attree S M, Budimir S, Fowke L C. 1990. Somatic embryogenesis and plantlet regeneration from cultured shoots and cotyledons of seedlings from stored seeds of black and white spruce (Picea mariana and Picea glauca). Can J Bot, 68(1): 30–34. DOI:10.1139/b90-005 |
| [] | Gupta P K, Durzan D J. 1985. Shoot multiplication from mature trees of Douglas-fir (Pseudotsuga menziesii) and sugar pine (Pinus lambertiana). Plant Cell Rep, 4(4): 177–179. DOI:10.1007/BF00269282 |
| [] | Gupta P K, Pullman G S, Timmis R, et al. 1993. Forestry in the 21st Century: The biotechnology of somatic embrygenesis. Biotechnology, 11(4): 454–459. |
| [] | Harry I S, Thorpe T A. 1991. Somatic embryogenesis and plant regeneration from mature zygotic embryos of red spruce. Bot Gaz, 152(4): 446–452. DOI:10.1086/337905 |
| [] | Liao Y K, Amerson H V. 1995. Slash pine (Pinus elliottii Engelm) somatic embryogenesis.Ⅰ.Initiation of embryogenic cultures from immature zygotic embryos. New For, 10(2): 145–163. |
| [] | Maruyama E, Hosoi Y, Ishii K. 2005. Somatic embryo production and plant regeneration of Japanese black pine(Pinus thunbergii). J For Res, 10(5): 403–407. DOI:10.1007/s10310-005-0159-6 |
| [] | Pullman G S, Johnson S, Peter G, et al. 2003. Improving loblolly pine somatic embryo maturation: comparison of somatic and zygotic embryo morphology, germination and gene expression. Plant Cell Rep, 21(8): 747–758. |
| [] | Pullman G S, Johnson S, Tassel S V, et al. 2005. Somatic embryogenesis in loblolly pine (Pinus taeda) and Douglas fir (Pseudotsuga menziesii): improving culture initiation and growth with MES pH buffer, biotin, and folic acid. Plant Cell, Tissue and Organ Culture, 80(1): 91–103. DOI:10.1007/s11240-004-9099-7 |
| [] | Salajova T, Salaj J. 2005. Somatic embryogenesis inPinus nigra: embryogenic tissue initiation, maturation and regeneration ability of established cell lines. Biologia Plantarum, 49(3): 333–339. DOI:10.1007/s10535-005-0003-z |
| [] | Yildirim T, Kaya Z, Isik K. 2006. Induction of embryogenic tissue and maturation of somatic embryos in Pinus brutia TEN. Plant Cell Tiss Organ Cult, 87(1): 67–76. DOI:10.1007/s11240-006-9137-8 |
| [] | Zhang Cunxu, Li Qian, Kong Lisheng. 2007. Induction, development and maturation of somatic embryos in Bunge's pine (Pinus bungeana Zucc. ex Endl.). Plant Cell Tiss Organ Cult, 91(3): 273–280. DOI:10.1007/s11240-007-9294-4 |
 2012, Vol. 48
2012, Vol. 48