文章信息
- 何恒斌, 王华, 贾桂霞
- He Hengbin, Wang Hua, Jia Guixia
- 沙冬青根瘤的组织、超微结构及糖蛋白的亚细胞定位
- Nodule Histology and Ultrastructure of Ammopiptanthus mongolicus and Subcellular Localization of Glycoprotein in Nodules
- 林业科学, 2012, 48(12): 31-38.
- Scientia Silvae Sinicae, 2012, 48(12): 31-38.
-
文章历史
- 收稿日期:2012-10-09
- 修回日期:2012-11-28
-
作者相关文章
根瘤菌与豆科(Leguminosae)植物共生关系是地球上固氮效率最高的共生系统(Mylona et al., 1995)。根瘤菌与豆科植物首先进行信号交换和识别,然后根瘤菌通过侵染线侵染寄主植物根系(Timmers et al., 1999);同时,皮层细胞产生根瘤原基(Yang et al., 1994);最终细菌被释放到寄主根瘤原基细胞中,发育成具有固氮功能的成熟根瘤(Long, 1996)。该共生系统精妙的互作机制和重大的生态意义,引起科学家的高度关注。
沙冬青(Ammopiptanthus mongolicus)为豆科沙冬青属植物,是我国西北荒漠地区仅有的2种常绿阔叶灌木之一。沙冬青与根瘤菌形成根瘤后,在我国西北荒漠地区缺水少氮的环境条件下,对沙冬青的生长发育、优良性状的形成及其生物群落的发育和多样性的维系具有重要作用。目前,关于沙冬青-根瘤菌共生系统的研究还非常有限,主要集中在根瘤菌多样性(何恒斌等,2006a;2006b;毕江涛等,2009a;2009b)的研究,仅有韩善华等(1999)报道过沙冬青根瘤菌的超微结构。许多研究表明,植物糖蛋白凝集素在豆科植物和根瘤菌共生的早期信号识别中发挥重要作用,参与决定共生关系的特异性(Diaz et al., 1995;van Rhijn et al., 1998;2001),如豌豆(Pisum sativum)根毛顶端的凝集素可以结合根瘤菌产生的多个多糖信号(Diaz et al., 1995);van Rhijn等(1998)将大豆(Glycine max)凝集素基因转化到百脉根(Lotus corniculatus)中,使其结瘤特异性发生了改变。以上研究表明,凝集素是根瘤菌与豆科根毛识别的重要调控因子,而其在根瘤发育和固氮等共生中后期过程中的功能还不清楚。因此, 本文研究了沙冬青根瘤的组织结构、超微结构以及糖蛋白的亚细胞定位,分析了沙冬青根瘤的结构特点,为探究沙冬青的荒漠共生机制提供基础。
1 材料与方法 1.1 材料沙冬青种子采自内蒙古自治区阿拉善左旗自然分布区。筛选出籽粒平整饱满、大小均匀、无虫蛀者作为试验材料。
根瘤菌菌株AZ1分离自阿拉善左旗野生沙冬青的根瘤(何恒斌等,2006b)。
1.2 沙冬青种子萌发及根瘤菌接种将种子在70%酒精中处理5 min,无菌水漂洗3次;0.1% HgCl2灭菌12 min,无菌水漂洗5次。28 ℃发芽,胚根伸出1 cm后,播种于塑料花盆(20 cm×15 cm×14 cm)中,栽培基质为高压灭菌(121 ℃,30 min)的珍珠岩。每月浇施1次无氮Hoagland营养液(除氮素外,其他元素含量不变)。
将根瘤菌AZ1接种到YMA液体培养基中,28 ℃,200 r·min-1震荡培养,待OD600=1.0时,离心,弃上清,用无菌水重悬至OD600=3×10-3。在沙冬青播种7天后,每盆沙冬青浇施100 mL的上述新鲜根瘤菌液。
1.3 沙冬青根瘤组织结构、超微结构及糖蛋白定位观察分别采集根瘤菌接种10,20,40天的根瘤,清洗,于FAA中固定,番红、固绿双染,按常规方法制作石蜡切片,在光学显微镜下观察沙冬青根瘤结构。
超薄切片及糖蛋白定位基本按照Jian等(1987)的钌红染色电镜细胞化学方法,并稍作修改。将根瘤样品切成小块,投入二甲砷酸钠缓冲液(50 mmol·L-1,pH7.3)配制的戊二醛(2.5%)和钌红(1 000 mg·L-1)混合液中,室温、黑暗条件下固定、染色2 h,洗涤。用二甲砷酸钠缓冲液配制的锇酸(2%)和钌红(500 mg·L-1)混合液,室温、黑暗条件下固定、染色3 h。洗涤,进行系列乙醇脱水;Spur树脂包埋,LKB-V型超薄切机切片,切片经醋酸双氧铀染色,在H-600型透射电子显微镜下观察照相。
2 结果与分析 2.1 沙冬青根瘤的组织结构在沙冬青成熟根瘤纵切面上,由根瘤顶端到与根部连接处表现出明显的侵染年龄梯度(图 1-1):Ⅰ区为分生组织,染色后为深蓝绿色,此区中的细胞较小、密集,没有根瘤菌的侵染,根瘤其他部分都由该区的细胞分化而来。Ⅱ区包围着Ⅰ区,其细胞比Ⅰ区大,该区细胞停止分裂并开始分化,侵染线已经侵染到该区的细胞,为沙冬青根瘤的侵染区。Ⅱ-Ⅲ区是侵染区与固氮区的过渡部分,根瘤菌开始释放到寄主细胞中,被染成紫色的细胞比例明显增多。Ⅲ区的细胞几乎全被染成紫色,类菌体几乎充满整个细胞,仅有少数未被侵染的细胞,在新鲜根瘤中该区为粉红色,为高效固氮区;Ⅳ区染色与Ⅲ区相比颜色较浅,固氮效率降低,新鲜根瘤中为褐色,为低效固氮的老化区。
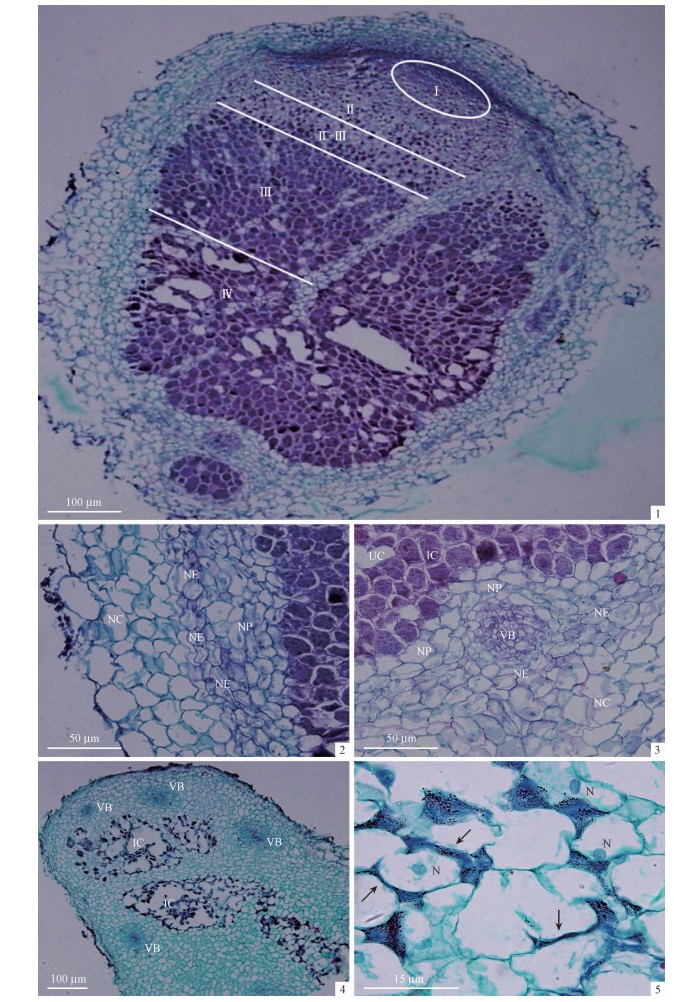
|
图 1 沙冬青根瘤的组织结构 Fig.1 The histology of A. mongolicus nodule IC:侵染细胞Infected cell; UC:非侵染细胞Un-infected cell; NP:根瘤薄壁细胞Nodule parenchyma; NE:根瘤内皮层Nodule epidermis; VB:维管束Vascular bundle; NC:根瘤皮层Nodule cortex; N:细胞核Nuclear. 1.成熟固氮根瘤的纵切面,由顶端到底部依次分为分生组织区(Ⅰ)、侵染区(Ⅱ)、固氮区(Ⅲ)和老化区(Ⅳ),侵染区和固氮区的过度区域(Ⅱ-Ⅲ);2,3.除分生组织区外,侵染区、固氮区和老化区均有皮层、内皮层、薄壁细胞层、维管束和中心侵染组织组成;4.畸形根瘤的纵切面;5.畸形根瘤细胞间的侵染线和“侵染槽”类似结构,箭头示胞间侵染线。 1. A longitudinal section of a nitrogen-fixing nodule. From the apical part to the basal region, several central zones can be distinguished: the bacteria-free meristematic zone Ⅰ, infection zone Ⅱ, nitrogen-fixing zone Ⅲ, senescent zone Ⅳ, and interzone Ⅱ-Ⅲ; 2, 3. With the exception of the apical meristem, the three other zones are surrounded by lateral nodular tissues such as the parenchyma, the vascular bundles, the endodermis and the cortex, successively; 4. A longitudinal section of a abnormal nodule; 5. The infection threads (arrowheads) and "infection pockets" like structure in intercellular spaces of abnormal nodules. |
沙冬青根瘤除Ⅰ区分生组织外,均由4部分组成, 由外向内依次为:皮层、内皮层、薄壁细胞层和中心组织。经染色后, 皮层、内皮层、薄壁细胞层呈绿色, 而中心侵染组织呈紫红色, 染色较深。皮层:由数层细胞构成, 细胞较大且排列较为疏松, 有显著的细胞间隙,外围几层细胞扁平状, 且细胞壁木质化。内皮层:由1~2层扁平的砖形细胞构成, 排列整齐、紧密, 无细胞间隙,细胞核和核仁较大(图 1-2)。薄壁组织层:由6~7层薄壁组织细胞组成, 比侵染细胞小,比皮层排列紧密、细胞间隙小,其中分化有导管和筛管, 构成维管束, 外围有数层薄壁细胞围绕(图 1-3)。中心侵染组织:由薄壁组织细胞构成, 分布有大量的侵染细胞和少量的非侵染细胞(图 1-2, 3)。侵染细胞被不同程度的侵染, 此类细胞体积较大。侵染初期中心组织在根瘤中比例小, 侵染细胞也少, 至成熟期中心侵染组织占据根瘤的大部分, 衰老时期细胞内根瘤菌大部分解体。
在试验中观察到一部分异常根瘤, 外观上比较不规则, 显微观察其内部结构发现, 根瘤皮层细胞层数非常多, 很厚, 细胞小而致密, 与无限型根瘤的结构不同(图 1-4);中心组织占瘤面积比较小, 大部分中空, 根瘤菌只在胞间隙和中柱部位形成多个条带状侵染网络(图 1-5)。这种根瘤是否具固氮活性有待探讨。
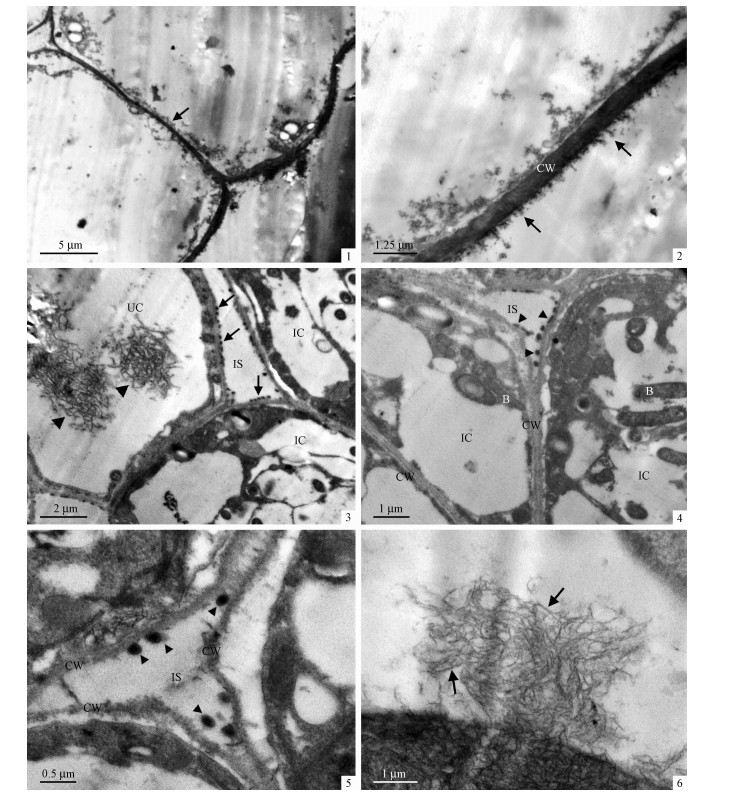
2.2 沙冬青根瘤菌的超微结构沙冬青根瘤最外层是体积较大的薄壁细胞,其中央有一个体积很大的液泡,液泡周围只有少量的细胞质,细胞间隙较大,个别细胞含有淀粉粒(图 2-1, 2)。根瘤Ⅱ-Ⅲ区薄壁细胞内侧的细胞,体积较小,为侵染初期细胞,细胞质开始变浓,出现类菌体,但数量较少,体积较小, 其中部分还未形成类菌体周膜,只有个别成熟类菌体(图 2-3);相邻的侵染细胞间存在较为丰富的胞间连丝(图 2-4);在该区的侵染细胞中存在着活跃的膜装配过程(图 2-5):内质网将合成的膜物质向细胞膜运输(图 2-5,左侧白色箭头所示),内质网用新合成的膜系统包被释放到细胞中的类菌体(图 2-5,右侧黑色箭头所示),建立类菌体周膜系统;Ⅱ-Ⅲ区细胞含有丰富的淀粉粒(图 2-6, 7)。侵染组织由大量的侵染细胞和少量的非侵染细胞组成,侵染细胞中含有大量类菌体,几乎充满整个细胞(图 2-8)。类菌体的外面均有周膜,以此将菌体与寄主细胞质分开,有些细菌周膜内包含多个拟菌体;类菌体一般为圆形和杆状,呈现多样化趋势(图 2-9, 10);在成熟的侵染细胞中,类菌体的拟核区出现电子密度较高的DNA纤维, 并有白色β-聚羟基丁酸颗粒出现(图 2-9)。类菌体在释放到寄主细胞中后,新形成的细菌周膜只包含有1个类菌体;随着类菌体的发育,相邻的类菌体周膜间发生融合、扩大,形成大的周膜空间,使多个类菌体位于同一个类菌体周膜中(图 2-8, 10)。

|
图 2 沙冬青根瘤的超微结构
Fig.2 Ultrastructure of A. mongolicus nodule
IC:侵染细胞Infected cell;CW:细胞壁Cell wall;IS:细胞间隙Intercellular space;S:淀粉粒Starch grain;Ve:小泡Vesicular;B:根瘤菌Bacteria;ER:内质网Endomembrane reticulum;M:线粒体Mitochondria;PBM:类菌体周膜Perbacteriod membrane;PBS:类菌体空间Perbacteriod space;G:高尔基体Golgi body. 1.沙冬青根瘤薄壁细胞;2.少数薄壁细胞含有淀粉粒;3.在Ⅱ-Ⅲ过渡区,根瘤菌被释放到寄主细胞中,没有类菌体周膜的包被(短箭头所示);4. Ⅱ-Ⅲ过渡区中,侵染细胞间有丰富的胞间连丝(长箭头所示);5. Ⅱ-Ⅲ过渡区中,寄主内质网对类菌体周膜的装配,内质网向根瘤菌周围运输周膜物质(黑色箭头所示),同时与细胞膜相连(白色箭头所示);6, 7. Ⅱ-Ⅲ过渡区,侵染细胞中丰富的淀粉粒;8.类菌体几乎充满固氮区的侵染细胞;9.成熟类菌体形态,β-聚羟基丁酸(黑色短箭头所示),DNA纤维(白色长箭头所示),胞间连丝(黑色长箭头所示);10.类菌体周膜的融合, 箭头示根瘤菌膜。 1. Parenchyma in A. mongolicus nodule; 2. Starch grains in parenchyma; 3. Bacteria was released into a host cell without perbacteriod membrane in interzone Ⅱ-Ⅲ (arrow and arrowhead); 4. Much plasmodesma (arrows) connected two contiguous infected cells in interzone Ⅱ-Ⅲ; 5. Perbacteriod membrane was being assembled by host endomembrane reticulum in interzone Ⅱ-Ⅲ, membrane material was being transported to bacteria vicinity (black arrows) from ER, which was also connected to plasma membrane (white arrows); 6, 7. An infected cell in interzone Ⅱ-Ⅲ contained many starch grains; 8. Infected cell in nitrogen-fixing zone Ⅲ was filled with perbacteriod; 9. Intact perbateriod shape, poly-β-hydroxybutyrate granules (black arrowheads), DNA fibrils (white arrow), and plasmodesma (black arrows); 10.The fusion of perbateriod membrane, bacteria membrane (arrow). |
在薄壁细胞中,细胞壁结构清晰可见,位于细胞内壁表面上有一薄薄的糖蛋白层,而且结构比较疏松,特别是外部边缘更为扩散,有的部位呈现为絮状(图 3-1,2)。细胞被侵染后,细胞壁糖蛋白层为颗粒状,并主要分布在细胞壁的外侧(图 3-3, 4, 5)。值得注意的是,在侵染细胞的间隙(图 3-3)或者侵染细胞与非侵染细胞间隙(图 3-4, 5),有大量的糖蛋白颗粒,大部分附着在细胞壁上,少数游离在细胞间隙(图 3-5)。薄壁组织区和侵染区中糖蛋白形式和位置的变化格局可能预示着根瘤菌侵染沙冬青以及类菌体生长发育的某种特殊信号机制。
|
图 3 糖蛋白在沙冬青根瘤中的亚细胞定位 Fig.3 The subcellular localization of glycoprotein in A. mongolicus nodule CW:细胞壁Cell wall;IC:侵染细胞Infected cell;IS:细胞间隙Intercellular space;UC:非侵染细胞Un-infected cell;B:根瘤菌Bacteria. 1, 2.根瘤薄壁细胞内壁上疏散的糖蛋白(箭头所示);3.侵染细胞与非侵染细胞间隙中的糖蛋白颗粒;4.侵染细胞间隙中的糖蛋白颗粒;5.附着在细胞外壁上的糖蛋白及游离的糖蛋白;6.非侵染细胞液泡中被染成深色的絮状结构. 1, 2. Glycoprotein in a loose form (arrows) was located at internal wall of parenchyma cells; 3. Glycoprotein grains (arrows) were translocated into the intercellular space between infected and un-infected cells, flocculent structure (arrowheads) in one un-infected cell; 4. Glycoprotein grains (arrowheads) were translocated into the intercellular space between infected cells; 5. Glycoprotein grains (arrowheads) were attached to the external wall or dissociated in the intercellular space; 6. Flocculent structure (arrows) in vacuole was deeply stained in an un-infected cell. |
此外,在侵染组织中,出现一个特殊的现象:多个成熟侵染细胞中间往往会出现几个未侵染的细胞,这种细胞中没有类菌体,具少量的细胞质,位于细胞壁周围,液泡中出现染色较深的絮状物质(图 3-3, 6);细胞之间有较大的空隙(图 3-3)。这种非侵染细胞靠近细胞空隙的地方有丰富的高尔基体。
3 讨论 3.1 沙冬青根瘤的组织结构不同豆科寄主的根瘤形态有一定区别,根据分生组织的性质和根瘤原基在根系中的形成位点,豆科植物的根瘤可分为“无限型”(indeterminated)和“有限型”(determinated)2类(Long, 1996)。沙冬青成熟根瘤的纵切面,表现出明显的根瘤菌侵染年龄梯度,属于典型的“无限型”根瘤。一般认为,沙冬青属于第三纪亚热带常绿阔叶林旱生化类型的孑遗种(朱宗元等,1999),这与“无限型”根瘤的温带属性似乎矛盾。这可能是由于沙冬青孑遗后长期生活在温带荒漠地区,逐渐适应环境条件而发展成为“无限型”生长的根瘤; 或者,沙冬青是亚热带豆科植物中的特例,在孑遗前本身就是“无限型”根瘤。
本研究中沙冬青畸形根瘤的根瘤菌只在胞间隙和中柱部位形成多个条带状侵染网络,而且根瘤菌无法释放到细胞中。正常与畸形根瘤侵染格局的差异,似乎与其他豆科植物中鉴定出来的2种根瘤菌侵染模式相对应。在豆科共生系统中,根瘤菌侵染有2种途径:胞内侵染和胞间侵染。胞内侵染是科学家了解较为清楚的途径:根瘤菌诱导根毛弯曲,细胞壁局部水解,质膜内陷,根瘤菌进入到根毛内部;根毛内部形成侵染线,经过皮层细胞,根瘤菌由侵染线释放到根瘤原基细胞中。模式豆科植物蒺藜苜蓿(Medicago truncatula)以及大部分温带豆科植物均为这种以根毛为开端的胞内侵染方式(Vance et al., 1982; Wood et al., 1989)。而许多在进化中较为古老的热带豆科植物种类属于胞间侵染途径:根瘤菌借由侧根伸出形成的裂缝进入根系,并在较大的胞间空隙定殖下来,形成所谓的“侵染槽”(infection pocket);后续的侵染途径在不同植物中发生差异。在田菁(Sesbania rostrata)和假含羞草属(Neptunia)中,侵染槽变窄形成胞间侵染线,随后胞内侵染线侵入到根瘤原基(Subba-Rao et al., 1995);而合萌属(Aeschynomene)、柱花草属(Stylosanthes)和落花生属(Arachi)中,侵染槽中的根瘤菌借助细胞塌陷直接进入根瘤原基(Lievens et al., 2001)。最近的研究表明:在非淹水状态下,根瘤菌借助根毛利用胞内侵染途径进入田菁(半水生豆科植物)根瘤原基;在淹水条件下,根毛生长被阻止,胞内侵染受到抑制,根瘤菌利用胞间侵染途径进入田菁根瘤原基(Goormachtig et al., 2004)。结合本研究对沙冬青根瘤的组织观察,正常根瘤应属于典型的胞内侵染方式,畸形根瘤中的侵染格局却呈现出胞间侵染的特点。沙冬青作为一种荒漠植物,所处环境极为严苛,多种环境逆境会阻止根毛的出现和生长,从而使胞内侵染方式的根毛通道消失;因此,沙冬青兼具2种根瘤菌侵染方式,将保证其在不同环境条件下氮素的充足供应。进一步研究沙冬青2种侵染方式与不同环境条件的对应关系,将为解释沙冬青强抗性提供新的视角,同时对揭示荒漠豆科植物的共生机制和生存机制提供重要理论基础。
3.2 沙冬青根瘤超微结构和糖蛋白定位本研究发现,沙冬青根瘤的侵染-固氮过渡区(Ⅱ-Ⅲ区)呈现多样化的细胞,表现出丰富的细胞学过程。根瘤菌在这一区域开始由侵染线释放到寄主细胞内,最初释放的根瘤菌数量较少,体积较小,还未形成类菌体周膜。随后,寄主细胞启动类菌体周膜的合成、装配过程,内质网将合成的膜物质以小泡的形式向根瘤菌周围运输,并逐渐将根瘤菌包被起来,与周围的细胞质分开,形成完整的类菌体周膜;类菌体周膜发生融合、扩大,将多个根瘤菌包被在同一个空间中。上述的超微观察说明,类菌体周膜是一种起源于寄主的内膜系统,由寄主的内质网合成、装配。本研究还发现,在此过程中,内质网同时与细胞膜和形成中的类菌体周膜相连,暗示出寄主细胞膜与类菌体周膜的形成存在某种联系。
在Ⅱ-Ⅲ过渡区,相邻的侵染细胞间存在较为丰富的胞间连丝和淀粉粒及其前体白色质体。胞间连丝是植物体内的共质管道,小分子物质(如离子、代谢物、激素等)可以经由它在细胞间扩散,从而协调细胞间的生理生化过程(Roberts et al., 2003; Burch-Smith et al., 2011)。多个研究表明,胞间连丝可以通过促进特定转录因子在胞间的运动,决定细胞命运(Lucas et al., 1995; Kurata et al., 2005);也可以借助对小RNA胞间移动的控制,在表观遗传修饰中发挥重要作用(Carlsbecker et al., 2010; Dunoyer et al., 2010; Molnar et al., 2010; Olmedo-Monfil et al., 2010)。根瘤中存在侵染细胞与非侵染细胞的分化、寄主细胞与根瘤菌间信号和代谢物质的交换、细胞的程序化死亡(Puppo et al., 2005)等,这些细胞学事件都需要细胞间的功能协调,胞间连丝可能在其中发挥重要的通道功能。
在沙冬青根瘤薄壁细胞中,糖蛋白层位于细胞内壁表面,结构比较疏松。细胞被侵染后,在侵染细胞的间隙或者侵染细胞与非侵染细胞间隙,有大量的糖蛋白颗粒附着在细胞壁上,少数游离在细胞间隙。前人的研究表明,凝集素作为豆科寄主的一种糖蛋白,在共生关系最早期的特异性识别中发挥重要作用(王逸群等,2000)。利用基因工程技术,将豌豆凝集素基因(psl)转导入白三叶草(Trifolium repens)中,使白三叶草能够与豌豆专一的根瘤菌建立共生关系,表明凝集素参与决定宿主与根瘤菌间的共生专一性(Diaz et al., 1989; 1995)。在本研究中,在薄壁组织区和侵染区中糖蛋白形式和位置的变化格局,说明糖蛋白在共生关系中后期的根瘤发育及固氮中也具有重要功能。
作为我国特有的珍稀濒危豆科植物,沙冬青与根瘤菌共生关系的研究较少。而关于沙冬青根瘤结构的研究更为少见,仅韩善华等(1999)报道了沙冬青根瘤菌在野生根瘤的不同侵染细胞中呈现出形态的变化。本文通过组织切片和超微结构研究,明确了沙冬青根瘤属于无限型根瘤(而这种根瘤的温带属性,与沙冬青的亚热带起源似乎存在矛盾);发现了沙冬青根瘤菌正常根瘤中进行胞内侵染,而在畸形根瘤中却表现出胞间侵染的特点,在荒漠豆科植物还未见类似报道,沙冬青根瘤菌2种侵染方式与环境因子的关系值得深入研究;首次报道了糖蛋白在豆科根瘤中的亚细胞定位和形态变化, 表明糖蛋白对中后期的根瘤发育也有潜在功能。沙冬青为木本植物,研究基础较为薄弱,其共生分子机制研究面临较大挑战;与豆科模式植物进行比较基因组学研究,特别是共生信号通路方面的比较研究,将是值得期待的研究方向。
| [] | 毕江涛, 贺达汉, 陈卫民, 等. 2009a. 沙冬青根瘤菌遗传多样性和系统发育分析. 西北植物学报, 29(4): 695–703. |
| [] | 毕江涛, 贺达汉, 谢瑞梅, 等. 2009b. 沙冬青根瘤菌结瘤基因nodA PCR-RFLP分析. 中国沙漠, 29(4): 703–710. |
| [] | 韩善华, 张红, 王双. 1999. 沙冬青根瘤菌的电子显微镜研究. 中国微生态学杂志, 11(1): 27–29. |
| [] | 何恒斌, 郝玉光, 丁琼, 等. 2006a. 沙冬青植物群落特征及其根瘤多样性研究. 北京林业大学学报, 28(4): 123–128. |
| [] | 何恒斌, 贾昆峰, 贾桂霞, 等. 2006b. 沙冬青根瘤菌的抗逆性. 植物生态学报, 30(1): 140–146. |
| [] | 王逸群, 荆玉祥. 2000. 豆科植物凝集素及其对根瘤菌的识别作用. 植物学通报, 17(2): 127–132. |
| [] | 朱宗元, 马毓泉, 刘钟龄, 等. 1999. 阿拉善-鄂尔多斯生物多样性中心的特有植物和植物区系的性质. 干旱区资源与环境, 13(2): 1–15. |
| [] | Burch-Smith T M, Stonebloom S, Xu M, et al. 2011. Plasmodesmata during development: Re-examination of the importance of primary, secondary, and branched plasmodesmata structure versus function. Protoplasma, 248(1): 61–74. DOI:10.1007/s00709-010-0252-3 |
| [] | Carlsbecker A, Lee J Y, Roberts C J, et al. 2010. Cell signalling by microRNA165/6 directs gene dose-dependent root cell fate. Nature, 465(7296): 316–321. DOI:10.1038/nature08977 |
| [] | Diaz C L, Logman T J J, Stam H C, et al. 1995. Sugar-binding activity of pea lectin expressed in white clover hairy roots. Plant Physiology, 109(4): 1167–1177. DOI:10.1104/pp.109.4.1167 |
| [] | Diaz C L, Melchers L S, Hooykaas P J J, et al. 1989. Root lectin as a determinant of host-plant specificity in the Rhizobium-legume symbiosis. Nature, 338(6216): 579–581. DOI:10.1038/338579a0 |
| [] | Dunoyer P, Schott G, Himber C, et al. 2010. Small RNA duplexes function as mobile silencing signals between plant cells. Science, 328(5980): 912–916. DOI:10.1126/science.1185880 |
| [] | Goormachtig S, Capoen W, James E K, et al. 2004. Switch from intracellular to intercellular invasion during water stress-tolerant legume nodulation. PNAS, 101(16): 6303–6308. DOI:10.1073/pnas.0401540101 |
| [] | Jian L C, Sun L H, Sun D L. 1987. Glycoproteins at the cell surface in cold hardy and cold tender wheat(Triticum aestivum L.). Plant Biology, 5: 59–66. |
| [] | Kurata T, Ishida T, Kawabata-Awai, et al. 2005. Cell-to-cell movement of the CAPRICE protein in Arabidopsis root epidermal cell differentiation. Development, 132(24): 5387–5398. DOI:10.1242/dev.02139 |
| [] | Lievens S, Goormachtig S, Holsters M. 2001. A critical evaluation of differential display as a tool to identify genes involved in legume and nodulation: looking back and looking forward. Nucleic Acids Research, 29(17): 3459–3468. DOI:10.1093/nar/29.17.3459 |
| [] | Long S R. 1996. Rhizobium symbiosis: nod factors in perspective. Plant Cell, 8(10): 1885–1898. DOI:10.1105/tpc.8.10.1885 |
| [] | Lucas W J, Bouche-Pillon S, Jackson D P, et al. 1995. Selective trafficking of KNOTTED1 homeodomain protein and its mRNA through plasmodesmata. Science, 270(5244): 1980–1983. DOI:10.1126/science.270.5244.1980 |
| [] | Molnar A, Melnyk C W, Bassett A, et al. 2010. Small silencing RNAs in plants are mobile and direct epigenetic modification in recipient cells. Science, 328(5980): 872–875. DOI:10.1126/science.1187959 |
| [] | Mylona P, Pawlowski K, Bisseling T. 1995. Symbiotic nitrogen fixation. Plant Cell, 7(7): 869–885. DOI:10.1105/tpc.7.7.869 |
| [] | Olmedo-Monfil V, Durán-Figueroa N, Arteaga-Vázquez M, et al. 2010. Control of female gamete formation by a small RNA pathway in Arabidopsis. Nature, 464(7288): 628–632. DOI:10.1038/nature08828 |
| [] | Puppo A, Groten K, Bastian F, et al. 2005. Legume nodule senescence: roles for redox and hormone signaling in the orchestration of the natural aging process. New Phytologist, 165(3): 683–701. |
| [] | Roberts A G, Oparka K J. 2003. Plasmodesmata and the control of symplastic transport. Plant Cell & Environment, 26(1): 103–124. |
| [] | Subba-Rao N S, Mateos P F, Baker D, et al. 1995. The unique root-nodule symbiosis between Rhizobium and the aquatic legume, Neptunia natans (L. f.) Druce. Planta, 196(2): 311–320. DOI:10.1007/BF00201390 |
| [] | Timmers A C J, Auriac M C, Truchet G. 1999. Refined analysis of early symbiotic steps of the Rhizobium-Medicago interaction in relationship with microtubular cytoskeleton rearrangements. Development, 126(16): 3617–3628. |
| [] | van Rhijn P, Fujishige N A, Lim P O, et al. 2001. Sugar-binding activity of pea lectin enhances heterologous infection of transgenic alfalfa plants by Rhizobium leguminosarum biovar viciae. Plant Physiology, 126(1): 133–144. DOI:10.1104/pp.126.1.133 |
| [] | van Rhijn P, Goldberg R B, Hirsch A M. 1998. Lotus corniculatus nodulation specificity is changed by the presence of a soybean lectin gene. Plant Cell, 10(8): 1233–1249. DOI:10.1105/tpc.10.8.1233 |
| [] | Vance C P, Johnson L E B, Stade S, et al. 1982. Birdsfoot trefoil (Lotus corniculatus) root nodules: morphogenesis and the effect of forage harvest on structure and function. Canadian Journal Botany, 60(4): 505–518. DOI:10.1139/b82-068 |
| [] | Wood S M, Newcomb W. 1989. Nodule morphogenesis: the early infection of alfalfa (Medicago sativa) root hairs by Rhizobium meliloti. Canadian Journal of Botany, 67(10): 3108–3122. DOI:10.1139/b89-390 |
| [] | Yang W C, de Blank C, Meskiene I, et al. 1994. Rhizobium nod factors reactivate the cell cycle during infection and nodule primordium formation, but the cycle is only completed in primordium formation. Plant Cell, 6(10): 1415–1426. DOI:10.1105/tpc.6.10.1415 |
 2012, Vol. 48
2012, Vol. 48

