文章信息
- 李姝江, 朱天辉
- Li Shujiang, Zhu Tianhui
- 杂交竹梢枯病菌毒素蛋白纯化及致病力
- Purification of the Toxic Protein from Arthrinium phaeospermum and Its Pathogenicity
- 林业科学, 2012, 48(11): 144-149.
- Scientia Silvae Sinicae, 2012, 48(11): 144-149.
-
文章历史
- 收稿日期:2011-08-24
- 修回日期:2012-09-17
-
作者相关文章
2. 四川农业大学森林保护省级重点实验室 雅安 625014
2. 2 Provincial Key Laboratory of Forest Protection, Sichuan Agricultural University Ya'an 625014
撑×绿杂交竹(Bambusa pervariabilis×Dendrocalamopsis grandis)梢枯病是长江中上游退耕还林毁灭性病害之一,可造成严重的生态和经济损失。由于该病是近年来四川栽培区新发现的病害,相关研究较少,目前仅对该病的病原及发生规律(朱天辉等,2009a)、症状特点及空间格局(朱天辉等,2009b)等方面做了一些研究。暗孢节菱孢菌(Arthrinium phaeospermum)为撑×绿杂交竹梢枯病最主要的病原菌,有较强的致病性(朱天辉等,2009a),但其致病机制尚无研究。
毒素为植物病原菌借以侵袭寄主植物的主要力量,是植物病理学的研究热点之一(Hatta et al., 2002;于莉等,2002;Suzuki et al., 2003;张利辉等,2003;Aremu et al., 2004),但病原真菌种类不同,所产生的致病毒素也有差异,且具有各种独特的化学结构及生理活性。迄今真菌能够产生具有致病活性的毒素物质的报道较多(Bournival et al., 1994;Rasmussen et al., 2004;杨斌等,2005;朱天辉等,2005;Shimizu et al., 2006),其中以多糖(Abang et al., 2009)、萜类化合物(Rattan,2010)、生物碱(Higashiguchi et al., 2006;Lorenz et al., 2009)及还原酮类(Mehdi et al., 2006;Xu et al., 2010)等的研究较为突出。此外,蛋白类毒素如Ap-toxin(Quayyum et al., 2003)、Vd-toxin(Palmer et al., 2005)、Ptr ToxA (Sarma et al., 2005)、Ptr ToxB(Betts et al., 2011)的研究也有报道。暗孢节菱孢菌致杂交竹梢枯病的症状特点表明其致病作用极可能与毒素有关(朱天辉等,2009b),但为何种活性物质尚未见证实。本研究以暗孢节菱孢菌为对象,对其致病毒素进行了纯化、序列分析和致病力测定,旨在进一步揭示该菌对杂交竹的致病机制。
1 材料与方法 1.1 试验材料供试菌株:暗孢节菱孢菌,分离于杂交竹梢枯病株,由四川农业大学森林保护实验室提供。
杂交竹品种:(撑×绿)杂交竹,撑篙竹(Bambusa pervariabilis)为母本,大绿竹(Dendrocalamopsis grandis)为父本,通过人工授粉培育,一年生(四川省杂交竹栽培区)。
毒素发酵液:以改进Fries为基础培养基(张金林等,2005),定量接种在PDA平板上培养的直径为5 mm的暗孢节菱孢菌丝块,26 ℃,140 r·min-1震荡培养15天,双层纱布过滤后,取其滤液备用。
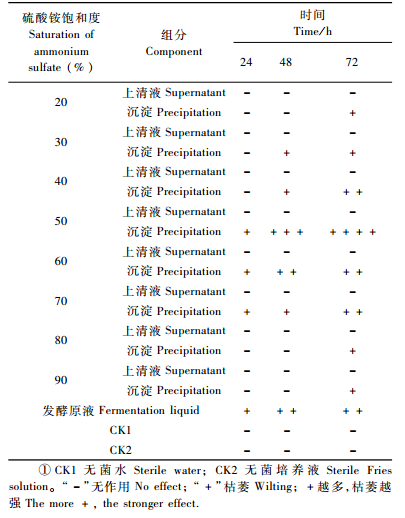
1.2 试验方法1) 毒素致病组分的确定硫酸铵分级盐析:取2 000 mL发酵液6 000 r·min-1分批离心,取上清液,弃除菌体和发酵残渣。慢慢向上清液中加入固体硫酸铵至20%饱和度,冰箱中静置2 h后,8 000 r·min-1离心15 min,分别收集上清和沉淀。将收集的上清液分为2等份,一份作生物测定,另一份加入固体硫酸铵,依次按照同样的方法调节到30%,40%,50%,60%,70%,80%,90%的硫酸铵饱和度。收集每1个饱和度的沉淀,将其溶解在磷酸缓冲液(PBS)中,用杂交竹浸渍法分别测定各饱和度上清液和沉淀的致病活性,同时确定硫酸铵的最适饱和度。
生物活性检测:采用浸渍法(Ho et al., 1996),取生长均匀一致、无病虫害幼嫩枝条(每枝5叶片)用75%酒精消毒10 s,再用无菌水清洗3次,然后插入保鲜膜封口的无菌1.5 mL离心管中,分别加入上述分离后的溶液(40 μg·mL-1)1 mL,以未接菌的培养液和无菌水为对照。25 ℃培养箱中培养(每天光照12 h),每处理6枝,重复3次。于24,48,72 h观察其枯萎状态。
2) 毒素蛋白的纯化(1)样品的透析和浓缩:透析袋预处理后,将用最佳硫酸铵饱和度盐析的毒素物质置透析袋中,用稀释10倍的pH6.5的磷酸缓冲液透析过夜,除去硫酸铵,将透析过装有毒素的透析袋用聚乙二醇60000包埋,浓缩至原体积的20%时取出,得到毒素蛋白粗提物。(2) Sephadex G-100凝胶层析(吴士良,2004)初步纯化,洗脱速度为0.6 mL·min-1,配合核酸蛋白检测仪在波长280 nm检测,检测结果由计算机记录。收集各个蛋白洗脱峰,浸渍法检测活性(Ho et al., 1996)。将有致病活性峰的样品,装入处理好的透析袋中采用上述方法浓缩,至约2 mL时收集,置4 ℃冰箱,备用。(3) SDS-PAGE检测活性蛋白(李建庆等,2008):选用分子量范围在20 000~94 000之间蛋白质标准样品,常规方法配制电泳缓冲液、丙烯酰胺贮存液和凝胶,SDS-PAGE电泳上述活性物质。(4) Q Sepharose fast flow强阴离子交换层析(王家政等,2001)进一步纯化,洗脱速度为0.6 mol·min-1,配合核酸蛋白检测仪在波长280 nm检测,收集各个洗脱峰,浸渍法检测活性(Ho et al., 1996)。(5)超滤离心管浓缩(吴士良,2004):将以上强阴离子交换层析具有致病活性蛋白样品加入超滤离心管滤膜上端,离心后体积为原来的10%,取出放入4 ℃冰箱,备用。将经过浓缩后的具有致病活性的样品分别用上述SDS-PAGE电泳,确定其为单一蛋白,为N末端部分氨基酸序列测定做准备。
3) 毒素蛋白N末端部分氨基酸序列测定纯化的有致萎活性毒素蛋白经SDS-PAGE后,凝胶置于CAPS缓冲液(含有0.1 mol·L-1 3-cyclohexylamino-l-propanesulfonic acid,10%甲醇,pH11.0)中浸泡2 min;同时将测序级PVDF膜在无水甲醇中浸泡15 s,再移至CAPS缓冲液中;将SDS-PAGE凝胶上的毒素蛋白转移至PVDF膜上;切下PVDF膜上的毒素蛋白带,由上海基康生物技术有限公司测序;采用BLASTP程序,通过NCBI(美国国家生物技术信息中心,NIH下属机构)Web服务器进行蛋白质序列数据库的类似性检索,网址为:http/www.ncbi.nlm.nih.gov/。
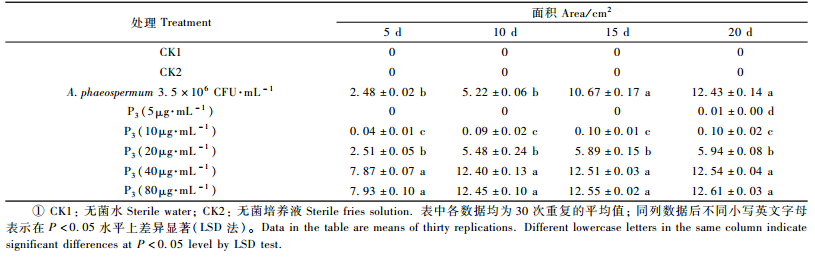
4) 毒素蛋白致病力测定分别用5,10,20,40,80 μg·mL-1的毒素蛋白溶液,以及A.phaeospermum悬液(3.5×106 CFU·mL-1)、无菌水(CK1)和无菌培养液(CK2)作为活性测试液,采用针刺法(Pedras et al., 2009)对毒素蛋白进行田间致病力检测。每个处理30株,每株1 mL。用灭菌针从上倾斜向下刺入杂交竹主干竹节处(杂交竹生长均匀一致、无病虫害;针刺前用75%酒精消毒10 s,并用无菌水清洗3次),然后抽出灭菌针,滴入0.1 mL液体。分别于5,10,15,20天后记录菱形病斑数量并计算其面积,病斑面积(cm2)=(a×b)/2(a,b分别为菱形病斑的两条对角线)。试验数据采用EXCEL和SPSS13.0软件分析处理,LSD法进行多重比较(P<0.05)。
2 结果与分析 2.1 毒素致病组分和硫酸铵最适饱和度将发酵液进行分级盐析后,对不同饱和度硫酸铵沉淀所得非蛋白类和蛋白类物质经杂交竹致病性生物检测显示(表 1),发酵液中非蛋白部分(上清液)无活性,而蛋白部分(沉淀)有活性;且随着硫酸铵饱和度的增大,活性物质的沉淀量逐步增加,达到50%时硫酸铵沉淀量最多活性最大,继续增大饱和度,活性物质的析出量逐步减少。由此可以确定活性物质为蛋白类,且最佳硫酸铵饱和度为50%。
|
|
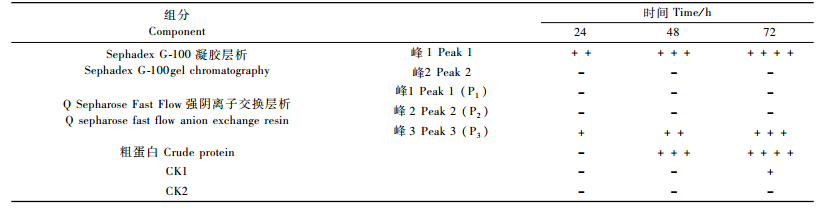
经过分级沉淀后的物质,经Sephadex G-100凝胶层析纯化后得到峰1和峰2两个波峰(图 1),波峰间分离明显,几乎没有重叠。致病活性检测结果表明(表 2):峰1具有致病性,而峰2不具有活性。收集活性峰1,聚乙二醇60000浓缩,进一步分离纯化。

|
图 1 粗蛋白的Sephadex G-100凝胶层析洗脱曲线 Fig.1 Elution curve of crude protein by Sephadex G-100 gel chromatography |
|
|
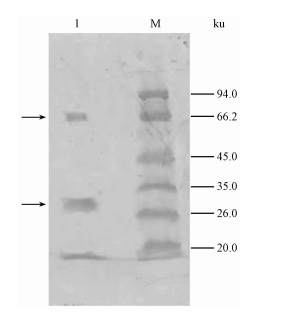
有致病活性的峰1浓缩样品经SDS-PAGE检测,结果显示(图 2),峰1由27,67 ku 2种蛋白质组成,纯度不够好,因此需将活性峰1浓缩后用Q sepharose fast flow阴离子交换树脂进一步纯化。
|
图 2 活性峰SDS-PAGE电泳 Fig.2 SDS-PAGE spectrum of the activated peak |
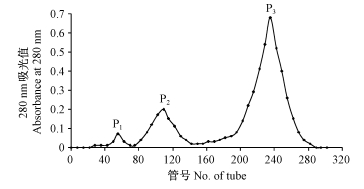
将过Sephadex G-100凝胶层析纯化后收集的活性峰1浓缩,用Q Sepharose Fast Flow强阴离子交换树脂进一步的分离纯化显示(图 3),A280洗脱曲线出现一个坡度较小的穿透峰1,随着NaCl浓度的升高,紧随出现第2个洗脱峰2,但峰值较小。最后,随着NaCl浓度的大幅度提高,出现了1个较大的洗脱峰3,将以上3个峰依次命名为P1,P2和P3。收集P1,P2,P3,活性检测只有P3具有致病活性(表 2)。将P3浓缩至0.2 mL,置于4 ℃冰箱备用。
|
图 3 活性峰1的Q sepharose fast flow强阴离子交换层析洗脱曲线 Fig.3 Elution curve of activated peak 1 by Q sepharose fast flow anion exchange |
有致病活性的P3峰样品浓缩后SDS-PAGE检测表明(图 4),2种层析法结合已经得到了纯度较高的单一蛋白,该蛋白以P3表示。

|
图 4 Q sepharose fast flow强阴离子变换层析后毒素蛋白P3电泳 Fig.4 SDS-PAGE spectrum of toxic protein P3 after Q sepharose fast flow |
通过2种层析方法获得有致病活性的毒素蛋白,有毒力的为能测序的P3蛋白(表 2),P1,P2 无活性。
2.5 毒素蛋白P3的N末端部分氨基酸序列分析及对蛋白质序列库的类似性检索将纯化得到的抗菌蛋白P3经SDS-PAGE测定为单一条带,分子量约为27 ku,其N末端7个氨基酸序列:H2N-Ala-Gln-Ser-Val-Pro-Tyr-Gly。
测得N末端氨基酸序列后,为判定P3是否为1种新蛋白,以N末端7个氨基酸序列片段为靶序列,在NCBI蛋白质数据库进行蛋白质序列类似性搜索,从中共检索出100个与P3 N末端序列相似。结果表明:检测出的100个序列多是丝氨酸蛋白酶或丝氨酸蛋白酶前体及重组酶的序列,这100个序列具有致病活性的只有枯草芽孢蛋白酶(subtilisin protease)(登录号:AAA22814.1),而且枯草芽孢蛋白酶分子量27 ku,与P3的分子量极为相近。另外,P3多是从N末端第1个残基与库中序列的第84~86或107~109对准,这些序列在对准点之前的序列属于信号肽序列,作为一个胞外蛋白酶,分泌过程中已除去信号肽序列,检索到的subtilisin protease除去对准点的序列,剩余的长度与P3的序列长度相符。
2.6 毒素蛋白P3致病力与病原菌侵染力的比较用A.phaeospermum悬液和P3(10,20,40,80 μg·mL-1)处理的150株杂交竹针刺处均出现不同大小的褐色菱形病斑,而CK1和CK2在整个检测期都没有病斑出现(表 3)。对比A.phaeospermum悬液和毒素蛋白P3的处理发现,除5 μg·mL-1的P3外,菱形病斑面积在5~10天均大幅增长,且A.phaeospermum悬液与20 μg·mL-1的P3在此期间差异不显著;而10天后P3(10~80 μg·mL-1)处理的病斑面积保持在相对稳定的水平,A.phaeospermum悬液的处理在10~15天还有一个显著增长的趋势,15~20天增长缓慢,且A.phaeospermum悬液与40,80 μg·mL-1 P3处理从15天开始差异不显著。从毒素蛋白P3的浓度上看,5 μg·mL-1的处理检测前期没有病斑出现,直到20天时才有较小的病斑;10 μg·mL-1的处理在整个检测期内病斑面积都没有超过0.1 cm2;20~80 μg·mL-1的处理增长趋势相似,但40与80 μg·mL-1无显著差异,20 μg·mL-1处理的病斑面积与上述处理差异显著。
|
|
本研究采用柱层析和阴离子交换层析从暗孢节菱孢发酵液中纯化出一种对杂交竹有致病活性的蛋白质类物质,这一结果与Vijayakumar等(1996)和Bloor(2008)从引起人体皮肤病的暗孢节菱孢菌中分离获得的致病因子arthrichitin和arthrinic acid不同,印证了同种真菌在不同寄主不同条件下所产生的致病活性物质存在差异。该蛋白经N末端测序得到7个氨基酸序列为H2N-Ala-Gln-Ser-Val-Pro-Tyr-Gly,通过NCBI对蛋白质数据库的类似性检索,发现其与枯草芽孢蛋白酶(subtilisin protease)无论在分子量大小还是N端序列均类似,由此推测其与subtilisin protease同源性较高或者有可能为该物质。结合赵从等(2007)和姚刚等(2009)从枯草芽孢杆菌Bacillus subtilis中分离得到subtilisin protease的报道,该物质是否能由暗孢节菱孢产生还需进一步的结构测定和比对来验证。
蛋白质的分离纯化至今没有单独或一套现成的方法,往往都是将分子筛层析、离子交换层析、疏水层析、亲和层析等联合使用达到目的。本试验首先用柱层析纯化获得的活性峰检测后纯度并不理想,而后经阴离子交换层析才得到纯度较高分子量为27 ku的单一蛋白,可见蛋白质这种大分子物质的纯化较为复杂且要求较高。此外,本研究中纯化过程不同波峰的获取物,其致病力及所导致的症状都有所不同,对比前人在研究板栗疫病菌毒素(Cp-I toxin)(韩珊等,2009)、松赤枯病毒素(Pf-toxin)(朱天辉等,2003)中的结果,可以看出本试验中引起杂交竹萎蔫的活性物质比较单一,而不是多种物质的协同作用。用纯化物进行生测,其反应时间较粗毒素快;在田间致病力检测中,纯化物反应时间也比病原菌快,分析其原因可能是检测用毒素的浓度较杂交竹自然发病时所产毒素的浓度高,故其致萎性也相对增强。另外,用纯蛋白P3对杂交竹处理时,显示的症状与病原菌所致典型症状相同,再次印证了该毒素蛋白是引起杂交竹梢枯病的主要因素。浓度差异显示5~10 μg·mL-1为该蛋白的有效起始作用浓度,且浓度越高其致病力越强,验证了该毒素的毒力大小,这与甘莉等(1995)、陈桂平等(2009)研究结果相似。当一个新的蛋白质或核酸序列被测定出来后,为判定是否是新蛋白或新基因,就需要进行对序列数据库的类似性检索,本研究采用NCBI检索发现存在与纯蛋白P3相似的序列,获得有生物性意义的结果。暗孢节菱孢菌作为杂交竹的新病原,致病机制尚未完全清楚,其毒素导致杂交竹枯死只是机制的一个方面,有关该毒素蛋白的作用位点及寄主细胞信号识别、传导机制需深入研究。
| [] | 陈桂平, 客绍英, 陈玉芹. 2009. 菘蓝根腐病菌毒素最适浓度的筛选及其对菘蓝幼苗可溶性蛋白的影响. 安徽农业科学, 37(33): 16392–16394. |
| [] | 甘莉, 吕金殿, 汪沛洪. 1995. 棉花黄萎病菌分泌的糖蛋白毒素与其致病力的关系. 中国农业科学, 28(2): 58–65. |
| [] | 韩珊, 朱天辉. 2009. 寄生隐丛赤壳菌致病毒素Cp-I的分离纯化和结构分析. 菌物学报, 28(4): 535–540. |
| [] | 李建庆, 张永安, 杨忠岐, 等. 2008. 杀天牛毒蛋白的分离纯化及其N-末端氨基酸序列的测定. 西北农林科技大学学报:自然科学版, 36(3): 171–175. |
| [] | 汪家政, 范明. 2001. 蛋白质技术手册. 北京, 科学出版社: 77-100. |
| [] | 吴士良. 2004. 生物化学与分子生物学实验教程. 北京, 科学出版社: 20-24. |
| [] | 杨斌, 叶建仁, 包宏, 等. 2005. 松针褐斑病菌毒素LA-Ⅰ的分离纯化及其化学结构. 林业科学, 41(2): 86–90. DOI:10.11707/j.1001-7488.20050214 |
| [] | 姚刚, 程建军, 孙鹏, 等. 2009. 枯草芽孢杆菌发酵产碱性蛋白酶的研究. 食品科学, 30(23): 347–351. DOI:10.3321/j.issn:1002-6630.2009.23.079 |
| [] | 于莉, 陈捷, 李赤, 等. 2002. 黑斑毒素对感病和抗病向日葵叶组织超微结构的影响. 植物病理学报, 32(3): 252–256. |
| [] | 张利辉, 刘云惠, 董金皋, 等. 2003. 玉米大斑病菌特异性毒素组分的分离与纯化. 植物病理学报, 33(1): 67–71. |
| [] | 张金林, 庞民好, 刘颖超, 等. 2005. 坪草腐霉病菌毒素产生除草活性物质的条件优化. 河北农业大学学报, 28(4): 84–88. |
| [] | 赵从, 张敏, 王建玲, 等. 2007. 枯草芽孢杆菌ZC-7中性蛋白酶的分离纯化及酶学性质研究. 中国生物工程杂志, 27(10): 28–33. |
| [] | 朱天辉, 黄宗超, 高强章, 等. 2009a. 撑×绿杂交竹梢枯病病原及发生规律研究. 中国森林病虫, 28(2): 10–12, 31. |
| [] | 朱天辉, 黄宗超, 高强章, 等. 2009b. 撑×绿杂交竹梢枯病调查及空间分布型研究. 四川林业科技, 30(1): 29–31, 37. |
| [] | 朱天辉, 罗孟军, 叶华智. 2003. 枯斑盘多毛孢Pf-毒素活性组分的分离纯化. 植物病理学报, 33(6): 541–545. |
| [] | 朱天辉, 罗孟军, 叶华智. 2005. 枯斑盘多毛孢Pf-毒素活性组分的研究Ⅰ, 活性组分Ⅰ的结构分析. 菌物学报, 24(1): 112–125. |
| [] | Abang M M, Abraham W R, Asiedu R, et al. 2009. Secondary metabolite profile and phytotoxic activity of genetically distinct forms of Colletotrichum gloeosporioides from yam (Dioscorea spp.).. Mycological Reasearch, 113(1): 130–140. DOI:10.1016/j.mycres.2008.09.004 |
| [] | Aremu E A, Tanaka K, Akagi Y, et al. 2004. Detection of fungi producing infection-inhibiting metabolites against Alternaria alternata Japanese pear pathotype from fungi inhabiting internal tissues of Japanese pear shoots. Journal of General Plant Pathology, 70(2): 139–142. DOI:10.1007/s10327-003-0102-7 |
| [] | Betts M F, Manning V A, Cardwell K B, et al. 2011. The importance of the N-terminus for activity of Ptr ToxB, a chlorosis-inducing host-selective toxin produced by Pyrenophora tritici-repentis. Physiological and Molecular Plant Pathology, 75(4): 138–145. DOI:10.1016/j.pmpp.2011.03.002 |
| [] | Bloor S. 2008. Arthrinic acid, a novel antifungal polyhydroxyacid from Arthrinium phaeospermum. Journal of Antibiotics, 61(8): 515–517. DOI:10.1038/ja.2008.69 |
| [] | Bournival B L, Ginoza H S, Schenck S, et al. 1994. Characterization of sugarcane response to Bipolaris sacchari: inoculations and host-specific HS-toxin. Phytopathlogy, 46(4): 672–676. |
| [] | Higashiguchi F, Nakamura H, Hayashi H, et al. 2006. Purification and structure determination of capsaicin and dihydrocapsaicin from varions Capsicum fruits. Journal of Agricultural and Food Chemistry, 54(16): 5948–5933. DOI:10.1021/jf0607720 |
| [] | Hatta R, Ito K, Hosaki Y, et al. 2002. A conditionally dispensable chromosome controls host-specific pathogenicity in the fungal plant pathogen Alternaria alternata. Genetics, 161(1): 59–70. |
| [] | Ho S H, Koh L, Ma Y, et al. 1996. The oil of garlic, Allium sativum L. (Amaryllidaceae), as a potential grain protectant against Tribolium castaneum (Herbst) and Sitophilus zeamais Motsch. Postharvest Biology and Technology, 9(1): 41–48. |
| [] | Lorenz N, Haarmann T, Pažoutová S, et al. 2009. The ergot alkaloid gene cluster: functional analyses and evolutionary aspects. Phytochemistry, 70(15-16): 1822–1832. DOI:10.1016/j.phytochem.2009.05.023 |
| [] | Mehdi R B A, Siond S, Fguira Z F B, et al. 2006. Purification and structure determination of four bioactive molecules from a newly isolated Streptomyces sp. TN97 strain. Process Biochemistry, 41(7): 1506–1513. DOI:10.1016/j.procbio.2006.02.010 |
| [] | Palmer C S, Saleeba J A, Lyon B R. 2005. Phytotoxicity on cotton ex-plant of an 18. 5 kDa protein from culture filtrates of Verticillium dahliae. Physiological and Molecular Plant Pathology, 67(6): 308–318. |
| [] | Pedras M S C, Chumala P B, Jin W, et al. 2009. The phytopathogenic fungus Alternaria brassicicola: phytotoxin production and phytoalexin elicitation. Phytochemistry, 70(3): 394–402. DOI:10.1016/j.phytochem.2009.01.005 |
| [] | Quayyum H A, Gijzen M, Traquair J A. 2003. Purification of a necrosis-inducing, host-specific protein toxin from spore germination kluid of Alternaria panax. Phytopathology, 93(3): 323–328. DOI:10.1094/PHYTO.2003.93.3.323 |
| [] | Rasmussen J B, Kwon C Y, Meinhardt S W. 2004. Requirement of host signaling mechanisms for the action of Ptr ToxA in wheat. European Journal of Plant Pathology, 110(3): 333–335. DOI:10.1023/B:EJPP.0000019789.49449.a5 |
| [] | Rattan R S. 2010. Mechanism of action of insecticidal secondary metabolites of plant origin. Crop Protection, 29(9): 913–920. DOI:10.1016/j.cropro.2010.05.008 |
| [] | Sarma G N, Manning V A, Ciuffetti L M, et al. 2005. Structure of ptr toxA: an RGD-containing host-selective toxin from Pyrenophora tritici-repentis. Plant Cell, 17(11): 3190–3202. DOI:10.1105/tpc.105.034918 |
| [] | Shimizu N, Hosogi N, Hyon G S, et al. 2006. Reactive oxygen species (ROS) generation and ROS-induced lipid peroxidation are associated with plasma membrane modifications in host cells in response to AK-toxin Ⅰ from Alternaria alternata Japanese pear pathotype. Journal of General Plant Pathology, 72(1): 6–15. DOI:10.1007/s10327-005-0245-9 |
| [] | Suzuki T, Shinogi T, Narusaka Y, et al. 2003. Infection behavior of Alternaria Alternata Japanese pear pathotype and localization of 1, 3-β-D-glucan in compatible and incompatible interactions between the pathogen and host plants. Journal of General Plant Pathology, 69(2): 91–100. DOI:10.1007/s10327-002-0001-3 |
| [] | Vijayakumar E K S, Roy K, Chatterjee S, et al. 1996. Arthrichitin, a new cell wall active metabolite from Arthrinium phaeospermum. Journal of Organic Chemistry, 61(19): 6591–6593. DOI:10.1021/jo960769n |
| [] | Xu L S, Jia J G, Lv J, et al. 2010. Characterization of the expression profile of a wheat aci-reductone-dioxygenase-like gene in response to stripe rust pathogen infection and abiotic stresses. Plant Physiology and Biochemistry, 48(6): 461–468. DOI:10.1016/j.plaphy.2010.03.002 |
 2012, Vol. 48
2012, Vol. 48