文章信息
- 马星霞, 蒋明亮, 覃道春
- Ma Xingxia, Jiang Mingliang, Qin Daochun
- 竹材受不同败坏真菌危害的宏观和微观变化
- Macro-and Micro-Structural Changes in Bamboo after Attack by Various Fungi
- 林业科学, 2012, 48(11): 76-82.
- Scientia Silvae Sinicae, 2012, 48(11): 76-82.
-
文章历史
- 收稿日期:2011-07-21
- 修回日期:2012-09-07
-
作者相关文章
2. 国际竹藤中心 北京 100102
2. International Center for Bamboo and Rattan Beijing 100102
危害木竹材的微生物因子主要有真菌和细菌,根据危害方式和危害程度不同,将危害真菌分为霉菌、变色菌和腐朽菌(马星霞等,2011)。新砍伐的竹材由于组织中糖类(如淀粉)等比较丰富,含水率较大,所以尤其容易遭受霉菌和变色菌的侵染(马星霞等,2009a;2009b)。霉菌和变色菌一般不会破坏竹材的细胞壁,影响竹材的强度,但会严重影响竹材及其制品的外观,降低其品质和商品价值(Ye,2002)。同时,伴随着霉菌和变色菌的侵染,腐朽菌也会进一步侵入,腐朽菌不仅影响竹材及其制品的外观,更严重的是破坏细胞壁结构,直接影响竹材强度,使其逐渐腐朽,降低甚至丧失使用价值。由腐朽菌导致的腐朽也是纸浆竹运输和储存期的严重问题,经过一年储存的纸浆竹,其质量损失率达25%(Jiang,2007)。
通过高分辨率的光学显微镜,很多专家揭示了木材微生物对寄主木材的败坏过程(Cartwright et al., 1929; Schwarze et al., 2000a; 2000b; Baum et al., 2002; Schwarze, 2007),指出掌握生物败坏因子入侵竹材的规律是实现竹材科学保护的基础,但对竹材与其微生物败坏因子相互作用研究的文献报道很少。因此,本文参照国家标准GB/T 18261—2000《防霉剂对防治木材霉菌及蓝变菌的试验方法》和GB/T 13942.1—2009《木材耐久性能第1部分:天然耐腐性实验室试验方法》中的危害生物侵染试材的方法,分别将霉菌、变色菌和密粘褶菌(褐腐菌)侵染竹材,观察竹材被这些败坏因子侵染发生的宏观变化,并采用扫描电镜(SEM)观察不同败坏因子入侵竹材引起的竹材微观结构变化。
1 材料与方法 1.1 供试菌株本试验使用的菌株如表 1所示(马星霞等,2009a)。
|
|
本试验材料采用浙江杭州庙山坞产的3~4年生毛竹(Phyllostachys edulis)。从地面基部1.3 m以上截取1 m作为试材。每段竹材取中间的3~4节,再按照不同菌株侵染试验锯解成不同的试样尺寸。
1.3 霉菌与变色菌侵染试验方法将部分竹材除去表皮和内表皮髓外组织,锯解成尺寸为50 mm×20 mm×5 mm的小条,而带皮带髓竹材锯解为50 mm×20 mm×自然厚度的试样,同时进行试验。参照国家标准GB/T 18261—2000《防霉剂防治木材霉菌与蓝变菌的试验方法》,在无菌条件下,用移液器从三角瓶内吸取制备好的新鲜霉菌与变色菌孢子和菌丝体混合悬浮液,注入已有平板培养基的培养皿(直径9 cm)内(每个培养皿内0.2~0.5 mL),使之在培养基表面均匀分布,再在铺满菌丝的培养皿中放2根已灭菌的玻璃棒(直径3 mm),平行排列,然后将试样横放在玻璃棒上面,每个培养皿内放2块试样。将培养皿封好后放在霉菌培养箱内,保持温度25~28 ℃,相对湿度85%,培养4周。观察霉菌与变色菌侵染情况,记录试材感染值。然后擦拭掉竹材表面的菌丝和孢子团,观察表面颜色变化后,沿着径向方向劈开试材,观察内部颜色变化(表 2)。
|
|
将部分竹材除去表皮和内表皮髓外组织,锯解成尺寸为20 mm×20 mm×10 mm的小块,而带皮带髓竹材锯解为20 mm×20 mm×自然厚度的试样,同时进行试验。参照国家标准GB/T13942.1—2009《木材天然耐久性能第1部分:天然耐腐性实验室试验方法》,将试材放入砂基培养基已培养好的腐朽菌培养瓶中,置于饲木上。然后将盛有试样的培养瓶放置于恒温恒湿培养箱中,保持温度(28±2) ℃,相对湿度85%左右。分别于试菌侵染第4,8,12,16周时取出12块试材,测量质量损失率。
1.5 扫描电镜观察(SEM)SEM切片和电镜观察方法参照Behbood等(2010)的方法,将经过霉菌、变色菌和腐朽菌侵染试验的试材刷去表面菌丝,流水冲洗表面,然后浸入FAA固定液中固定12 h以上,用滑走切片机切取10 mm×10 mm×1 mm试样,每试样分别横切和纵切,将每个切片在3%的戊二醛中固定24 h,接着用梯度酒精(50%—70%—90%—100%)脱水,每级脱水1 h,之后用导电胶粘于小托盘上,在JFC-1600型自动精度仪(auto fine coater)上进行抽真空喷金处理,喷镀电流为30 mA,时间为60 s,白金厚度一般可达8 nm,然后采用日本电子株式会社(JEOL)生产的JSM-5500LV型扫描电子显微镜观察、成像。
2 结果与分析 2.1 竹材受霉菌与变色菌侵染的表面及内部微观变化特征霉菌与变色菌侵染竹材如图 1所示。从图中可见:所有的霉菌与变色菌在竹材上的侵染值都达到了最高危害值4,去皮去髓的竹材上的感染值也为4(图片略)。擦洗掉试材表面的菌丝和霉菌孢子团观察竹材表面,发现哈慈木霉侵染后的竹材表面未发生颜色变化,但产紫青霉使竹材的内表皮髓外组织的颜色变成紫红,而变色菌可可球二孢、串珠镰刀菌、链格孢菌和茎点霉菌使竹材的表面发生青褐色、紫黑色至黑色的颜色变化(图 2)。

|
图 1 霉菌与变色菌侵染竹材 Fig.1 Bamboo sheets infected by molds and stain fungi a为哈慈木霉侵染;b为产紫青霉侵染;c为链格孢菌侵染;d为串珠镰刀菌侵染;e为可可球二孢侵染;f为茎点霉菌侵染。 a by Trichoderma harzianum; b by Penicillium purpurogenum; c by Alternaria alternata; d by Fusarium moniliforme; e by Botryodiplodia theobromae; f by Phoma sp. |

|
图 2 竹材被变色菌侵染发生的颜色变化 Fig.2 Macro-structural changes in bamboo after attack by stain fungi a为对照竹材;b为产紫青霉侵染后的竹材;c为被可可球二孢侵染的竹材;d为被串珠镰刀菌侵染的竹材;e为被链格孢菌侵染的竹材;f被茎点霉菌侵染的竹材。 a bamboo specimen of no stain fungi infection; b by Penicillium purpurogenum; c by Botryodiplodia theobromae; d by Fusarium moniliforme; e by Alternaria alternata; f by Phoma sp. |
将哈慈木霉和产紫青霉侵染后的试材切片后进行扫描电镜观察,未发现其内部有菌丝和孢子的存在,竹材结构保持完好(图 3)。分析认为:气生菌丝生长不旺盛的霉菌,主要靠分生孢子和分生孢子团侵染竹材表面,不能进入竹材内部。有些能够产生色素的霉菌如产紫青霉,分泌的色素在竹材表面附着,使表面发生颜色变化,竹材颜色变化深度反映了色素渗入深度。一般色素分泌仅能够渗入竹材表面几微米(Schmidt, 2006),所以竹材的颜色变化发生在孢子团聚集的几个微米的表面,对竹材内部颜色没有影响。

|
图 3 哈慈木霉侵染后的竹材的横切SEM Fig.3 Scanning electron micrograph of cross section of bamboo after Trichoderma harzianum invasion My:竹材后生木质部导管Metaxylem vessels;Fs:竹材的纤维束组织Fibre strands;Pc:薄壁细胞组织Parenchyma tissues. |
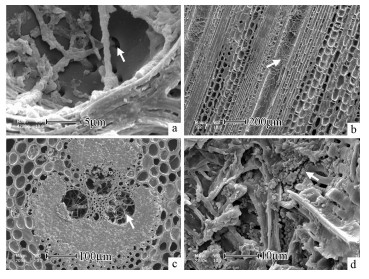
变色菌在寄主上生长,一般具有发达的气生菌丝,将变色菌可可球二孢、串珠镰刀菌、链格孢菌、茎点霉菌侵染后的试材切片后进行电子扫描电镜观察发现:变色菌菌丝在细胞间主要通过细胞壁上的纹孔进行扩展(图 4a),进入到不同组织的细胞内部,沿着后生木质部导管、原生木质部和薄壁组织细胞之间的孔隙蔓延,填充到竹材的维管束中(图 4b,c)。菌丝在细胞内生长,甚至于产孢(图 4d)。同时,因变色菌的菌丝能侵入到竹材内部而分泌色素,从而使竹材的内部发生青褐色、紫黑色至黑色的颜色变化(图片略)。
|
图 4 变色菌侵染竹材的横切和纵切SEM Fig.4 Scanning electron micrograph of cross and vertical section of bamboo after stain fungi invasion a为串珠镰刀菌侵染竹材的横切SEM图;b为细交链格孢菌侵染竹材的纵切面图;c为可可球二孢在竹材维管束中的占据图(横切);d为茎点霉菌在竹材内部产孢(横切)。 a:SEM of cross section of bamboo after Fusarium moniliforme invasion; b:SEM of vertical section of bamboo after Alternaria alternate invasion; c:SEM of cross section of bamboo after Botryodiplodia theobromae invasion; d:SEM of cross section of bamboo after Phoma sp. |
受霉菌和变色菌侵染17周,竹材引起的质量损失率很小或没有,说明霉菌和变色菌对竹材的降解很少,甚至没有。
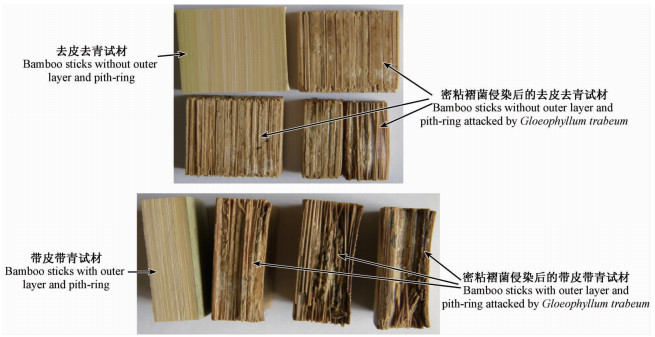
2.2 腐朽菌对竹材侵染的宏观及微观变化腐朽菌密粘褶菌侵染竹材4,8,12,16周后的质量损失率如图 5所示,经过4周的腐蚀,竹材的质量损失率不足6%,去皮去髓的竹材质量损失率为5.64%,带皮带髓竹材质量损失率为5.88%,但发现2种试样的竹材结构已经变得比较松软,表明其强度损失严重;到第8周肉眼观察竹材更加松软,但去皮去髓竹材质量损失仍仅为6.64%,与第4周差别不大,带皮竹材质量损失率为11%;腐朽12周,竹材的质量损失率继续稍稍增加,带皮竹材质量损失率达到13.6%,而去皮竹材仅为7.5%;过了12周的腐朽时间后,竹材质量损失率急剧下降,带皮竹材和去皮竹材的质量损失率分别达到35.5%和23.9%。去皮竹材腐朽为细条带状,而带皮带髓竹材表皮和内表皮髓外组织保持较完整结构,呈层状,竹材中部腐朽严重,完全丧失强度,与去皮后竹材腐朽情况一致(图 6)。

|
图 5 竹材受褐腐菌密粘褶菌腐朽4,8,12和16周后的质量损失率 Fig.5 The percentage of mass loss of bamboo sticks infected by brown-rot fungus Gloeophyllum trabeum after 4, 8, 12, 16 weeks |
|
图 6 竹材被密粘褶菌侵染后发生的宏观变化 Fig.6 Macro-structural changes in bamboo sticks attacked by brown-rot fungus Gloeophyllum trabeum |
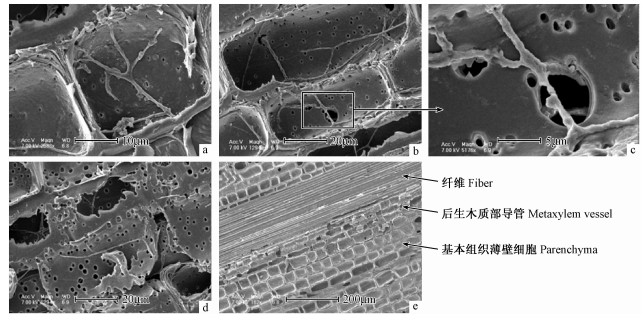
扫描电镜观察竹材受密粘褶菌侵染后的内部结构变化发现:侵染4周与8周的竹材内部结构变化不明显,仅观察到菌丝在细胞内和细胞间蔓延,菌丝在细胞间的蔓延主要通过细胞壁的纹孔进行(图 7a),与变色菌相似。密粘褶菌在竹材组织内部扩展,菌丝分枝越来越多,菌丝越来越粗,并首先在穿过细胞壁的菌丝周围使细胞壁形成孔洞(图 7b, c)。孔洞随之越来越大,形成的孔洞越来越多,最后导致整个竹材组织瓦解(图 7d)。腐朽12周的竹材结构发生严重破坏,不同组织的破坏顺序和程度不同。从竹材纵切面观察不同部位的腐朽严重程度可推测腐朽的顺序,遭到最严重破坏的后生木质部导管细胞壁应是腐朽菌首先降解的部位,被破坏其次严重的是基本组织薄壁细胞的细胞壁,破坏轻微的也是最后破坏的是纤维束中的纤维细胞壁(图 7e)。说明首先发生降解的是木质部导管细胞壁,然后是基本薄壁组织细胞壁,最后是纤维。
|
图 7 密粘褶菌侵染竹材12周的SEM Fig.7 Scanning electron micrograph of cross and vertical section of bamboo after Gloeophyllum trabeum invasion 12 weeks a:菌丝穿过细胞壁纹孔在细胞中蔓延(横切);b, c:穿过细胞壁的菌丝周围出现孔洞(横切);d:降解孔越来越大,相邻的降解孔连在一起,使细胞壁溃解(横切);e:竹材被密粘褶菌侵染垂直切面图,首先破坏的是后生木质部导管壁,其次是基本薄壁组织细胞,留下纤维层。 a: Hyphae of G. trabeum spreading in the cell after through the cell wall pits; b, c: The holes appeared around the hypha through the cell wall; d: The bore holes later enlarged uniformly to diameters several times greater than original hyphal size; e: Vertical section showed that bamboo decay by G. trabeum firstly on metaxylem vessel wall. |
一般所提及的霉菌与变色菌并非是分类学上的名词,而仅仅是习惯术语,所以并没有严格的界限。某些霉菌也能使木竹材表面颜色发生变化,如产紫青霉导致材料表面红紫色变化。而有些变色菌也能在材料表面造成“霉斑”,如镰刀菌在材料表面形成黑色斑点。本文将造成竹材颜色变化、菌丝生长发达并能够侵入到竹材内部的真菌统称变色菌,而将气生菌丝生长不发达、仅在木材表面聚集产孢不能或难以侵入竹材内部的败坏真菌称为霉菌。
霉菌菌丝仅能穿过竹材表面几毫米,大量分生孢子团在竹材表面形成霉斑,哈慈木霉和产紫青霉侵染后的竹材未发现内部有菌丝和孢子的存在(图 3),竹材结构完好。产紫青霉能够分泌色素,在竹材表面色素沉着,使表面发生颜色变化,但由于菌丝未能伸入内部,所以对竹材内部颜色没有影响。霉菌的生命力比较旺盛,仅靠少数水分就能生长,在极端温度下也能生存(马星霞等,2009b),所以一般靠涂刷油漆等方式掩盖,而难以根除。
据报道,真菌的附着孢是使真菌靠机械力量固定到材料上的特殊形式的菌丝,变色菌的这一结构称为“Transpressoria”(Schmidt, 2006)。变色菌菌丝靠机械压力穿透竹材的细胞壁,也有的菌丝通过纹孔进入竹材,填充在竹材的维管束中(图 4b,c),在后生木质部导管、原生木质部和薄壁组织细胞之间的孔隙中蔓延(图 4c), 占据能够侵入的空间。菌丝在细胞与细胞之间的扩展是通过细胞壁的纹孔(图 4a)。菌丝在细胞内生长、产孢(图 4d)。Schmidt(2006)实验室测试发现,霉菌和变色菌可降解果胶、半纤维素和纤维素,但不能降解木质化的细胞壁,所以本试验中霉菌与变色菌对竹材的质量变化影响很小。变色菌菌丝在竹材内部,依靠原生木质部和薄壁组织细胞内存储的小分子糖类、淀粉、磷脂等有机物作为营养,很少破坏细胞壁,对竹材的细胞壁结构及强度没有太大影响;但菌丝分泌的色素加上本身菌丝的内部聚集使竹材发生严重的颜色变化。可可球二孢、串珠镰刀菌、链格孢菌等变色菌和茎点霉菌不仅使竹材的表面发生青褐色、紫黑色至黑色的颜色变化,而且菌丝能够侵入到竹材内部影响竹材内部的颜色变化。由于竹材比木材更富有淀粉等糖类和其他盐类物质,所以更容易被霉菌和变色菌侵染。竹材的防霉、防变色处理是目前竹材加工利用不可缺少的环节和难点。
Nutman (1929)曾经描述了褐腐菌Polyporus hisidus最初侵入细胞壁的过程:在与细胞接触的菌丝顶端产生一种钩状结构的“侵入钉”,穿过细胞壁时开始增大,靠机械压力穿透细胞壁后,细胞壁开始消解,形成沙漏型的消解孔,而后“侵入钉”恢复为一般菌丝。Cartwright (1930)报道Postia placenta的菌丝尖端在接触的细胞壁管腔内壁形成刻痕,然后迅速穿过细胞壁。菌丝穿过形成的孔洞后来不规则地增大,直径超过菌丝直径的数倍,表明在菌丝穿过细胞壁时伴随着最初降解酶的分泌和降解反应的发生。穿透孔洞的形成与否是分辨腐朽菌与变色菌及霉菌的有效方式之一。菌丝穿透细胞壁时孔洞增大或穿过后孔洞恢复为菌丝直径大小可区分不同的腐朽菌。
腐朽菌降解木材时,一般首先在细胞壁上形成孔洞(Liese, 1970; Schwarze et al., 2004; Schwarze, 2007)。过去很多人认为孔腔和孔洞的形成是软腐菌降解的典型特征(Savory, 1954; Zabel et al., 1985; Eriksson et al., 1990),但后来被证实有些白腐菌和褐腐菌也能形成这种降解孔洞(Kleist et al., 2001; 2002; Schwarze et al., 2000c; 2005;Worrall et al., 1997)。
在本研究中,密粘褶菌菌丝通过竹材细胞壁的纹孔(图 7a)在竹材细胞与细胞之间蔓延,与变色菌一致,但其菌丝穿过竹材细胞壁后壁上有孔腔存在,说明了降解反应的发生。密粘褶菌菌丝在竹材内部的分枝越来越多,菌丝直径越来越大,在穿过墙壁的菌丝周围逐渐出现孔洞,孔洞随之越来越大,相邻的孔洞也逐渐连接成片,最终导致组织的破损和崩解(图 7b, c, d)。
从竹材纵切面观察,破坏最严重的是后生木质部导管壁细胞,其次是基本薄壁组织细胞壁,最后才是纤维层。这可推测木质部导管细胞壁首先发生降解,然后是基本薄壁组织细胞壁,剩下的纤维比较难以降解,观察腐朽后的竹材,剩余物为一缕一缕的纤维丝,与显微结构观察结果一致。
与白腐菌明显不同,褐腐菌迅速降解细胞壁的纤维素,留下甲基化的木质素,从而引起剧烈的强度损失和木材聚合度的下降(Zabel et al., 1992)。本研究中竹材在褐腐菌密粘褶菌腐朽4,8,12周时,虽然质量损失率并不大,质量损失下降的趋势不显著(图 4),但竹材非常松软,表明试材从最开始被侵入时强度就急剧下降了。
4 结论1) 不论是带皮带青竹材还是去皮去青竹材,都很容易遭受霉菌、变色菌和腐朽菌的侵染,霉菌与变色菌的菌丝和孢子团在竹材上的侵染面积达到100%,但对竹材的质量损失影响很小;而腐朽菌降解竹材,使其发生超过20%的质量损失率。
2) 霉菌由于菌丝结构不发达,仅分生孢子团聚集竹材表面,少数分泌色素的霉菌还影响竹材表面,使其发生颜色变化,但不能进入竹材内部破坏竹材的内部结构或影响内部颜色变化。
3) 变色菌由于具有发达的菌丝结构,所以不仅在竹材的表面聚集,使竹材发生颜色变化,还深入到竹材内部使其内部发生相应的青变、褐变和黑变等颜色变化。
4) 变色菌和腐朽菌侵入竹材的过程是:菌丝由细胞壁纹孔进入到不同组织的细胞内部,并沿着后生木质部导管、原生木质部和薄壁组织细胞之间的孔隙蔓延,填充到竹材的维管束中。变色菌在细胞内生长,甚至于产孢, 同时分泌色素, 使竹材内部变色。
5) 密粘褶菌降解竹材的过程为:菌丝在竹材组织内部扩展,菌丝分枝越来越多,在穿过胞壁的菌丝周围逐渐出现孔洞,孔洞随之越来越大,相邻的孔洞也逐渐连接成片,最终导致组织的破损和崩解。竹材组织受褐腐菌侵染发生降解的顺序是:首先发生降解的是木质部导管细胞壁,然后是基本薄壁组织细胞壁,最后是纤维。
| [] | 马星霞, 蒋明亮, 李志强. 2011. 木材生物降解与保护. 北京, 中国林业出版社. |
| [] | 马星霞, 蒋明亮, 覃道春, 等. 2009a. 我国竹材变色菌和霉菌的分离与鉴定. 竹子研究汇刊, 28(4): 35–39. |
| [] | 马星霞, 蒋明亮, 吕文华, 等. 2009b. 竹材主要变色菌霉菌的生长特性研究. 林业科学研究, 22(6): 819–823. |
| [] | Baum S, Schwarze F W M R. 2002. Large-leaved lime (Tilia platyphyllos) has a low ability to compartmentalize decay fungi via reaction zone formation. New Phytologist, 154(2): 481–490. DOI:10.1046/j.1469-8137.2002.00390.x |
| [] | Behbood M, Holger M. 2010. Microbial attack of acetylated wood in field soil trials. International Biodeterioration & Biodegradation, 64(1): 41–50. |
| [] | Cartwright K S G. 1930. A decay of Sitka Spruce timber, caused by Trametes serialis Pr. A cultural study of the fungus. Forest Products Research Bulletin No.4, London. |
| [] | Cartwright K S T G, Findlay W P K. 1929. A satisfactory method of staining fungal mycelium in wood sections. Annals of Botany, 43(2): 412–413. |
| [] | Eriksson K E L, Blanchette R A, Ander P. 1990. Microbial and enzymatic degradation of wood and wood components. Springer, Berlin, New York. |
| [] | Jiang Z H. 2007. Bamboo and rattan in the world. China Forestry Publishing House, Beijing. |
| [] | Kleist G, Schmitt U. 2001. Characterisation of a softrot-like decay pattern caused by Coniophora puteana (Schum.) Karst. in Sapelli wood (Entandrophragma cylindricum Sprague). Holzforschung, 55(6): 573–578. |
| [] | Kleist G, Ray M, Murphy R. 2002. Micromorphology of decay in keruing heartwood by the basidiomycetes Phellinus contiguous and Dacromyces stillatus. IRG/WP 02-10454. International Research Group on Wood Preservatives, Cardiff, Wales, UK. |
| [] | Liese W. 1970. Ultrastructural aspects of woody tissues disintegration. Annual Review of Phyopatholgy, 8: 231–258. DOI:10.1146/annurev.py.08.090170.001311 |
| [] | Nutman F J. 1929. Studies of wood-destroying fungi. I. Polyporus hisidus (Fries). Annals of Applied Biology, 16(1): 40–64. |
| [] | Savory J G. 1954. Breakdown of timber by ascomycetes and fungi imperfecti. Annals of Applied Biology, 41(2): 336–347. DOI:10.1111/aab.1954.41.issue-2 |
| [] | Schmidt O. 2006. Wood and tree fungi: biology, damage, protection, and use.Springer-Verlag Berlin Heidelberg. |
| [] | Schwarze F W M R. 2007. Wood decay under the microscope. Fungal Biology Reviews, 21(4): 133–170. DOI:10.1016/j.fbr.2007.09.001 |
| [] | Schwarze F W M R, Baum S. 2000c. Mechanisms of reaction zone penetration by decay fungi in beech wood. New Phytologist, 146(1): 129–140. DOI:10.1046/j.1469-8137.2000.00624.x |
| [] | Schwarze F W M R, Baum S, Fink S. 2000a. Dual modes of degradation by Fistulina hepatica in xylem cell walls of Quercus robur. Mycological Research, 104(7): 846–852. DOI:10.1017/S0953756299002063 |
| [] | Schwarze F W M R, Baum S, Fink S. 2000b. Resistance of fibre regions in wood of Acer pseudoplatanus degraded by Armillaria mellea. Mycological Research, 104(9): 1126–1132. DOI:10.1017/S0953756200002525 |
| [] | Schwarze F W M R, Mattheck C, Engels J. 2004. Fungal strategies of wood decay in trees. Springer, Heidelberg. |
| [] | Schwarze F W M R, Spycher M. 2005. Resistance of thermo-hygro mechanically densified wood to colonization and degradation by brown rot fungi. Holzforschung, 59(3): 358–363. |
| [] | Worrall J J, Anagnost S E, Zabel R A. 1997. Comparison of wood decay among diverse lignicolous fungi. Mycologia, 89(2): 199–219. DOI:10.2307/3761073 |
| [] | Ye Z H. 2002. Analysis on the character and industrial utilization of bamboo timber. Forestry Science and Technology, 27(3): 39–42. |
| [] | Zabel R A, Morrell J J. 1992. Wood microbiology decay and its prevention. Academic Press, San Diego. |
| [] | Zabel R, Lombard F F, Wang C J K, et al. 1985. Fungi associated with decay in treated southern-pine utility poles in the eastern United States. Wood and Fiber Science, 17(1): 75–91. |
 2012, Vol. 48
2012, Vol. 48



