文章信息
- 李楠, 柳新红, 李因刚, 李海波, 盛炜彤, 惠刚盈, 郑勇奇
- Li Nan, Liu Xinhong, Li Yingang, Li Haibo, Sheng Weitong, Hui Gangying, Zheng Yongqi
- 白花树天然群体的遗传多样性
- Genetic Diversity in Natural Populations of Styrax tonkinensis
- 林业科学, 2012, 48(11): 49-56.
- Scientia Silvae Sinicae, 2012, 48(11): 49-56.
-
文章历史
- 收稿日期:2012-02-21
- 修回日期:2012-06-10
-
作者相关文章
2. 浙江省林业科学研究院 杭州 310023
2. Zhejiang Academy of Forestry Hangzhou 310023
白花树(Styrax tonkinensis)又名越南安息香,属安息香科(Styracaceae)安息香属(Styrax)落叶乔木,阳性树种。天然分布于我国华南、西南并延伸至越南和老挝,跨越了北热带、南亚热带和中亚热带地区(黄淑美,1994; 黄椰林,2004; 中国科学院中国植物志编辑委员会,1987)。白花树为二倍体,2n= 2x=16(徐炳声等,1994),花两性(Orwa et al., 2009),以虫媒传粉为主。结实率较高,种子散布通常借助于鸟类或小的哺乳动物(中国科学院中国植物志编辑委员会,1987;Orwa et al., 2009)。白花树生长迅速,成材期短,是亚热带超短轮伐期纸浆材的较理想树种(骆昱春等,2007);种子油以不饱和脂肪酸为主,总含量达85.4%(肖复明等,2005),既可食用,也可用作工业原料,是优良的材、油兼用生物质能源树种(江香梅等,2006);其树形优美,花白色成串,清香,盛开时繁花似雪,极具观赏价值,适用于园林绿化;其树脂称“安息香”(国家药典委员会,2005),具有重要的药用价值。
白花树作为集材用、观赏、药用和油用等多种价值于一身的树种,逐渐引起研究者的关注,特别是近几年国内外研究不断增多。研究集中在育苗技术、引种驯化、表型研究、生理生态、化学成分和药理作用以及木材的开发利用等方面(范兰礼,2001;谢建秋等,2006;柳新红等,2011a;赵勋等,2011;Wang et al., 2006;Phuong et al., 2007),在分子生物学方面研究较少,只有柳新红等(2011b)对该种建立和优化SRAP扩增反应技术体系的研究。而有关其种质资源的收集、保存与评价尚未见报道,制约了对该树种遗传改良的研究、保育策略的制定及其合理的开发利用。
遗传多样性是生物多样性的基础(Nei, 1973),遗传多样性研究可以为物种起源、品种分类、亲本选配、品种保护等的研究提供依据,是保护和利用种质资源的重要基础。现代DNA分子标记的发展,极大地促进了遗传多样性研究。SRAP(Sequence Related Amplified Polymorphism,相关序列扩增多态性)标记是由Li和Quiros于2001年开发出的一种基于PCR的新型分子标记技术(Li et al., 2001)。该标记克服了RAPD(Random Amplified Polymorphic DNA)重复性差、SSR(Simple Sequence Repeat)位点较少、AFLP(Amplified Fragment Length Polymorphism)成本高的缺点(罗燕等,2010),是简单又经济、有效且可靠的分子标记系统,广泛用于多种植物的遗传多样性、指纹图谱构建和基因定位、纯度鉴定、比较基因组学等研究领域(Jing et al., 2011; Mohammad et al., 2009; Li et al., 2001; Wang et al., 2010; 李亚利等,2010; Li et al., 2003)。本研究应用SRAP分子标记技术对20个白花树天然群体进行分析,旨在揭示其遗传多样性水平和遗传结构现状,以期为合理保护与科学利用白花树种质资源提供理论依据。
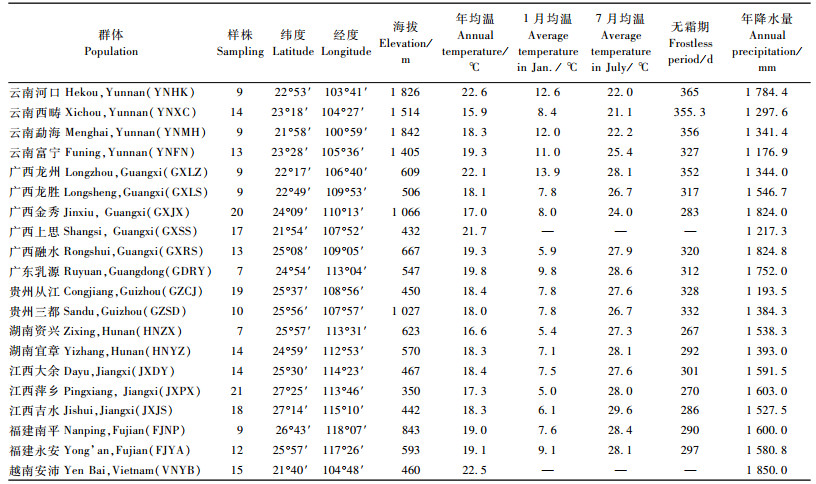
1 材料与方法 1.1 试验材料根据白花树的地理分布范围,在我国云南、广西、广东、贵州、湖南、江西、福建7个省以及越南安沛省采集了20个天然群体,269个个体。样木间距在50 m以上,采集其新发叶片,用硅胶干燥封存后带回实验室,-70 ℃下保存备用。各取样群体的地理位置、气候因子和样本数量详见表 1。
|
|
采用改良的CTAB法(Doyle et al., 1987)提取白花树叶片的DNA,应用Magabio核酸纯化试剂盒(Bioer,杭州)进行纯化。纯化后的DNA样品分别用1.5%的琼脂糖凝胶电泳和DNA/RNA紫外分光光度计(Gene Quant Pro,GE Healthcare)进行定性和定量检测。
1.2.2 PCR扩增与引物筛选经优化试验得出反应体系(20 μL)为:10×PCR Buffer 2 μL,24 ng模板DNA,1.5 U Taq DNA聚合酶,1.0 mmol·L-1 MgCl2 0.8 μL,10 mmol·L-1 dNTPs 2 μL,正向、反向引物均为1.5 μL(0.75 μmol·L-1),ddH2O 8.9 μL。扩增程序为:94 ℃预变性5 min;94 ℃变性1 min,35 ℃退火1 min,72 ℃延伸1 min,5个循环;94 ℃变性1 min,52 ℃退火1 min,72 ℃延伸1 min,35个循环;最后72 ℃延伸10 min,4 ℃保存。
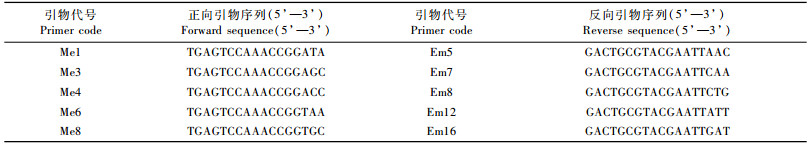
从20份群体中随机各挑选1个DNA样品进行引物初筛,在30个SRAP引物组合中筛选出8个引物对,用于所有群体DNA样本的PCR扩增(表 2)。1.2.3数据统计与分析对PCR扩增产物的电泳图谱进行位点判读,在相同迁移位置上以有带记为“1”,无带记为“0”,形成原始数据阵。计算各群体的多态条带百分率(PPB,percentage of polymorphic bands)和Shannon表型多样性指数(Ho,Shannon’s phenotypic diversity index),后者的计算公式为Ho=-ΣPilnPi,其中Pi为群体中第i个条带出现的频率(Shannon et al., 1949);并计算群体(Hpop)和物种(Hsp)水平的多样性,群体内多样性组分Hpop/Hsp和群体间多样性组分(Hsp-Hpop)/Hsp。采用WINAMOVA 1.55软件(Excoffier et al., 1992),度量群体间和群体内的遗传变异组分和遗传分化系数(ΦST),并计算群体间遗传距离。应用NTSYS-pc 2.10 (Rohlf, 2000)软件的Mantel统计学检验对群体间的地理距离和遗传距离进行相关性分析, 并做显著性检测,按SHAN程序和UPGMA方法进行聚类分析。
|
|
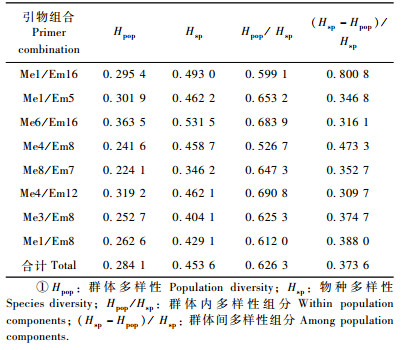
应用8个引物组合对20个白花树群体269个样品进行SRAP-PCR分析,共得到88个条带,其多态条带81个(表 3)。各引物组合扩增条带数为9~13,多态条带数为7~11,平均每对引物11个。统计结果(表 4)显示:白花树在物种水平上的多态条带百分率(PPB)为91.0%,Shannon表型多样性指数(Ho)为0.453 6。在群体水平上,PPB为31.82%~65.91%,其均值为49.49%;Shannon表型多样性指数(Ho)的变化范围为0.172 2~ 0.396 0,其均值为0.284 1。由表 4可看出,多态条带百分率(PPB)和Shannon表型多样性指数(Ho)由大到小排列具有相同的趋势,其中云南富宁(YNFN)群体(PPB=65.91%,Ho=0.396)的遗传多样性最大,广东乳源(GDRY)群体(PPB =31.82%,Ho=0.172 2)的遗传多样性最低。
|
|
|
|
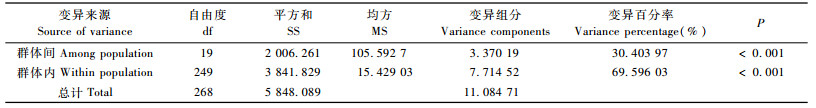
用Shannon表型多样性指数对白花树不同群体遗传变异的分析结果(表 5)表明,有37.36%的遗传变异存在于群体间。AMOVA分析结果(表 6)显示:白花树天然群体间和群体内都存在显著的遗传变异(P < 0.001),遗传分化系数(ΦST)为0.304 0;其中群体间遗传变异占总变异的30.40%,群体内变异占69.60%。Buso等(1998)指出分化指数介于0~0.05之间说明群体间分化很弱,0.05~0.15之间表示中等分化,0.15~0.25之间表示分化大,大于0.25表明分化极大。2种方法均表明白花树群体内的遗传变异是总变异的主要来源,群体之间有明显的遗传分化。
|
|
|
|
应用WINAMOVA1.55软件计算的群体间遗传距离(Ci et al., 2008)见表 7。由表 7可以看出,白花树天然群体的遗传距离在0.049 8~0.273之间变化,平均值为0.144 6。以湖南宜章(HNYZ)和江西大余(JXDY)群体的遗传距离最小(0.049 8),云南富宁(YNFN)和福建南平(FJNP)群体间的遗传距离最大(0.273),遗传分化程度高。对白花树20个天然群体的遗传距离进行UPGMA聚类分析的结果见图 1,结果显示,白花树群体聚为2大类群。第1类群中云南的所有群体和广西的2个群体聚在一起;第2类群中湖南宜章(HNYZ)和江西大余(JXDY)2个群体的遗传距离最近,首先聚到一起,再与广西、广东、福建和贵州所有群体以及江西的3个群体聚到一起,最后与遗传距离相对较远的越南安沛(VNYB)群体聚类。为研究地理距离对白花树遗传结构的影响,对群体间的遗传距离和地理距离进行Mantel检验,结果表明,群体间遗传距离与地理距离之间存在显著的相关性,相关系数r=0.448 14(P < 0.001)。
|
|

|
图 1 白花树20个天然群体的UPGMA聚类 Fig.1 Dendrogram resulting from UPGMA analysis of twenty natural populations of S. tonkinensis |
本文采用SRAP分子标记对白花树20个天然群体的遗传多样性和遗传结构进行了研究,结果表明,其多态条带百分率(PPB)高达91.0%,各群体在31.82%~65.91%之间;Shannon表型多样性指数(Ho)为0.453 6,各群体变化范围为0.172 2~0.396 0,其大小顺序与多态条带百分率(PPB)一致,这2种方法均显示白花树有着较高的遗传多样性。目前,关于安息香属植物遗传变异的研究未见报道,本研究结果与安息香科秤锤树属(Sinojackia)植物长果安息香(Sinojackia dolichocarpa)(PPB:72.99%)(Cao et al., 2006)和秤锤树属其他植物(姚小洪,2006)相比,白花树维持了较高的遗传多样性,并明显高于或接近其他木本植物基于SRAP分子标记的遗传多样性(左丹丹等,2009;刘志远等,2009;李梅等,2009)。白花树较高的遗传多样性水平反映了该物种的生物学特性和群体的历史。植物的分布和遗传多样性受更新世冰期的影响很大,在中国存在许多东西走向的大山,减缓了冰期低温对生物的影响(Shen et al., 2002)。我国的滇西高山峡谷地区、粤桂湘赣南岭山地和湘川鄂边境地区受第四纪冰川的影响不大,是许多生物重要的避难所(王献溥等,1994)。安息香科植物在始新世时广泛分布于东亚、北美和欧洲,经历更新世冰期后,分布于东亚的安息香科植物的大部分种得以幸存(Frtisch et al., 2001)。陈涛等(1996)认为南岭山地及其附近地区是安息香科植物的现代分布中心和保存中心。白花树集中分布在我国的华南、西南以及越南的北部,其种内较高的遗传多样性说明更新世冰期并没有对白花树的分布产生很大影响。其次,白花树以虫媒授粉为主,种子的散布靠自身重力和鸟兽取食,为基因重组提供了机会。此外,白花树群体表现出高的遗传多样性与其多样化的生境有关。白花树分布范围广,垂直分布在海拔100~2 000 m,可长于疏林中或林缘,亦生长于山坡或山谷(中国科学院中国植物志编辑委员会,1987),长期适应多样化的坏境,有利于其遗传变异的积累和保持。
3.2 白花树群体遗传分化根据Shannon指数和AMOVA分析群体的遗传分化,白花树群体间遗传分化明显,且遗传变异主要存在于群体内,2个指标的计算结果较接近,分别显示有37.36%和30.40%的遗传变异存在于群体间。Hamrick等(1992)总结了322种木本植物的遗传结构认为,广布、异交且种子随风传播或鸟兽取食的木本植物,其群体内的遗传多样性比群体间更丰富。植物类群的分类地位、分布范围、生活史特征、繁育系统、种子扩散机制、分布地区和演替阶段对群体遗传分化程度都有显著的影响,而其中繁育系统、分布范围和生活史特征对群体遗传结构影响最大(Hamrick et al., 1990)。白花树遗传结构的形成可能有以下几方面的原因:1)白花树主要靠飞行能力较弱的昆虫传粉,而群体间的地理距离普遍较大,最短的也有91.11 km,阻碍了群体间的基因交流。另外,白花树种子虽可借助自身重力和鸟兽取食来传播,但由于地理的阻隔,后代向外扩散的能力也相当有限。由弱飞行能力的动物授粉和靠种子迁移的植物群体之间的遗传分化显著(Avise,1994)。经Mantel检验表明20个白花树天然群体的地理距离和遗传距离间存在显著正相关,也说明地理隔离对群体分化产生了一定的影响。2)在野外调查中发现,由于人类活动干扰、原有植被的破坏以及不合理的开发利用,白花树的分布多呈零星状态,较大的种群偶见于交通偏僻不可及处,因此生境的片断化和适宜生存坏境的不断萎缩和退化,也是导致白花树群体间产生较大遗传分化的一个重要原因。3)植物生活史中任一阶段,特别是种子形成、传播、萌发、幼苗形成等阶段若不能正常进行,将直接影响到群体的补充和生存(王建波等,1998)。白花树群体的天然更新除萌蘖繁殖外,实生繁殖是其主要繁殖方式(江香梅等,2006)。白花树的种子存在休眠现象,需经沙藏处理才能正常地发芽,在自然环境中,其种子生活力和萌发率都很低。加之白花树为阳性树种,在自然群落中幼苗竞争能力弱,影响了白花树天然更新,有效的基因交流受到限制,也可能成为其群体间遗传分化较大的因素。
3.3 白花树遗传资源的保护本研究中揭示的白花树遗传多样性和遗传结构为其种质资源的有效保护和育种策略的制定提供了有价值的信息。本研究结果表明,白花树的遗传多样性水平较高,群体间形成了一定程度的遗传分化。在野外调查中发现,有些分布区已鲜有该树种存在。根据文献记载,在广西浦北、乐昌、湖南祁阳、贵州贞丰等地,应有白花树分布,但4年来的实地调查均未发现。原有成片分布的湖南资兴和广西龙胜等地,除仅剩少量幼小林木外,几乎被砍伐殆尽。广西金秀、上思等地只在较高海拔的山坡上剩余少量天然林分。因此针对现有群体遗传结构和现状,提出以下几点保护策略:1)越南安沛和福建永安群体的资源相对丰富,遗传多样性也较高,对它们应就地保护;江西吉水和萍乡群体资源虽丰富而遗传基础较弱,可以考虑设立保护点同时作为迁地保护基地,适当引进湖南、福建等群体的个体或后代以增加其遗传多样性。2)湖南资兴、广东乳源和广西龙胜群体的资源较少遗传多样性不高,且破坏较严重,因此对这3个群体应实施迁地保护。同时,对这3个地区的生境采取必要的保护,进行人工采种和育苗工作促进野生群体的恢复和遗传多样性的增加。3)其余群体的遗传多样性较高,但野生资源已所剩无几并且更新能力较差,建议在这些地区建立自然保护区、保护小区或保护点,加强其原生境的保护,减少人为干扰和破坏。4)通过人工授粉、人工播种、人工移植等方法,扩大和更新现有群体,创造群体之间的基因交流和重组条件,提高白花树的遗传多样性。
尽管白花树仍然维持了一个相对较高的遗传变异水平,但也不可忽视白花树群体的现状,生境片段化、栖息地破坏以及环境压力使其群体数量受到严重限制或者变小,有可能在未来群体中出现遗传多样性下降的现象,因此在采取相应保护措施的同时,要密切观察白花树未来的群体状况。此外,应研究白花树天然群体的繁育系统和生殖特性,以便为白花树制定完整有效的种质资源保护和育种策略。
| [] | 陈涛, 陈忠毅. 1996. 安息香科植物地理分布研究. 植物研究, 35(1): 97–99. |
| [] | 范兰礼. 2001. 东京野茉莉育苗和造林试验. 江西林业科技(4): 3–4, 8. |
| [] | 国家药典委员会. 2005. 中华人民共和国药典(Ⅰ部). 北京: 化学工业出版社, 101. |
| [] | 黄淑美. 1994. 安息香科的系统位置及地理分布. 热带亚热带植物学报, 2(4): 15–30. |
| [] | 黄椰林. 2004. 不同地理与生态分布植物类群的系统发育. 中山大学博士学位论文. |
| [] | 江香梅, 肖复明, 刘志开, 等. 2006. 优良生物质能源树种东京野茉莉及其培育技术. 生物质化学工程, 40(1): 341–344. |
| [] | 李梅, 侯喜林, 郝日明. 2009. 基于SRAP分子标记的桂花品种亲缘关系研究. 园艺学报, 36(11): 1667–1675. DOI:10.3321/j.issn:0513-353X.2009.11.015 |
| [] | 李亚利, 扈新民, 赵丹, 等. 2010. 运用SRAP分子标记鉴定辣椒杂交种纯度. 中国农学通报, 26(24): 67–70. |
| [] | 刘志远, 范卫红, 沈世华. 2009. 构树SRAP分子标记. 林业科学, 45(12): 54–58. DOI:10.11707/j.1001-7488.20091209 |
| [] | 柳新红, 李因刚, 赵勋, 等. 2011a. 白花树天然群体表型多样性研究. 林业科学研究, 24(6): 694–700. |
| [] | 柳新红, 李楠, 李因刚, 等. 2011b. 白花树SRAP-PCR反应体系的建立与优化. 浙江林业科技, 31(6): 30–34. |
| [] | 罗燕, 白史且, 彭燕, 等. 2010. 菊苣种质资源遗传多样性的SRAP研究. 草业科学, 19(5): 139–147. |
| [] | 骆昱春, 杨桦, 曾志光, 等. 2007. 东京野茉莉木材性质分析与利用. 江西农业大学学报, 29(1): 77–80. |
| [] | 王建波, 陈家宽, 利容千, 等. 1998. 长喙毛茛泽泻的生活史特征及濒危机制. 生物多样性, 6(3): 167–171. |
| [] | 王献溥, 刘玉凯. 1994. 生物多样性的理论与实践. 北京, 中国环境科学出版社: 55-80. |
| [] | 肖复明, 曾志光, 杨桦, 等. 2005. 东京野茉莉种子油营养成分研究. 天然产物研究与开发, 17(3): 344–345, 348. |
| [] | 谢建秋, 柳新红, 王军峰, 等. 2006. 东京野茉莉引种试验初报. 浙江林业科技, 26(4): 33–35. |
| [] | 徐炳声, 翁若芬, 栗田子郎. 1994. 东亚植物区系中若干双子叶植物的染色体新计数及其系统学和进化意义. 植物分类学报, 32(5): 411–418. |
| [] | 姚小洪. 2006. 秤锤树属与长果安息香属植物的保育遗传学研究. 中国科学院博士学位论文. |
| [] | 赵勋, 李因刚, 柳新红, 等. 2011. 白花树不同种源苗期光响应特性研究. 浙江林业科技, 31(1): 1–6. |
| [] | 中国科学院中国植物志编辑委员会. 1987. 中国植物志·第六十卷(第二分册). 北京, 科学出版社: 84-86. |
| [] | 左丹丹, 赵海涛, 刘春, 等. 2009. 蜡梅天然群体遗传多样性的SRAP标记分析. 园艺学报, 36(8): 1197–1202. |
| [] | Avise J C.1994.Molecular Markers, Natural History, and Evolution.New York: Chapman and Hal1. |
| [] | Buso G S C, Rangel P H, Ferreira A M E. 1998. Analysis of genetic variability of South American wild rice populations (Oryza glumaepatula) with isozymes and RAPD markers. Molecular Ecology, 7(1): 107–117. DOI:10.1046/j.1365-294x.1998.00321.x |
| [] | Cao Peijian, Yao Qinfang, Ding Bingyang, et al. 2006. Genetic diversity of Sinojackia dolichocarpa (Styracaceae), a species endangered and endemic to China, detected by inter-simple sequence repeat (ISSR). Biochemical Systematics and Ecology, 34(3): 231–239. DOI:10.1016/j.bse.2005.11.001 |
| [] | Ci Xiuqin, Chen Junqiu, Li Qiaoming, et al. 2008. AFLP and ISSR analysis reveals high genetic variation and inter-population differentiation in fragmented populations of the endangered Litsea szemaois(Lauraceae)from Southwest China. Plant Syst Evol, 273(3/4): 237–246. |
| [] | Doyle J J, Doyle J L. 1987. A rapid DNA isolation procedure for small quantities of fresh leaf Material. Phytochem Bull, 19(1): 11–15. |
| [] | Excoffier L, Smouse P E, Quattro J M. 1992. Analysis of molecular variance inferred from metric distances among DNA haplotypes: application to human mitochondrial DNA restriction data. Genetics, 131(2): 479–491. |
| [] | Frtisch P W, Morton C M, Chne T, et al. 2001. Phylogeny and biogeography of the Styracaceae. Internal Journal of Plant Sciences, 162(Suppl.): S95–S116. |
| [] | Hamrick J L, Godt M J W, Sherman-Broyes S L. 1992. Factors influencing levels of genetic diversity in woody plant species. New Forests, 6(1-4): 95–124. DOI:10.1007/BF00120641 |
| [] | Hamrick J L, Godt M J W.1990.Allozyme diversity in plant species//Brown A H D, Clegg M T, Kahler A L, et al.Plant Population Genetics, Breeding, and Genetic Resources. Sunderland, MA: Sinauer, 43-63. |
| [] | Jing Zange, Tang Zheng, Zhang Xiaoling, et al. 2011. Mature and origin as a marker of genetic diversity in early-mid broccoli (Brassica oleracea var. italica) based on SRAP analysis. African Journal of Agricultural Research, 6(2): 297–299. |
| [] | Li G, Gao M, Yang B, et al. 2003. Gene for gene alignment between the Brassica and Arabidopsis genomes by direct transcriptome mapping. Theoretical and Applied Genetics, 107(1): 168–180. DOI:10.1007/s00122-003-1236-x |
| [] | Li G, Quiros C F. 2001. Sequence-related amplified polymorphism(SRAP), a new marker system based on a simple PCR reaction: Its application to mapping and gene tagging in Brassica. Theoretical and Applied Genetics, 103(2/3): 455–461. |
| [] | Mohammad Z, Rauf G. 2009. Diversity and relationships among Durum Wheat Landraces (Subconvars) by SRAP and phenotypic marker polymorphism. Research Journal of Biological Sciences, 4(8): 960–966. |
| [] | Nei M. 1973. Analysis of gene diversity in subdivided population. Proceedings of National Academic Science, 70(12): 3321–3323. DOI:10.1073/pnas.70.12.3321 |
| [] | Orwa C, Mutua A, Kindt R, et al. 2009. Agroforestree Database: a tree reference and selection guide version 4.0. http://www.worldagroforestry.org/af/treedb/. |
| [] | Phuong L X, Shida S, Saito Y. 2007. Effects of heat treatment on brittleness of Styrax tonkinensis wood. Wood Science, 53(3): 181–186. DOI:10.1007/s10086-006-0841-0 |
| [] | Rohlf F J.2000. NTSYS-pc: Numerical Taxonomy and Multivariate Analysis System, Version 2.1. Exeter Software, Setauket, New York. |
| [] | Shannon C E, Weaver W.1949.The mathematical theory of communication. University of Illinois Press, Urbana. |
| [] | Shen L, Chen X Y, Li Y Y. 2002. Glacial refugia and postglacial recolonization patterns of organisms. Acta Ecologica Sinica, 22: 1983–1990. |
| [] | Wang Feng, Hua Huiming, Pei Yuehu, et al. 2006. Triterpenoids from the resin of Styrax tonkinensis and their antiproliferative and differentiation effects in human leukemia HL-60 cells. Journal of Natural Products, 69(5): 807–810. DOI:10.1021/np050371z |
| [] | Wang Y X, Sun X Y, Tan B Y, et al. 2010. A genetic linkage map of Populus adenopoda Maxim.× P. alba L. hybrid based on SSR and SRAP markers. Euphytica, 173(2): 193–205. DOI:10.1007/s10681-009-0085-3 |
 2012, Vol. 48
2012, Vol. 48