文章信息
- 蒋瑶, 戚晓利, 唐芳, 赵树堂, 陈军, 卢孟柱
- Jiang Yao, Qi Xiaoli, Tang Fang, Zhao Shutang, Chen Jun, Lu Mengzhu
- 利用基因芯片筛选影响茎分化的相关基因
- Application of Genechip in Screening the Stem Differentiation-Related Genes
- 林业科学, 2012, 48(11): 42-48.
- Scientia Silvae Sinicae, 2012, 48(11): 42-48.
-
文章历史
- 收稿日期:2012-08-24
- 修回日期:2012-09-21
-
作者相关文章
2. 佳木斯大学生命科学学院 佳木斯 154007
2. College of Life Sciences, Jiamusi University Jiamusi 154007
植物个体的发育在形成种子时,新一代的植株就已经完成了形态学上的初步分化。种子在适宜的条件下经过一系列的生长发育,成为具有根、茎、叶的幼苗(Doerner, 1999; Sussex, 1989)。这一过程涉及到复杂的细胞分裂、组织分化和器官发生的生物学过程。原分生组织衍生出维管植物根和茎的顶端分生组织形成了顶端生长点。茎尖顶端分生组织(SAM,shoot apical meristem)通过未分化干细胞的增殖和分化之间的平衡不断地产生地上器官,是植物生长发育最基本的活动之一。对SAM的研究已成为发育生物学的研究热点(Yadav et al., 2010),该领域研究不仅解释了对SAM的分子调控机制,也为叶、花及茎的器官发育机制奠定了基础(Finlayson et al., 2010)。顶端分生组织的形成与分化不仅受到复杂基因网络的调控,外界的各种环境刺激以及体内激素也能影响分生组织的分化(Gong et al., 2005)。
近年来基因芯片应用广泛,可实现自动、快速、平行地检测样品中上万基因的表达情况,并能检测基因间的互作,寻找新的功能基因。Seki等(2001)利用拟南芥(Arabidopsis thaliana)基因芯片鉴定到19个低温诱导基因和99个失水诱导基因,其中8个低温诱导基因和33个失水诱导基因是以前没有报道过的;12个压力诱导基因被鉴定是DREB1A的靶基因,其中6个是新基因。基因芯片还被运用于检测突变体,并以此来确定某些特殊性状。Vlachonasios等(2003)利用基因芯片研究了拟南芥的功能基因ada2b和gcn5,并分析了这2个基因的T-DNA突变体在生长发育中表现出的多重表型。除此之外,利用拟南芥来研究其他木本植物基因功能已成为一种常用的研究手段,Wang等(2009)用拟南芥全基因组基因芯片分析了毛白杨次生维管再生系统发育过程中不同时期的基因表达谱,并利用相应基因的拟南芥突变体进行功能研究,充分利用了拟南芥生长周期短、突变体资源丰富的优势。
本课题组在筛选木材形成相关基因的拟南芥突变体时得到了一个株系Abnormal Flower Development Line(AFDL),该植株的表型并不是由T-DNA插入的基因导致(Qi et al., 2011)。AFDL株系的花器官发育异常,并且少数个体带有融合茎表型,基因表达分析结果显示该株系中AP1的表达量下降了约96倍,与AP1相拮抗的TFL1基因表达量上升了4.6倍(未发表),因此花分生组织转变成花序分生组织,AFDL的融合茎可能是由顶端分生组织分化异常所导致的。但是AFDL中AP1并没有发生基因突变,而是在表达水平上受到调控(Qi et al., 2011),AFDL的突变表型是由AP1下降引起的。本研究以野生型拟南芥为对照,对AFDL进行了全基因表达谱分析,并从差异表达基因中挑选了2个候选基因进行研究,从而筛选出对分生组织的建立与分化有重要作用的新基因,为揭示顶端分生组织的机制以及探讨花发育与茎发育之间的关系提供了研究基础。
1 材料与方法 1.1 材料 1.1.1 试验材料野生型拟南芥及拟南芥花异常株系AFDL的种子来自于拟南芥突变体资源中心(The Nottingham Arabidopsis Stock Centre,NASC),两者均为Lers型拟南芥。基因芯片采用Affymetrix公司的拟南芥ATH1-121501全基因组芯片。Gateway中间载体pDONR222.1及Gateway表达载体pMD32、pH7G由中国林业科学研究院陈军副研究员提供。农杆菌(Agrobacterium tumefaciens)GV3101均由中国林业科学研究院林木遗传育种国家重点实验室保存。
1.1.2 试剂cDNA合成与纯化及cRNA合成与纯化试剂盒均购自Affymetrix公司;Prime STARTM HS DNA Polymerase、TaKaRa rTaq等DNA聚合酶及定量试剂的SYBR® Premix EX TaqTM Ⅱ购自TAKARA公司;RNeasy® plant Mini Kit试剂盒、RNase-free Dnase试剂盒、PCR产物回收试剂盒QIAquick Gel Extraction Kit、质粒小量提取试剂盒QIAprep Spin Miniprep Kit均购自Qiagen公司;反转录试剂盒SuperscriptIII First-strand Kit、Gateway® BP Clonase® Enzyme Mix及Gateway® LR Clonase® Enzyme Mix购自Invitrogen公司;限制性内切酶购自NEB公司;Kanamycin,Spectinomycin及Silwet-77购自Sigma公司,Hygromycin购自ROCHE公司。其他的常用化学试剂均为分析纯级。引物由上海英骏公司合成。
1.2 研究方法 1.2.1 拟南芥种植及取材将野生型拟南芥及AFDL的种子用75%酒精灭菌,播种在1/2MS培养基上,一半播种野生型,一半播种AFDL。4 ℃暗培养春化3天,移至(22±2) ℃,16 h光照/8 h暗培养,光照条件为110 μmol·m-2 s-1的培养箱中。待植物长至约10片真叶时,取用整株去根幼苗为材料,每组取材各100 mg,重复取材2组。
1.2.2 RNA提取、cDNA和cRNA的合成及纯化取用100 mg拟南芥幼苗为材料,迅速投入液氮中并研磨成粉末,RNA的提取按照总RNA提取试剂盒RNeasy® plant Mini Kit的操作说明书进行。按照Affymetrix One-cycle cDNA Synthesis Kit试剂盒说明合成第1链cDNA,并以此为模板合成第2链cDNA,利用Affymetrix GeneChip Sample Cleanup Module纯化cDNA,并以纯化后的cDNA为模板反转录cRNA,该步骤依照GeneChip IVT Labeling Kit试剂盒说明书进行操作,检测cRNA质量并进行片段化,变性胶检测cRNA片段化结果。
1.2.3 芯片的杂交、洗涤及扫描芯片的杂交、洗涤及扫描均按照Affymetrix的真核生物杂交流程进行,芯片杂交试验设2次重复。用Affymetrix Hybridization Oven 640及Affymetrix Fluidics Station 450进行芯片杂交,采用Affymetrix GeneChip Scanner 3000进行基因芯片扫描,获得信号值后根据内标噪点等进行均一化处理。芯片数据通过Affymetrix Microarray Suite Version 5.0进行处理,应用GCOS软件将芯片信号转变成数字信号,并对通过筛选条件的探针进行基因注释和功能分类,采用公共数据库所提供的分析软件(http://www.affymetrix.com/analysis/index.affx;http://david.abcc.ncifcrf.gov/summary.jsp)进行分析。
1.2.4 载体构建及植物侵染、检测从基因芯片结果中挑选出2个显著差异表达的基因,并构建相应的植物表达载体,在AFDL芯片分析结果中表达量上升的基因构建超表达载体,而表达量下降的基因则构建抑制表达载体。根据Tair网站发表的基因全序列,分别设计5’端带有attB序列的引物进行目的基因片段扩增。
按照Invitrogen公司Gateway BP Clonase Enzyme Mix试剂说明书进行BP反应:混匀目的片段PCR产物及入门载体pDONR222.1,室温酶反应过夜,转化并筛选阳性克隆,PCR检测后送至上海英骏公司测序。提取测序正确的阳性克隆质粒,用MLUI单酶切线性化后进行LR反应:混合BP线性化产物及表达载体pMDC32或pH7G,目的片段在TOPO酶的作用下插入到表达载体的attR序列间,转化并筛选阳性克隆,提取质粒进行PCR及质粒大小检测;将植物表达载体通过电击法导入农杆菌GV3101的感受态菌株中,抗生素筛选并用PCR检测阳性转化子。
按照Clough等(1998)发表的花浸法转化野生型拟南芥,将T1代转基因拟南芥种子用含有25 mg·mL-1潮霉素的1/2MS培养基进行抗性筛选,大约2周后将阳性植株移至土壤中,长至临近抽薹时提取莲座叶基因组DNA并对插入的目的基因进行PCR检测。
1.2.5 基因表达分析对野生型拟南芥及转基因植株进行基因表达分析,设计并合成目的基因及内参基因ACTIN2的定量引物。分别以野生型及转基因植株的莲座叶为材料,提取总RNA并转录成第1链cDNA,操作同1.2.2。按照SYBR® Premix EX TaqTM Ⅱ使用说明进行Real-time PCR,以稀释25倍的第1链cDNA为模板,采用60 ℃退火,重复40个循环的两步法,并用相同退火温度进行溶解曲线扩增。每种样品重复3次,每次做4~6个技术重复。
2 结果与分析 2.1 AFDL表型、总RNA及芯片杂交质量分析AFDL拟南芥与野生型相比较主要差异表现在花瓣缺失(图 1 C),有强烈的花序,整株的形态饱满紧凑(图 1B),并且有少数个体出现了多主茎同时从莲座叶中萌发或者多茎融合的表型(图 1C, D),这些植株往往能形成更多的分枝。

|
图 1 野生型拟南芥、AFDL整株形态及AFDL融合茎表型 Fig.1 The phenotype of the wild-type and AFDL, and the multi-stems of AFDL A.野生型拟南芥The wild-type of Arabidopsis thaliana;B. AFDL;C, D. AFDL中的融合茎表型The multi-stems of the AFDL. |
用Agilent 2100 Bioanalyzer检测野生型拟南芥及AFDL的总RNA质量(图 2A),结果表明总RNA质量合格,可用作下一步cRNA的制备。
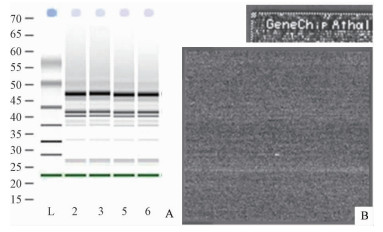
|
图 2 野生型及AFDL的总RNA质量检测、杂交芯片 Fig.2 The detection of the quality of RNA and the gene chip figure scanning for crossing signal L: Marker;A2, A3:花的总RNA Total RNA of flower;A5, A6:苗的总RNA Total RNA of seedling. |
本试验采用的ATH1-121501全基因组芯片中加入了内参基因:β-actin、GAPDH,杂交对照bioB、bioC、bioD和cre,Poly-A对照lys、phe、thr、dap以及B2 Oligo Performance。在芯片杂交后整张芯片的扫描图像呈现四周呈明暗交替的状态,并且左上角的芯片名称清晰可见(图 2B)。平均背景值的数值在20~150之间,内参基因β-actin及GAPDH探针组的3’/5’比值大于3,该指标说明RNA以及试验的质量达标。杂交后能检测到杂交对照和Poly-A对照的信号并且均呈递增趋势,说明芯片的杂交、洗涤以及扫描合格。样品表达P值、芯片的背景平均值以及噪点值均在适当的范围内,芯片数据可用于后续分析。
2.2 苗芯片差异表达基因分析整合重复样品的芯片数据,结果显示野生型拟南芥与AFDL的数据聚类具有明显差别(图 3A),在幼苗芯片中共得到了22 811个探针的表达信息,从芯片数据的散点分布图(图 3B)可得知:在野生型拟南芥和AFDL中大部分的基因表达水平相似,4对线分别代表变化倍数为2,3,10,30,对角线上下方的数据分别代表表达上升和表达下降的基因。

|
图 3 基因芯片数据整合及分析 Fig.3 The integration and analysis of the data acquired from genechip A.野生型及AFDL芯片数据聚类;B.AFDL芯片数据散点图;C.AFDL芯片数据变化倍数及数量;D.AFDL中变化倍数大于2且P < 0.01的数据图。 A. The cluster of the data between wild-type and AFDL; B. Scatter graph of AFDL; C. The fold change and amount of differently expressed genes; D. The distribution of the data with FC≥2 and P < 0.01 in AFDL. |
对苗芯片中显著差异表达的基因进行统计(图 3C,D),其中P < 0.05,变化倍数超过2倍的基因有197个,表达量上升的有97个,表达下降的有100个;P < 0.01,变化倍数超过2倍的基因有111个,其中上调的有67个,下降的有44个。差异表达基因的变化倍数主要集中在±2倍的范围内,该部分变化的基因数目在P < 0.05以及P < 0.01分别达到总数的78.17%和70.27%,基因表达变化范围在-6.768 36倍至8.035 32倍之间。
将AFDL幼苗芯片中表达差异极明显的基因(P < 0.01)进行GO分类,从参与的生物过程进行了分析(表 1)。在DAVID网站Functional Annotation在线分析软件中导入芯片数据中差异表达基因的AGI号(Huang et al., 2008; Sherman et al., 2009),输出结果中有一部分基因没有被分类(No hit),还有一些基因具有多个功能,在分类时参与了多项的统计。
|
|
表 1显示AFDL幼苗芯片分析结果中极显著差异表达基因主要参与了以下生物学过程:对于外界环境刺激的感应和应答,如氧气压力、温度、红光等光刺激应答;对日昼节律的感知和应答;对水分、盐及渗透压的应答以及对碳水化合物、无机物、有机物、金属离子的应答;对茉莉酸、脱落酸、乙烯和赤霉素等内源激素应答。此外还有部分基因参与了多糖、淀粉、碳水化合物以及葡聚糖的代谢过程,差异表达基因大部分参与了对外界及内源刺激感知和应答。
2.3 载体构建、转基因植株表型及基因表达分析在苗芯片结果中挑选了2个表达量变化超过2倍及在分生组织中表达的基因(表 2),并做了进一步的研究。
|
|
根据AFDL中基因表达的变化趋势,运用Gateway技术分别构建了基因超表达载体以及沉默表达载体(图 4A, B),通过花浸法转化野生型拟南芥,其中经PCR鉴定得到了18株超表达AT1G56300的转基因植株以及60株基因沉默AT1G65490的转基因植株。
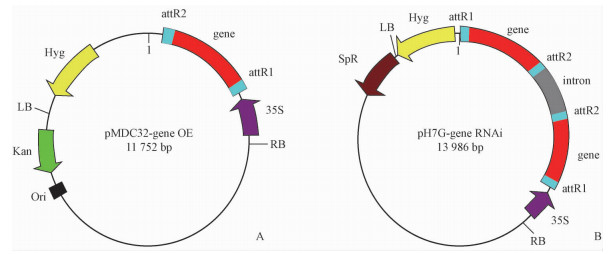
|
图 4 超表达载体(A)和RNAi沉默载体(B) Fig.4 The construction of over-expression (A) and RNAi vector (B) |
AT1G56300及AT1G65490转基因植株的花器官几乎与野生型拟南芥无异,但是分别有6株及11株表现出联体茎或丛生茎的表型,并且其真叶萌发与野生型拟南芥相比明显延后。从中挑出茎融合表型不同强弱的植株,其表型如图 5所示:强烈的融合茎从主茎下部就出现多条茎相互融合,并且还能再次分成二级融合茎,形成了一分为二、二分为四的指数分化模式(图 5B, G),这些融合的茎并没有表现出主次关系;表型稍弱的植株则在茎中部才能出现明显的融合茎,且不能形成更高级的融合茎(图 5A, F);表型最弱的植株则只在主茎靠近顶端处形成了不明显的融合茎(图 5 D),表型稍弱的植株则在主茎中部形成了较明显的融合茎(图 5E)。
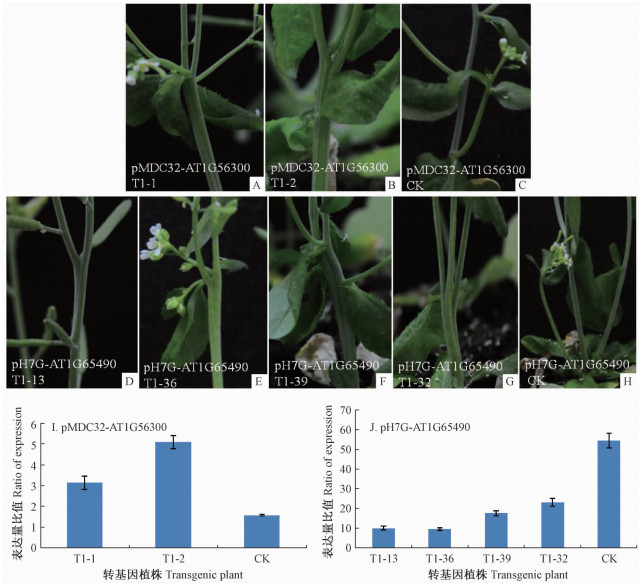
|
图 5 超表达及沉默表达的转基因植株表型及相应基因的定量分析 Fig.5 The phenotype of the transgenic plants harboring the pMDC32 or pH7G A-C. AT1G56300的超表达转基因植株;D-H. AT1G65490的抑制表达转基因植株;I. AT1G56300转基因植株的基因表达分析;J. AT1G65490转基因植株的基因表达分析。 A-C. The transplants of overexpression AT1G56300; D-H. The transplants of RNAi AT1G65490; I. The expression analysis of the AT1G56300 in overexpression plants; J. The expression analysis of the AT1G65490 in RNAi plants. |
选取不同强度的融合茎植株以及表型正常的转基因植株进行基因表达分析,其基因表达情况如图 5I,J所示,由图可知在AT1G56300超表达转基因株系中,表现出连体茎的植株中AT1G56300基因表达量比正常茎的要高2倍以上,并且连体程度越高的表达量越高;反之,在AT1G65490抑制表达转基因植株中,连体茎植株的AT1G65490基因表达量比正常茎的表达量低3~6倍,连体程度越高的植株基因表达量越低。由此可见,在拟南芥中超表达AT1G56300基因或抑制AT1G65490基因的表达都能引起融合茎的表型,且表型强弱程度与基因表达量相一致。
3 讨论及结论本课题前期在利用拟南芥突变体筛选木材形成相关基因的研究中得到了伴有多茎融合表型的花异常株系AFDL。本试验运用基因芯片对AFDL进行了全基因表达谱分析,芯片数据显示表达差异明显的基因主要参与感受外界刺激并作出应答的生物过程,这些刺激包括温度、光线、水分、盐分胁迫以及内源激素等,另外还有一些基因参与了多糖、淀粉、碳水化合物以及葡聚糖的代谢过程。推测AFDL突变表型的形成与多种外部环境及内源刺激有关,植物在抽薹前感应外界环境及内源刺激因子的刺激并产生响应信号,整合的生物信号进一步影响顶端分生组织的分化,最终形成特定的发育模式。整个过程受多条调控途径相互制衡,因此某个(些)途径的改变会导致异常植株表型。
在AFDL花序中AP1的表达量下降最显著,达到了约96倍(Qi et al., 2011),这是导致其产生多级花序的主要原因,在研究AP1与FUL以及CAL的相互作用时也出现了相似的表型(Ferrándiz et al., 2000)。AP1启动子元件预测结果表明,在其启动子内存在许多受到环境调控的作用元件。如水分胁迫的应答因子;应答光质、光周期等条件的调控元件;受到ABA、GA以及乙烯诱导的调控因子以及盐胁迫、金属离子胁迫、糖代谢诱导等应答因子都参与了AP1表达的调控。AFDL抽薹前的幼苗芯片结果显示AFDL中许多对环境刺激应答的基因表达水平都发生了改变,因此推测AFDL在幼苗期对外界刺激产生不同于野生型拟南芥的应激信号,而这些信号整合后抑制AP1的表达,最终形成了多分枝的表型。
从芯片中从挑选出2个差异表达基因,其中AT1G56300基因的超表达植株以及AT1G65490基因的抑制表达植株均出现了多茎融合或丛生的表型,连体茎表型强弱程度与基因表达水平相一致。其次,在转基因植株萌发真叶时也表现出明显延后,这说明了AT1G56300以及AT1G65490的异常表达可能通过影响茎尖分生组织的分化来改变茎的形态。有研究表明在胚胎发育时期形成的茎尖分生组织以及胚后发育过程形成的腋分生组织决定了茎的整体形态和结构(Dodsworth, 2009),在茎尖分生组织分化初期,细胞分化功能受到影响就会造成茎的分化紊乱(Finlayson et al., 2010),因此推测这2个基因在调节茎的分化上有重要的作用。
本研究利用基因芯片对抽薹前AFDL幼苗进行了基因表达分析,发现了一批显著变化基因均参与了应答外界刺激的生物过程,其中AT1G56300以及AT1G65490两个基因的转基因植株在真叶萌发以及茎发育上表现出异常,它们很可能通过破坏分生组织的分化来影响茎的发育和整株的形态。因此,从花异常株系中筛选与组织分化及茎发育相关的新基因,不仅为发掘花发育与茎发育之间的联系以及推动研究木本植物同源基因的表达模式和功能打下基础,也为树木形态建成的研究提供依据。
| [] | Clough S J, Bent A F. 1998. Floral dip: a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana. The Plant Journal, 16(6): 735–743. DOI:10.1046/j.1365-313x.1998.00343.x |
| [] | Dodsworth S. 2009. A diverse and intricate signalling network regulates stem cell fate in the shoot apical meristem. Developmental Biology, 336(1): 1–9. DOI:10.1016/j.ydbio.2009.09.031 |
| [] | Doerner P. 1999. Shoot meristems: Intercellular signals keep the balance. Current Biology, 9(10): R377–R380. DOI:10.1016/S0960-9822(99)80232-2 |
| [] | Ferrándiz C, Gu Q, Martienssen R, et al. 2000. Redundant regulation of meristem identity and plant architecture by FRUITFULL, APETALA1 and CAULIFLOWER. Development, 127: 725–734. |
| [] | Finlayson S A, Krishnareddy S R, Kebrom T H, et al. 2010. Phytochrome regulation of branching in Arabidopsis. Plant Physiology, 152(4): 1914–1927. DOI:10.1104/pp.109.148833 |
| [] | Gong Pengtao, Li Di. 2005. Genetic control of plant shoot branching. Molecular Plant Breeding, 3(2): 151–162. |
| [] | Huang D W, Sherman B T, Lempicki R A. 2008. Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources. Nature Protocols, 4: 44–57. DOI:10.1038/nprot.2008.211 |
| [] | Qi Xiaoli, Jiang Yao, Tang Fang, et al. 2011. An Arabidopsis thaliana (Ler) inbred line AFDL exhibiting abnormal flower development mainly caused by reduced AP1 expression. Chinese Science Bulletin, 56(1): 1–9. DOI:10.1007/s11434-010-9974-z |
| [] | Seki M, Narusaka M, Abe H, et al. 2001. Monitoring the expression pattern of 1300 Arabidopsis genes under drought and cold stresses by using a full-length cDNA microarray. The Plant Cell, 13(1): 61–72. DOI:10.1105/tpc.13.1.61 |
| [] | Sherman B T, Lempicki R A. 2009. Bioinformatics enrichment tools: paths toward the comprehensive functional analysis of large gene lists. Nucleic Acids Research, 37(1): 1–13. DOI:10.1093/nar/gkn923 |
| [] | Sussex I M. 1989. Developmental programming of the shoot meristem. Cell, 56(2): 225. DOI:10.1016/0092-8674(89)90895-7 |
| [] | Vlachonasios K E, Thomashow M F, Triezenberg S J. 2003. Disruption mutations of ADA2b and GCN5 transcriptional adaptor genes dramatically affect Arabidopsis growth, development, and gene expression. The Plant Cell, 15(3): 626–638. DOI:10.1105/tpc.007922 |
| [] | Wang Minjie, Qi Xiaoli, Zhao Shutang, et al. 2009. Dynamic changes in transcripts during regeneration of the secondary vascular system in Populus tomentosa Carr. revealed by cDNA microarrays. BMC Genomics, 10: 215. DOI:10.1186/1471-2164-10-215 |
| [] | Yadav R K, Tavakkoli M, Reddy G V, et al. 2010. WUSCHEL mediates stem cell homeostasis by regulating stem cell number and patterns of cell division and differentiation of stem cell progenitors. Development, 137(1): 3581–3589. |
 2012, Vol. 48
2012, Vol. 48



