文章信息
- 黄平, 崔鹏娇, 郑勇奇, 张川红, 于雪丹
- Huang Ping, Cui Pengjiao, Zheng Yongqi, Zhang Chuanhong, Yu Xuedan
- 基于SSR标记月季品种鉴定及遗传关系分析
- SSR-Based Molecular Identification and Analysis of Genetic Relationships among Rose Varieties
- 林业科学, 2012, 48(10): 55-62.
- Scientia Silvae Sinicae, 2012, 48(10): 55-62.
-
文章历史
- 收稿日期:2012-02-16
- 修回日期:2012-05-29
-
作者相关文章
2. 北京植物园 北京 100093
2. Beijing Botanical Garden Beijing 100093
月季是我国重要的木本观赏花卉之一,通常指蔷薇科(Rosaceae)蔷薇属(Rosa)一类植物总称,包括月季花、蔷薇、玫瑰等,大约含200个种,主要分布在北半球温带地区,中国分布95种(中国科学院昆明植物研究所,2006)。根据美国月季协会(American Rose Society)分类方法,月季分为野生种(Wild Species)、古老月季(Old Garden Rose)、现代月季(Modern Rose)三大类,其中古老月季和现代月季又可细分为不同的园艺品种群。现代月季是复杂的种间杂交产物,品种数量超过20 000,目前普遍认为现代月季栽培品种起源于蔷薇属少数几个野生种(Gudin,2000;陈俊愉,2001);野生种为二倍体(2x=14),现代月季品种多为四倍体(4x=28),少数为三倍体(3x=21),月季染色体数目的变异也给遗传学分析带来一定难度。
植物新品种保护(Plant Variety Protection)是对育种者在品种培育过程中所付出的劳动进行保护的一种模式。随着植物新品种保护工作的不断发展,大量月季品种获得植物新品种保护授权,截至2009年,我国月季授权品种数量为105个,占总量35%(国家林业局植物新品种保护办公室,2010)。目前,所有授权品种都是通过形态学性状或生理学特性进行描述,随着品种不断增加,品种间形态学性状差异越来越小,这将给植物新品种授权工作带来一定的难度,特别是形态学测试需要设置大量的参照品种进行对比,不仅加大测试工作量,还增加测试成本。因此,品种测试、品种鉴定等实际工作对新技术的需求也越来越强烈。随着分子生物技术不断发展,RFLP,RAPD,AFLP,SSR等分子标记技术广泛应用于遗传图谱构建(Debener et al., 1999;Yan et al., 2005;Zhang et al., 2006)、系统发生分析、群体遗传分析等方面。分子标记被认为可作为品种鉴定和测试的一种有效补充方法(Zheng et al., 2007; 王琼等,2008)。与其他标记相比,简单序列重复(Simple Sequences Repeats,SSR)具有稳定性高、可重复性强、多态性好等优点,并且其实验操作简单,扩增产物易判读和赋值,特别是数据分析自动化和标准化的特点完全可以满足品种DNA数据库的建立的基本要求。目前,SSR标记已经成功应用于葡萄(Vitis vinifera)、番茄(Lycopersicon esculentum)、小麦(Triticum aestivum)、杨树(Populus)、切花月季(Rosa hybrida)等植物品种鉴定(This et al., 2004;Vosman et al., 2001;冯锦霞等,2011;Esselink et al., 2003)以及部分切花月季DNA数据库构建(Smulders et al., 2009)。
本研究利用M13-TP-SSR技术(M13-Tail-primer SSR)对部分月季品种进行品种鉴定分析以及遗传关系研究,旨在探索该技术在月季品种鉴定以及DNA指纹数据库构建中的可行性,为分子标记在植物新品种鉴定中的应用以及我国月季DNA指纹数据库构建奠定基础,为我国植物新品种授权、信息管理以及客观、公正、准确地处理品种权侵权案例提供技术支持。
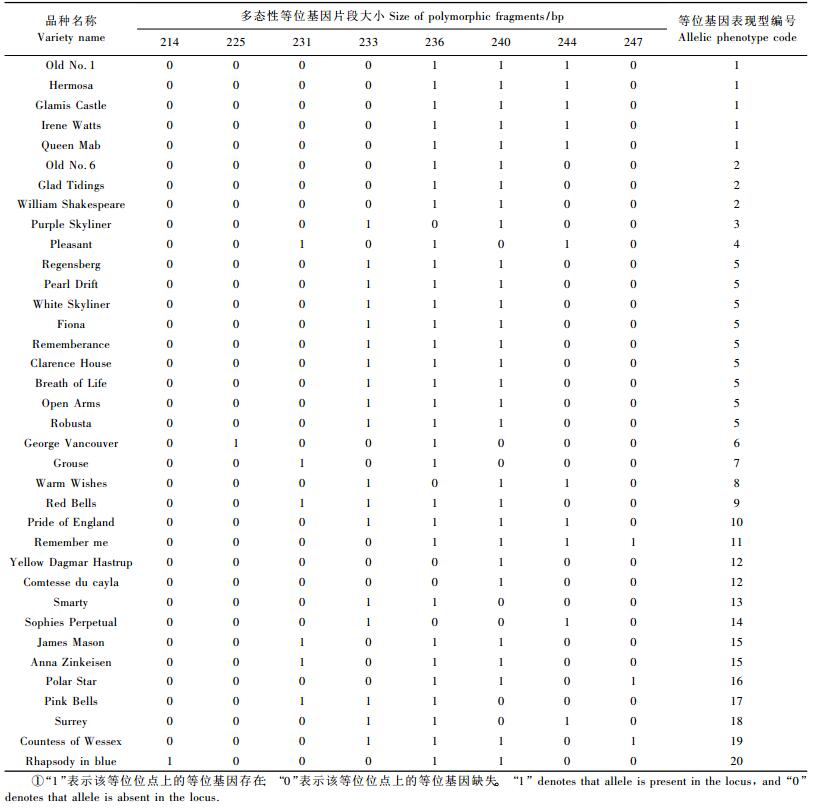
1 材料与方法 1.1 试验材料36个月季品种收集栽植于北京植物园苗圃,包括中国月季(China rose)、藤本月季(Climbing rose)、丰花月季(Floribunda rose)、杂交香水月季(Hybrid tea rose)、微型月季(Miniature rose)和多花月季(Polyantha rose)等多个品种群(表 1),其中品种Rosa ‘Old No.1’和Rosa ‘Old No.6’是中国传统月季品种,而Rosa ‘Hermosa’, Rosa ‘Irene Watts’, Rosa ‘Queen Mab’, Rosa ‘Comtesse du cayla’, Rosa ‘Sophies Perpetual’是从欧洲引进的中国月季。2011年7月下旬采集月季幼叶,-70 ℃保存。
|
|
基因组DNA提取采用CTAB法,0.1 g新鲜叶片组织加液氮研磨成粉末状,加2%CTAB缓冲液(2% CTAB, 1.4 mol·L-1NaCl, 20 mmol·L-1 EDTA, pH8.0, 100 mmol·L-1 Tris-HCl, pH8.0, 1%PVP-40, 2% 2-ME), DNA提取方法参照Doyle等(1987)。DNA质量和浓度使用紫外分光光度计NanoDrop8000检测,加灭菌水稀释至50 ng·μL-1,-20 ℃保存。
1.3 PCR扩增SSR引物序列参见表 2,PCR采用3条引物进行扩增,包括M13序列5′-CACGACGTTGT AAAACGAC-3′(M13通用引物5′端加CY5荧光标记),SSR正向引物前端加M13序列尾巴以及反向序列。PCR扩增采用20 μL反应体系,10 μL 2×Taq MasterMix(10 mmol·L-1 Tris-HCl, pH8.3;50 mmol·L-1 KCl,1.5 mmol·L-1 MgCl2,250 μmol·L-1 dNTP each,Taq酶0.05 U·μL-1, 北京天根),DNA模板25 ng,正向引物2 μmol·L-1,反向引物2 μmol·L-1,M13荧光标记引物2 μmol·L-1,加ddH20补齐至20 μL。PCR扩增程序,第1轮: 94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸45 s,25个循环;72 ℃后延伸10 min,4 ℃保存。第2轮:加2 μmol·L-1M13-荧光引物,94 ℃预变性5 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,10个循环;72 ℃再延伸10 min,4 ℃保存。
|
|
15 μL上样缓冲液(甲酰胺:分子量内标=80:1)中加入0.5 μL PCR扩增产物,PCR产物95 ℃变性2 min,然后毛细管电泳检测(CEQ8000 GeXP, Beckman),片段分析使用Genetic Analysis System软件。根据每个位点所观察到PCR扩增片段有无以及大小,建立二元矩阵,并记录每个位点的等位变异和等位基因表现型数量(Becher et al., 2000)。品种倍性分析采用MAC-PR方法(Esselink et al., 2004)。多态性信息含量PIC=1—∑Pi2,Pi表示在i位点上观察等位基因频率。品种间Dice遗传相似系数计算: SD=2a/(2a+b+c),a表示2个品种共有条带数量;b表示品种之一特有的条带数量;c表示另一品种特有的条带数量(Dice,1945)。品种间聚类分析使用非加权组平均法(UPGMA),所有数据使用NTSYS-pc 2.1e分析(Rohlf,2000)。
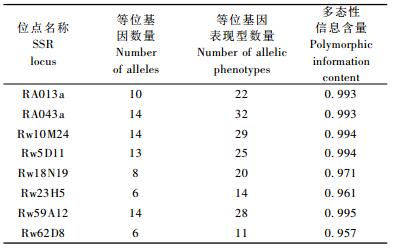
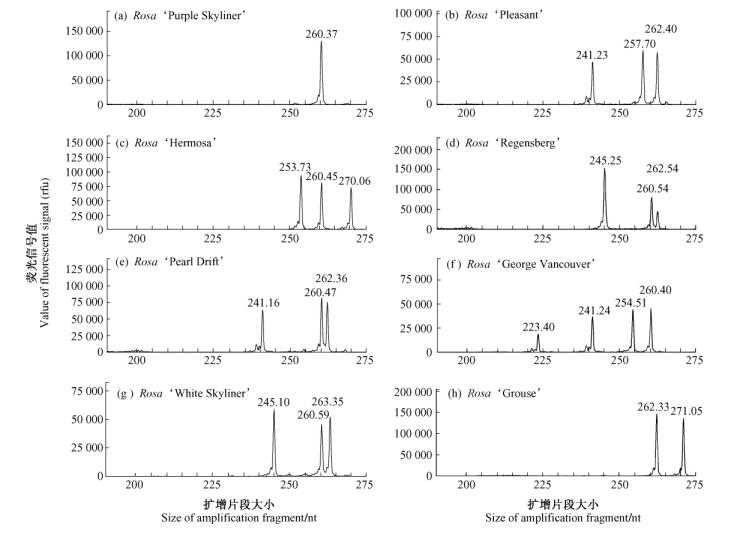
2 结果与分析 2.1 SSR位点多态性分析利用筛选获得的8对SSR标记引物进行PCR扩增,结果显示(表 3)8个SSR位点共检测出85个等位基因变异,SSR位点等位基因变异范围为6~15,平均每个位点等位基因变异数为10.6,其中Rw5D11位点产生13个等位基因变异,图 1为8个品种在Rw5D11位点上等位基因表现型。SSR位点多态性信息含量介于0.957~0.995之间。
|
|
|
图 1 月季品种在Rw5D11位点的等位基因变异 Fig.1 Allelic phenotype of 8 rose varieties at Rw5D11 locus |
利用毛细管电泳检测PCR产物,获得8个SSR位点的等位基因表现型。36个品种在RA013a位点上存在22个等位基因表现型,Rw62D8位点上有11个等位基因表现型,其中单位点分辨力最好的是RA043a,36个品种产生32个独特的等位基因表现型(表 3)。表 4为36个品种在Rw18N19位点上的等位基因表现型。结合8个位点等位基因信息,每个品种具有独特的等位基因表现型。区分所有品种最少需要2个SSR位点,如位点Rw10M24与Rw62D8,Rw18N19与Rw59A12,RA043a与Rw23H5,RA043a与Rw5D11等8个组合可清晰、准确地区分所有供试品种。
|
|
品种间遗传相似度介于0.105~0.791之间,Rosa ‘Pleasant’与Rosa ‘Yellow Dagmar Hastrup’遗传相似系数最小(0.136),Rosa ‘Breath of Life’和Rosa ‘White Skyliner’遗传相似系数最大(0.791),结果表明Rosa ‘Breath of Life’与Rosa ‘White Skyliner’亲缘关系很近,可能是Rosa ‘White Skyliner’的育种亲本。聚类分析显示,在遗传相似度为0.32处,36个月季品种聚为6类(图 2):第1类群包括6个中国月季;其余30个品种分为5类,其中第2类群包含19个现代月季,该组中包含了杂交茶香月季、藤本月季、多花月季等多个园艺品种群;第3类群组包括法国蔷薇品种Rosa galica ‘James Mason’和灌木月季Rosa ‘Anna Zinkeisen’;第4类群包括Rosa ‘Sophies Perpetual’,Rosa ‘Purple Skyliner’,Rosa ‘Rhapsody in blue’;第5类群包括多花月季Rosa ‘Grouse’,2个微型月季Rosa ‘Pink Bells’和Rosa ‘Red Bells’,这2个品种起源于共同的杂交亲本;第6类群由杂交玫瑰Rosa ‘Yellow Dagmar Hastrup’与杂交科达西蔷薇Rosa ‘George Vancouver’组成,两者虽分布于同一类群,但遗传相似度较小。

|
图 2 基于UPGMA月季品种聚类分析 Fig.2 Cluster analysis of rose varieties based on UPGMA |
目前,在我国林业授权新品种中,蔷薇属植物品种数量最多,因此,研究选择了月季作为试验材料,材料涉及多个品种群的月季品种。研究认为SSR标记可用于月季品种鉴定,但SSR位点分辨力也存在明显差异(表 3)。SSR不仅具有稳定性好、可重复性高、条带简单、多态性丰富等特点,而且在近缘种间SSR引物具有良好的通用性。Rw10M24,Rw5D11,Rw18N19,Rw23H5等是从二倍体光叶蔷薇(Rosa wichurana)中开发的SSR标记位点;Ra013a,Ra043a源于切花月季(Rosa hybrida ‘Asami Red’);试验所选择的8对引物在供试材料中均可扩增出多态性等位基因,材料涉及法国蔷薇(Rosa galica)、硕苞蔷薇(Rosa bracteata)、玫瑰(Rosa rugosa)等多个种。结果表明试验所用的SSR引物在蔷薇属近缘种间具有良好保守性,也反映蔷薇属内不同种之间基因组存在较高的同源性。
根据SSR扩增指纹初步确定品种倍性,结果显示Rosa ‘Purple Skyliner’在多个位点上等位基因比率为1:0(纯合)或者1:1(杂合),推断该品种可能为二倍体或者四倍体。SSR指纹结果显示Rosa ‘Yellow Dagmar Hastrup’为三倍体,而品种信息记载为二倍体,两者存在差异,可能供试品种是伪‘Yellow Dagmar Hastrup’材料。
影子带(stutter band)是阻碍SSR标记广泛应用的主要问题,它可能对基因型分析产生干扰,先前研究表明二碱基重复SSR位点中产生影子带几率较大(Esselink et al., 2003), 在本文研究中也遇到了同样的问题,适当改变PCR扩增条件可有效抑制影子带的产生,例如提高退火温度,使用降落PCR等。DNA指纹数据库构建须严格筛选SSR位点,筛选SSR位点需要遵循一些原则,如多态性良好、扩增片段易判读等。之前研究提出了筛选高质量位点的方法(Smudlers et al., 1997),王凤格等(2003a; 2003b; 2008)认为在绘制玉米(Zea mays)DNA指纹中SSR核心引物的确定须从SSR位点的PIC值、扩增产物质量、可重复性等多个方面考虑,并筛选了10对引物作为构建玉米自交系的核心引物组合,还在建立玉米指纹图谱过程中探索了多重PCR应用,提出了DNA指纹构建规范化标准(赵久然等,2003;王凤格等,2006)。
随着植物新品种申请、授权数量快速增长,构建我国林木授权品种和已知品种的DNA指纹数据库刻不容缓,一方面有利于实现品种管理的信息化和数据库化,提高工作效率;另一方面有利于维护育种者权利保护,为实现侵权事件的快速处理提供参考标准。近年来,国外主要农作物如玉米、小麦、番茄等都已经建立了品种DNA数据库,这些数据库构建主要应用是SSR标记技术(Bredemeijer et al., 2002;Röder et al., 2002;Gunjaca et al., 2008)。目前,我国在农作物如水稻(Oryza sativa)、玉米中开展了相关研究,品种DNA指纹数据库构建研究也获得了一些进展(程本义等,2009)。2010年,我国初步建成了玉米DNA指纹数据库(http://www.maizeDNA.com),数据库包含品种形态性状数据、图片、DNA指纹图谱等信息(王凤格等,2010)。
随着月季遗传学、基因组学研究不断深入,许多SSR位点侧翼序列信息公布,这为月季品种分子鉴定以及品种数据库建立创造了有利条件,但只有少数标记定位于遗传图谱。建议未来研究工作可从筛选多态性良好、扩增稳定、均匀分布于染色体上的核心引物组合,建立标准化等位基因检测方法(This et al., 2004)等方面入手,最终,以我国授权月季品种、已知品种为材料,建立月季品种DNA指纹数据库,实现植物新品种数据库信息化管理与应用。Debener等(2009)认为月季虽然人工培育时间长,经济价值高,但遗传学研究、基因组结构、功能基因分析等方面知之甚少,提出将月季作为园艺模式植物进行全基因组测序。全基因组测序不但解决了SSR引物开发的难题,而且SSR可精确定位于染色体,这将推动月季品种DNA指纹数据库建立、品种分子鉴定以及分子标记在品种测试中应用等实际工作的开展。
3.2 月季品种间遗传关系SSR标记是一种共显性标记,在二倍体生物中,标记数据可转化为该位点的等位基因型,而SSR标记在多倍体杂合样本中赋值比较复杂(Creste et al., 2003)。结果显示在SSR位点上不同品种存在明显的基因型差异,但在多倍体植物中准确计算等位基因拷贝数存在难度,通常只能获得每个SSR位点的等位基因表现型,而且目前缺少适用的数学模型用于精确估计多倍体个体间的遗传差异(Kosman et al., 2005;Scariot et al., 2006)。因此,在数据分析过程中,我们采用较为常用的“0-1”方式对SSR数据进行赋值。
中国月季与其他品种群月季的遗传相似度较小(图 2),分布于不同的聚类群。第1聚类群为中国月季,其中包含2个中国传统月季品种,4个从欧洲引进的中国月季,可能是由于这些品种培育过程使用过相同的育种材料,这也进一步证实了中国月季在月季育种历史中做出了贡献,这与先前的研究结果是相似的(唐开学等,2008;邱显钦等,2009)。从新品种培育角度考虑,中国月季与其他品种群的月季存在遗传差异,未来月季新品种培育、新种质创制工作可从中选择优质品种作为杂交育种材料。第2组包括杂交茶香、藤本、丰花、多花等多个品种群,主要是因为月季人工培育历史悠久,杂交频繁,其间发生了基因重组,品种间存在较为普遍的基因渐渗。杂交科达西蔷薇是以玫瑰(Rosa rugosa)和科达西蔷薇(Rosa kordesii)为亲本杂交培育的栽培品种,因此,杂交科达西蔷薇与杂交玫瑰品种聚为一类;而源于相同亲本的杂交子代聚为一组。谱系关系与SSR标记分析研究结果高度一致,说明SSR标记应用于月季品种亲缘关系研究是可靠的。起源不同种的月季品种间存在较大的遗传距离,虽然有些品种分布于同一聚类群,但品种间遗传相似性较小,也从一定程度上说明月季品种遗传多样性较为丰富。分子标记用于研究品种起源和亲缘关系具有一定的优势,因为分子标记可直接反映基因组重组、生物间遗传物质交换的真实过程,不易受环境因素的干扰,检测不受生长季节限制等;而形态学分析主要以表型性状观测为基础,多数表型性状是受到复杂的多基因控制,且表型性状表达易受环境影响。
致谢:
中国林业科学研究院王豁然研究员、北京植物园郭翎老师为本试验提供了宝贵材料。
| [] | 陈俊愉. 2001. 中国花卉品种分类学. 北京, 中国林业出版社: 132-135. |
| [] | 程本义, 吴伟, 夏俊辉, 等. 2009. 浙江省水稻品种DNA指纹数据库初步构建及其应用. 浙江农业学报, 21(6): 555–560. |
| [] | 冯锦霞, 郑勇奇, 张川红, 等. 2011. 利用荧光SSR标记鉴别杨树品种. 林业科学, 47(6): 167–174. DOI:10.11707/j.1001-7488.20110625 |
| [] | 国家林业局植物新品种保护办公室. 2010. 中国林业植物授权新品种. 北京, 中国林业出版社. |
| [] | 邱显钦, 张颢, 李树发, 等. 2009. 基于SSR分子标记分析云南月季种质资源亲缘关系. 西北植物学报(9): 1764–1771. |
| [] | 唐开学, 邱显钦, 张颢, 等. 2008. 云南蔷薇属部分种质资源的SSR遗传多样性研究. 园艺学报, 35(8): 1227–1232. |
| [] | 王琼, 郑勇奇, 周建仁. 2008. 分子标记在林业植物新品种鉴别中的应用及前景. 林业科学, 44(6): 180–182. DOI:10.11707/j.1001-7488.20080631 |
| [] | 王凤格, 赵久然, 戴景瑞, 等. 2006. 玉米DNA指纹数据库建库标准规范的建立. 玉米科学, 14(6): 66–68. |
| [] | 王凤格, 赵久然, 郭景伦, 等. 2003a. 中国玉米新品种DNA指纹库建立系列研究Ⅰ.玉米品种纯度及真伪鉴定中SSR技术标准实验体系的建立. 玉米科学, 11(1): 3–6. |
| [] | 王凤格, 赵久然, 佘花娣, 等. 2003b. 中国玉米新品种DNA指纹库建立系列研究Ⅲ.多重PCR技术在玉米SSR引物扩增中的应用. 玉米科学, 11(4): 3–6. |
| [] | 王凤格, 赵久然, 孙世贤, 等. 2010. 我国玉米DNA指纹数据库管理系统的建立. 玉米科学, 18(2): 41–44. |
| [] | 赵久然, 王风格, 郭景伦, 等. 2003. 中国玉米新品种DNA指纹库建立系列研究Ⅱ.适于玉米自交系和杂交种指纹图谱绘制的SSR核心引物的确定. 玉米科学, 11(2): 3–5, 8. |
| [] | 中国科学院昆明植物研究所. 2006. 云南植物志:12卷. 北京, 科学出版社: 571-600. |
| [] | Becher S A, Steinmetz K, Weising K, et al. 2000. Microsatellites for cultivar identification in Pelargonium. Theoretical and Applied Genetics, 101(4): 643–651. DOI:10.1007/s001220051526 |
| [] | Bredemeijer G, Cooke R, Ganal M, et al. 2002. Construction and testing of a microsatellite database containing more than 500 tomato varieties. Theoretical and Applied Genetics, 105(6): 1019–1026. |
| [] | Creste S, Tulmann Neto A, de Oliveira Silva S, et al. 2003. Genetic characterization of banana cultivars (Musa spp.) from Brazil using microsatellite markers. Euphytica, 132(3): 259–268. DOI:10.1023/A:1025047421843 |
| [] | Debener T, Linde M. 2009. Exploring complex ornamental genomes:the rose as a model plant. Critical Reviews in Plant Sciences, 28(4): 267–280. DOI:10.1080/07352680903035481 |
| [] | Debener T, Mattiesch L. 1999. Construction of a genetic linkage map for roses using RAPD and AFLP markers. Theoretical and Applied Genetics, 99(5): 891–899. DOI:10.1007/s001220051310 |
| [] | Dice L R. 1945. Measures of the amount of ecologic association between species. Ecology, 26(3): 297–302. DOI:10.2307/1932409 |
| [] | Doyle J J, Doyle J L. 1987. A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochemical Bulletin, 19(1): 11–15. |
| [] | Esselink G, Nybom H, Vosman B. 2004. Assignment of allelic configuration in polyploids using the MAC-PR (microsatellite DNA allele counting-peak ratios) method. Theoretical and Applied Genetics, 109(2): 402–408. |
| [] | Esselink G, Smulders M, Vosman B. 2003. Identification of cut rose (Rosa hybrida) and rootstock varieties using robust sequence tagged microsatellite site markers. Theoretical and Applied Genetics, 106(2): 277–286. DOI:10.1007/s00122-002-1122-y |
| [] | Gudin S. 2000. Rose:Genetics and breeding. Plant Breeding Reviews, 17: 59–189. |
| [] | Gunjaca J, Buhinicek I, Jukic M, et al. 2008. Discriminating maize inbred lines using molecular and DUS data. Euphytica, 161(1): 165–172. |
| [] | Hibrand-Saint Oyant L, Crespel L, Rajapakse S, et al. 2008. Genetic linkage maps of rose constructed with new microsatellite markers and locating QTL controlling flowering traits. Tree Genetics and Genomes, 4(1): 11–23. |
| [] | Kimura T, Nishitani C, Iketani H, et al. 2006. Development of microsatellite markers in rose. Molecular Ecology Notes, 6(3): 810–812. DOI:10.1111/men.2006.6.issue-3 |
| [] | Kosman E, Leonard K J. 2005. Similarity coefficients for molecular markers in studies of genetic relationships between individuals for haploid, diploid and polyploid species. Molecular Ecology, 14(2): 415–424. DOI:10.1111/j.1365-294X.2005.02416.x |
| [] | Röder M, Wendehake K, Korzun V, et al. 2002. Construction and analysis of a microsatellite-based database of European wheat varieties. Theoretical and Applied Genetics, 106(1): 67–73. DOI:10.1007/s00122-002-1061-7 |
| [] | Rohlf F. 2000. NTSYS-pc:numerical taxonomy and multivariate analysis system. Version 2.1. USA, Applied Biostatistics Inc Setauket. |
| [] | Scariot V, Akkak A, Botta R. 2006. Characterization and genetic relationships of wild species and old garden roses based on microsatellite analysis. Journal of the American Society for Horticultural Science, 131(1): 66–73. |
| [] | Smulders M, Bredemeijer G, Rus-Kortekaas W, et al. 1997. Use of short microsatellites from database sequences to generate polymorphisms among Lycopersicon esculentum cultivars and accessions of other Lycopersicon species. Theoretical and Applied Genetics, 94(2): 264–272. DOI:10.1007/s001220050409 |
| [] | Smulders M, Esselink D, Voorrips R, et al. 2009. Analysis of a database of DNA profiles of 734 Hybrid Tea Rose varieties. Acta Horticulturae, 836: 169–174. |
| [] | This P, Jung A, Boccacci P, et al. 2004. Development of a standard set of microsatellite reference alleles for identification of grape cultivars. Theoretical and Applied Genetics, 109(7): 1448–1458. DOI:10.1007/s00122-004-1760-3 |
| [] | Vosman B, Cooke R, Ganal M, et al. 2001. Standardization and application of microsatellite markers for variety identification in tomato and wheat. Acta Horticulturae, 546: 307–316. |
| [] | Yan Z, Denneboom C, Hattendorf A, et al. 2005. Construction of an integrated map of rose with AFLP, SSR, PK, RGA, RFLP, SCAR and morphological markers. Theoretical and Applied Genetics, 110(4): 766–777. DOI:10.1007/s00122-004-1903-6 |
| [] | Zhang L, Byrne D, Ballard R, et al. 2006. Microsatellite marker development in rose and its application in tetraploid mapping. Journal of the American Society for Horticultural Science, 131(3): 380–387. |
| [] | Zheng Y Q, Zhang C H, Wang Q, et al. 2007.Application of biochemical and molecular techniques in forest trees in China[EB/OL].[2007-04-20].http://www.upov.int/restrict/bmt-cropsubgroups/docs/bmt-two-rose-2-2.pdf. |
 2012, Vol. 48
2012, Vol. 48