文章信息
- 高志民, 刘青, 牟少华, 李雪平, 胡陶
- Gao Zhimin, Liu Qing, Mu Shaohua, Li Xueping, Hu Tao
- 绿竹锌指蛋白基因BoBZF克隆及功能初步分析
- Cloning and Primary Functional Analysis of a Zinc Finger Protein Gene of BoBZF from Bambusa oldhamii
- 林业科学, 2012, 48(10): 49-54.
- Scientia Silvae Sinicae, 2012, 48(10): 49-54.
-
文章历史
- 收稿日期:2011-08-05
- 修回日期:2012-08-15
-
作者相关文章
据统计,我国约有1/2的土地面积为干旱和半干旱地区,干旱缺水是影响植物正常生长发育的重要限制因子,也是土地荒漠化的主要因素(洪平等,2008)。因此,培育耐旱植物新品种是利用干旱地、治理荒漠化有效的途径之一。现代生物技术的发展为植物耐旱育种创造了有利条件,研究表明利用转基因技术将锌指蛋白(zinc finger protein)基因在目标植物中过量表达后,能够提高植物的抗逆性(田路明等,2005;Huai et al., 2009)。
与其他大多数木本植物相比,竹类植物的耐旱性相对较低,但随着对竹类植物应用开发的不断深入,人们对其耐旱性的关注日趋增强。对竹类植物的耐旱性研究主要是在形态观察、生理与生化指标测定的基础上对不同竹种进行综合评价。例如,采用模糊数学中隶属函数方法对4种地被观赏竹耐旱性综合评价显示,耐旱性黄条金刚竹(Pleioblastus kongosanensis f. aureostriatus)>菲白竹(Sasa fortunei)>菲黄竹(S. auricoma)>铺地竹(S. argenteostriatus)(赵兰等,2010);以SOD活性、MDA含量和可溶性糖含量3种生理指标对5种观赏丛生竹的耐旱性综合研究表明,观音竹(Bambusa multiplex var. riviereorum)和小琴丝竹(Bambusa multiplex var. multiplex)的耐旱性最强,其次是菲黄竹和靓竹(Sasa glabra f. alba-striata),孝顺竹(Bambusa multiplex)最弱(王晓洁等,2010)。同时,也借鉴了其他植物耐旱研究方法,如王福升等(2011)采用根压法对52种竹子的根压进行了测定,认为木质部栓塞是导致竹子耐旱能力下降的原因之一。但要真正揭示竹子的耐旱机制仅从表型、生理生化角度是不够的,需要结合分子生物学的研究。
目前,绿竹(Bambusa oldhamii)是我国东南沿海防护林建设中所使用的优良竹种之一,在沿海防护中发挥重要生态保护功能的同时,又能产生一定的经济效益。由于沿海地区经常出现季节性干旱的问题,因此绿竹的耐旱性研究日趋受到重视。通过对水分胁迫条件下绿竹光合作用、叶绿素含量、质膜透性、叶保水力、叶片相对含水量、水分饱和亏缺、丙二醛含量、游离脯氨酸含量、植株中营养元素(N,P,K,Na)含量等生理、生化指标变化的详细研究(郑荣妹,2003),证明绿竹是耐旱能力较强的竹种之一,但从分子水平来研究绿竹的耐旱性尚未见报道。本研究从绿竹耐旱相关锌指蛋白基因的分离入手,在生物信息学分析的基础上,通过构建基因的植物过量表达载体,转化模式植物拟南芥(Arabidopsis thaliana)来对其功能进行初步研究,以期为今后竹子的抗逆分子育种提供参考。
1 材料与方法 1.1 试验材料绿竹扦插苗(2年生)取自浙江省温州,在竹藤科学与技术重点开放实验室内盆栽于直径为15 cm塑料盆中,栽培基质为腐殖质土和蛭石(7:3)。培养温度为25 ℃,光周期为光/暗=16 h/8 h。
1.2 总RNA提取与cDNA合成应用Invitrogen公司的Trizol reagent提取绿竹叶片、叶鞘、幼茎和根的RNA(Gao et al., 2006),用Promega公司的反转录试剂盒合成cDNA。参照Clontech公司的SMARTTM RACE试剂盒操作说明合成3′cDNA和5′cDNA。
1.3 基因的克隆、测序与分析根据毛竹(Phyllostachys edulis)锌指蛋白基因(FP100973)cDNA序列设计引物,由上海生工生物工程技术服务有限公司合成。BoZ-F:5′-ATGAG GATCCAGTGCGACG-3′;BoZ-R:5′-TCATCCAAG ATCAGGAACGATGAAG-3′。
PCR反应体系为:cDNA(0.04 μg·L-1)1 μL,正向引物(10 μmol·L-1)1 μL,反向引物(10 μmol·L-1)1 μL,dNTP(各2.5 mmol)3 μL,2×Buffer 10 μL,Taq酶(5 U·μL-1)0.2 μL,总体积为20 μL。反应条件:94 ℃ 1 min,61 ℃ 1 min,72 ℃ 1 min,共35个循环。
PCR产物电泳分析后,用上海申能博彩生物科技有限公司试剂盒回收,按照Promega的pGEM-T easy载体快速连接试剂盒操作流程,将回收的DNA片段连接到载体上,转化大肠杆菌(Esherichia coli)DH5α菌株,经蓝白斑筛选,提取阳性克隆质粒并酶切图谱分析后,再将单克隆送北京华大科技有限公司测序。
根据获得序列设计RACE引物。5′-RACE引物BoZ5-1:5′-ACGGCGGAAAGAACGGCGACGACGGC AC-3′;BoZ5-2:5′-TGGTGCTTGCTGGCGAGCTTGT TGGCGG-3′。3′-RACE引物BoZ3-1:5′-TTCGTGT TCTGCGTGGAGGACAGGGCG-3′;BoZ3-2:5′-TGGGTTCACGGAGCTGGAGTGGTTCGC-3′。分别以3′cDNA和5′cDNA为模板,BoZ5-1,BoZ3-1分别与UPM配对进行第1轮PCR反应,条件为:94 ℃ 30 s,72 ℃ 3 min,5个循环;94 ℃ 30 s,70 ℃ 30 s,72 ℃ 3 min,5个循环;94 ℃ 30 s,68 ℃ 30 s,72 ℃ 3 min,25个循环。分别以第1轮PCR产物为模板,BoZ5-2,BoZ3-2分别与NUP配对进行巢式PCR反应,条件为:94 ℃30 s,68 ℃ 30 s,72 ℃ 50 s,25个循环。PCR产物经回收、连接后送公司测序。
应用DNASTAR5.01、SMART等生物软件分析获得cDNA序列及其编码蛋白质的结构特点,并与NCBI数据库中已知核酸和蛋白序列进行比较分析。
1.4 基因的组织特异性表达检测利用引物BoZ-F和BoZ-R,采用RT-PCR法确定BoBZF基因在不同器官中的表达量。以绿竹Actin基因作内标(李雪平等,2007),PCR反应条件:94 ℃ 5 min;94 ℃ 1 min,58 ℃ 1 min,72 ℃ 1 min,28个循环;72 ℃ 10 min。
1.5 基因植物表达载体的构建根据克隆测序后的BoBZF基因序列和植物表达载体pBI121的多克隆位点设计引物,上游引物5′端添加XbaⅠ酶切位点,BoZ-F1:5′-tctagaAT GGGGAGAGGGAGAGTTG-3′;下游引物5′端添加SacⅠ酶切位点,BoZ-R1:5′-gagctcCAATAGTTGAA TCTGTTCTTGC-3′。
以测序正确的质粒DNA为模板,采用高保真酶进行PCR扩增。反应条件为:94 ℃ 5 min;94 ℃ 1 min,62 ℃ 1 min,72 ℃ 1 min,35个循环;72 ℃ 10 min。扩增产物回收后加A与pGEM-T easy连接后转化大肠杆菌DH5α,对阳性克隆测序。将测序正确的克隆用双酶切回收,直接插入到pBI121的多克隆位点,并进行酶切检测。
1.6 拟南芥转化、检测与表型初步分析将构建好的载体质粒用电击法转入农杆菌(EHA105),用蘸花法转化拟南芥(徐芳等, 2005)。经连续卡那霉素(50 mg·L-1)抗性筛选,没有分离的纯系用于下一步试验。提取转BoBZF基因拟南芥植株的RNA反转录成cDNA,用引物BoZ-F和BoZ-R进行RT-PCR检测,同时以质粒DNA和野生型拟南芥的cDNA作为对照。
当幼苗长到约5 cm时, 充分浇水1次后停止浇水,定期观察不同株系的表型,记录转基因植株和野生型拟南芥的生长期天数。另外,播种转基因拟南芥种子于MS培养基上,生长10天后用30%的PEG-6000处理(张依章等,2006),同时以野生型拟南芥为对照,7天后观察表型。
2 结果与分析 2.1 基因克隆用BoZ-F和BoZ-R进行扩增反应,PCR产物经1%的琼脂糖凝胶电泳后用EB染色,结果显示(图略),在750 bp左右有1条亮带,且随着退火温度的提高特异性更强,与预测的基因片段相符。选择退火温度61.8 ℃进行扩增回收目的片段,并与pGEM-T easy载体连接,转化后将单克隆送公司测序。测序结果表明,插入片段为771 bp。通过第1轮PCR和第2轮巢式PCR,获得目的片段测序结果显示,5′ RACE和3′ RACE扩增获得序列分别为284 bp和367 bp,与保守区序列拼接,去掉重叠部分,得到1个1 076 bp的全长cDNA序列。
2.2 序列分析通过DNASTAR软件对获得的全长cDNA序列分析,结果显示5′非翻译区为156 bp,3′非翻译区为149 bp,读码框为771 bp,编码256个氨基酸,其蛋白质的等电点和分子量分别为4.875和27 099.71 u。读码框G+C含量高达69.13%,这与禾本科(Gramineae)单子叶植物基因序列的结构特点相符合(Campbell et al., 1990)。蛋白结构分析表明,所编码的氨基酸包含2个B-Box锌指结构,分别位于读码框的第4—47位和第53—100位,锌指结构的结合域为CHC3H2,2个锌指区之间有5个氨基酸隔开(图 1)。编码蛋白的特征符合B-Box锌指蛋白的特征(Slack et al., 1998),该基因命名为BoBZF(GenBank登记号为EU606025)。

|
图 1 BoBZF编码区核酸序列及其推导出的氨基酸序列 Fig.1 Nucleotide sequence and deduced amino acid sequence of BoBZF B-box1:单下划线Single underline;B-box2:双下划线Double underline. |
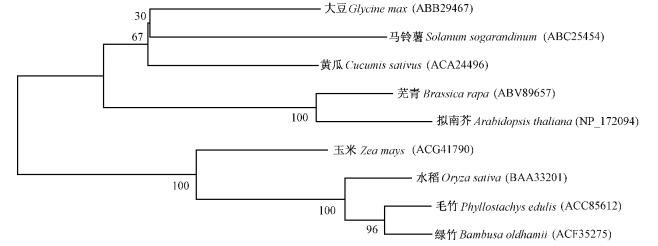
利用NCBI在线软件blastx对BoBZF序列进行分析比较,结果显示BoBZF编码的蛋白与其他植物的锌指蛋白都有较高的一致性,其中与来自毛竹的PeBZ1(ACC85612)一致性最高,达89.1%,与模式植物水稻(Oryza sativa)和拟南芥的锌指蛋白一致性分别为81.0%和49.0%。应用MEGA4软件的系统进化树分析表明,BoBZF与毛竹、水稻、玉米(Zea mays)等单子叶植物的锌指蛋白聚类到一起,而与黄瓜(Cucumis sativus)、大豆(Glycine max)、拟南芥、马铃薯(Solanum sogarandinum)、芜青(Brassica rapa)等的锌指蛋白聚类到另一组(图 2),说明所获得的绿竹BoBZF基因编码的蛋白确实属于锌指蛋白,且系统进化树分析与形态学分类相符合。
|
图 2 基于B-box基因编码锌指蛋白序列构建的系统进化树 Fig.2 Phylogenetic tree based on the zinc finger proteins coded by B-box genes 每个分支上的数字表示1 000次重复搜索的靴带值。 Numbers on major branches indicated bootstrap estimates for 1 000 replicates. |
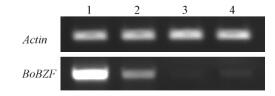
组织特异性表达表明,BoBZF在叶片、叶鞘、幼茎和根中均有表达(图 3),其中在叶片的表达丰度较高,其次是叶鞘,在根中表达较弱,而在幼茎中仅有微弱表达。这与拟南芥AZF2和STZ的表达模式相类似(Sakamoto et al., 2004)。
|
图 3 BoBZF基因的RT-PCR分析 Fig.3 RT-PCR analysis of BoBZF gene 1:叶片Leaf; 2:叶鞘Sheath; 3:幼茎Stem; 4:根Root. |
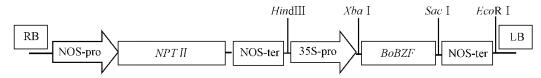
为进一步验证BoBZF基因的功能,构建了该基因植物表达载体。由BoZ-F1和BoZ-R1的PCR产物获得阳性克隆的测序结果可知,插入片段为780 bp,包含了BoBZF基因编码区768 bp以及添加的酶切位点XbaⅠ(tctaga)和SacⅠ(gagctc)12 bp。以切除GUS片段后的pBI121(XbaⅠ和SacⅠ双酶切)作为载体,将BoBZF基因片段插入到多克隆位点,即获得了BoBZF基因的植物表达载体(图 4)。
|
图 4 BoBZF基因植物表达载体 Fig.4 Plant expression vector of BoBZF gene |
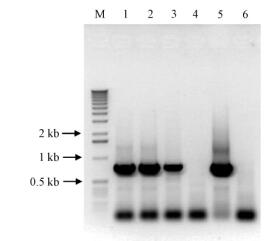
转化拟南芥,对T0代进行卡那霉素抗性筛选,共获得抗性植株15个单株,对T1代单株收种并继续筛选,获得不发生分离的种子T3代3个株系。RT-PCR检测结果表明,BoBZF基因在3个株系中均得到了表达,目的片段与阳性对照一致;而对照野生型拟南芥中没有检测到(图 5)。
|
图 5 转BoBZF拟南芥植株T3代RT-PCR检测 Fig.5 BoBZF transgenics checked by RT-PCR 1-3:转基因植株Transgenics; 4:野生型对照Wild type control; 5:质粒对照Plasmid control; 6:水对照Water control. |
耐旱性表型观察显示,停止浇水后60天野生型拟南芥已经干枯(图 6 CK),而3个转基因株系仍有绿色新生莲座叶形成,种子成熟稍晚(图 6A, B, C),生长期明显延长(15~20天)。

|
图 6 控水处理转BoBZF基因拟南芥表型 Fig.6 Phenotype of BoBZF transgenics by water control A, B, C:转基因植株Transgenics; CK:野生型对照Wild type control. |
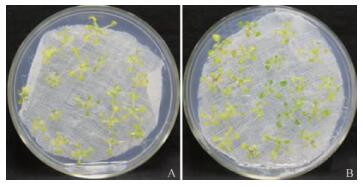
利用PEG模拟水分胁迫法筛选拟南芥抗性个体,操作简单,方便快捷,特别适合实验室进行大规模筛选(张依章等,2006)。用30%的PEG-6000处理在MS培养基上生长10天的拟南芥幼苗,7天后野生型拟南芥全部黄化(图 7A),而转基因植株尚存在部分叶片为绿色(图 7B)。表明BoBZF基因有助于提高转基因拟南芥的耐旱性。
|
图 7 PEG处理转BoBZF基因拟南芥表型 Fig.7 Phenotype of BoBZF transgenics treated with PEG A:野生型对照Wild type control; B:转基因植株Transgenics. |
锌指蛋白基因家族是一个庞大的转录因子家族,对干旱、高盐和低温等非生物胁迫具有一定的调节作用。研究表明,B-Box型锌指蛋白基因在细胞内通过抑制核糖体的产生来影响生物合成活动,从而抑制蛋白的合成,以此来参与调控核糖体RNA的合成和细胞的生长;B-Box型锌指蛋白基因作为转录因子还能够直接抑制RNaseⅠ和5S RNA的转录(Borden et al., 1995;1996;1998)。拟南芥的锌指蛋白AZF2和STZ作为转录抑制子,通过对其他转录因子转录活性的下调来发挥作用;在干旱、低温、高盐和ABA等处理条件下,AZF2和STZ的表达活性显著提高(Sakamoto et al., 2004)。本研究从绿竹中分离的B-Box型锌指蛋白基因BoBZF为组成型表达,且在叶片的表达丰度最高,其表达模式与胁迫条件下AZF2和STZ相类似,暗示BoBZF可能在绿竹对干旱的耐受性中发挥着类似的作用。同时,BoBZF编码蛋白与水稻等单子叶植物的锌指蛋白结构上较高的一致性,意味着它们拥有相似的功能,如可能与其他蛋白互作对开花花期进行调控等(Song et al., 1998)。
目前,对竹类植物抗逆分子生物学的研究尚停留在一些抗逆基因的克隆与序列分析层面(杨洋等,2010;张艳等,2010;张智俊等,2011),尤其是在竹类植物遗传转化体系尚不完善的情况下,对于竹子耐旱功能基因的研究更是举步维艰。然而,已有许多耐旱相关基因被分离鉴定,并通过转基因实现了植物对水分胁迫逆境耐受程度的提高(王君丹等,2004;赵楠等,2009),这为开展竹类植物研究提供了良好的借鉴。本研究通过BoBZF基因在拟南芥中过量表达,获得了对PEG处理具有一定耐受性的转基因植株,生长期延长,间接证明BoBZF在竹子中的功能与竹子的耐旱性密切相关,其编码蛋白是耐旱调控组成元件之一,但BoBZF在绿竹中是如何发挥作用的尚需进一步深入研究。另外,已有研究表明,植物对逆境的应答往往是受多基因控制的(唐益苗等,2009),其表达调控是呈网络式的,因此使用单个基因来改良植物的耐旱能力是有限的,选择多个基因组合实现共转化可能是未来竹类植物耐旱分子育种更为有效的方法。
| [] | 洪平, 徐凯, 刘亚欣, 等. 2008. 抗旱耐盐基因与作物的改良及其在荒漠化治理中的前景. 农业资源与环境科学, 24(4): 398–402. |
| [] | 李雪平, 高志民, 彭镇华, 等. 2007. 绿竹咖啡酸-O-甲基转移酶基因(COMT)的克隆及分析. 林业科学研究, 20(5): 722–725. |
| [] | 唐益苗, 赵昌平, 高世庆, 等. 2009. 植物抗旱相关基因研究进展. 麦类作物学报, 29(1): 166–173. |
| [] | 田路明, 黄丛林, 张秀海, 等. 2005. 逆境相关植物锌指蛋白的研究进展. 生物技术通报(6): 12–16. |
| [] | 王福升, 田新立, 丁雨龙, 等. 2011. 用根压法研究竹子的耐旱、耐寒性. 林业科学, 47(8): 176–181. DOI:10.11707/j.1001-7488.20110827 |
| [] | 王君丹, 胡鸢雷, 魏晓, 等. 2004. 脱水素基因转化的矮牵牛对干旱胁迫的反应. 分子植物育种, 2(3): 369–374. |
| [] | 王晓洁, 刘西岭, 辛华. 2010. 青岛引种的5种观赏丛生竹的抗旱性研究. 中国农学通报(22): 248–251. |
| [] | 徐芳, 熊爱生, 彭日荷, 等. 2005. 植物遗传转化的新方法:Floral Dip. 中国蔬菜(3): 29–31. |
| [] | 杨洋, 张智俊, 罗淑萍. 2010. 毛竹甘油醛-3-磷酸脱氢酶基因的克隆与序列分析. 经济林研究, 28(3): 7–13, 24. |
| [] | 张艳, 高健, 徐有明. 2010. 毛竹β-1, 3-葡聚糖酶基因的克隆及序列分析. 分子植物育种, 8(3): 533–541. |
| [] | 张智俊, 杨洋, 罗淑萍, 等. 2011. 毛竹液泡膜Na+/H+逆向运输蛋白基因克隆及表达分析. 农业生物技术学报, 19(1): 69–76. |
| [] | 张依章, 王幼宁, 张文胜, 等. 2006. 聚乙二醇模拟水分胁迫筛选拟南芥突变体的新方法. 植物生理学通讯, 42(2): 285–287. |
| [] | 赵兰, 邢新婷, 江泽慧, 等. 2010. 4种地被观赏竹的抗旱性研究. 林业科学研究, 23(2): 221–226. |
| [] | 赵楠, 赵飞, 李玉花. 2009. 锌指蛋白结构及功能研究进展. 生物技术通讯, 20(1): 131–134. |
| [] | 郑荣妹. 2003. 沿海沙地引种绿竹等竹子的抗盐抗旱机理研究. 福建农林大学硕士学位论文. http://cdmd.cnki.com.cn/article/cdmd-10389-2003096071.htm |
| [] | Borden K L, Lally J M, Martin S R, et al. 1995. Novel topology of a zinc-binding domain from a protein involved in regulating early Xenopus development. EMBO Journal, 14(23): 5947–5956. |
| [] | Borden K L, Lally J M, Martin S R, et al. 1996. In vivo and in vitro characterization of the B1 and B2 zinc-binding domains from the acute promyelocytic leukemia protooncoprotein PML. Proc Natl Acad Sci, 93: 1601–1606. DOI:10.1073/pnas.93.4.1601 |
| [] | Borden K L. 1998. RING fingers and B-boxes:zinc-binding protein-protein interaction domains. Biochem Cell Biol, 76(2/3): 351–358. |
| [] | Campbell W H, Gowri G. 1990. Codon usage in higher plants, green algae and cyanobacteria. Plant Physiology, 92(1): 1–11. DOI:10.1104/pp.92.1.1 |
| [] | Gao Zhimin, Li Xueping, Li Lubin, et al. 2006. An effective method for total RNA isolation from bamboo. Chinese Forestry Science and Technology, 5(3): 52–54. |
| [] | Huai J, Zheng J, Wang G. 2009. Overexpression of a new Cys2/His2 zinc finger protein ZmZF1 from maize confers salt and drought tolerance in transgenic Arabidopsis. Plant Cell, Tissue and Organ Culture, 99(2): 117–124. DOI:10.1007/s11240-009-9582-2 |
| [] | Sakamoto H, Maruyama K, Sakuma Y, et al. 2004. Arabidopsis Cys2/His2-type zinc-finger proteins function as transcription repressors under drought, cold, and high-salinity stress conditions. Plant Physiology, 136(1): 2734–2746. DOI:10.1104/pp.104.046599 |
| [] | Slack F J, Ruvkun G. 1998. A novel repeat domain that is often associated with RING finger and B-box motifs. Trends in Biochemical Sciences, 23(12): 474–475. DOI:10.1016/S0968-0004(98)01299-7 |
| [] | Song J, Yamanoto K, Shomura A, et al. 1998. Isolation and mapping of a family of putative zinc-finger protein cDNAs from rice. DNA Research, 5(5): 95–101. |
 2012, Vol. 48
2012, Vol. 48
