文章信息
- 高海波
- Gao Haibo
- 沙冬青细胞对MeJA处理的初始生理响应
- Primary Physiological Responses of Ammopiptanthus mongolicus Cells Induced by Methyl Jasmonate
- 林业科学, 2012, 48(10): 24-29.
- Scientia Silvae Sinicae, 2012, 48(10): 24-29.
-
文章历史
- 收稿日期:2012-04-25
- 修回日期:2012-06-06
-
作者相关文章
2. 北京林业大学生物科学与技术学院 北京 100083
2. College of Biological Science and Biotechnology, Beijing Forestry University Beijing 100083
多种生物、非生物刺激均能引起植物细胞内Ca2+流、H+流、H2O2水平及质膜电位发生具有时间和空间特征的变化;植物细胞能对不同的刺激进行正确的识别,通过信号转导过程引起植物产生相应的生理响应(Wu et al., 2009)。茉莉酸(jasmonate acid,JA)及茉莉酸甲酯(methyl jasmonate,MeJA)是调节植物生长发育、病虫害防御及胁迫反应的关键信号分子(Farmer, 2007;Wu et al., 2010);外源施用JA或MeJA后,可以诱导多种植物组织或细胞产生与昆虫取食相类似的防御反应(Gundlach et al., 1992)。近年来非损伤微测技术逐渐成为一种新兴研究离子跨膜运输的手段,可以对被测对象不产生任何损伤的情况下获取进出样品的各种分子、离子浓度、流速及运动方向信息(Newman, 2001)。
沙冬青(Ammopiptanthus mongolicus)系豆科(Leguminosae)植物,为干旱荒漠中常绿灌木,在干旱荒漠区发挥着防风固沙效益的生态效益。由于沙冬青分布区狭小、种群数量少且病害危害严重,加之人类的破坏,沙冬青自然种质资源趋于濒危(张进虎等, 2010)。因此,研究沙冬青害虫防治策略,资源保护方法,对发挥其生态和景观效益都具有重要的理论和实践意义。本研究以沙冬青悬浮细胞为材料,借助非损伤微测技术及激光共聚焦显微镜,研究沙冬青细胞经MeJA诱导后,细胞内Ca2+流、H+流、H2O2及质膜电位的变化情况,阐明它们早期事件间的作用关系,以期为沙冬青的保护和病虫害的生物防治提供一定的理论基础。
1 材料与方法 1.1 细胞培养沙冬青种子由宁夏盐池县森林病虫害际治检疫站提供。沙冬青种子在超净工作台上用0.1 %升汞消毒15 min,无菌水冲洗3次。去除种皮后的种子接种在B5培养基(6-BA 1 mg·L-1,NAA 1 mg·L-1,20 g·L-1蔗糖,pH 5.8)中暗培养。待子叶展平后将下胚轴剪成0.8~1 cm的小段接种在B5培养基中,进行愈伤组织的黑暗诱导。
诱导出来的愈伤组织接种于B5培养基(6-BA 1 mg·L-1、NAA 1 mg·L-1,20 g·L-1蔗糖,pH 5.8)中,摇床运行条件为:160 r·min-1,25 ℃,持续黑暗。每隔12天按照1:10(v/v)的比例对细胞进行1次继代培养。为消除细胞培养液对测量结果的影响,试验前对B5培养基中培养的沙冬青细胞悬浮进行离心洗涤。5 mL沙冬青细胞300 g离心5 min后去上清;然后加入5 mL Ca2+、H+流测试液(成分为:0.1 mmol·L-1 KCl,0.1 mmol·L-1 CaCl2,0.1 mmol·L-1 MgCl2,0.5 mmol·L-1 NaCl,0.2 mmol·L-1 Na2SO4,0.3 mmol·L-1 MES,0.1% Sucrose,pH 5.8),对细胞进行离心洗涤2次;最后加入5 mL测试液平衡2 h后进行相应的离子流测量。
1.2 细胞贴壁方法测量前首先使细胞粘附在玻璃底培养皿(Glass bottom dishes,P35G-1.5-10-C, MatTek Corporation)底部。培养皿的玻璃底用0.000 8 mg·mL-1的多聚赖氨酸(Poly-L-lysine,P7890-25MG,sigma)水溶液浸润5 min后,去离子水冲洗3次,50 ℃烘2 h烘干后备用。50 μL洗涤后的沙冬青细胞滴在培养皿的中部,约20 s后用测试液洗涤皿底部3次,去除未贴壁的细胞。
1.3 离子流的测定Ca2+,H+离子流的测定在中国林业科学研究院林木遗传育种国家重点实验室完成,采用扫描离子选择电极技术(SIET)(系统型号为BIO-IM-008,美国杨格公司),参考杨光等(2010)的方法。仪器的采样频率为0.2 Hz。每个处理首先测量5 min的Ca2+或H+稳态离子流,在含有细胞的玻璃底培养皿中加入相应浓度的试剂后继续进行35~40 min的Ca2+,H+流的测量。数据处理时删除开始测量后2 min的数据,消除加药干扰对Ca2+,H+流的影响(Shabala et al., 2001)。
1.4 H2O2测定方法采用H2O2特异的荧光探针H2DCF-DA检测胞内的H2O2含量的变化(Kristiansen et al., 2009)。贴壁后的细胞用50 μmol·L-1的H2DCF-DA室温避光孵育5 min,吸去H2DCF-DA,玻璃底培养皿中加入3 mL含或无抑制剂的测试液(Allan et al., 1997)。激光共聚焦显微镜(Leica TCS SP5)进行DCF荧光检测。每个处理,首先进行0时间的对照检测,加药后每隔5 min进行1次DCF荧光测量,共测量30 min。每次独立测量,起始时间荧光强度为100%,计算不同处理后同一细胞其他各时间荧光强度的相对值。
激光共聚焦荧光显微镜设置为:激发波长488 nm,发射波长510~530 nm,扫描速度512×512像素。沿着Z轴进行厚度为3 μm层面扫描,三维重建图像后获得每个细胞的荧光图像用LeciaApplication Suite软件进行像素值(0~255)的测量,再换算为荧光强度的相对值(Maffei et al., 2006)。
1.5 质膜电位测定采用质膜电位特异性荧光探针DiBAC4(3)检测细胞质膜电位的变化。DiBAC4(3)为带负电荷可以跨膜的慢反应荧光探针,利用DiBAC4(3)在细胞膜内外分布的差异测膜电位,可以动态监测膜电位的变化。DiBAC4(3)本身荧光强度很低,当质膜发生去极化反应后,DiBAC4(3)进入细胞与胞质内的蛋白质结合后荧光强度增加;质膜发生超极化反应后,DiBAC4(3)流出细胞,荧光强度下降(Maffei et al., 2006;McLamore et al., 2010)。
细胞贴壁后,用3 mL含有2.5 μmol·L-1 DiBAC4(3)的测试液,室温避光孵育30 min,保留染料(McLamore et al., 2010)。激光共聚焦荧光显微镜测量荧光强度。测量过程中进行加药处理的实验,要保证加药后玻璃底培养皿中DiBAC4(3)浓度为2.5 μmol·L-1。激光共聚焦荧光显微镜设置及图像处理方法与H2O2测量相同。
1.6 试验设计试验中MeJA瞬时处理采用的浓度为100 μmol·L-1(Wang et al., 2005)。抑制剂试验中,胞内Ca2+库抑制剂钌红(ruthenium red,RR)浓度为10 μmol·L-1,预处理贴壁细胞30 min后,进行MeJA的瞬时处理(Dombrowski et al., 2007);H2O2清除剂过氧化氢酶(CAT)浓度为100 U·mL-1,预处理10 min后,进行MeJA的瞬时处理(Allan et al., 1997)。H+-ATP抑制剂邻钒酸盐(vanadate)瞬时处理的浓度为100 μmol·L-1(Lamotte et al., 2006)。
1.7 统计分析每个不同的处理,取6个连续的离子流数据平均值,得到0.5 min内所测离子的平均流速。整合离子流是不同处理后测量时间内响应离子流速的积分(扣除加药后测量的前2 min的数据,以消除加药时液体的流动对电极电位的影响)。用软件Origin pro 8.6(Originlab Corporation, USA)的积分工具进行整合离子流的计算;进行单因素方差分析和Tukey多重比较(McLamore et al., 2010)。
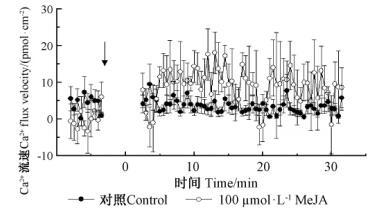
2 结果与分析 2.1 MeJA处理后沙冬青细胞Ca2+,H+流变化沙冬青细胞经100 μmol·L-1 MeJA瞬时诱导后与对照相比Ca2+流速没有显著差异(图 1)。结果表明:沙冬青细胞对MeJA的响应过程中,Ca2+跨膜流动并不是MeJA诱导的主要事件。
|
图 1 MeJA处理沙冬青细胞Ca2+流的变化 Fig.1 Changes of Ca2+ flux induced by MeJA of A. mongolicus cells 负值代表Ca2+内流,正值代表Ca2+外流;每个数据点是30 s内离子流的平均值;误差为标准误(6~9个细胞)。下同。 Negative values correspond to Ca2+ influx and positive value to Ca2+ efflux, Data are means ± SE(n=6-9). Each point represents average flux over a 30 s interval and bars represent the standard error (n=6-9 cells). The same below. |
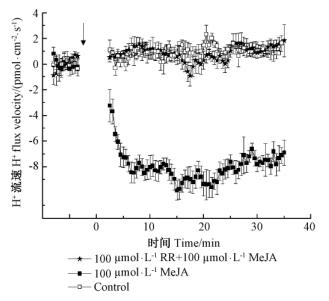
沙冬青细胞经100 μmol·L-1 MeJA处理后,出现H+迅速、持续振荡内流;然而10 μmol·L-1的胞内Ca2+库抑制剂钌红预处理30 min后,完全抑制了MeJA引起的H+内流(图 2)。结果说明:MeJA引起的沙冬青细胞H+内流与MeJA处理后,胞内Ca2+库中Ca2+的释放有关。
|
图 2 MeJA处理沙冬青细胞H+流的变化 Fig.2 Changes of H+ flux induced by MeJA of A. mongolicus cells |
不同处理后的细胞内H+整合离子流,可直观的表明测定时间内H+进出细胞总量的情况。MeJA处理后出现H+大量的内流,测定的时间内流量(-113±15)pmol·cm-2,与对照比差异显著(P < 0.05);沙冬青细胞经RR预处理后,H+整合离子流与对照比无显著差异(图 3)。

|
图 3 不同处理诱导的沙冬青细胞整合H+流变化 Fig.3 Changes of integrated fluxes of H+ induced by MeJA in A. mongolicus cells under different treatment 每个数值为6~9个重复的平均值,不同的字母表示处理间差异显著,Tukey多重比较,P < 0.05。 Each value represents the mean of 6-9 independent experiments. Values(±SE) labeled with different letters between the different treatment indicate significant difference at P < 0.05, according to Tukey's multiple comparison test. |
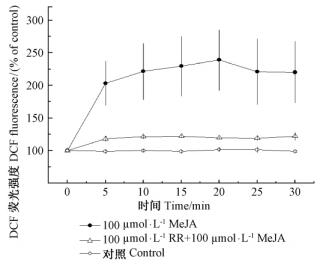
100 μmol·L-1 MeJA处理后,沙冬青细胞内DCF荧光强度在给药后5 min迅速升高,在20 min后达到最大值,并且在测量的时间内一直维持在较高的水平。RR预处理细胞后,明显抑制了MeJA引起的H2O2的积累。试验结果表明:MeJA诱导的H2O2的产生依赖于胞内Ca2+的释放(图 4)。
|
图 4 MeJA诱导的沙冬青细胞H2O2的变化 Fig.4 Changes of H2O2 production of A. mongolicus cells induced by MeJA 每个数据点相对荧光强度表示为相对于零时间点(100%)的荧光强度;每个点代表平均值±标准误,9~12个细胞的平均值。下同。 The pixel intensities of fluorescence at each given point were determined and relative changes in H2O2 production were expressed by considering samples at zero times as the control(100%). Each value represents the mean of 9-12 different cells collected from at least three independent experiments. Values are means ±SE. The same blow. |
为判断MeJA处理后沙冬青细胞内H+内流与H2O2积累的关系,进行了抑制剂试验。100 U·mL-1的H2O2清除剂过氧化氢酶预处理沙冬青细胞10 min后,基本抑制了MeJA引起的H+内流,表明H2O2的积累作用于H+内流的上游,即MeJA处理后引起的H2O2积累是随后细胞H+内流的条件(图 2)。
2.3 MeJA处理后沙冬青细胞质膜电位的变化DiBAC4(3)为带负电荷可跨膜的荧光探针,本身荧光强度很低,当质膜发生去极化反应后,DiBAC4(3)进入细胞与胞质内的蛋白质结合后荧光强度增加;质膜发生超极化反应后,DiBAC4(3)流出细胞,荧光强度下降(Konrad et al., 2008)。
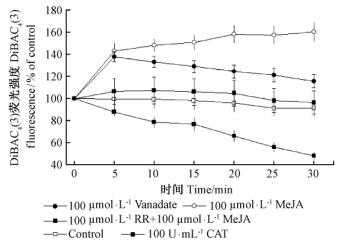
为了判断DiBAC4(3)用来检测细胞膜电位变化的可靠性,用100 μmol·L-1的H+-ATP抑制剂邻钒酸盐瞬时处理沙冬青细胞后,DiBAC4(3)荧光强度迅速显著升高,5 min后荧光强度达到最大值,并且在测量的时间内膜电位发生持续去极化反应(图 5),表明DiBAC4(3)用来检测沙冬青细胞膜电位变化的可行性(Lamotte et al., 2006)。
MeJA处理后,沙冬青细胞5 min后质膜电位快速升高,在测量时间内膜电位呈现持续去极化状态;RR预处理后的沙冬青细胞,MeJA未能引起质膜电位产生去极化反应(图 5)。抑制剂试验表明:沙冬青细胞膜电位发生去极化反应,是MeJA诱导的早期事件之一,膜电位的去极化依赖于胞内Ca2+库Ca2+的释放。
|
图 5 不同处理诱导的沙冬青细胞质膜电位的变化 Fig.5 Changes of membrane potential of A. mongolicus cells induced by different treatment |
本次试验阐明了激发子MeJA诱导后,沙冬青悬浮细胞的跨膜离子流、H2O2及膜电位等早期事件之间的联系。
Ca2+作为重要的第二信使参与了植物的许多信号转导过程,正常情况下胞内游离的Ca2+浓度很低(Munemasa et al., 2011)。包括昆虫取食在内的多种刺激均会引起胞内Ca2+浓度迅速升高,从而激活包括钙调蛋白等Ca2+传感蛋白,诱发蛋白质磷酸化及产生转录响应(Maffei et al., 2007)。Ca2+流是植物响应生物/非生物刺激后产生的早期事件之一,但植物对外界刺激产生响应后,并不总是出现Ca2+的跨膜内流。马铃薯(Solanum tuberosum)、番茄(Lycopersicor escuintum)及烟草感染马铃薯X病毒(Potato virus X,PVX)后并未出现Ca2+内流,而感染病原菌P. syringae后出现Ca2+内流。说明Ca2+流的特异性与外界刺激的类型及植物种类有关(Jabs et al., 1997;Shabala et al., 2010)。
MeJA瞬时处理沙冬青细胞后,未检测到Ca2+的明显内流,但这不表明胞内Ca2+浓度不发生变化。细胞受到生物或非生物刺激后,胞质内游离Ca2+浓度升高的来源,可能来自于胞外介质Ca2+内流入及(或)内质网、液泡等胞内细胞器中Ca2+的释放(Evans et al., 2001)。本试验结果表明:钌红预处理沙冬青细胞后,抑制MeJA处理引起地H+质子内流、H2O2的积累及膜电位去极化。说明胞内钙库中Ca2+的释放,对MeJA瞬时处理后沙冬青细胞内发生的H+质子内流、H2O2积累及膜电位去极化等初始生理响应过程起着重要的调节作用。
H+对植物的生长发育起着重要的调节作用,胞内H+浓度的变化同样受到不同环境刺激的影响。H+可以作为信号分子参与植物细胞内的信号转导过程(Monshausen et al., 2009b)。植物生长发育过程中机械刺激能快速调节胞内pH的变化;胞内pH的变化通过调节胞内蛋白质活性构象,起到联系细胞内不同的代谢及信号转导途径的作用(Monshausen et al., 2009a)。MeJA瞬时处理沙冬青细胞后H+持续内流,说明H+内流是MeJA处理后,沙冬青细胞早期产生的响应事件。胞内Ca2+释放抑制剂RR预处理彻底抑制了MeJA触发的沙冬青细胞H+内流。MeJA瞬时处理沙冬青细胞后,产生的H+内流依赖于胞内Ca2+的释放。
细胞内活性氧(Reactive Oxygen Species,ROS)的产生与Ca2+信号之间存在复杂的关系,Ca2+信号可以位于ROS信号的上游或者下游(Sagi et al., 2001)。胞内Ca2+库抑制剂RR彻底抑制了MeJA诱导的H2O2的产生;而H2O2清除剂CAT彻底抑制了H+内流。MeJA处理沙冬青细胞引起的胞内H2O2的积累,依赖于胞内Ca2+的释放;胞内H2O2积累触发了H+内流。海灰翅夜蛾(Spodoptera littoralis)取食利马豆植株后的数分钟内,取食部位以及其邻近部位的细胞,质膜发生去极化反应(Maffei et al., 2006)。膜电位的变化是离子跨膜流动的结果(Wu et al., 2009)。MeJA处理沙冬青细胞后质膜电位迅速发生去极化反应,而胞内Ca2+库抑制剂RR、H2O2清除剂CAT预处理细胞后均抑制了这种去极化反应,也抑制了MeJA引起的H+质子内流。表明H2O2的积累位于H+质子内流的上游,H+内流是MeJA瞬时处理后沙冬青质膜电位发生去极化的主要原因。
本试验发现:沙冬青细胞经MeJA瞬时处理后,胞内Ca2+库中Ca2+释放、H+内流及H2O2积累是沙冬青细胞产生防御反应的早期事件,这是本研究的一个阶段性成果。但植物是以整体作出防御响应的,因此后续试验应采用MeJA处理沙冬青植株后,研究沙冬青植株内防御物质的变化情况,以期与MeJA处理后沙冬青细胞内产生的初始响应信号的变化进行印证,从而为沙冬青的病害虫防治及资源保护提供理论依据。
| [] | 杨光, 古丽·巴哈尔·阿巴拜克力, 马峰, 等. 2010. 膜泡相关蛋白OsSEC27P增强缺铁转基因烟草根的H+分泌. 科学通报, 55(13): 1233–1239. |
| [] | 张进虎, 廖空太, 李德禄, 等. 2010. 几种不同生境条件下天然沙冬青种群分布格局与特征. 干旱区资源与环境, 24(11): 151–154. |
| [] | Allan A C, Fluhr R. 1997. Two distinct sources of elicited reactive oxygen species in tobacco epidermal cells. The Plant Cell, 9(9): 1559–1572. DOI:10.1105/tpc.9.9.1559 |
| [] | Dombrowski J E, Bergey D R. 2007. Calcium ions enhance systemin activity and play an integral role in the wound response. Plant Science, 172(2): 335–344. DOI:10.1016/j.plantsci.2006.09.011 |
| [] | Evans N H, McAinsh M R, Hetherington A M. 2001. Calcium oscillations in higher plants. Current Opinion in Plant Biology, 4(5): 415–420. DOI:10.1016/S1369-5266(00)00194-1 |
| [] | Farmer E E. 2007. Plant biology: jasmonate perception machines. Nature, 448(7154): 659–660. DOI:10.1038/448659a |
| [] | Gundlach H, Müller M J, Kutchan T M, et al. 1992. Jasmonic acid is a signal transducer in elicitor-induced plant cell cultures. Proceedings of the National Academy of Sciences of the United States of America, 89(6): 2389–2393. DOI:10.1073/pnas.89.6.2389 |
| [] | Jabs T, Tschope M, Colling C, et al. 1997. Elicitor-stimulated ion fluxes and O2- from the oxidative burst are essential components in triggering defense gene activation and phytoalexin synthesis in parsley. Proceedings of the National Academy of Sciences of the United States of America, 94(9): 4800–4805. DOI:10.1073/pnas.94.9.4800 |
| [] | Konrad K R, Hedrich R. 2008. The use ofvoltage-sensitive dyes to monitor signal-induced changes in membrane potential-ABA triggered membrane depolarization in guard cells. Plant Journal, 55(1): 161–173. DOI:10.1111/tpj.2008.55.issue-1 |
| [] | Kristiansen K A, Jensen P E, Moller I M, et al. 2009. Monitoring reactive oxygen species formation and localisation in living cells by use of the fluorescent probe CM-H2DCFDA and confocal laser microscopy. Physiologia Plantarum, 136(4): 369–383. DOI:10.1111/ppl.2009.136.issue-4 |
| [] | Lamotte O, Courtois C, Dobrowolska G, et al. 2006. Mechanisms of nitric-oxide-induced increase of free cytosolic Ca2+ concentration in Nicotiana plumbaginifolia cells. Free Radical Biology and Medicine, 40(8): 1369–1376. DOI:10.1016/j.freeradbiomed.2005.12.006 |
| [] | Maffei M E, Mithöfer A, Arimura G I, et al. 2006. Effects of feedingSpodoptera littoralis on lima bean leaves.Ⅲ. Membrane depolarization and involvement of hydrogen peroxide. Plant Physiology, 140(3): 1022–1035. DOI:10.1104/pp.105.071993 |
| [] | Maffei M E, Mithöfer A, Boland W. 2007. Before gene expression: early events inplant-insect interaction. Trends in Plant Science, 12(7): 310–316. DOI:10.1016/j.tplants.2007.06.001 |
| [] | McLamore E S, Diggs A, Calvo Marzal P, et al. 2010. Non-invasive quantification of endogenous root auxin transport using an integrated flux microsensor technique. The Plant Journal, 63(6): 1004–1016. DOI:10.1111/tpj.2010.63.issue-6 |
| [] | Monshausen G B, Bibikova T N, Weisenseel M H, et al. 2009a. Ca2+ regulates reactive oxygen species production and pH during mechanosensing in Arabidopsis roots. Plant Cell, 21(8): 2341–2356. DOI:10.1105/tpc.109.068395 |
| [] | Monshausen G B, Gilroy S. 2009b. Feeling green: mechanosensing in plants. Trends in Cell Biology, 19(5): 228–235. DOI:10.1016/j.tcb.2009.02.005 |
| [] | Munemasa S, Hossain M A, Nakamura Y, et al. 2011. The Arabidopsis calcium-dependent protein kinase, CPK6, functions as a positive regulator of methyl jasmonate signaling in guard Cells. Plant Physiology, 155(1): 553–561. DOI:10.1104/pp.110.162750 |
| [] | Newman I A. 2001. Ion transport in roots: measurement of fluxes usingion-selective microelectrodes to characterize transporter function. Plant Cell and Environment, 24(1): 1–14. DOI:10.1046/j.1365-3040.2001.00661.x |
| [] | Sagi M, Fluhr R. 2001. Superoxide Production by Plant Homologues of the gp91phox NADPH Oxidase.Modulation of Activity by Calcium and by Tobacco Mosaic Virus Infection. Plant Physiology, 126(3): 1281–1290. |
| [] | Shabala L, Shabala S, Ross T, et al. 2001. Membrane transport activity and ultradian ion flux oscillations associated with cell cycle of Thraustochytrium sp. Functional Plant Biology, 28(2): 87–99. DOI:10.1071/PP00121 |
| [] | Shabala S, Babourina O, Rengel Z, et al. 2010. Non-invasive microelectrode potassium flux measurements as a potential tool for early recognition of virus-host compatibility in plants. Planta, 232(4): 807–815. DOI:10.1007/s00425-010-1213-y |
| [] | Wang J W, Wu J Y. 2005. Nitric oxide is involved in methyl jasmonate-induced defense responses and secondary metabolism activities of Taxus cells. Plant and Cell Physiology, 46(6): 923–930. DOI:10.1093/pcp/pci098 |
| [] | Wu J, Baldwin I T. 2010. New insights into plant responses to the attack from insect herbivores. Annual Review of Genetics, 44(1): 1–24. DOI:10.1146/annurev-genet-102209-163500 |
| [] | Wu J Q, Baldwin I T. 2009. Herbivory-induced signalling in plants: perception and action. Plant Cell and Environment, 32(9): 1161–1174. DOI:10.1111/pce.2009.32.issue-9 |
 2012, Vol. 48
2012, Vol. 48
