文章信息
- 董杰, 詹亚光, 任健
- Dong Jie, Zhan Yaguang, Ren Jian
- 茶条槭悬浮培养的动力学
- Kinetics in Suspension Culture of Acer ginnala
- 林业科学, 2012, 48(10): 18-23.
- Scientia Silvae Sinicae, 2012, 48(10): 18-23.
-
文章历史
- 收稿日期:2011-08-26
- 修回日期:2012-08-17
-
作者相关文章
茶条槭(Acer ginnala)是槭树科(Aceraceae)落叶小乔木或灌木。主要分布在中国、朝鲜、日本、蒙古及俄罗斯东西伯利亚地区。没食子酸在医药、食品、化工、轻工、军工、印染等方面有极大的经济价值(Jie et al., 2011;黄栋等,2009;李雷鹏等,2007;汪荣斌等,2011;闫女等,2010)。茶条槭的叶片中含有大量的没食子酸(3、4、5-三羟基甲苯酸),一直以来没食子酸主要从茶条槭叶片中提取和分离,这样不仅破坏了茶条槭资源,而且极大的限制了其作为新型药物的临床研究和推广应用。因此,利用茶条槭细胞悬浮培养技术生产没食子酸,对大规模生产没食子酸具有重要的意义。
笔者前期的研究表明:没食子酸可以在茶条槭愈伤组织和悬浮细胞中积累(董杰等,2008;Dong et al., 2011;李海艳等,2008),但细胞增殖、营养物质消耗与没食子酸的积累联系十分紧密,这种关系的研究将为细胞由培养瓶转移到生物反应器的扩大培养提供重要的技术参数,而要实现大规模工业化生产植物次生代谢产物的关键技术之一就是生物反应器技术。本研究在茶条槭细胞悬浮培养周期内,不同的培养阶段茶条槭细胞生长和培养基中碳源、氮源、磷源的消耗,电导率的变化,以及细胞的鲜质量与干质量的变化,从而了解茶条槭细胞生长、营养消耗与次生代谢产物积累的基本规律,为提高茶条槭悬浮细胞中没食子酸的积累和建立结构化动力学模型提供理论依据。
1 材料与方法 1.1 茶条槭悬浮细胞用茶条槭种子子叶诱导愈伤组织,选择分散、生长速度快的愈伤组织多次继代后转到液体培养基中进行细胞悬浮培养。经过6代以上的继代后,获得分散性非常好的细胞悬浮物,建立稳定的细胞系。
1.2 细胞培养条件茶条槭细胞液体培养基为改良的WPM培养基(董杰等,2008)附加TDZ 0.008 mg·L-1,6-BA 0.1 mg·L-1,蔗糖20 g·L-1,灭菌前将pH值调至5.8。在250 mL锥形瓶中加入100 mL液体培养基,接种3 g茶条槭愈伤组织进行悬浮培养。悬浮细胞在温度为25 ℃,光照时间为16 h·d-1,摇床转速为120 r·min-1的条件下培养,每14天继代1次。通过多次继代培养,获得分散的绿色细胞系。在250 mL锥形瓶中加入100 mL液体培养基,接种3 g以上试验获得的悬浮细胞系进行悬浮培养。培养条件与前面的试验条件相同,但不进行继代培养,每3天取样1次,测定细胞鲜质量与干质量、没食子酸含量和培养基中蔗糖,NH4+,NO3-和PO43-的浓度。
1.3 测定方法 1.3.1 悬浮培养茶条槭细胞鲜质量和干质量测定用200目筛过滤培养细胞,并将水分用滤纸吸干,称其鲜质量。然后将新鲜细胞放入烘箱中,60 ℃烘干至质量不变后称其干质量。
增长指数=W1/W2。
W1为收获时悬浮细胞的质量,W2为接种愈伤组织的质量。
1.3.2 没食子酸提取和含量测定(董杰等,2008)1) 将干燥的茶条槭细胞粉碎后,用100目筛过滤,精确称得待测样品100 mg,放入5 mL容量瓶中,加入甲醇2 mL,超声2 min,再加入2 mL 10%硫酸,60 ℃水浴1 h,最后甲醇定容至5 mL,室温下沉淀1 h,离心取上清,0.45 μm膜过滤,过滤后将滤液注入液相色谱样品管中,没食子酸含量采用液相色谱法进行测定。
色谱条件为:流动相:甲醇:水为4:6;流速:0.5 mL·min-1;色谱柱:HiQ sil C18W 4.6 mmΦ×250 mm;检测波长:270 nm。
2) 没食子酸含量应用液相色谱法做出没食子酸标准曲线得到峰面积与没食子酸含量关系公式
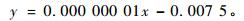
|
(1) |
其中,x为峰面积y没食子酸含量,R2=0.999 4。
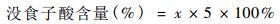
|
(2) |
根据以上公式将测得的峰面积代入公式①求出没食子酸含量,再根据公式②求出没食子酸含量的百分含量。
1.3.3 TTC法测定细胞活力(刘华等,2001)在10 mL试管中加入0.2 g新鲜悬浮细胞,再加入2.5 mL 0.4% TTC液, 2.5 mL pH 7.0的磷酸缓冲液,混匀,25 ℃,黑暗处理13~16 h。离心除去上清液,用5 mL蒸馏水洗涤细胞3次。加入5 mL 95%乙醇, 60 ℃水浴保温30 min。再置于室温下,待细胞完全无色时,485 nm下测其吸光值。
1.3.4 营养物质分析收集摇瓶中的培养液,碳源含量的测定采用蒽酮试剂测定(Dubois et al., 1956),硝酸盐采用苯酚二磺酸反应定量测定(Wang et al., 1998)。铵根离子采用靛定酚蓝法测定(Weatherbum et al., 1967)。磷酸根采用钼酸盐-钒酸盐试剂比色法测定(Chen et al., 1956)。
2 结果与分析 2.1 茶条槭细胞悬浮培养生长曲线图 1为茶条槭细胞的生长中,细胞干质量和鲜质量的动态变化。茶条槭细胞悬浮培养的生长呈现出S型曲线,并且可以分为不同阶段:0~6天悬浮细胞生长较慢,为延迟期,原因可能是细胞在继代过程中转入新的培养液中时,新培养基中的渗透压较高,盐浓度也较高,而悬浮细胞不能迅速适应;6~12天茶条槭细胞增长快,处于对数生长期;12~24天进入稳定期,细胞增殖速度变慢,之后细胞生长进入衰亡期。
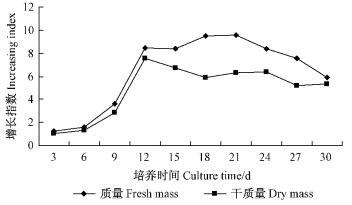
|
图 1 茶条槭细胞悬浮培养时细胞的生长曲线 Fig.1 Dynamic changes of cell growth in A. ginnala |
由图 2可知:茶条槭细胞内没食子酸的积累与细胞生长曲线联系紧密,细胞的生长曲线与没食子酸的积累曲线类似,属于生长偶联型。在延迟期,细胞内次生代谢较慢,没食子酸的含量仅为0.158%。茶条槭细胞增殖迅速,没食子酸的积累速度也变快,细胞内没食子酸含量也快速增加,到第12天时没食子酸含量达到0.49%。在生长对数期没食子酸含量快速增长。而在稳定期和衰亡期,细胞逐渐褐化、死亡,细胞内没食子酸的含量也呈现下降的趋势。
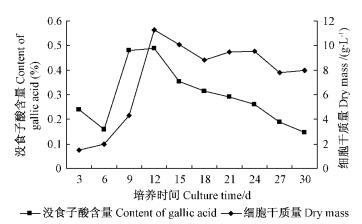
|
图 2 茶条槭细胞悬浮培养没食子酸合成动力学特征 Fig.2 Dynamic changes of gallic acid content in A. ginnala |
由图 3可知:茶条槭细胞悬浮培养的第9天细胞活力达到最大,经TTC法测定其OD值为2.207,此时细胞活力最强;随后细胞快速生长,细胞干质量达到最大,细胞活力的变化和细胞干质量的变化基本一致。
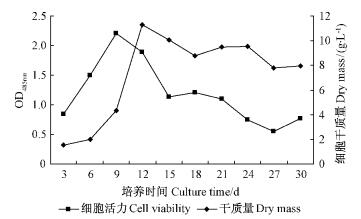
|
图 3 茶条槭细胞悬浮培养时细胞活力的变化分析 Fig.3 Dynamic changes of cell viability in A. ginnala |
无机盐的总浓度用培养基的电导率值来表示。由图 4可以知:细胞生长的需要消耗无机盐,在稳定期(12~24天)之前,无机盐的浓度逐渐降低,而细胞进入衰亡期后(24天以后),死亡的细胞增多,死亡细胞的细胞液进入培养基中,使培养基中无机盐增多,电导率上升。

|
图 4 培养液中电导率的变化 Fig.4 Dynamic changes of electric conductivity in culture solution |
图 5为细胞增长和碳源利用的曲线。蔗糖作为茶条槭细胞培养中的碳源,其作用是构成细胞的组成成分,细胞代谢物的碳架,提供能量及维持培养基中渗透压。茶条槭细胞培养的过程中,0~15天中,碳源逐渐减少,细胞质量逐渐增加,表明糖的快速代谢。碳源的消耗趋势与细胞的生长阶段也较为吻合。在延迟期中,蔗糖迅速被分解为葡萄糖和果糖(还原糖)。在快速生长期时,蔗糖已被大量分解,浓度急速下降。稳定期中,糖含量在27天时稍有上升,可能是由于一些细胞的衰老凋亡,其糖类进入培养基中。
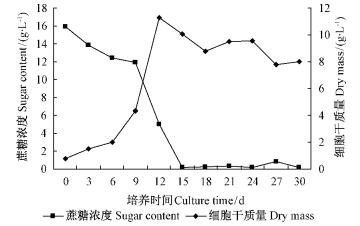
|
图 5 茶条槭细胞悬浮培养时培养基中碳源的消耗和干重的变化 Fig.5 Dynamic changes of sugar content in culture solution |
由图 6可知:在细胞生长过程中,氮源的消耗速度比较快,但NH4+与NO3-离子的吸收没有保持完全同步。12天时已经消耗近90%的NH4+,而前6天NO3-的吸收速率较小,第6天开始才被快速吸收,第15天时NO3-几乎被吸收殆尽。在培养的前期,NH4+比NO3-的吸收速度快,其原因可能是:茶条槭细胞生长所需的蛋白质的合成与NH4+密切相关,没食子酸和其他一些次生代谢产物合成与NO3-有关。
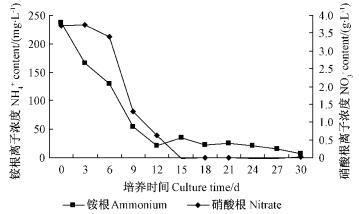
|
图 6 茶条槭细胞悬浮培养时培养基中氮源的消耗 Fig.6 Dynamic changes of NH4+, NO3- content in culture solution |
由图 7可知:与碳源相似,通过15天的培养,磷源也随茶条槭细胞生长而被大量消耗。

|
图 7 茶条槭细胞悬浮培养时培养基中无机磷与蔗糖的消耗 Fig.7 Dynamic changes of PO43- and sugar content in culture solution |
培养基电导率的变化与其中无机盐的吸收与利用有关。当细胞干质量逐渐增加时,培养基的电导率逐渐下降,第24天后,电导率略有上升。分析原因可能是稳定期部分细胞凋亡,其中无机盐释放到培养基中,使其电导率上升。如图 8所示:细胞干质量增加时,培养基的电导率逐渐减小,电导率的减小和细胞生物量的增加显现出线性关系:
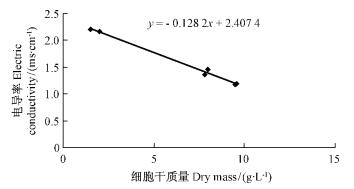
|
图 8 茶条槭悬浮培养电导率与生物量的关系 Fig.8 Dynamic relationships of electric conductivity in culture solution and biomass |
Y=-0.126 1X+2.433 2。
其中X(g·L-1)为细胞干质量,Y (ms·cm-1)为培养基电导率。即随细胞干质量的增加,电导率逐渐减小。
2.9 细胞比生长速率和没食子酸比生成速率生长速率是用来确定培养物或生物生长速度的量度。细胞培养过程中大多数细胞都有指数生长期,在连续培养过程中指数生长期可能变成很长的时期。对于此类细胞培养,可以用生长速率γx=dX/dt ≈△X/△t,来表示单位时间细胞数量的增加,式中X是细胞量,t是时间。
细胞的比生长速率是指单位质量的细胞,在单位时间内所增加的细胞质量。生长速率可看做是绝对生长速度,比生长速率可看成是相对生长速度。比生长速率μ=1/X·dX/dt≈1/X·ΔX/Δt,式中X是细胞量,t是时间。
茶条槭细胞培养的生长速率和比生长速率(图 9)与细胞生长曲线(图 10)一致,μ的变化可将茶条槭细胞的生长划分为3个阶段。在延迟期(0~6天),细胞的比生长速率和生长速率都较小。培养12天时,生长速率和比生长速率都达到最大,分别为2.331 g·L-1d-1和0.541 d-1,之后开始下降直到培养周期结束。

|
图 9 茶条槭细胞生长速率和比生长速率 Fig.9 Dynamic changes of cell growth rate and specific growth rate |
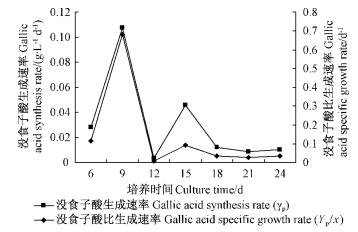
|
图 10 没食子酸的生成速率和比生成速率 Fig.10 Dynamic changes of gallic acid synthesis rate and specific growth rate |
依照之前计算方法,同时研究了茶条槭培养过程中没食子酸的生成速率γp和比生成速率Yp/x=γp/X。在第9天,没食子酸生成速率和比生成速率均达到最大值,在第15天又达到了一个高峰(图 10)。
细胞生长与没食子酸的合成之间显现出部分偶联关系。没食子酸的比生成速率当细胞比生长速率在0.3~0.4时较高,而在高于或低于此范围时,没食子酸合成的比生成速率并不高(图 11)。
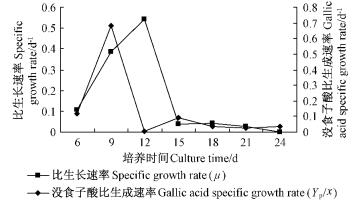
|
图 11 茶条槭细胞比生长速率和没食子酸比生成速率 Fig.11 Dynamic changes of cell specific growth rate and gallic acid specific growth rate |
在植物细胞培养生产次生代谢产物的研究中,培养物的生长规律和次生代谢物合成的规律,对于提高次生代谢物的产量,进行商业化生产具有重要意义(范桂枝等,2011;李春英等,2010)。本研究确立茶条槭细胞悬浮培养周期约为15天,经过15天的悬浮培养,最大生物量和没食子酸含量分别达到了11.3 g·L-1和0.49%。分析茶条槭悬浮细胞生长与没食子酸积累的动力学关系,细胞的最大比生长速率和没食子酸的最大比生成速率分别为0.541 d-1和0.682 d-1。当细胞比生长速率在0.3~0.4 d-1的范围时,没食子酸的比生成速率较大。没食子酸的比生成速率和比生长速率具有一定的联系,茶条槭细胞的生长和没食子酸的合成的模型为部分生长偶联型。
茶条槭细胞30 g·L-1接种量进行悬浮培养15天后,消耗了培养基中大量的碳源、磷源;培养12天后,大量消耗NH4+,而NO3-的消耗速率没有前者快,6天后才开始被迅速消耗,15天时NO3-降到最少。培养基的电导率随细胞生长而逐渐减小,21天时降到最小,而后又略有上升。在大多数植物细胞培养过程中,植物细胞并不是直接吸收蔗糖,而是先将蔗糖水解成葡萄糖和果糖,果糖转化成葡萄糖,再被吸收(陈志宏等,1992)。植物细胞吸收葡萄糖后,其中一些可以转化成细胞壁等,另外还有一些被细胞呼吸利用产生能量,为细胞的其他生命活动提供能量。NH4+和NO3-是培养基的主要氮源,在细胞培养前期,主要用于细胞生长所需的结构蛋白,在对数生长期,细胞逐渐开始合成次生代谢物,次生代谢途径中酶的合成需要消耗氮源。细胞衰亡期时吸收氮源减少(Sun等,2003)。试验结果与许多种类植物细胞如雷公藤(李琰等,2010)、烟草(Nicotiana tabacum)(李春英等,2010;张秀清等,2004)、高山红景天(Rhodiola sachalinensis)(许建峰等,1996;1997;1999;艾江宁等,2009)培养过程的结论相同。
植物细胞吸收的磷源主要作用(Tolbert,1980):1)有5%~15%磷在细胞质中,参与合成脱氧核糖核苷酸、核糖核苷酸或三磷酸腺苷等含磷物质;2)其余的磷储存于液泡中,可以将细胞质中磷维持在一个相对稳定水平,这种储存方式有利于调控细胞的增殖与分化等过程。很多研究表明:植物细胞在培养的延迟期会大量吸收培养基中的磷源。相似的结果在红豆杉(Taxus)细胞的培养中也存在(Venkatesh et al., 1995;兰文智等,2002;马玺等,2004;梅兴国等,1997;2000;余斐等,2001)。磷代谢与糖代谢密切相关,在细胞培养开始阶段,细胞就开始吸收磷,并将其储藏在液泡中,随细胞的增殖逐渐进入细胞质中被消耗。当细胞培养进入稳定期时,部分细胞凋亡,细胞中的磷进入培养基中(Liu et al., 2002)。
本研究结果表明:可以在茶条槭细胞培养过程中采用分批添加营养成分的方法来提高没食子酸的产量,如在细胞培养的第15天添加硝酸盐、蔗糖、磷酸盐,第12天添加铵盐,以补充培养基中的营养成分。
| [] | 艾江宁, 贾景明. 2009. 高山红景天细胞悬浮培养生长和产物积累动力学. 沈阳药科大学学报, 26(8): 653–656. |
| [] | 陈志宏, 陈因良. 1992. 细胞培养工程. 上海, 华东化工学院出版社: 256-257. |
| [] | 董杰, 齐凤慧, 詹亚光. 2008. 茶条槭悬浮培养体系的建立与没食子酸合成的优化条件. 植物学通报, 25(6): 734–740. |
| [] | 范桂枝, 翟俏丽, 于海娣, 等. 2011. 白桦细胞悬浮培养产三萜及其营养成分消耗的动态. 林业科学, 47(1): 62–67. DOI:10.11707/j.1001-7488.20110110 |
| [] | 黄栋, 王瑾, 李冬林. 2009. 茶条槭的生物学特性与培育技术研究. 现代农业科学, 16(4): 112–113. |
| [] | 兰文智, 余龙江, 金文闻, 等. 2002. 红豆杉悬浮细胞放大培养的细胞生长与紫杉醇合成动力学. 生命科学研究, 6(1): 55–59. |
| [] | 李春英, 赵春建, 祖元刚, 等. 2010. 烟草叶片组织块悬浮培养合成辅酶Q_(10)的动力学研究. 森林工程, 26(5): 17–20. |
| [] | 李海艳, 宋继园, 董杰, 等. 2008. 茶条槭愈伤组织的再生体系建立及其没食子酸含量的测定. 植物学通报, 25(2): 212–219. |
| [] | 李雷鹏, 马晓倩, 孙亮, 等. 2007. 茶条槭在东北地区的研究现状及展望. 东北林业大学学报, 35(10): 81–82. DOI:10.3969/j.issn.1000-5382.2007.10.028 |
| [] | 李琰, 杨钰琪, 冯俊涛, 等. 2010. 离体条件下雷公藤不定根生长与营养成分消耗动态研究. 西北农林科技大学学报:自然科学版, 38(11): 134–138. |
| [] | 刘华, 梅兴国. 2001. TTC法测定红豆杉细胞活力. 植物生理学通讯, 37(6): 537–539. |
| [] | 马玺, 马英, 刘威, 等. 2004. 红豆杉细胞培养生产紫杉醇. 药物生物技术, 11(6): 401–405. |
| [] | 梅兴国, 鲁明波, 余龙江, 等. 1997. 红豆杉细胞悬浮培养及动力学研究. 华中理工大学学报, 25(2): 105–107. |
| [] | 梅兴国, 余斐, 张姝, 等. 2000. 红豆杉细胞悬浮培养结构化数学模型的探讨. 生物技术, 10(3): 8–11. |
| [] | 汪荣斌, 王存琴, 刘晓龙, 等. 2011. 茶条槭化学成分及药食应用研究进展. 安徽农业科学, 39(9): 5387–5388, 5517. |
| [] | 许建峰, 韩爱明, 冯朴荪. 1996. 高山红景天愈伤颗粒组织悬浮培养动力学及工艺的研究. 生物工程学报, 12(4): 460–465. |
| [] | 许建峰, 韩爱明, 冯朴荪. 1997. 高山红景天细胞悬浮培养生长和营养成分摄取动力学及其计量关系. 应用与环境生物学报, 3(2): 100–105. |
| [] | 许建峰, 谢健, 李宁, 等. 1999. 高山红景天致密愈伤组织颗粒悬浮培养结构化动力学模型. 大连理工大学学报, 3(1): 47–52. |
| [] | 闫女, 王丹, 高亚卉, 等. 2010. 七里峪不同海拔茶条槭种群的遗传多样性. 林业科学, 46(10): 50–56. DOI:10.11707/j.1001-7488.20101008 |
| [] | 余斐, 吴诚德, 罗杰, 等. 2001. 红豆杉细胞在反应器中培养动力学的研究. 华中科技大学学报, 29(S1): 52–54. |
| [] | 张秀清, 方晓华, 杨国伟, 等. 2004. 烟草细胞培养生产辅酶Q_(10)的动力学研究. 中国农学通报, 19(4): 44–46, 61. |
| [] | Chen P S, Toribara T Y, Huber W. 1956. Microdetermination of phosphorus. Analynic Chemistry, 11(28): 1756–1759. |
| [] | Dubois M, Gilles K A, Hamilton J K. 1956. Colorimetric methods for thedetermination of sugar and related substances. Analytical Chemistry, 28(3): 350–357. DOI:10.1021/ac60111a017 |
| [] | Dong J, Zhan Y G. 2011. Effects of several physiochemical factors on cell growth and gallic acid accumulation of Acer ginnala Maxim cell suspension culture. African Journal of Biotechnology, 10(40): 7831–7839. DOI:10.5897/AJB |
| [] | Liu C Z, Guo C, Wang Y C. 2002. Effect of light irradiation on hairy root growth and artemisinin biosynthesis of Artemisia annua L. Process Biochemistry, 7(38): 581–585. |
| [] | Tolbert N E. 1980. The Biochemistry of Plants. New York, The Plant Cell, Academic Press: 437-488. |
| [] | Sun P, Li Y, Yang X J. 2003. Microwave technique extraction and determination of total flavonoids in Cistanche deserticola. Resand Practice of Chin Med, 2(6): 28–29. |
| [] | Venkatesh S, Luis P, Susan M. 1995. Taxol production in bioreactors:kinetics of biomass accumulation, nutrient uptake, and taxol production by cell suspensions of Taxus baccata. Biotechnology and Bioengineering, 6(18): 666–676. |
| [] | Wang L J, Zhang Z. 1998. Analytical Chemistry. Beijing, Chemistry Industry Publication: 351-353. |
| [] | Weatherbum M V. 1967. Phenol hypochlorite reaction for determination of ammonia. Analytical Chemistry, 8(39): 971–974. |
 2012, Vol. 48
2012, Vol. 48

