文章信息
- 王桂英, 杨敏生, 霍雪梅, 王艳平, 李珊珊
- Wang Guiying, Yang Minsheng1, Huo Xuemei, Wang Yanping, Li Shanshan
- 741杨双Bt基因的遗传转化及转基因株系的抗虫性*
- Transformation of 741 Poplar with Double Bt Genes and the Insect-Resistance of the Transgenic Plant
- 林业科学, 2012, 48(9): 42-49.
- Scientia Silvae Sinicae, 2012, 48(9): 42-49.
-
文章历史
- 收稿日期:2012-02-09
- 修回日期:2012-03-28
-
作者相关文章
2. 廊坊市农林科学院 廊坊 065000
2. Langfang Academy of Agriculture and Forestry Sciences Langfang 065000
植物基因工程为通过插入抗虫基因并表达毒蛋白创造抗虫植物提供了机会(Jouanin et al.,1998),自1987年比利时植物遗传公司的Vaeck等(1987)首次将苏云金芽孢杆菌(Bacillus thuringiensis,Bt)毒蛋白基因导入烟草(Nicotiana tabacum)中表现出对一龄烟草天蛾幼虫的抗性之后,抗虫转基因研究引发了人们极大的兴趣。在众多杀虫蛋白中,被广泛接受的是Bt毒蛋白,同化学杀虫剂相比其更具有环境安全性(Betz et al.,2000)。因此,尽管目前转基因生物体对环境的风险仍存争论,Bt植物仍然是一种有前途的化学杀虫剂的替代品并继续得到发展(Hails,2000)。Bt基因已经被广泛地用于多种植物的遗传转化,用来控制鳞翅目(Lepidoptera)、双翅目(Diptera)和鞘翅目(Coleoptera)的害虫。
近年来人们在Bt基因的修饰与改造、表达载体的构建、植物组织转化、抗虫植物的培育等方面做了大量工作(Génissel et al.,2003;王继磊等,2010)。随着Bt作物的大面积种植,有关目标昆虫产生抗性的报道也引起了人们的重视(Bates et al.,2005; Li et al.,2007; Liu et al.,2009)。第1代的抗虫植物只是将单一的Bt基因转入植物中表达,昆虫产生抗性的风险较高(Christou et al.,2006)。由于来源不同的抗虫基因各有其类型、杀虫机制及抗虫谱,因此第2代、第3代研究则尝试联合使用2种或2种以上的杀虫机制不同或特异性结合位点不同的抗虫基因转化植物(Gatehouse,2008),采用共转化、二次转化、杂交及构建双价或多价表达载体等方法获得双抗或多抗,发挥多基因的累加效应。如Bt基因(BtCry1A或BtCry3A)与各类蛋白酶抑制剂基因(CpTI,PI,API或OC-I)联合,转化棉花(Gossypium)、欧洲黑杨(Populus nigra)、741杨{ [Populus alba × (P. davidiana + P. simonii) ] × P. tomentosa}、银腺杨(P. alba × P. glandulosa)及三倍体毛白杨(P. tomentosa) (郭三堆等,1999; Guo et al.,2003;李明亮等,2000; 田颖川等,2000; 张冰玉等,2005; 杨敏生等,2006)。在同时表达2个Bt基因的研究上,Sachs等(1998)将分别含有Cry1Ab和Cry1Ac的棉花进行杂交,得到了同时含2种Bt毒蛋白的棉花,从而提高了抗虫性。还有将Cry1Ab和Cry1Ac构建成融合蛋白基因转入杂交水稻(Oryza sativa)的报道(Tu et al.,2000 )。本实验室已获得了同时表达BtCry1Ac基因和慈姑蛋白酶抑制剂基因API的741杨株系(田颖川等,2000; 郑钧宝等,2000),对鳞翅目害虫表现出了专一毒杀特性。为扩大其抗虫谱,获得对鳞翅目和鞘翅目害虫兼具抗性的741杨植株,本研究拟通过构建含BtCry3Aa基因的植物表达载体,采用根癌农杆菌(Agrobacterium tumefaciens)介导的二次转化法,再将BtCry3Aa基因导入,获得同时表达Cry1Ac + API和Cry3Aa基因的741杨。使昆虫难以同时对2种以上抗虫物质产生抗性,从而缓和抗性风险,提高转基因杨树的抗虫能力。
1 材料与方法 1.1 材料 1.1.1 植物材料普通杂种741杨及已转入BtCry1Ac + API基因的741株系pB29。以上材料均为本实验室保存。诱导叶片分化培养基为MS + 6-BA1. 0 mg·L-1 + NAA0. 1 mg·L-1,生根培养基为1 /2 MS + IBA0. 3 mg·L-1。农杆菌为YEB培养基,大肠杆菌(Escherichia coli)为LB培养基。
1.1.2 菌种、质粒、酶和生化试剂根癌农杆菌菌株LBA4404;真核表达载体pCAMBIA1305,TDNA区携带有CaMV35S启动子、NOS终止子及潮霉素磷酸转移酶基因(hpt)筛选标记; 质粒pBCC3(Cry3Aa /pBCC3/DH5α)。以上均为本实验室保存。大肠杆菌DH5α空菌株、克隆载体pUCm-T质粒和T4 DNA连接酶购自上海生物工程公司(Sangon)。限制性内切酶NcoⅠ /BstEⅡ、Taq DNA聚合酶、RNase A、DL2000核酸分子量标样和DNA胶回收试剂盒(UNIQ-10 Column Kit)等均购于TaKaRa公司。ELISA蛋白检测试剂盒购自美国Agdia公司。潮霉素(Hyg)、卡那霉素(Kan)、抑菌剂头孢噻腭钠(CTX)等其余常规药品均为进口或国产分析纯级。
1.1.3 PCR检测引物检测Cry1Ac基因及Cry3Aa基因的引物分别为F1,R1; F2,R2;扩增片段长度分别为595 bp和1 794 bp。均由本实验室保存。
F1: 5'-CAACCCGAACATCAACGAAT-3',
R1: 5'-GCCAATAAGCCTAGTTAAATCA-3';
F2: 5'-CCATGGCTGCTGATAACAACACGGA-3',
R2: 5'-GGTAACCTTAATTCACTGGAATGAACTC-3'。
1.2 方法 1.2.1 基本分子生物学操作与引物设计质粒DNA的提取、限制性内切酶酶切反应、琼脂糖电泳、目的片段的扩增、PCR产物与酶切产物的连接和转化、重组子的筛选等。引物设计采用DNAstar与Primer5. 0软件,根据已知Cry3Aa基因的核苷酸序列,设计扩增基因全长的特异性引物F3和R3,并在引物的5'端和3'端分别加入了限制性内切酶NcoⅠ /BstEⅡ酶切位点。引物由上海生工生物工程公司合成。序列如下(下划线处为克隆及鉴定酶切位点) :
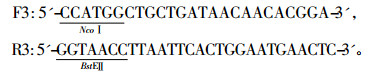
|
以Cry3Aa /pBCC3质粒载体为模板,扩增出Cry3Aa全长基因(1 794 bp)。用1%的琼脂糖凝胶电泳鉴定PCR产物,并将PCR产物连接到质粒pUCm-T载体中,得到中间载体T-Cry3Aa。将Cry3Aa通过NcoⅠ /BstEⅡ位点连接到pCAMBIA1305中,得到含Cry3Aa的植物表达载体pCAMBIA1305-Cry3Aa。采用冻融法将此载体转入农杆菌EHA105内,挑取单克隆转化子经限制性酶切鉴定无误后,用于杨树外植体的遗传转化。构建过程见图 1。
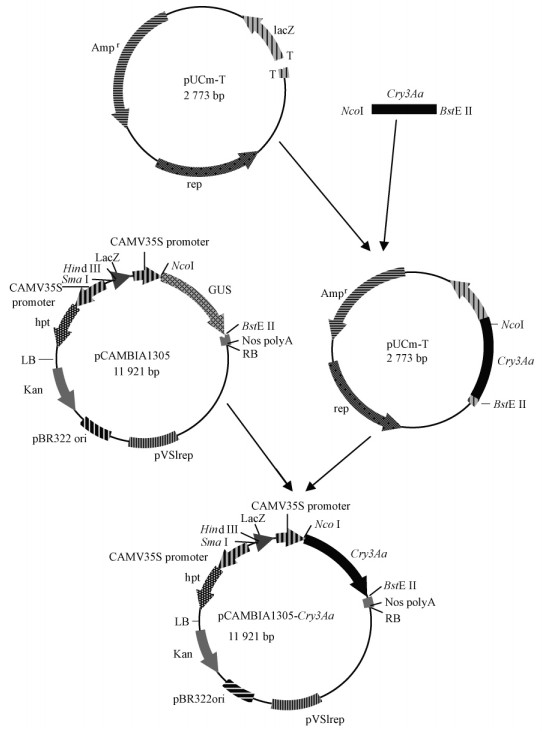
|
图 1 pCAMBIA1305-Cry3Aa植物表达载体构建流程 Fig.1 Construction procedure of the plant expression vector pCAMBIA1305-Cry3Aa |
取pB29无菌苗充分展开的幼嫩叶片,垂直于主脉横切3 ~ 5个深达主脉的伤口,用农杆菌菌液浸染10 min,不时轻摇菌液,使叶片与菌充分接触。取出叶片后用无菌滤纸吸干,置于不含选择压的共培养基上,28 ℃黑暗条件2 ~ 3天。共培养后无菌水清洗3次,转接到筛选培养基上光照培养。
1.2.4 转基因植株的PCR及ELISA毒蛋白检测获得Hyg抗性的苗生根后移栽大田,取1年生田间苗叶片,采用CTAB法提取基因组DNA,用Cry1Ac基因和Cry3Aa基因各自特异性引物进行PCR扩增。阳性对照模板为pCAMBIA1305- Cry1Ac-Cry3Aa质粒(在pCAMBIA1305-Cry3Aa的基础上引入Cry1Ac而得),阴性对照模板为未经转化的普通741杨和pB29基因组DNA; 蛋白检测阳性对照试剂盒自带,阴性对照为741。检测过程参照试剂盒的说明进行,用BioRad 550型酶标仪测定结果。
1.2.5 转基因植株的抗虫性测验用获得的双Bt转基因株系、pB29和对照741的1年生田间苗叶片饲喂柳蓝叶甲(Plagiodera versicolora)和美国白蛾(Hyphantria cunea)。每个处理选用大小一致的叶子,放置于干净带透气盖的组培用三角瓶中。柳蓝叶甲室内人工饲养,一龄幼虫(L1)刚孵化出5 h左右,三龄(L3)为刚从二龄(L2)蜕皮进三龄的幼虫; 布置虫数每瓶30头,设3次重复,每天调查1次。美国白蛾用一龄幼虫(L1)和四龄幼虫(L4)。一龄幼虫为从卵刚孵化出3 h左右的幼虫,体长1. 1 mm左右; 每瓶30头,设3次重复,每天调查1次。四龄幼虫为体长0. 9 cm,刚从三龄蜕皮进入四龄的幼虫; 每瓶15头,6次重复,隔天调查1次。计算多次重复的平均死亡率和死亡指数及标准差,死亡率=饲养末期的死亡总数/初期的饲养总数× 100%。死亡指数= ∑(天数×当天死亡数) /(总死亡数×总天数)。死亡指数越小,前期死亡比例越大,毒力越大; 死亡指数越大,后期死亡比例越大,毒力越小。
2 结果与分析 2.1 植物表达载体的鉴定 2.1.1 中间载体T-Cry3Aa的构建与检测以含有Cry3Aa基因的重组质粒pBCC3为模板,扩增得到Cry3Aa基因,与pUCm-T载体连接得到中间载体T-Cry3Aa。用NcoⅠ和BstEⅡ酶切此中间载体,电泳显示出1 794 bp和2 773 bp的2个片段,与Cry3Aa基因序列(1 794 bp)和T载体大片段(2 773 bp)大小相符(图 2a)。上述表明Cry3Aa基因已成功构建于载体T-Cry3Aa中。

|
图 2 用NcoⅠ和BstEⅡ酶切中间载体T-Cry3Aa和植物表达载体pCAMBIA1305-Cry3Aa检测 Fig.2 Identification of recombinant plasmid T-Cry3Aa and pCAMBIA1305-Cry3Aa digested with restriction endonuclease NcoⅠ and BstE Ⅱ |
分别用 Nco Ⅰ和BstE Ⅱ双酶切T-Cry3Aa和pCAMBIA1305,琼脂糖凝胶电泳回收Cry3Aa小片段和pCAMBIA1305大片段,用T4 DNA连接酶将2个片段连接,使Cry3Aa插到35S和NOS中间,得到35S-Cry3Aa-NOS表达框架,构建成重组质粒。用NcoⅠ和BstE Ⅱ酶切pCAMBIA1305-Cry3Aa,电泳结果显示出大小约1 794 bp和9 788 bp的条带,与Cry3Aa基因片段(1 794 bp)和p1305载体大片段(9 788 bp)相符合(图 2b)。上述表明Cry3Aa基因已成功构建于载体pCAMBIA1305中。
2.2 转基因植株的获得叶片在筛选培养基(分化培养基+ Hyg10 mg· L-1 + CTX400 mg ·L-1 )培养10天左右时,愈伤或绿色芽点出现,抗性芽因其体内含有潮霉素磷酸转移酶(hpt)基因,能在含有一定浓度Hyg的培养基上生长,而未转化的细胞则死亡。经多次筛选共获得9个转基因株系(霍雪梅,2009),编号为pCCA1— pCCA9。获得的抗性芽生根诱导后经炼苗移栽至大田定植。通过农杆菌介导的遗传转化获得转基因植株的过程如图 3。

|
图 3 转双Bt基因741杨无性系的再生过程 Fig.3 Regeneration of the transgenic 741 lines with double Bt gene a:共培养2天后叶片的状况; b:转化叶片在筛选培养基上产生抗性愈伤组织; c:愈伤组织分化出抗性芽; d:抗性芽增殖; e:转基因植株生根; f:转基因植株移栽至花盆中。 a: Leaves after 2 days'co-culture; b: Transgenic leaf callus; c: Shoots regenerated from callus; d: Shoots multiplication; e: The transgenic plants roots; f: Transplantation to flower pot. |
转基因植株经特异引物PCR扩增Cry1Ac基因,电泳检测如图 4a,各转基因株系均扩增得到1条与阳性质粒作模板PCR扩增条带大小相同的约600 bp的特异条带(引物扩增长度为595 bp)。说明各转基因株系中Cry1Ac基因稳定存在。各转基因植株经特异引物PCR扩增检测Cry3Aa基因(图 4b),均得到1条与质粒作模板条带大小一致的约1 800 bp的特异条带(引物扩增长度为1 794 bp),而pB29基因组未出现PCR扩增条带。证明外源Cry3Aa基因已整合到各无性系基因组中。

|
图 4 转双Bt基因741杨植株的PCR检测 Fig.4 PCR amplification of transgenic poplar plants with Cry1Ac and Cry3Aa genes a: PCR分析转双Bt基因741杨植株中Cry1Ac(595 bp)基因1.阳性对照; 2 - 10. pCCA1—9; 11. pB29; 12.阴性对照741杨。b: PCR分析转双Bt基因741杨植株中的Cry3Aa(1 794 bp)基因1 - 9. pCCA1—9; 10.阳性对照; 11.阴性对照pB29。M: DL 2 000 Marker. a: Cry1Ac gene (595 bp) PCR amplification of the transgenic 741 poplar 1. Positive control; 2 - 10. pCCA1—9; 11. pB29; 12. Negative control 741 poplar. b: PCR amplification of Cry3Aa gene(1 794 bp) from the transgenic 741 poplar 1 - 9. pCCA1—9; 10. Positive control; 11. Negative control pB29. M: DL 2 000 Marker. |
检测Cry1Ac蛋白用美国Agdia公司的Bt-Cry1Ab /1Ac ELISA蛋白检测试剂盒,检测结果pCCA1—9和pB29呈现蓝色阳性反应,对照741无显色反应,所测得毒蛋白含量如图 5a。检测Cry3Aa蛋白用美国Agdia公司的Bt-Cry3A ELISA蛋白检测试剂盒,检测结果pCCA1—9呈现黄色阳性反应,pB29及对照741无显色反应。所测得毒蛋白含量如图 5b。蛋白浓度以每克(g)新鲜叶片所含毒蛋白纳克数(ng)计算。横坐标p1—7代表pCCA1—7,p9代表pCCA9,p29代表pB29;无pCCA8,pCCA8移栽大田苗太少叶片不够布置试验用,未参与虫试及毒蛋白检测。
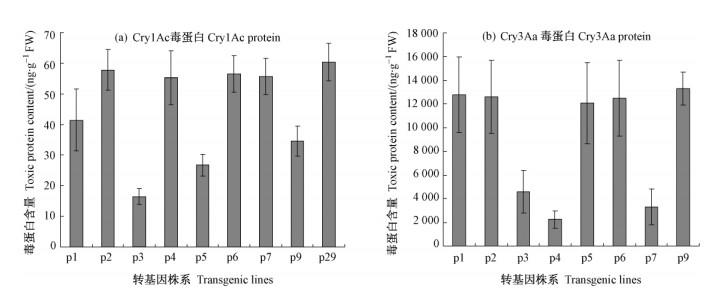
|
图 5 pC系列Cry1Ac和Cry3Aa毒蛋白含量 Fig.5 Cry1Ac and Cry3Aa toxic protein content p1—7. pCCA1—7; p9. pCCA9; p29. pB29. |
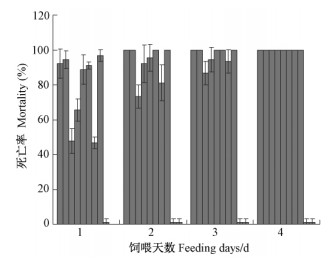
转基因叶片对柳蓝叶甲一龄虫(L1)和三龄虫(L3)均具有毒杀效果。取食pC系列叶片后,三龄虫4天(图 6)内、一龄虫2天内(表 1)全部死亡。而pB29(单抗鳞翅目)和对照741的死亡率只有1% ~ 3%。一龄虫取食1天时死亡率相对低的是pCCA3和pCCA7,分别为79%和89%;三龄虫取食1天时死亡率相对低的是pCCA3,pCCA4和pCCA7,分别为48%,66%和47%。虽然三龄虫随虫龄增大虫体抗性相对增强,但pCCA-1,2,6,9四个系号第2天致死率就达到了100%,pCCA5为96%,第3天也达到100%;而pCCA-3,4,7上的幼虫取食4天后才全部死亡。根据转基因叶片对柳蓝叶甲的致死率和死亡指数,在对鞘翅目的抗性上将pC系列划分为3类:高抗株系(pCCA-1,2,5,6,9);中抗株系(pCCA-4,7);低抗株系(pCCA3)。一龄虫取食1天后拍照如图 7(幼虫仍分散在叶片上),图中只选取了高、中、46低抗的部分系号,在pC系列中,可以看出pCCA3的取食面积最大。pCCA2和pCCA9叶片只有分散的取食斑痕,多数取食斑在放大镜下才明显看到。而pB29和对照741取食面积相当,30头一龄虫1天的取食就对叶片造成了明显的危害。
|
图 6 柳蓝叶甲三龄虫死亡率 Fig.6 Mortality of L3 P. versicolora 每一组柱形图从左到右依次为: pCCA1—7,pCCA9,pB29和741(CK)。Each group of histogram in proper order from left to right: pCCA1—7,pCCA9,pB29 and 741(CK). |
|
|

|
图 7 柳蓝叶甲一龄虫取食1天后的叶片 Fig.7 One-day-eating leaves by L1 P. versicolora |
用转基因叶片饲喂美国白蛾一龄幼虫,取食第1天死亡率在6% ~ 35%,与柳蓝叶甲一龄虫不同的是死亡高峰出现在第2天,3天后全部死亡(表 1)。说明转基因植株对于刚从卵孵化出的美国白蛾幼虫也具有很好的毒杀性。但从死亡率和死亡指数2项指标综合分析,pCCA1对美国白蛾的抗性是偏低的。
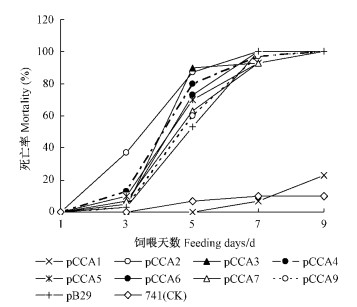
美国白蛾幼虫共有7个龄期,一至三龄幼虫吐丝结网,营群居生活,四龄以后开始分散。为研究转基因植株对于飘移来的四龄以上美国白蛾的抗虫性,取中间的四龄虫做饲喂试验。结果表明幼虫的抗性明显提高,死亡时间延长至7 ~ 9天。从四龄虫累积死亡率折线图(图 8)看出,pCCA2—7,pCCA9和pB29在第7 ~ 9天时死亡率达100%,而pCCA1在第7天和第9天时的死亡率分别只有7%和23%。从四龄虫可以明显看出pCCA1对美国白蛾的毒杀效果不佳,这与一龄虫的结果相吻合。所以按死亡率确定pC系列的pCCA2—7和pCCA9为高抗美国白蛾株系,pCCA1为低抗株系。
|
图 8 美国白蛾四龄虫累计死亡率 Fig.8 The mortality of L4 H. cunea |
转抗虫基因植物要想获得到较好的抗虫效果,Bt基因在植物中必须能得以高效表达(Estruch et al.,1997),许多研究表明转Bt基因植物中的毒蛋白的高效表达需要对Bt基因进行修饰改造(Perlak et al.,1991)。这一结论首先在许多转基因作物中被发现,后来在一些多年生植物中更加得以证实。741杨无性系pB29中的Cry1Ac基因是经过部分改造的(田颖川等,2000)。本试验所用Cry3Aa基因也经修饰改造,由组成型强表达启动子CaMV35S启动子和NOS终止子调控,并以hpt基因作为筛选标记基因。值得关注的是本研究中Cry3Aa蛋白表达量远远高于Cry1Ac蛋白表达,本实验室的其他转抗虫基因研究也证实了二者表达量的差别(田颖川等,2000;杨敏生等,2006; 牛小云等,2011),这种表达差别的原因有待进一步研究。另外组成型启动子能在所有细胞、任何时候进行转录,对转基因植株本身以及环境存在一定的影响,特异性启动子(组织特异型和诱导型启动子)平时不启动转录或转录活性很低,但在某些特定逆境信号的刺激下,转录活性能够显著地提高(朱丽萍等,2010),因此利用特异性启动子的研究也有待进行。
3.2 转基因植株中外源基因的表达与沉默本研究得到的pC系列741杨具有了双抗特性,在对鞘翅目柳蓝叶甲的抗性上,不同系号表现出了高、中、低抗的差异。所测Cry3Aa毒蛋白表达量与抗虫性表现一致,pCCA3,pCCA4和pCCA7抗虫性偏差,Cry3Aa毒蛋白含量也偏低。在对鳞翅目的抗性上,pCCA2—7,pCCA9与pB29表现一致,pCCA1理论上也应与pB29表现出一致抗性,因为原pB29本身是抗鳞翅目(含有BtCry1Ac基因和慈菇蛋白酶抑制剂API基因)的741杨转基因株系。但在美国白蛾的虫试中,pCCA1同pB29差别明显,pCCA1对四龄虫表现了极低的抗性。从Cry1Ac毒蛋白表达量来看,各系号差异较大。由此看来,BtCry3Aa 基因的插入对原基因组及蛋白表达产生了不同程度的影响。许多研究表明外源基因整合进植物的基因组后,其表达和稳定性与转基因的失活和沉默有关(Stam et al.,1997; Kilby et al.,1992; Wuet al.,2002)。转基因失活的机制有多种,如DNA甲基化、共抑制等(Wang et al.,2008; Meyer et al.,1994)。转基因沉默则指外源基因存在于生物体内,并未丢失或损伤,但该基因不表达或表达量极低的现象。转基因沉默可以发生在染色体DNA、转录和转录后3种不同的层次上(万小荣等,2011)。pC系列在抗虫性及毒蛋白表达上差异的具体原因尚需要进一步研究。
3.3 结论本研究在构建pCAMBIA1305-Cry3Aa植物表达载体的基础上,采用农杆菌介导法,将Cry3Aa基因转入已转Cry1Ac + API基因的杂种741毛白杨无性系pB29中,获得了含双Bt及API基因的pC系列。PCR及ELISA均检测到了双Bt基因的存在与表达。用转基因株系叶片进行柳蓝叶甲和美国白蛾饲虫试验结果表明,转基因植株对鳞翅目和鞘翅目具有双抗虫性。其中pCCA2,pCCA5,pCCA6和pCCA9具有双高抗; pCCA3,pCCA4和pCCA7对柳蓝叶甲表现出中低抗性,对美国白蛾则高抗; 而pCCA1表现对美国白蛾的极低抗性,对柳蓝叶甲则高抗。本研究首次获得既抗鳞翅目又抗鞘翅目的转双Bt 741杨,使得本品种对2类主要的林业害虫兼具抗性,为开展后续研究及在林业生产上的应用打下了基础。对转基因株系的荧光定量PCR检测及Southern,Northern,Western分析将于下一步深入进行。
| [] | 郭三堆, 崔洪志, 夏兰芹. 1999. 双价抗虫转基因棉花研究. 中国农业科学, 32(3): 1–7. |
| [] | 霍雪梅. 2009. 抗虫基因植物表达载体构建、遗传转化及表达研究. 保定: 河北农业大学硕士学位论文. |
| [] | 李明亮, 张辉, 胡建军. 2000. 转Bt基因和蛋白酶抑制剂基因杨树抗虫性的研究. 林业科学, 36(2): 93–97. DOI:10.11707/j.1001-7488.20000215 |
| [] | 牛小云, 黄大庄, 杨敏生. 2011. 转Btcry3A抗虫基因杨树中毒蛋白的时空表达. 林业科学, 47(12): 154–157. DOI:10.11707/j.1001-7488.20111223 |
| [] | 田颖川, 郑均宝, 虞红梅. 2000. 转双抗虫基因杂种741毛白杨的研究. 植物学报, 42(3): 263–268. |
| [] | 万小荣, 莫爱琼, 杨妙贤. 2011. 植物基因沉默机制研究进展. 安徽农业科学, 39(17): 10188–10189, 10347. DOI:10.3969/j.issn.0517-6611.2011.17.032 |
| [] | 王继磊, 刘迪秋, 丁元明. 2010. Bt转基因抗虫植物研究进展. 生物学杂志, 27(4): 75–78. |
| [] | 杨敏生, 李志兰, 王颖. 2006. 双抗虫基因对三倍体毛白杨的转化和抗虫性表达. 林业科学, 42(9): 61–68. |
| [] | 张冰玉, 苏晓华, 李义良. 2005. 转双价抗蛀干害虫基因杨树的获得及其抗虫性鉴定. 林业科学研究, 18(3): 364–368. |
| [] | 郑均宝, 梁海永, 高宝嘉. 2000. 转双抗虫基因741毛白杨的选择及抗虫性. 林业科学, 36(2): 13–19. DOI:10.11707/j.1001-7488.20000203 |
| [] | 朱丽萍, 于壮, 邹翠霞. 2010. 植物逆境相关启动子及功能. 遗传, 32(3): 229–234. |
| [] | Bates S, Zhao Jianzhou, Roush R, et al. 2005. Insect resistance management in GM crops: past, present and future. Nature Biotechnology, 23(1): 57–62. DOI:10.1038/nbt1056 |
| [] | Betz F S, Hammond B G, Fuchs R L. 2000. Safety and advantages of Bacillus thuringiensis protected plants to control insect pests. Regul Toxicol Pharmacol, 32(2): 156–173. DOI:10.1006/rtph.2000.1426 |
| [] | Christou P, Capell T, Kohli A, et al. 2006. Recent developments and future prospects in insect pest control in transgenic crops. Trends in Plant Science, 11(6): 302–308. DOI:10.1016/j.tplants.2006.04.001 |
| [] | Estruch J J, Carozzi N B, Desai N, et al. 1997. Transgenic plants: an emerging approach to pest control. Nature Biotechnology, 15(2): 137–141. DOI:10.1038/nbt0297-137 |
| [] | Gatehouse J. 2008. Biotechnological prospects for engineering insect resistant plants. Plant Physiology, 146(3): 881–887. DOI:10.1104/pp.107.111096 |
| [] | Génissel A, Leplé J C, Millet N, et al. 2003. High tolerance against Chrysomela tremulae of transgenic poplar plants expressing a synthetic cry3Aa gene from Bacillus thuringiensis ssp tenebrionis. Mol Breeding, 11(2): 103–110. DOI:10.1023/A:1022453220496 |
| [] | Guo Hongnian, Wu Jiahe, Chen Xiaoying, et al. 2003. Cotton Plants transformed with the activated chimeric Cry1Ac and API-B genes. Acta Botanica Sinica, 45(1): 108–113. |
| [] | Hails R S. 2000. Genetically modified plants—the debate continues. Trends in Ecology and Evolution, 15(1): 14–18. DOI:10.1016/S0169-5347(99)01751-6 |
| [] | Jouanin L, Bonade-Bottino M, Girard C, et al. 1998. Transgenic plants for insect resistance. Plant Science, 131(1): 1–11. DOI:10.1016/S0168-9452(97)00239-2 |
| [] | Kilby N J Nigel, Leyser H M O, Furner I J. 1992. Promoter methylation and progressive transgene inactivation in Arabidopsis. Plant Molecular Biology, 20(1): 103–112. DOI:10.1007/BF00029153 |
| [] | Li Guoping, Wu Kongming, Gould F, et al. 2007. Increasing tolerance to Cry1Ac cotton from cotton bollworm, Helicoverpa armigera, was confirmed in Bt cotton farming area of China. Ecological Entomology, 32(4): 366–375. DOI:10.1111/een.2007.32.issue-4 |
| [] | Liu Biao, Wang Liang, Zeng Qing, et al. 2009. Assessing effects of transgenic Cry1Ac cotton on the earthworm Eisenia fetida. Soil Biology & Biochemistry, 41(9): 1841–1846. |
| [] | Meyer P, Heidmann. 1994. Epigenetic variants of a transgenic petunia line show hyper-methylation in transgene-DNA: An indication for specific recognition of foreign DNA in transgenic plants. Mol Gen Genet, 243(4): 390–399. |
| [] | Perlak F J, Fuchs R L, Dean D A, et al. 1991. Modification of the coding sequence enhances plant expression of insect control protein genes. Proc Natl Acad Sci USA, 88(8): 3324–3328. DOI:10.1073/pnas.88.8.3324 |
| [] | Sachs E S, Benedict J H, Stelly D M, et al. 1998. Expression and segregation of gene encoding cry1A insecticidal protein in cotton. Crop Sciences, 38(1): 1–11. DOI:10.2135/cropsci1998.0011183X003800010001x |
| [] | Stam M, Mol J N M, Kooter J M. 1997. The silence of genes in transgenic plants. Annals of Bot, 79(1): 3–12. DOI:10.1006/anbo.1996.0295 |
| [] | Tu Jumin, Zhang Guoan, Datta K, et al. 2000. Field performance of transgenic elite commercial hybrid rice expressing Bacillus thuringiensis δ-endotoxin. Nature Biotechnology, 18(10): 1101–1104. DOI:10.1038/80310 |
| [] | Vaeck M, Reynaerts A, Hofte H, et al. 1987. Transgenic plants protected from insect attack. Nature, 328(2): 33–37. |
| [] | Wang Haihai, Wu Shenjie, Li Feifei, et al. 2008. Transgene silencing caused by 35S promoter methylation in upland cotton (Gossypium hirsutum). Cotton Science, 20(4): 274–280. |
| [] | Wu Gang, Cui Hairui, Shu Qingyao, et al. 2002. Transcriptional silencing and developmental reactivation of cry1Ab gene in transgenic rice. Science in China, 45(1): 68–78. |
 2012, Vol. 48
2012, Vol. 48


