文章信息
- 袁颖红, 樊后保, 李辉信, 刘文飞, 沈芳芳, 郭虎波
- Yuan Yinghong, Fan Houbao, Li Huixin, Liu Wenfei, Shen Fangfang, Guo Hubo
- 模拟氮沉降对杉木人工林土壤微生物的影响*
- Effects of Simulated Nitrogen Deposition on Soil Microorganism in a Chinese Fir Plantation
- 林业科学, 2012, 48(9): 8-14.
- Scientia Silvae Sinicae, 2012, 48(9): 8-14.
-
文章历史
- 收稿日期:2011-08-20
- 修回日期:2012-08-03
-
作者相关文章
2. 南京农业大学资源与环境科学学院 南京 210095;
3. 江西农业大学园林与艺术学院 南昌 330045
2. College of Resources and Environmental Sciences, Nanjing Agricultural University Nanjing 210095;
3. College of Landscape and Art, Jiangxi Agricultural University Nanchang 330045
土壤微生物是土壤的重要组成部分,在土壤的物质转化和能量流动中发挥着重要作用(Atlas,1984)。目前,大气氮沉降增加已成为全球变化的重要现象之一。随着我国经济快速发展,化肥及石化燃料使用量大幅增加,氮沉降量大幅上升,我国氮沉降的现状和发展趋势已引起国际关注(孙崇基,2001; Galloway et al., 2002)。长期增加的氮沉降改变了许多森林类型的生物地球化学循环已是事实。了解氮沉降对森林土壤微生物的影响及其机制对于森林和环境管理具有重要意义。国外关于土壤微生物对氮沉降的响应研究亦是近几年才起步,大部分研究结果表明,长期氮沉降增加能给土壤微生物带来不利影响(Lilleskov et al., 2001; 2002; Waldrop et al., 2004; Compton et al., 2004; Deforest et al., 2004),但有关氮沉降对亚热带杉木(Cunninghamia lanceolata)林土壤微生物的影响研究还未见报道。本研究通过野外模拟试验,探讨氮沉降增加对杉木人工林土壤微生物的影响,为研究氮沉降对亚热带森林生态系统的影响提供参考。
1 研究区概况研究区位于福建省三明市沙县官庄国有林场的白溪工区21林班8小班的南坡(117° 43' 29″ E,26°30'47″ N),属中亚热带季风气候,四季气温温暖适中,日照充足,年平均气温18. 8 ~ 19. 6 ℃,年平均降水量1 606 ~ 1 650 mm,全年无霜期271天。平均海拔200 m,土壤为山地红壤。试验林为1992年营造的杉木人工林,面积6 hm2。林下植被稀疏,以五节芒(Miscanthus floridulus)、芒萁(Dicranopteris olichotoma)和蕨(Pteridium aquilinum var. latiusculum)等为主,盖度3% ~ 5%。
2 研究方法2003年12月在研究区设置立地和林分条件相似的杉木人工林固定样地12块,样地面积均为20m×20m,样地设中心区和缓冲区,中心区面积15m×15m。2004年1月开始对12块样地中心区进行4种处理:对照N0(0kgN·hm-2a-1)、N1(60kgN·hm-2a-1)、N2(120kgN·hm-2a-1)和N3(240kgN·hm-2a-1),每种处理重复3次。每月月初以溶液的形式喷洒于样地中心区。按照处理水平的要求,将CO(NH2)2溶解在20L水中,以背式喷雾器在林地人工来回均匀喷洒。对照样地中心区喷施同样量的水。
2010年3月用土壤采样器在样地中心区多点(9点)混合采集土壤原状样品,分表层(0~20cm)、中层(20~40cm)和底层(40~60cm)进行采样,把土样密封后带回实验室,剔除植物残根和大于2mm的石子等杂物后,置于0~4℃冰箱待处理(1周)。
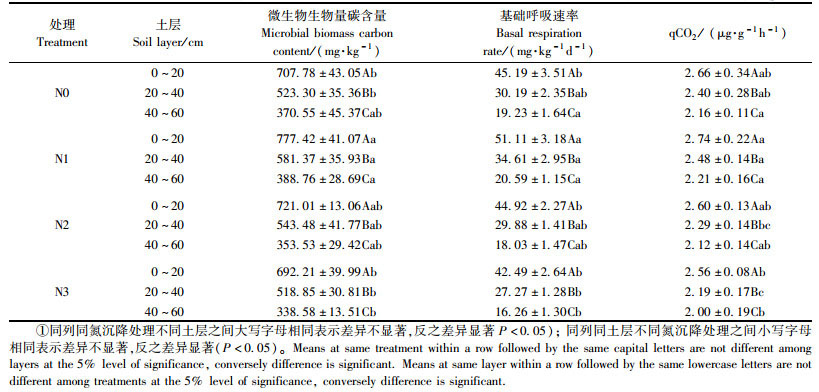
土壤微生物生物量碳表征土壤中微生物的数量,基础呼吸用于表征土壤中微生物的活性,而代谢熵则用于表征单位微生物对土壤有机碳的利用能力。土壤基础呼吸速率采用碱液吸收法测定; 土壤微生物生物量碳含量采用氯仿熏蒸K2SO4浸提法测定(Vance et al., 1987); 代谢熵qCO2为土壤基础呼吸速率与微生物生物量碳含量之比。
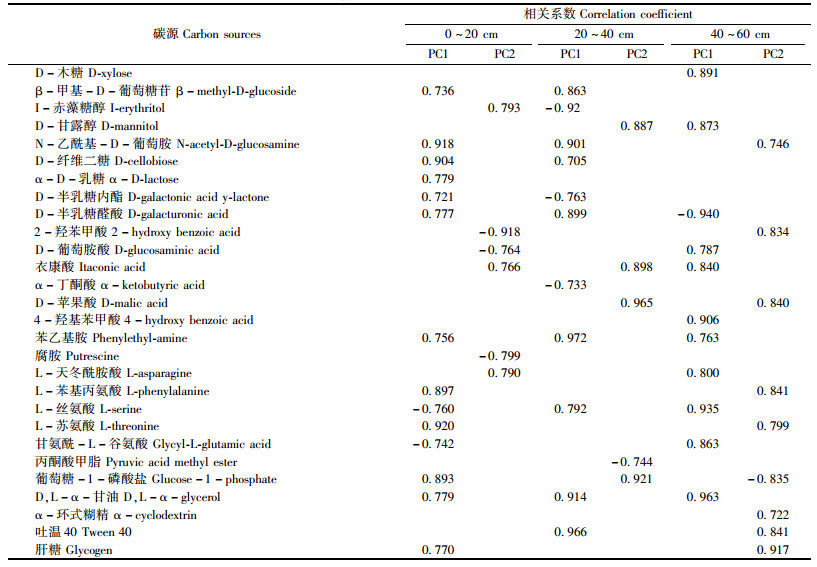
采用96孔BIOLOG ECO板(eco micro plate,美国Matrix Technologies Corporation生产)测定土壤微生物群落功能多样性。称取相当于5. 00g烘干土质量的鲜土,放在45 mL 0. 85%氯化钠溶液中,振荡30 min后,静置,倒出上清液,摇匀后加入eco micro plate中。每块板被划分为3个区,每个区除了1个孔不含碳源(空白)以外,其余31个孔分别含有不同的碳源(31种碳源分为6类:碳水化合物包括β - 甲基 - D - 葡萄糖苷、D - 木糖、I - 赤藻糖醇、D - 甘露醇、N - 乙酰基-D -葡萄胺、D - 纤维二糖和α - D - 乳糖; 羧酸包括D - 半乳糖内酯、D - 半乳糖醛酸、2 - 羟苯甲酸、4 - 羟基苯甲酸、y - 羟基丁酸、D - 葡萄胺酸、衣康酸、α - 丁酮酸和D - 苹果酸; 胺类包括苯乙基胺和腐胺; 氨基酸包括L - 精氨酸、L - 天冬酰胺酸、L - 苯基丙氨酸、L - 丝氨酸、L - 苏氨酸和甘氨酰- L -谷氨酸; 酚酸类化合物包括丙酮酸甲脂、α - 环式糊精、葡萄糖 -1 -磷酸盐和D,L - α-甘油; 多聚物包括吐温40、吐温80和肝糖)。每个孔中加样125 μL,25 ℃恒温培养(总共用了36块板)。吸光值(OD)测定时间为培养后第0,1,2,3,4,5,6和7天,每天上午10点测定)。平均颜色变化率(AWCD)表征微生物群落碳源利用率,AWCD =[∑(C -R) ]/31,C为反应孔(31个)的吸光值(OD),R为对照孔的吸光值。微生物Shannon-Wiener多样性指数H计算公式为H= -∑ Pi(InPi),Pi = (C-R)/∑(C -R)。微生物均匀度指数E计算公式为E = H / InR(Zak et al., 1994); H和E均选用培养的OD相对值进行计算(144 h后OD值趋于稳定); 并选用培养144 h时的土壤微生物群落碳源利用数据进行碳源主成分分析(PCA)。
相关指标的差异显著性检验采用SPSS13. 0统计软件进行。
3 结果与分析 3.1 氮沉降对土壤微生物生物量碳含量、基础呼吸速率和代谢熵的影响在各处理中土壤微生物生物量碳含量、基础呼吸速率和代谢熵随着土壤深度的增加而下降,即:表层>中层>底层。在各层次土壤中,随着氮沉降量的增加,各处理微生物生物量碳含量、基础呼吸速率和代谢熵先增加后下降(表 1)。
|
|
连续7天测得的平均颜色变化率(AWCD: average well color development)见图 1。从图 1中可以看出:平均颜色变化率随培养时间的延长而提高; 不同处理在开始的48小时都变化不大,表明这时各碳源未被利用或很少被利用,而在第48小时之后快速升高,反映出此期间各碳源被大量利用,至144小时后趋于稳定。在各处理中,平均颜色变化率随着土壤深度的增加呈下降趋势,表现为表层>中层>底层。在所有层次土壤中,随着氮沉降量增加平均颜色变化率先增加后下降,表现为N3<N2<N0<N1,即N1处理的微生物群落对碳源利用程度最高,N3处理的微生物群落对碳源利用程度最低。

|
图 1 平均颜色变化率(AWCD)动态 Fig.1 Dynamic of average well color development(AWCD) |
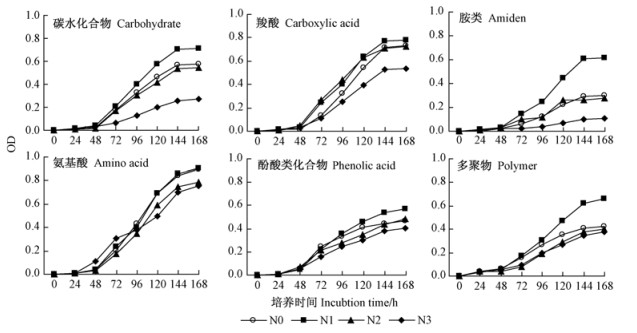
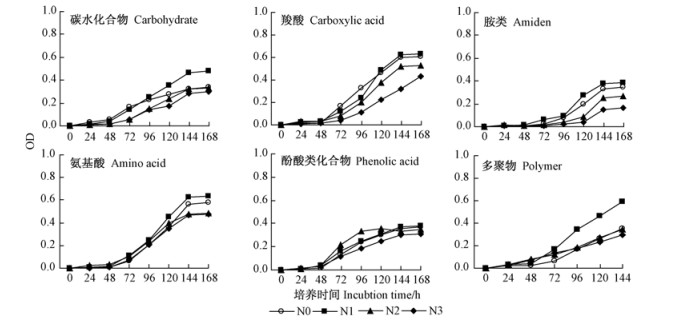
由图 2,3和4可知:在第0~48小时内,各处理各土层微生物群落对6类碳源利用的吸光值均较低,第48~144小时内各处理各土层微生物群落对6类碳源利用的吸光值增速较快,至第144小时趋于稳定。在各处理中,6类碳源利用的吸光值随着土壤深度的增加呈下降趋势,即:表层>中层>底层。N1处理的微生物群落对6类碳源的利用程度最高,N3处理利用程度最低,而N0与N2处理的微生物利用程度居中,即: N1>N0>N2>N3,这与平均颜色变化率一致。
|
图 2 0 ~ 20 cm土层不同处理土壤微生物群落对6类碳源利用的吸光值(OD)动态 Fig.2 Dynamics of absorption value (OD) for soil microbial community using six carbon sources under different treatments in 0 -20 cm soil layer |
|
图 3 20 ~ 40 cm土层不同处理土壤微生物群落对6类碳源利用的吸光值(OD)动态 Fig.3 Dynamics of absorption value (OD) for soil microbial community using six carbon sources under different treatments in 20 -40 cm soil layer |

|
图 4 40 ~ 60 cm土层不同处理土壤微生物群落对6类碳源利用的吸光值(OD)动态 Fig.4 Dynamics of absorption value (OD) for soil microbial community using six carbon sources under different treatments in 40 -60 cm soil layer |
在0~20 cm土层,各处理在整个培养期均表现为对碳水化合物、羧酸和氨基酸的利用程度较高,而对胺类、酚酸类化合物和多聚物的利用程度较低(图 2)。在20~40和40~60 cm土层,各处理在整个培养期均表现为对羧酸和氨基酸的利用程度较高,而对碳水化合物、胺类、酚酸类化合物和多聚物的利用程度较低(图 3,4)。
3.4 碳源主成分分析经PCA分析提取2个主成分: 0~20 cm土层的主成分1(PC1)代表了41. 66%的信息,主成分2最低。(PC2)代表了23. 45%的信息; 20~40 cm土层的PC1代表了36. 31%的信息,PC2代表了26. 06%的信息; 40~60 cm土层的PC1代表了37. 64%的信息,PC2代表了27. 68%的信息(图 5)。不同处理土壤微生物群落对碳源利用的表现为:在PC1上,N1处理的得分最高,其次为N0和N2处理,N3处理最低,表明N1处理对碳源利用有很大的反应; 在PC2上,各层次土壤表现各异。整体来看不同氮沉降处理分异较大,表现出经氮沉降处理后微生物群落的不稳定性。
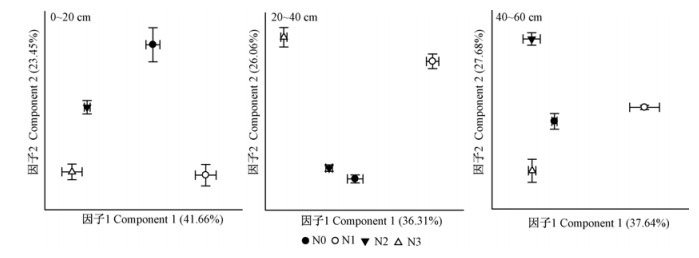
|
图 5 不同氮沉降处理的土壤微生物碳源利用类型的主成分分析 Fig.5 Principal components analysis for carbon utilization of soil microorganism under different treatments |
对不同氮沉降处理的碳源主成分进行分析,31种碳源中与PC1和PC2相关性较大的碳源有28种,如表 2所示。由表 2可知:在0~20 cm土层与PC1相关性较大的碳源有14种,对碳水化合物和氨基酸等碳源利用程度较高,而与PC2相关性较大的碳源有6种,对羧酸等碳源利用程度较高; 在20~40cm土层与PC1相关性较大的碳源有11种,对碳水化合物和羧酸等碳源利用程度较高,而与PC2相关性较大的碳源有5种,对羧酸和酚酸类化合物等碳源利用程度较高; 在40~60 cm土壤中与PC1相关性较大的碳源有11种,对碳水化合物、羧酸和氨基酸等碳源利用程度较高,而与PC2相关性较大的碳源有9种,对酚酸类化合物和多聚物等碳源利用程度较高。
|
|
随着土深增加,各处理土壤微生物ShannonWiener多样性指数与均匀度指数均下降。随着氮沉降量的增加,各土层土壤微生物多样性指数与均匀度指数均先增加后下降,即: N1>N0>N2>N3(表 3)。
|
|
氮沉降能间接或直接影响土壤微生物的生长繁殖和活动能力,土壤微生物的种类、数量、物种多样性、种群结构及其功能将会随之发生变化,进而对土壤中物质转化、土壤中营养物质有效性产生影响(Craig et al., 1995; Johnson,1992; Keency,1980)。本研究结果表明:低氮(N1)能促进土壤微生物生物量的增加,而高氮(N2和N3)则抑制土壤微生物生物量; 低氮处理的土壤微生物群落对碳源的利用能力较强,而不施氮处理次之,高氮处理最低; 主成分分析表明各处理的微生物群落对碳源的利用存在不同。由于氮增加改变了土壤中营养物质的有效性,也改变了微生物对底物(碳源)的利用模式,最终导致微生物群落组成发生变化(Biederbeck et al., 1996) :长期高氮沉降可以影响异养型微生物群落对底物利用的有效性,降低土壤微生物生产力(Deforest et al., 2004); Compton等(2004)在哈佛森林开展长期氮输入试验,研究表明氮增加均引起土壤微生物生物量碳含量的减少,降低了土壤微生物对底物利用率; 然而Johnson等(1992)研究表明氮增加可以显著增加微生物量和微生物活性,并且微生物对底物碳和氮的利用率提高了3倍; Frey等(2004)在哈佛森林开展氮沉降试验,研究表明阔叶林和混交林土壤微生物对底物的利用率与氮增加并没有明显关系。这些结果可能与森林类型、施氮时间、研究时期和施氮量等有关。
本研究表明低氮处理(N1)最有利于提高微生物群落Shannon-Wiener多样性指数与均匀度指数,高氮处理(N2和N3)反之。这可能是由于适量的氮肥有利于土壤微生物的生长,而高氮促进了某些微生物种群(如偏于利用植物残体的种群)同时抑制了其他种群,致使群落多样性指数与均匀度指数下降。在计算土壤微生物多样性指数时,本研究利用的是培养144 h时的光密度值,不同的研究报道中所采用的时间和方法并不统一(王纪杰等,2008; 张逸飞等,2006; Grove et al., 2004)。本研究中,土壤微生物生物量在144 h处于对数期,之后进入稳定期,采用144 h时的吸光值(OD)进行分析更真实地反映了实际情况。总的来说,低氮(N1)对土壤微生物具有促进作用,高氮则表现为抑制作用。由此可以推断,目前我国一些地区的高氮沉降(侯爱敏等,2002; 刘菊秀等,2001; 周国逸等,2001)势必会对森林土壤微生物群落产生影响。
| [] | 侯爱敏, 彭少麟, 周国逸. 2002. 鼎湖山地区马尾松年轮元素含量与酸雨的关系. 生态学报, 22(9): 1552–1559. |
| [] | 刘菊秀, 周国逸, 温达志. 2001. 酸沉降影响下广东陆地生态系统表层土壤特征. 农业环境保护, 20(4): 231–234. |
| [] | 孙崇基. 2001. 酸雨. 北京, 中国环境科学出版社: 1-213. |
| [] | 王纪杰, 徐秋芳, 姜培坤. 2008. 毛竹凋落物对阔叶林土壤微生物群落功能多样性的影响. 林业科学, 44(9): 146–151. DOI:10.11707/j.1001-7488.20080926 |
| [] | 张逸飞, 钟文辉, 李忠佩. 2006. 长期不同施肥处理对红壤水稻土酶活性及微生物群落功能多样性的影响. 生态与农村环境学报, 22(4): 39–44. |
| [] | 周国逸, 闫俊华. 2001. 鼎湖区域大气降水特征和物质元素输入对森林生态系统存在和发育的影响. 生态学报, 21(12): 2002–2012. DOI:10.3321/j.issn:1000-0933.2001.12.006 |
| [] | Atlas R M. 1984. Diversity of microbial community. Advanced Microbiology Ecology, 7: 1–47. |
| [] | Biederbeck V O, Campbell C A, Ukrainetz H. 1996. Soil microbial and biochemical properties after ten years of fertilization with urea and anhydrous ammonia. Canadian Journal of Soil Science, 76(1): 7–14. DOI:10.4141/cjss96-002 |
| [] | Compton J E, Watruda L S, Porteousa L A. 2004. Response of soil microbial biomass and community composition to chronic nitrogen additions at Harvard forest. Forest Ecology and Management, 196(1): 143–158. DOI:10.1016/j.foreco.2004.03.017 |
| [] | Craig L M, Dobbs F C, Tiedje J M. 1995. Phylogenetic diversity of the bacterial community from a microbial mat at an active, Hydrothermal vent system, Loihi Seamount, Hawaii. Applied and Environmental Microbiology, 61(4): 1555–1562. |
| [] | Deforest J L, Zaka D R, Pregitzerc K S. 2004. Atmospheric nitrate deposition and the microbial degradation of cellobiose and vanillinin a northern hardwood forest. Soil Biology and Biochemistry, 36(6): 965–971. DOI:10.1016/j.soilbio.2004.02.011 |
| [] | Frey S D, Knoor M, Parrent J L. 2004. Chronic nitrogen enrichment affects the structure and function of the soil microbial community in temperate hardwood and pine forests. Forest Ecology and Management, 196(1): 159–171. DOI:10.1016/j.foreco.2004.03.018 |
| [] | Galloway J N, Cowling E B. 2002. Reactive nitrogen and the world: 200 years of change. Ambio, 31(2): 64–71. DOI:10.1579/0044-7447-31.2.64 |
| [] | Grove J A, Kautola H, Javadpour S. 2004. Assessment of changes in the microorganism community in a biofilter. Biochemecal Engineering Journal, 18(2): 111–114. DOI:10.1016/S1369-703X(03)00182-7 |
| [] | Johnson D W. 1992. Nitrogen retention in forest soils. Journal of Environmental Quality, 21(1): 1–12. |
| [] | Keency D R. 1980. Prediction of soil nitrogen availability in forestecosystems: a literature review. Forest Science, 26(1): 159–171. |
| [] | Lilleskov E A, Fahey T J, Lovett G M. 2001. Ectomycorrhizal fungal aboveground community change over an atmospheric nitrogen deposition gradient. Ecological Applications, 11(2): 397–410. DOI:10.1890/1051-0761(2001)011[0397:EFACCO]2.0.CO;2 |
| [] | Lilleskov E A, Hobbie E A, Fahey T J. 2002. Ectomycorrhizal fungal taxa differing in response to nitrogen deposition also differ in pure culture organic nitrogen use and natural abundance of nitrogen isotopes. New Phytologist, 154(1): 219–231. DOI:10.1046/j.1469-8137.2002.00367.x |
| [] | Waldrop M P, Zaka D R, Sinsabaugh R L. 2004. Microbial community response to nitrogen deposition in northern forest ecosystems. Soil Biology and Biochemistry, 36(9): 1443–1451. DOI:10.1016/j.soilbio.2004.04.023 |
| [] | Zak J C, Willig M R, Moorhead D L. 1994. Functional diversity of microbial communities: a quantitative approach. Soil Biology and Biochemistry, 26(9): 1101–1108. DOI:10.1016/0038-0717(94)90131-7 |
 2012, Vol. 48
2012, Vol. 48