文章信息
- 崔琴琴, 韩小娇, 陈益存, 占志勇, 林丽媛, 汪阳东
- Cui Qinqin, Han Xiaojiao, Chen Yicun, Zhan Zhiyong, Lin Liyuan, Wang Yangdong
- 油桐生物素羧基载体蛋白编码基因VfBCCP的克隆与表达分析
- Isolation and Expression Characteristics of Biotin Carboxyl Carrier Protein Coding Gene(VfBCCP) from Vernicia fordii
- 林业科学, 2012, 48(8): 155-160.
- Scientia Silvae Sinicae, 2012, 48(8): 155-160.
-
文章历史
- 收稿日期:2012-04-11
- 修回日期:2012-06-18
-
作者相关文章
油桐(Vernicia fordii)属于大戟科(Euphorbiaceae)油桐属植物,原产于我国,是世界上著名的木本工业油料树种。其种子榨出的桐油是品质最好的天然干性油之一。桐油具有干燥快、抗酸碱、耐冷热、防腐蚀等特性,作为重要的工业用油广泛应用于制造涂料、高级油墨、增塑剂、医药以及化学试剂等行业(黄挺,2001;Brown et al., 2005)。同时油桐作为生物柴油原料树种具有良好的应用前景(钱能志等,2007;Shang et al., 2010;Chen et al., 2010)。在油桐种子生长发育过程中,7月为桐油的缓慢形成期,7月底到9月初为桐油的迅速累积期,而9月初至10月中旬为桐油累积完成期(王汉涛等,1985)。桐油中桐酸占脂肪酸总量的80%左右,是决定桐油性质的主要成分(何方等,2005)。因此,研究桐酸生物合成途径相关的调控基因对于油桐分子改良具有重要的理论和实际指导意义。
乙酰辅酶A羧化酶(ACCase)参与长链脂肪酸合成的第1步,催化乙酰辅酶A生成丙二酸单酰辅酶A,是植物脂肪酸合成的关键酶和限速酶(Slabas et al., 1992;Thelen et al., 2002a)。ACCase酶主要由生物素羧化酶(BC)、生物素羧基载体蛋白(BCCP)、羧基转移酶α-CT和β-CT 4种亚基构成。其中BCCP蛋白是连接ACCase酶另外3个亚基的纽带和桥梁,在乙酰CoA羧化反应中起着重要的作用。Choi等(1995)首次从拟南芥(Arabidopsis thaliana)中克隆到了BCCP基因,Thelen等(2002b)构建了拟南芥BCCP2基因的反义表达载体与超表达载体并转化拟南芥,研究表明BCCP蛋白在转基因拟南芥中表达量变化与ACCase酶的活性以及种子油脂含量密切相关。随后在大豆(Glycine max)(Reverdatto et al., 1999)、欧洲油菜(Brassica napus)(Thelen et al., 2001;戴晓峰等,2007)、花生(Arachis hypogaea)(李孟军等,2009)、陆地棉(Gossypium hirsutum)(Qiao et al., 2007)和麻疯树(Jatropha curcas)(Gu et al., 2011)等多种植物中分离出此基因,并将陆地棉BCCP1基因转化拟南芥(刘正杰等,2011),但是关于油桐BCCP基因方面的研究还未有文献报道。为研究油桐种子桐油合成规律以及分离重要调控基因,本实验室前期构建了高质量的油桐种仁cDNA文库(周冠等,2009),从中发现了1条BCCP基因片段,经分析确认为全长cDNA序列,本文对其进行了生物信息学分析。同时,为了分析其内含子,又从油桐基因组DNA中分离出了油桐BCCP基因组序列。此外,利用建立的实时荧光定量PCR内参体系,探讨了油桐BCCP基因在油桐不同发育时期种子中的表达规律,并分析了不同时期油桐种仁脂肪酸含量变化规律,为进一步研究油桐BCCP基因在油桐脂肪酸生物合成中的调控作用奠定基础。
1 材料与方法 1.1 材料随机选取油桐品种‘陈家圩9-24’(种植于1978年)的种子为试材。于2011年盛花期10周后即桐油开始形成时采样,采自浙江省金华市婺城区东方红林场国家级油桐基因库。从7月16日开始,每次取3个单株果实,每个单株取3个果实,此后每隔10~15天取1次,共6个发育时期。果实采集后去果皮,将种子立即用液氮速冻,存于-80 ℃冰箱备用。
RNA提取试剂盒(RN38 EASYspin plus Plant RNA kit)购自北京艾德莱生物科技有限公司,SuperScriptⅢ反转录试剂盒购自Invitrogen公司,Taq DNA聚合酶、DNA凝胶回收试剂盒、大肠杆菌DH5α感受态细胞、pMD-18T Simple Vector和荧光定量试剂盒SYBR PrimeScript TM RT-PCR Kit均购自Takara公司。所有引物合成及DNA序列测定均由上海生物工程技术服务有限公司合成。ABI7300实时定量PCR仪、索氏抽提器B-811与Agilent 6890N气相色谱仪带氢火焰离子化检测器(FID)分别购自Applied Biosystems公司、瑞士BUCHI公司与Agilent公司。37种脂肪酸甲酯混合标样纯度为96.9%~99.9%,购自Sigma公司;异辛烷、甲醇:色谱纯,购自美国天地试剂公司;氢氧化钾:优级纯,购自天津市科密欧化学试剂开发中心;石油醚、一水硫酸氢钠:分析纯,购自国药集团化学试剂有限公司。
1.2 方法1) 油桐BCCP基因cDNA序列分离 在本实验室构建的油桐种仁cDNA文库的基础上,将cDNA文库中的BCCP基因的克隆进行活化,对重组子进行T7和SK双向测序,并应用软件Vector NTI 910分析测序结果,在网上进行BLAST X比对分析。
2) 油桐BCCP基因组DNA序列克隆 以油桐叶片为材料,采用CTAB法进行油桐基因组DNA的提取。根据油桐BCCP基因cDNA序列设计特异引物BCCP-F(5′-ATGGCATCCATATCGGTT-3′)和BCCP-R (5′-GAGGTTTCCTTGGATCACGA-3′),以油桐基因组DNA为模板,94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火40 s,72 ℃延伸50 s,共35个循环;最后72 ℃延伸7 min进行PCR扩增。经1%琼脂糖凝胶电泳分析后回收目的条带,连接到克隆载体pMD18-T中,并转化感受态大肠杆菌(Escherichia coli)DH5α,37 ℃过夜培养后挑取单菌落,进行菌液PCR检测,将阳性结果送至上海生物工程技术服务有限公司测序。
3) 油桐种仁RNA提取与实时荧光定量PCR分析 将-80 ℃保存的油桐种子迅速取出,去除种皮,在液氮中研磨种仁,按照艾德莱公司的RNA提取试剂盒说明书,提取油桐品种‘陈家圩9-24’6个发育时期的种子RNA,设置2个生物学重复。用NanoDrop2000微量分光光度计测定RNA浓度,并进行1%琼脂糖电泳分析其完整性。反转录时各取RNA 3 μg,使用Superscript Ⅲ first strand synthesis system反转录合成一链,合成后的cDNA稀释30倍,用于实时荧光定量PCR。
根据BCCP基因cDNA全长序列设计实时荧光定量PCR引物BCCP-RTF(5′-GCATCTGCTCC TCCAAGTTC-3′)和BCCP-RTR(5′-TCACAAAT GGAGGTTCACCA-3′)。以油桐泛素蛋白基因Ubiquitin(JQ680041)为内参,设计其特异性引物UBQ-RTF(5′-CCGTGGTGGCTGTTAAGTTT-3′)和UBQ-RTR(5′-AAGGCCATTTCAACATCCTG-3′)。反应在ABI7300实时定量PCR仪上进行,方法参照荧光定量试剂盒SYBR PrimeScript TM RT-PCR Kit说明书。荧光定量PCR扩增的反应体系为:cDNA模板2 μL,2×SYBR Premix Ex TaqTM 10 μL,特异引物(10 μmol·L-1)0.4 μL,50×ROX Reference Dye 0.4 μL,用水补足20 μL。PCR扩增条件为:95 ℃ 30 s预变性后,95 ℃变性5 s,60 ℃复性31 s,共40个循环,同时对Real-time PCR产物进行SYBR熔解曲线分析,每个试样平行做4次反应,重复试验2次,并参考Pfaffl(2001)的方法进行数据分析。
4) 桐油提取与脂肪酸成分分析 利用索氏抽提法(魏红等,2004)进行油桐品种‘陈家圩9-24’6个发育时期种仁油脂的提取。随后称取桐油60 mg左右至具塞试管中,用4 mL异辛烷溶解,加2 mol·L-1的KOH-CH3OH溶液200 μL,盖上玻璃塞猛烈振摇30 s进行甲酯化,静置至澄清,加入1 g Na2HSO4·H2O猛烈振摇15 s,盐沉淀后取上清液待测定。色谱条件为HP-INNOWAX毛细管色谱柱(30 m×0.25 μm×0.25 μm);程序升温:初始温度140 ℃,保持1 min,以4 ℃·min-1升至250 ℃,保持5 min;进样口温度220 ℃,进样量1 μL;载气为高纯氮气,纯度≥99.999%。各组分参考标准品出峰情况进行定性,定量按峰面积归一化法计算各峰面积的相对含量。
5) 生物信息学分析 在瑞士生物信息学研究所网站(http://us.Expasy.org/)上运用Compute pI /Mw软件对目的基因编码蛋白等电点和分子量进行预测。使用SignalP 4.0 Server(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽分析。用DNAMAN软件对其二级结构和疏水性预测分析,并进行多序列比对和同源性分析。利用丹麦科技大学(DTU)的CBS服务器上的TMHMM Server v. 2.0(http://www.cbs.dtu.dk/services/TMHMM/)程序进行蛋白序列跨膜区分析。
2 结果与分析 2.1 油桐VfBCCP基因cDNA及DNA序列分析对油桐种仁cDNA文库中发现的BCCP片段进行测序分析,最终确认为全长cDNA序列,该基因长度为1 023 bp,命名为VfBCCP,GenBank登录号为JQ736807(公开日期为2013年6月30日)。该基因含有1个759 bp的开放读码框,5′非翻译区长82 bp,3′非翻译区长182 bp,共编码252个氨基酸。
根据VfBCCP基因cDNA序列设计特异性引物,以油桐基因组DNA为模板分离到了VfBCCP基因组序列,长度为2 157 bp,GenBank登录号为JX171700。序列比对后发现(图 1),油桐VfBCCP基因含有5个内含子(A, B, C, D, E),长度与位置分别为718 bp(128 bp—845 bp),100 bp(1 001 bp—1 100 bp),159 bp(1 419 bp—1 577 bp),194 bp(1 648 bp—1841 bp)和85 bp(1 907 bp—1 991 bp)。
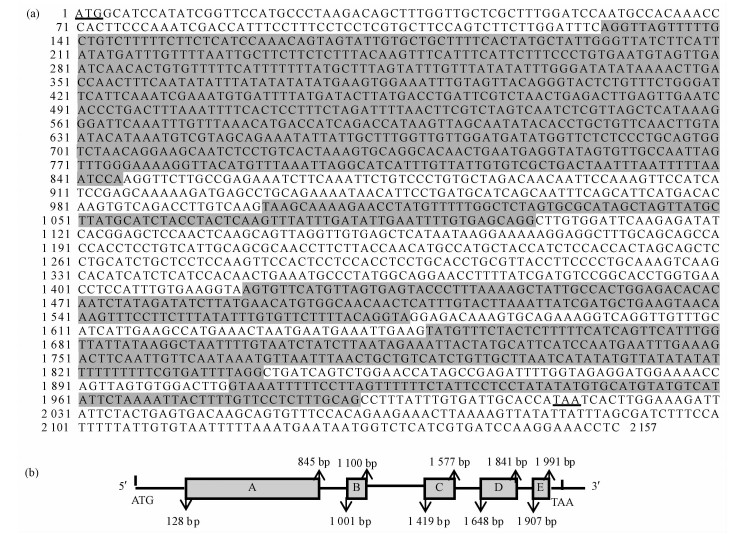
|
图 1 VfBCCP内含子序列(a)与结构(b) Fig.1 Intron sequence(a) and structure(b) of VfBCCP ATG是起始密码子,TAA是终止密码子,阴影部分代表内含子。A,B,C,D,E为5个内含子区。 ATG is initiation codon, TAA is stop codon, and the shaded letters represent introns. A, B, C, D, E are five introns. |
对油桐VfBCCP编码蛋白进行序列分析,预测其等电点为5.76,分子量为26 496.6 u。信号肽分析表明VfBCCP蛋白没有信号肽,是一个非分泌性蛋白。其疏水性结果显示,疏水性最大值为2.91,最小值为-3.25,大部分区域为亲水区。经过二级结构预测,VfBCCP蛋白由62个ɑ螺旋,23个延伸链和167个随意卷曲构成,它们分别占到24.60%,9.13%和66.27%,说明VfBCCP编码蛋白主要以无规则卷曲为主,含少量的α螺旋,间或有直链。跨膜区分析发现,VfBCCP蛋白无明显跨膜区,不可能是膜上的受体或定位于膜上。油桐VfBCCP蛋白与部分植物蛋白质序列进行比对(图 2)及亲缘关系分析(图 3)表明,油桐VfBCCP蛋白具有生物素化结构域(EAMKLMN),并且与大戟科油料植物麻疯树和蓖麻(Ricinus communis)的同源性最高,分别为85.6%和80.8%,而与欧洲油菜同源性最低,只有53.4%。

|
图 2 油桐VfBCCP与其他植物BCCP氨基酸序列同源性比较 Fig.2 Homology comparison of BCCP in Vernicia fordii and other plants Jc:麻疯树Jatropha curcas; Vf:油桐Vernicia fordii; Rc:蓖麻Ricinus communis; Bn:油菜Brassica napus.方框部分为生物素化结构域。The box represents biotinylation domain. |

|
图 3 VfBCCP与其他植物BCCP的进化关系 Fig.3 Phylogenetic tree based on BCCP of Vernicia fordii and other species |
为了分析VfBCCP在种子成熟过程中的时间表达规律,以油桐泛素蛋白基因Ubiquitin为内参,采取实时荧光定量PCR的方法,对油桐品种‘陈家圩9-24’种子6个发育时期的VfBCCP表达水平进行了分析。从图 4中可以看出,VfBCCP在7月份表达量较低,进入8月份表达量迅速升高为7月的5~8倍,到9月份表达量有所下降,表明VfBCCP的表达与桐油形成规律相一致。
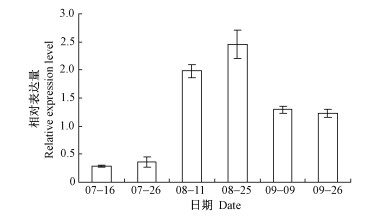
|
图 4 不同发育时期VfBCCP基因的表达分析 Fig.4 Expression levels of VfBCCP at different developmental stages |
此外,为了初步探索VfBCCP基因与油桐脂肪酸合成的相关性,对油桐品种‘陈家圩9-24’6个发育时期的种子进行了油脂提取,并做了脂肪酸成分分析。通过对不同时期油桐种仁脂肪酸含量分析(图 5)显示,在脂肪酸合成过程中,桐酸含量呈上升趋势,到9月底占脂肪酸总量的75.8%,表明油桐脂肪酸的积累过程虽然包含其他脂肪酸的积累,但主要是桐酸的积累过程。VfBCCP在种子油脂合成过程中的表达情况与桐酸的积累趋势相类似,预示着VfBCCP参与了油桐脂肪酸的积累过程。

|
图 5 不同时期油桐种仁脂肪酸含量变化 Fig.5 The variation of fatty acids contents in tung kernels at different developmental stages |
乙酰辅酶A羧化酶(ACCase)催化种子脂肪酸生物合成的第1步骤,是最关键的限速步骤。Davis等(2000)的研究表明,ACCase的BC,BCCP,α-CT,β-CT亚基中任何一个亚基的基因超量表达都能提高ACCase的活性,并对脂肪酸合成率有所提高。作为ACCase的重要组成部分,BCCP蛋白负责将羧基从生物素羧化酶(BC)转移到羧基转移酶(CT)上,对于脂肪酸合成起着纽带和桥梁的作用。
BCCP亚基在生物素酰化位点周围存在一个保守区域,即生物素化结构域。研究表明生物素结合位点的保守序列是植物ACCase所共有的(Choi et al., 1995;Thelen et al., 2001;刘正杰等,2011)。Thelen等(2000)从欧洲油菜中克隆得到的BCCP氨基酸序列具有完整的生物素化结构域(EAMKLMN),李孟军等(2009)从花生中克隆出2个BCCP基因(accB1和accB2),其编码蛋白都具有生物素酰化基序(EAMKLMN)。戴晓峰等(2007)从甘蓝型油菜(Brassica napus)中克隆到3个BCCP基因,只有BCCP1基因编码的蛋白质具备完整的生物素化功能结构域(EAMKLMN),而BCCP2和BCCP3由于移码突变其编码蛋白都缺少生物素化结构域,因此不具有生物素化的功能。本研究对油桐VfBCCP氨基酸序列的保守区进行分析发现,VfBCCP同样具有EAMKLMN这一保守区域,推测其具有生物素化的功能,能够参与乙酰辅酶A羧化反应。
通过实时荧光定量PCR分析,VfBCCP表达规律与油桐种仁油脂形成规律相一致。同样,在种子油脂合成过程中相关基因的表达分析也表现出类似的结果。Pastor(2011)对油桐油脂合成相关基因VfFADX(油酸脱氢酶)与VfDGAT2(二酰基甘油酰基转移酶)进行表达分析得出,VfFADX与VfDGAT2在7月表达量较低,到8月中旬表达量迅速升高,进入9月份表达量开始下降。此外,方嘉兴等(1998)分析了不同时期油桐干种仁的脂肪酸含量变化,其中作为桐油主要成分的桐酸在脂肪酸合成过程中呈上升趋势,而其他脂肪酸如棕榈酸、亚油酸及亚麻酸含量都呈下降趋势。本文对油桐品种‘陈家圩9-24’种子6个发育时期种仁脂肪酸成分进行了分析,获得的脂肪酸合成趋势与方嘉兴等(1998)的研究结果基本一致,在脂肪酸合成过程中,唯有桐酸含量呈上升趋势。VfBCCP是油桐脂肪酸合成的关键酶,而桐酸是油桐脂肪酸的主要成分,是受VfBCCP间接调控形成的主要的脂肪酸,VfBCCP在种子油脂合成过程中的表达情况与桐酸的积累趋势相类似,推测VfBCCP参与了油桐脂肪酸的合成过程。本试验将进一步通过调控VfBCCP的表达深入研究其在桐酸合成以及桐油累积过程中的作用,为实现油桐的遗传改良奠定基础。
| [] | 戴晓峰, 卢长明, 吴刚, 等. 2007. 甘蓝型油菜生物素羧基载体蛋白基因的克隆与结构分析. 中国农业科学, 40(9): 1883–1889. |
| [] | 方嘉兴, 何方. 1998. 中国油桐. 北京, 中国林业出版社: 113-115. |
| [] | 何方, 何柏, 王承南, 等. 2005. 油桐产品质量等级标准制订说明. 经济林研究, 23(4): 118–122. |
| [] | 黄挺. 2001. 中国油桐业前景广阔. 世界农业(8): 18–19. |
| [] | 李孟军, 夏晗, 王兴军, 等. 2009. 花生野生近缘种生物素羧基载体蛋白基因的克隆与结构分析. 华北农学报, 24(6): 6–10. DOI:10.7668/hbnxb.2009.06.002 |
| [] | 刘正杰, 张园, 王彦霞, 等. 2011. 陆地棉异质型ACCase基因的种子特异表达载体构建与遗传转化. 分子植物育种, 9(3): 270–277. |
| [] | 钱能志, 费世民, 韩志群. 2007. 中国林业生物柴油. 北京, 中国林业出版社: 182-196. |
| [] | 王汉涛, 段聪仁, 徐树华, 等. 1985. 油桐种仁与油脂形成规律的研究. 经济林研究, 3(2): 29–35. |
| [] | 魏红, 钟红舰, 汪红. 2004. 索氏抽提法测定粗脂肪含量的改进. 中国油脂, 29(6): 52–54. |
| [] | 周冠, 汪阳东, 陈益存, 等. 2009. 油桐种仁cDNA文库的构建及其油体蛋白oleosin基因的生物信息学分析. 林业科学研究, 22(2): 177–181. |
| [] | Brown K, Keeler W. 2005. The History of Tung Oil. Wildland Weeds, 9(1): 4–24. |
| [] | Chen Y H, Chen J H, Chang C Y, et al. 2010. Biodiesel production from tung(Vernicia montana)oil and its blending properties in different fatty acid compositions. Bioresource Technology, 101(24): 9521–9526. DOI:10.1016/j.biortech.2010.06.117 |
| [] | Choi J K, Yu F, Wurtele E S, et al. 1995. Molecular cloning and characterization of the cDNA coding for the biotin-containing subunit of the chloroplastic acetyl-coenzyme A carboxylase. Plant Physiol, 109(2): 619–625. DOI:10.1104/pp.109.2.619 |
| [] | Davis M S, Solbiati J, Cronan J E. 2000. Overproduction of acetyl-CoA carboxylase activity increases the rate of fatty acid biosynthesis in Escherichia coli. The Journal of Biological Chemistry, 275(37): 28593–28598. DOI:10.1074/jbc.M004756200 |
| [] | Gu K Y, Chiam H H, Tian D S, et al. 2011. Molecular cloning and expression of heteromeric ACCase subunit genes from Jatropha curcas. Plant Science, 180(4): 642–649. DOI:10.1016/j.plantsci.2011.01.007 |
| [] | Pastor S. 2011. Determining biological roles of four unique Vernicia fordii acyl-CoA Binding Proteins. University of New Orleans Theses and Dissertations, Paper 1337. |
| [] | Pfaffl M W. 2001. A new mathematical model for relative quantification real-time RT-PCR. Nucleic Acids Research, 29(9): 2002–2007. |
| [] | Qiao Z X, Liu J Y. 2007. Cloning and characterization of cotton heteromeric acetyl-CoA carboxylase genes. Progress in Natural Science, 17(12): 1412–1418. |
| [] | Reverdatto S, Beilinson V, Nielsen N C. 1999. A multisubunit acetyl coenzyme A carboxylase from soybean. Plant Physiology, 119(3): 961–978. DOI:10.1104/pp.119.3.961 |
| [] | Shang Q, Jiang W, Lu H F, et al. 2010. Properties of tung oil biodiesel and its blends with 0# diesel. Bioresource Technology, 101(2): 826–828. DOI:10.1016/j.biortech.2009.08.047 |
| [] | Slabas A R, Fawcett T. 1992. The biochemistry and molecular biology of plant lipid biosynthesis. Plant Molecular Biology, 19(1): 169–191. DOI:10.1007/BF00015613 |
| [] | Thelen J J, Mekhedov S, Ohlrogge J B. 2000. Biotin carboxyl carrier protein isoforms in Brassicaceae oilseeds. Biochemical Society Transactions, 28(6): 595–598. DOI:10.1042/bst0280595 |
| [] | Thelen J J, Mekhedov S, Ohlrogge J B. 2001. Brassicaceae express multiple isoforms of biotin carboxyl carrier protein in a tissue-specific manner. Plant Physiology, 125(4): 2016–2028. DOI:10.1104/pp.125.4.2016 |
| [] | Thelen J J, Ohlrogge J B. 2002a. Metabolic engineering of fatty acid biosynthesis in plants. Metabolic Engineering, 4(1): 12–21. DOI:10.1006/mben.2001.0204 |
| [] | Thelen J J, Ohlrogge J B. 2002b. Both antisense and sense expression of biotin carboxyl carrier protein isoform 2 inactivates the plastid acetyl-coenzyme A carboxylase in Arabidopsis thaliana. The Plant Journal, 32(4): 419–431. DOI:10.1046/j.1365-313X.2002.01435.x |
 2012, Vol. 48
2012, Vol. 48

