文章信息
- 王江岭, 顾建锋, 陈先锋, 段维军
- Wang Jiangling, Gu Jianfeng, Chen Xianfeng, Duan Weijun
- 东亚型和欧洲型拟松材线虫的形态学和ITS PCR-RFLP鉴定
- Identification of East Asian and European Types of Bursaphelenchus mucronatus by Morphological and ITS PCR-RFLP Methods
- 林业科学, 2012, 48(8): 113-117.
- Scientia Silvae Sinicae, 2012, 48(8): 113-117.
-
文章历史
- 收稿日期:2011-02-11
- 修回日期:2012-01-23
-
作者相关文章
拟松材线虫(Bursaphelenchus mucronatus)的形态、生物学特征与松材线虫(B. xylophilus)非常相似,并可能对松属(Pinus)部分种类有一定的致病性。
此外,拟松材线虫形态特征还与豆伞滑刃线虫(B. doui)伪伞滑刃线虫(B. fraudulentus)等非常相似(Braasch et al., 2004),单从形态学角度很难进行准确的鉴定(Braasch,2008;张奇等,2008)。Braasch(1991)根据形态学及分子生物学等方面的差异,又将拟松材线虫分为2个地理型:东亚型(east Asian type)和欧洲型(European type)。此后有很多学者的研究证实了这一点(Zheng et al., 2003;Iwahori et al., 2004;Urek et al., 2007;Burgermeister et al., 2005;2009),这更增加了拟松材线虫的鉴定难度。
鉴于国内尚未有文献论述拟松材线虫2个地理型之间的差异,并且笔者研究发现欧洲型拟松材线虫的ITS PCR-RFLP图谱存在变化。为便于有关实验室对该线虫进行准确鉴定,现将结果报道如下。
1 材料与方法 1.1 线虫来源所用线虫均为宁波口岸从进境木质包装中分离所得,具体见表 1。
|
|
用Zeiss Axio Imager Z1显微镜和Zeiss AxioCam MRm CCD数码相机对线虫的整体形态和内部特征进行观察、摄影。
1.3 ITS-RFLP分析 1.3.1 线虫DNA的提取(王江岭等,2010)将线虫放入ddH2O清洗,挑取单条线虫放入200 μL PCR管中[含8 μL ddH2O和1 μL 10×PCR Buffer(Mg2+ free)],85 ℃加热5 min,-70 ℃放置30 min,85 ℃加热2 min,向PCR管中加入1 μL 1 mg·mL-1蛋白酶K,56 ℃加热2 h,95 ℃加热10 min,13 000 r·min-1离心PCR管1 min,得到DNA粗提液,-20 ℃保存备用。
1.3.2 rDNA的ITS区PCR扩增PCR扩增采用50 μL反应体系:ddH2O 19.4 μL,10×PCR Buffer(Mg2+ free)5 μL,25 mmol·L-1 MgCl2 5 μL,0.1 mmol·L-1 dNTP 4 μL,10 μmol·L-1上游引物F194 (Ferris et al., 1993)(5′-CGTAACAAGGT AGCTGTAG-3′)3 μL,10 μmol·L-1下游引物5368r (Vrain,1993)(5′-TTTCACT CGCCGTTACTAAGG-3′)3 μL,5 U·μL-1 Taq酶0.6 μL,模板DNA 10 μL。
扩增程序为:94 ℃ 4 min;94 ℃ 40 s,52 ℃ 1 min,72 ℃ 1.5 min,36个循环;72 ℃ 8 min。
1.3.3 RFLP分析取上述PCR扩增产物8 μL加入0.5 μL ddH2O,1 μL限制性内切酶对应Buffer,并分别用0.5 μL的限制性内切酶Rsa Ⅰ,Hae Ⅲ,Msp Ⅰ,Hinf Ⅰ,Alu Ⅰ于37 ℃酶切3 h,酶切后的DNA用加入EB的1.5%琼脂糖凝胶电泳(5 V·cm-1,50 min),紫外检测仪上观察记录结果并拍照,获得线虫的ITS-RFLP图谱。
2 结果与分析 2.1 主要形态特征拟松材线虫2种地理型的雄虫形态基本一致,仅虫体大小、交合刺大小、喙突长度、基顶与交合刺所成角度有一定变化,但没有规律。
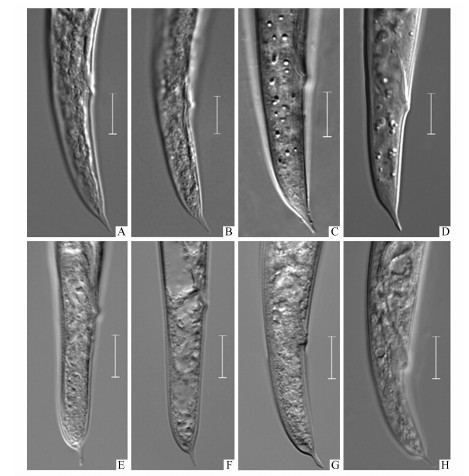
拟松材线虫2种地理型的区别主要是雌虫尾部形态:东亚型雌虫尾部呈圆锥形,尾尖突与尾几乎连续,缢缩不明显;而欧洲型雌虫尾呈亚圆柱形,尾尖突与尾端缢缩明显(图 1)。
|
图 1 东亚型和欧洲型拟松材线虫雌虫尾部(标尺=10 μm) Fig.1 East Asian and European type of B. mucronatus female tails (Scale bars=10 μm) A-D:东亚型East Asian type; E-H:欧洲型European type. |
不同来源的欧洲型拟松材线虫rDNA-ITS区经PCR扩增后,测序结果显示扩增产物均为约925 bp的片段。东亚型拟松材线虫约为920 bp。
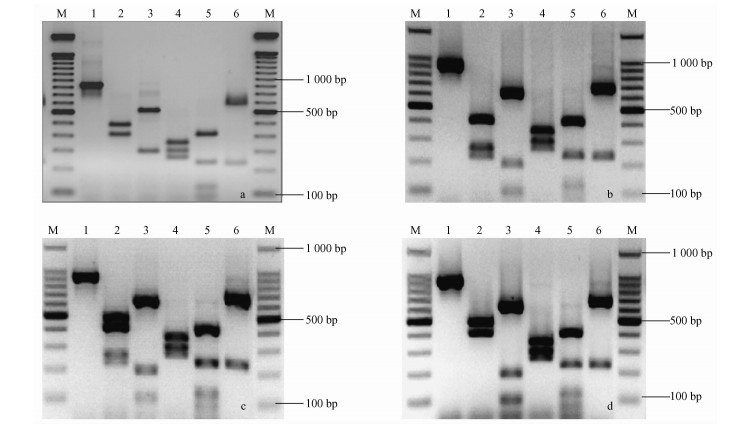
2.3 PCR-RFLP结果与分析选用对伞滑刃线虫具有鉴别作用的5种限制性内切酶Rsa Ⅰ,Hae Ⅲ,MspⅠ、HinfⅠ和AluⅠ,对各个来源的东亚型和欧洲型拟松材线虫rDNA-ITS区的PCR扩增产物进行酶切分析,得到3种酶切图谱(图 2)。3种酶切图谱区别在于Rsa Ⅰ酶切产物大小差异,分别为:4条(变异型A)、3条(变异型B)、5条(变异型A+B)(表 2)。其中变异型A与Burgermeister等(2009)结果一致。
|
图 2 东亚型拟松材线虫和欧洲型拟松材线虫3种变异型ITS-RFLP图谱 Fig.2 ITS-RFLP of east Asian and European type of B. mucronatus a.东亚型拟松材线虫East Asian type(Burgermeister et al.,2009); b.变异型A Type A; c.变异型A+B Type A+B; d.变异型B Type B; M: Marker(100 bp ladder);1:为未酶切的ITS区PCR产物rNDA amplicationproduct;2-6: Rsa Ⅰ,Hae Ⅲ,Msp Ⅰ,Hinf Ⅰ和Alu Ⅰ 5种限制性内切酶的酶切产物Digestion products obtained with Rsa Ⅰ, Hae Ⅲ, Msp Ⅰ, Hinf Ⅰ, and Alu Ⅰ。 |
|
|
通过对不同来源欧洲型拟松材线虫进行酶切研究,各株系线虫得到的变异型酶切图谱见表 2。除460-1得到了全部3种变异型酶切图谱外,其他只得到1到2种酶切图谱(表 1)。统计显示:得到变异型A酶切图谱占绝大多数。以前的研究大多选用大量线虫作为DNA来源,不能表现出单个线虫DNA序列的微小差异,因此也多得到变异型A酶切图谱的结果。
从以上结果可以看出:之所以欧洲型拟松材线虫有3种限制性内切酶Rsa Ⅰ的结果,是因为该种线虫的部分群体存在核糖体ITS区段序列的异质性或微不均一性(microheterogeneity)(Burgermeister et al., 2009),即同一种内、个体间或者个体内部ITS区段在相同位置存在DNA序列的差异。在变异型B的基础上,变异型A在490 bp的产物上多了一个Rsa Ⅰ酶切位点,将其分成263 bp和227 bp 2个片段;而变异型A+B则是混合体,显示同一条线虫的PCR扩增产物中,多数产物上(显示酶切产物条带颜色较深)没有针对490 bp的产物的酶切位点,但少数产物上存在酶切位点。
3 讨论目前已发现B. corneolus, B. singaporensis, B. sexdentati, B. doui等多种伞滑刃线虫存在ITS区段序列的异质性现象(Lange et al., 2007;Kanzaki et al., 2008;Burgermeister et al., 2009),但未曾有关于欧洲型拟松材线虫ITS区段序列的异质性现象的报道。Urek等(2007)展示欧洲型拟松材线虫应属于变异型A+B,但文中既没有对此作进一步分析,又忽略了263 bp和227 bp 2个条带。
尽管该现象会造成伞滑刃属线虫ITS PCR-RFLP图谱的细微差异,但由于这一现象较少见,并且都只是其中一种酶切结果略有差异,因此这对依据ITS PCR-RFLP图谱进行种类鉴定影响甚微。ITS PCR-RFLP仍是伞滑刃属线虫鉴定十分可靠的辅助手段,得到了广泛的应用。
在形态学鉴定时,拟松材线虫易与伪伞滑刃线虫、豆伞滑刃线虫混淆。伪伞滑刃线虫虫体更粗壮(雌虫和雄虫a=33.5和36.6,而拟松材线虫a>40),端生尾尖突多数着生于近腹面且微向腹面弯曲,长约1.5~2.6 μm,偶尔尾端钝圆,较拟松材线虫短(拟松材线虫尾尖突长度平均超过4 μm),并且雄虫交合刺远端盘状突膨大不明显。豆伞滑刃线虫雌虫尾尖突多位于腹面,长2~4 μm,形态多变(阶梯形、几乎钝圆、丝状、方形、鸟嘴形);交合刺大(长36~40 μm),且中部较平直。拟松材线虫与伪伞滑刃线虫、豆伞滑刃线虫的ITS PCR-RFLP图谱有显著差异(Burgermeister et al., 2009)。
Wingfield等(1983)报道从美国明尼苏达州和威斯康辛州的香脂冷杉(Abies balsamea)中分离到M型松材线虫。该线虫形态特征与欧洲型拟松材线虫十分接近,其雌虫所有个体都有明显的尾尖突,平均值为2~3 μm(有关M型松材线虫的形态和分子特征正在进一步研究),而欧洲型拟松材线虫的平均值一般超过4 μm。但研究表明M型松材线虫的ITS PCR-RFLP图谱与松材线虫完全一致(Li et al., 2009)。
松材线虫雌虫偶尔也有会有尾尖突,一般不超过2 μm,但存在一些特殊情况。Braasch等(1996)报道一种圆尾形的松材线虫(US15株系)接种到苏格兰松(Pinus sylvestris)幼苗上后,3个月后从树苗上分离到的雌虫中,35%呈圆尾形,8%尾呈锥形,40%有短尾尖突(约1 μm),而17%有显著的尾尖突,长达4~5 μm。赵文霞等(2005)也报道一种圆尾形松材线虫接种到油松(Pinus tabulaeformis)上后,从死树上分离到的雌虫中85%具有尾尖突(该文没有给出具体数据)。郑炜等(2007)也报道从浙江宁波马尾松(P. massoniana)中分离到一种松材线虫,其雌虫尾尖突平均值达1.7 μm,最长达2.9 μm,但经灰葡萄孢霉(Botrytis cinerea)培养后,所有的雌虫尾尖突均消失。
此外,刘伟等(1995)报道1种加拿大的松材线虫株系在拟盘多毛孢(Pestalotiopsis sp.)上培养后,44%呈圆尾形,33%有不到1 μm的尾尖突,23%尾尖突达1.46~3.41 μm。
尽管松材线虫雌虫尾形多变,但R型松材线虫雌虫中总有一些个体是圆尾形的。由此可见,关于松材线虫、拟松材线虫及其近似种的形态鉴定十分困难。本研究表明:ITS PCR-RFLP方法是十分可靠的辅助手段,结合形态学鉴定方法,可有效区分拟松材线虫及其近似种,并且还可准确区分种内不同地理型,为拟松材线虫的鉴定提供了可靠依据。
| [] | 刘伟, 杨宝君. 1995. 松材线虫和拟松材线虫雄虫交合伞形状的比较. 林业科学研究, 8(2): 223–225. |
| [] | 王江岭, 顾建锋. 2010. 宁波口岸首次截获弗氏伞滑刃线虫. 植物检疫, 24(3): 32–36. |
| [] | 张奇, 孙丹, 张楚菁, 等. 2008. 松材线虫鉴定方法的研究与比较. 南开大学学报:自然科学版, 41(5): 43–49. |
| [] | 赵文霞, 杨宝君. 2005. 松材线虫雌虫尾部形态和寄主的关系. 林业科学研究, 18(3): 362–363. |
| [] | 郑炜, 顾建锋, 吴昊, 等. 2007. 宁波马尾松中松材线虫形态变异研究. 浙江林业科技, 27(3): 38–40, 44. |
| [] | Braasch H. 1991. Erster Nachweis von Bursaphelenchus mucronatus Mamiya und Enda, 1979 in der DDr und sein Vorkommen in Holzimporten aus der UdSSR nebst Erägnzungen zur Beschreibung dieser Art. Archiv für Phytopathologie und Pflanzenschutz, 27(3): 209–218. DOI:10.1080/03235409109439071 |
| [] | Braasch H. 1996. Pathogenitätstests mit Bursaphelenchus mucronatus an Kiefernund Fichtensämlingen in Deutschland. European Journal of Forest Pathology, 26(4): 205–216. DOI:10.1111/efp.1996.26.issue-4 |
| [] | Braasch H, Gu J, Burgermeister W, et al. 2004. Bursaphelenchus doui sp. n. (Nematoda: Parasitaphelenchidae) in packaging wood from Taiwan and South Korea-a new species of the xylophilus group. Russian Journal of Nematology, 12(2): 19–27. |
| [] | Braasch H. 2008. The enlargement of the xylophilus group in the genus Bursaphelenchus. Mota M M, Vieira P//Pine Wilt Disease: A worldwide Threat to Forest ecosystems. Springer Science+Business Media BV, 139-149. |
| [] | Burgermeister W, Metge K, Braasch H, et al. 2005. ITS-RFLP patterns for differentiation of 26 Bursaphelenchus species (Nematoda: Parasitaphelenchidae) and observations on their distribution. Russian Journal of Nematology, 13(1): 29–42. |
| [] | Burgermeister W, Braasch H, Metge K, et al. 2009. ITS-RFLP analysis, an efficient tool for differentiation of Bursaphelenchus species. Nematology, 11(5): 649–668. DOI:10.1163/156854108/399182 |
| [] | Ferris V R, Ferris J M, Faghihi J. 1993. Variation in spacer ribosomalDNA in some cyst-forming species of plant parasitic nematodes. Fundamental and Applied Nematology, 16(2): 177–184. |
| [] | Iwahori H, Kanzaki N, Futai K. 2004. Bursaphelenchus xylophilus and B. mucronatus in Japan: where are they from?. Nematology Monographs & Perspectives, 2: 793–803. |
| [] | Kanzaki N, Aikawa T, Maehara N, et al. 2008. Bursaphelenchus doui Braasch, Gu, Burgermeister & Zhang, 2005 (Aphelenchida: Parasitaphelenchidae), an associate of Monochamus subfasciatus Bates (Coleoptera: Cerambycidae) and Pinus densiflora Sieb. & Zucc. Nematology, 10(1): 69–78. DOI:10.1163/156854108783360195 |
| [] | Lange C, Burgermeister W, Metge K, et al. 2007. Phylogenetic analysis of isolates of the Bursaphelenchus sexdentati group using ribosomal intergenic transcribed spacer DNA sequences. Journal of Nematode Morphology and Systematics, 9(2): 95–109. |
| [] | Li H M, Trinh P Q, Waeyenberge L, et al. 2009. Characterisation of Bursaphelenchus spp. Isolated from packaging wood imported at Nanjing, China. Nematology, 11(3): 375–408. DOI:10.1163/156854109X446971 |
| [] | Urek G, Širca S, Geric B. 2007. Morphometrical and molecular characterization of Bursaphelenchus species from Slovenia. Helminthologia, 44(2): 37–42. |
| [] | Vrain T C. 1993. Restriction fragment length polymorphism separates species of the Xiphinema americanus group. Journal of Nematology, 25(3): 361–364. |
| [] | Wingfield M J, Blanchette A, Kondo E. 1983. Comparison of the pine wood nematode, Bursaphelenchus xylophilus from pine and balsam fir. European Journal of Forest Pathology, 13(5/6): 360–372. |
| [] | Zheng J, Subbotin S A, He S, et al. 2003. Molecular characterization of some Asian isolates of Bursaphelenchus xylophilus and B. mucronatus using PCR-RFLPs and sequences of ribosomal DNA. Russian Journal of Nematology, 11(1): 17–22. |
 2012, Vol. 48
2012, Vol. 48