文章信息
- 廖月枝, 严善春, 曹传旺, 刘丹
- Liao Yuezhi, Yan Shanchun, Cao Chuanwang, Liu Dan
- 甲氧虫酰肼对舞毒蛾幼虫解毒酶及其体内蛋白质表达的影响
- Effect of Methoxyfenozide on Activities of Detoxifying Enzymes and Expression of Proteins in Lymantria dispar larvae
- 林业科学, 2012, 48(8): 99-105.
- Scientia Silvae Sinicae, 2012, 48(8): 99-105.
-
文章历史
- 收稿日期:2011-01-17
- 修回日期:2011-11-06
-
作者相关文章
昆虫解毒酶是一类异质酶系,能够代谢大量的内源或外源底物,主要包括酯酶(esterase)、羧酸酯酶(carboxylesterase,CarE)、多功能氧化酶(mixed-function oxidases,MFOs)和谷胱甘肽S-转移酶(glutathione S-transferases,GSTs)等(尹显慧等,2008;丁双阳等,2001)。昆虫的解毒酶系活性能被各种外源化合物诱导,这使昆虫在受到非常严重的化学环境压力时能迅速做出反应,从而存活下来(周利琳等,2009)。对杀虫剂解毒代谢能力的增强是害虫产生抗药性的重要机制之一。甲氧虫酰肼(methoxyfenozide,RH-2485)为昆虫蜕皮激素类似物,以其独特的作用机制、良好的防治效果,对人类、天敌及环境安全而备受瞩目,已经成为替代有机磷和拟除虫菊酯类杀虫剂,防治棉花(Gossypium spp.)、玉米(Zea mays)、蔬菜及其他农作物上多种鳞翅目害虫的理想药剂(Irigaray et al., 2005;朱丽梅,2001;Schneider et al., 2004;顾秀慧等,2004),但尚未见将甲氧虫酰肼用于防治林木害虫的研究报道。廖月枝等(2009;2011)研究发现低剂量甲氧虫酰肼对舞毒蛾(Lymantria dispar)生长发育存在明显影响,对舞毒蛾幼虫体内的保护酶活性具有明显的干扰作用。为了进一步了解甲氧虫酰肼对舞毒蛾的杀虫活性及作用机制,本文测定了该药剂对舞毒蛾幼虫体内解毒酶及不同组织蛋白质表达的影响,为其在林业上的合理应用及舞毒蛾的无公害防治提供一定的理论依据。
1 材料与方法 1.1 供试材料舞毒蛾卵于2009年3月采自东北林业大学示范林场,该地未使用任何药剂防治。将采回的卵在室内孵化,幼虫用健康无药剂污染的成年白桦(Betula platyphylla)叶片饲养,每天观察并更换新鲜叶片,及时清理幼虫的排泄物和食物残渣。恒温饲养条件:温度(25±1) ℃,相对湿度60%~80%,光周期16L:8D。
1.2 毒力测定参照Zhao等(2002)及廖月枝等(2011)叶片药膜法。在预试验的基础上,用清水将24%甲氧虫酰肼悬浮剂(美国陶氏益农公司)稀释成系列浓度梯度,其中2,3龄幼虫选用的浓度为24,8,2.67,2.40,0.89,0.24,0.10 mg· L-1;4,5,6龄幼虫选用的浓度为240,24,8,2.67,0.89,0.30,0.10 mg· L-1;以清水作为对照。将未接触过药剂的白桦叶片在稀释好的药液中浸10 s后取出,在阴凉处晾干。用蘸有充足水分的脱脂棉裹住叶柄,放入透气性良好的透明养虫瓶(直径9 cm,高14 cm)中,然后接入大小一致的舞毒蛾2~6龄幼虫,每瓶各放入15头,各龄均重复4次。置于恒温养虫室内饲养,分别于48,72,96 h后检查死亡数。虫体变小,严重发黑,用毛笔轻触无反应或不能活动的视为死亡。
1.3 解毒酶活性测定 1.3.1 试虫处理根据毒力测定结果,用LC50剂量甲氧虫酰肼处理白桦叶片,饲喂健康、大小一致且饥饿12 h的2,4和6龄幼虫,其中2龄幼虫每养虫瓶放30头,4龄幼虫放15头,6龄幼虫放10头,处理方法和饲养条件同1.2节,以清水处理作为对照。分别于处理后6,12,24,36,48,60和72 h取处理组和对照组的活试虫,储存于-80 ℃冰箱用于制备酶液。
1.3.2 活性测定从-80 ℃超低温冰箱取出处理组和对照组中不同处理时间、大小一致的舞毒蛾2龄幼虫10头、4龄幼虫5头和6龄幼虫3头,解冻,经缓冲液漂洗后,置于玻璃匀浆器中,匀浆2~3 min,制备酶液。其中CarE酶液制备和活性测定参考Van Asperen(1962)和郭庆龙(2007)方法并略加修改,将原酶液稀释40倍用于试验;谷胱甘肽S-转移酶(GST)酶液制备和活性测定参照Booth等(1961)和郭庆龙(2007)方法并略加修改,将原酶液稀释10倍用于试验,反应体系中加入2.5 mL 0.066 mol·L-1、pH 7.0磷酸缓冲液,0.1 mL酶液;多功能氧化酶O-脱甲基(MFOD)酶液制备和活性测定参考Hansen等(1971)和王建军等(2009)的方法。每个处理均重复3次。蛋白质含量测定采用Bradford(1976)的考马斯亮蓝G-250法。
1.4 蛋白质表达变化检测 1.4.1 样品制备用甲氧虫酰肼LC50剂量处理白桦叶片,饲喂刚蜕皮、大小一致且饥饿12 h的4龄幼虫,处理方法和饲养条件同1.2节,以清水处理作为对照。处理后12,24和48 h,从处理组和对照组分别取出活试虫各30头,参照李照民等(2003)方法分离和制备表皮、中肠、血淋巴组织的蛋白质样品;采用Bradford(1976)的考马斯亮蓝G-250法测定各组织中蛋白质含量。
1.4.2 检测方法采用变性聚丙烯酰胺凝胶电泳(SDS-PAGE)检测表皮、中肠、血淋巴组织的蛋白质表达变化。分离胶浓度为12%,浓缩胶浓度为5%;电压:先80 V 20 min,然后调到100 V至电泳完毕;考马斯亮蓝染色。
1.5 数据统计分析用POLO软件处理分析毒力测定结果,计算致死中浓度(LC50)及其95%置信区间;采用SPSS 11.5软件进行方差分析,差异显著性检验采用LSD方法,显著水平为α=0.05或α=0.01。
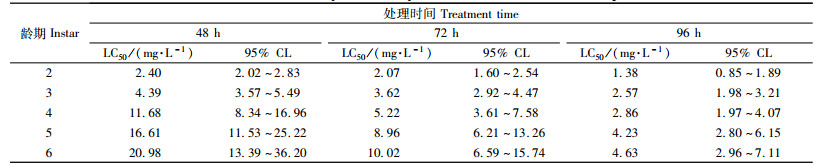
2 结果与分析 2.1 甲氧虫酰肼对舞毒蛾幼虫毒力的测定根据毒力测定结果,利用POLO软件处理得出甲氧虫酰肼对舞毒蛾幼虫不同龄期的致死中浓度(LC50)及其95%置信区间(表 1)。供试虫体刚接触药膜叶片时,虫体状态与之前并无差异,但随着其取食时间的延长,虫体活动力逐渐下降。从表 1可以看出:甲氧虫酰肼对舞毒蛾不同龄期幼虫均表现出较高活性。同一处理时间,对低龄幼虫的毒杀效果显著高于高龄幼虫,其中2,3龄幼虫对药剂敏感性最强。随着舞毒蛾幼虫龄期的增长,所需药量急剧增加,但是随着处理时间的延长,LC50剂量逐渐降低,因此,推荐在舞毒蛾低龄期进行防治。本试验选择处理48 h LC50作为试验剂量处理舞毒蛾2,4,6龄幼虫(LC50分别为2.40,11.68和20.98 mg· L-1),来测定甲氧虫酰肼对其体内解毒酶活性的影响。
|
|
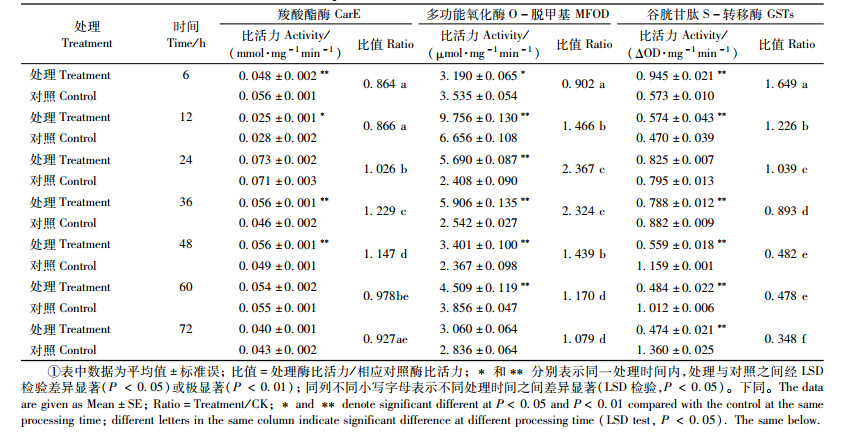
甲氧虫酰肼对舞毒蛾2龄幼虫体内解毒酶存在明显影响。从表 2中可以看出:舞毒蛾2龄幼虫经甲氧虫酰肼处理后,处理6~12 h,羧酸酯酶活性明显被抑制,24 h后逐渐被诱导,其中在处理36~48 h,处理组的该酶活性明显高于对照组,差异均极显著(P < 0.01),但60 h后又有所抑制,说明甲氧虫酰肼对舞毒蛾2龄幼虫体内该酶的影响较为复杂,处理初期对羧酸酯酶有抑制作用,但随着处理时间的延长,该酶活性逐渐被诱导,当药剂在幼虫体内的富集量达到一定程度时,对该酶又有抑制作用。甲氧虫酰肼对舞毒蛾2龄幼虫体内多功能氧化酶O-脱甲基也存在明显影响,处理6 h时,该酶活性明显被抑制,为同期对照的0.902倍,差异显著(P < 0.05),但从12 h起,甲氧虫酰肼对该酶具有明显诱导作用,其中在处理24 h时,对该酶诱导作用最强,为同期对照的2.367倍,差异极显著(P < 0.01),随着处理时间的延长,药剂对该酶的诱导作用呈下降趋势。甲氧虫酰肼对舞毒蛾2龄幼虫体内谷胱甘肽S-转移酶具有先诱导后抑制作用,处理6~12 h,处理组该酶活性明显高于对照组,差异均极显著(P < 0.01),但36 h后,该酶明显被抑制,且处理时间越长,对该酶的抑制作用越强,与对照组相比差异均极显著(P < 0.01)。以上研究发现2龄幼虫经甲氧虫酰肼处理后,其体内的多功能氧化酶O-脱甲基容易被诱导,增强对药剂的解毒作用,若长期使用该药剂,要注意检测该酶的活性变化。
|
|
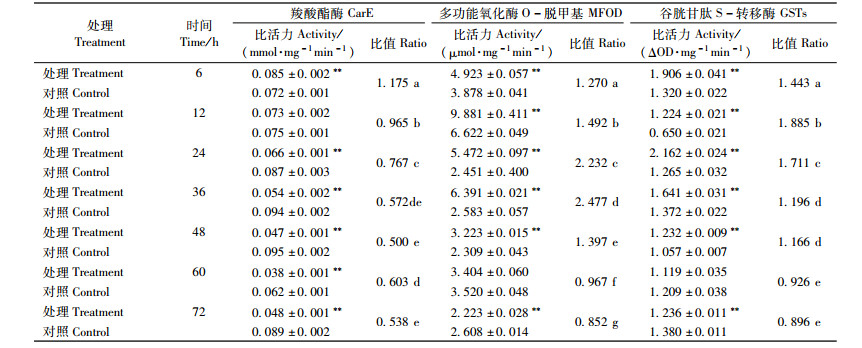
从表 3中可以看出:甲氧虫酰肼对舞毒蛾4龄幼虫体内羧酸酯酶具有明显的抑制作用,在各个处理时间点,甲氧虫酰肼对该酶的抑制作用与对照组相比差异均极显著(P < 0.01)。甲氧虫酰肼对4龄幼虫体内多功能氧化酶O-脱甲基和谷胱甘肽S-转移酶具有先诱导后抑制作用,其中在处理6 h时,对后者的诱导作用最强,为同期对照的1.576倍;处理48 h后,对前者的诱导作用最强,为同期对照的2.010倍;处理72 h后,对两者均有明显的抑制作用,分别为同期对照的0.577,0.473倍,差异均极显著(P < 0.01)。说明舞毒蛾4龄幼虫经甲氧虫酰肼处理后,其体内的羧酸酯酶明显被抑制,且处理时间越长,抑制作用越明显,但对多功能氧化酶O-脱甲基和谷胱甘肽S-转移酶诱导作用较强,60 h后,处理组的多功能氧化酶O-脱甲基活性才呈现出下降趋势,因此多功能氧化酶O-脱甲基和谷胱甘肽S-转移酶容易增强对该药剂的解毒作用,在甲氧虫酰肼长期使用过程中,应重点检测这2种酶的变化。
|
|
表 4为甲氧虫酰肼对舞毒蛾6龄幼虫体内解毒酶的影响。从表 4中可以看出:舞毒蛾6龄幼虫经甲氧虫酰肼处理后,6 h时,羧酸酯酶活性明显被诱导,但从12 h起,该酶活性被明显抑制,其中在处理48 h时,对该酶的抑制作用最强,为同期对照的0.500倍,与对照组相比差异极显著(P < 0.01)。6~48 h,多功能氧化酶O-脱甲基和谷胱甘肽S-转移酶活性均明显被诱导,60 h后,这2种酶活性逐渐被抑制,且均在处理72 h时,酶活性明显低于同期对照组(P < 0.01)。说明甲氧虫酰肼对6龄幼虫体内羧酸酯酶、多功能氧化酶O-脱甲基和谷胱甘肽S-转移酶均具有先诱导后抑制作用,且对这3种酶的影响存在明显的时间效应。
|
|
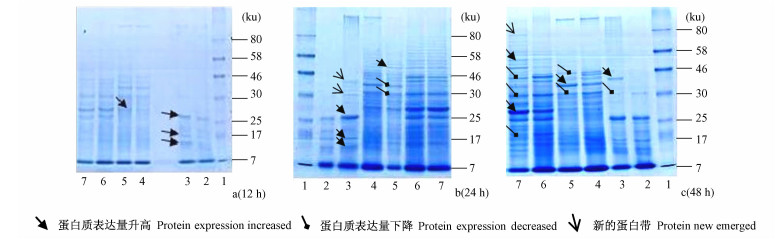
SDS-PAGE结果显示:不同的处理时间,甲氧虫酰肼能明显影响舞毒蛾不同组织的蛋白质表达(图 1)。与对照相比,处理12 h时,血淋巴组织中分子质量为7~25 ku的蛋白质表达量升高;中肠分子质量在25~30 ku的蛋白质表达量也有所升高(图 1a)。24 h后,血淋巴组织中除7~25 ku的蛋白质的表达量升高外,出现了分子质量为30 ku及30~46 ku的新蛋白带;中肠中分子质量为30 ku及30~46 ku的蛋白质表达量下降,分子质量为46~58 ku的蛋白质表达量有所升高(图 1b)。48 h后,血淋巴组织中分子质量为30 ku的蛋白质表达量明显低于对照,分子质量在30~46 ku的新蛋白质的表达量明显升高;中肠和表皮中的蛋白质表达均表现为明显变化,其中,中肠中分子质量为30及46 ku的蛋白质表达量明显低于对照,分子质量为30~46 ku的蛋白质表达量较对照有所升高;表皮中分子质量为17~25 ku, 30 ku, 30~46 ku的蛋白质表达量均低于对照,但在25~30 ku, 46~58 ku的蛋白质表达量较对照组有所升高,并出现了1条分子质量接近80 ku的新蛋白带(图 1c)。以上结果表明:处理12 h和24 h时甲氧虫酰肼对舞毒蛾幼虫体内蛋白质的干扰主要集中在血淋巴和中肠组织中,48 h后主要表现在表皮组织中。
|
图 1 甲氧虫酰肼对舞毒蛾幼虫不同组织中蛋白质表达影响的SDS-PAGE Fig.1 Variations of the expression of proteins in different tissues of L. dispar larvae detected by SDS-PAGE after treatment with methoxyfenozide 泳道1为标准分子质量蛋白质Lane 1 is protein markers;泳道2 ~7分别为对照血淋巴、处理血淋巴、对照中肠、处理中肠、对照表皮、处理表皮Lanes 2~7 are samples,which are control hemolymph,treated hemolymph,control midgut,treated midgut,control epidermis and treated epidermis.加样量30 μg 30 μg proteins per lane. |
本研究表明:甲氧虫酰肼作为蜕皮激素类似物中的新型化合物,能有效干扰舞毒蛾幼虫体内羧酸酯酶、多功能氧化酶O-脱甲基、谷胱甘肽S-转移酶活性及不同组织中蛋白质的表达。
羧酸酯酶、谷胱甘肽S-转移酶和多功能氧化酶是昆虫体内重要的解毒酶,在杀虫剂代谢、昆虫抗药性等方面都具有重要作用(吴青君等,2001;Mohan et al., 2003)。其中羧酸酯酶主要通过代谢体内某些内源及外来有害物质,使其分解,排出体外,从而起到解毒作用(尹显慧等,2008);多功能氧化酶是一种氧化酶系,具有底物非专一性,能够参与各种类型杀虫剂的解毒作用,其中O-脱甲基作用是多功能氧化酶对杀虫剂催化反应的重要类型之一(唐振华,1993);谷胱甘肽S-转移酶能催化生物体内的还原型谷胱甘肽与外源化合物的亲电子基团发生轭合,最终形成硫醚氨酸排出体外(曹挥等,2003)。有研究报道非甾醇蜕皮激素类杀虫剂在昆虫体内的解毒代谢与谷胱甘肽S-转移酶和多功能氧化酶有关(黄琳瑞,2005);兰亦全等(2004)报道甜菜夜蛾(Spodoptera exigua)福州自然种群对虫酰肼的抗性与谷胱甘肽S-转移酶有一定关系。王建军等(2009)研究发现亚致死剂量甲氧虫酰肼对斜纹夜蛾(Spodoptera litura)体内谷胱甘肽S-转移酶和多功能氧化酶具有一定的诱导作用。本研究发现,不同的处理时间,甲氧虫酰肼能有效干扰舞毒蛾不同龄期幼虫体内解毒酶活性,说明甲氧虫酰肼对舞毒蛾幼虫体内解毒酶的影响随处理时间的延长,酶活性不断发生变化,处理初期对幼虫体内这些酶的诱导作用可能是虫体对药剂的应激反应,即增强代谢以起到解毒作用,但是,随着处理时间的延长,药剂在虫体内富集量的增加,抑制了解毒酶活性,增强对虫体的毒性。另外,本研究还发现,甲氧虫酰肼对舞毒蛾幼虫体内谷胱甘肽S-转移酶影响的龄期效应不明显,各龄期具有类似的变化趋势;对幼虫体内的多功能氧化酶O-脱甲基诱导干扰作用较强,尤其对低龄幼虫诱导干扰作用更强。因此,在甲氧虫酰肼的长期使用过程中,应注意检测多功能氧化酶O-脱甲基活性的变化。
在昆虫蜕皮过程中,伴随着蛋白的合成和新生外骨架的分泌。Smagghe等(1992)研究发现RH-5849能够诱导棉贪夜蛾(Spodoptera littoralis)6龄幼虫表皮的蛋白带缺少或者表达量减少。Smagghe等(1999)用RH-0345,RH-5992,RH-5849和20E处理马铃薯甲虫(Leptinotarsa decemlineata)末龄幼虫发现,在2天后血淋巴中产生了分子质量大约为19,22和48 ku的3条多肽。另外前3个药剂同时还抑制分子质量为59, 62, 75和150 ku的多肽合成,而20E仅抑制59, 62和150 ku多肽的合成。用RH-0345, RH-5992, RH-5849处理6天后的幼虫,血淋巴中分子质量为16, 21, 24, 34, 64, 66, 69, 82, 125和250 ku的多肽不再合成。李照民等(2003)也发现用RH-2485处理棉铃虫(Helicoverpa armigera) 6龄幼虫,处理24 h和48 h后幼虫的脂肪体和体壁的1种主要蛋白质表达量降低,处理48 h后血淋巴和中肠有新的酯酶同工酶表达。黄琳瑞(2005)用虫酰肼处理甜菜夜蛾5龄幼虫后发现,虫酰肼引起甜菜夜蛾幼虫体内3条蛋白质发生了变化,并形成新的条带,且处理48 h后的样品较处理24 h后的样品相应蛋白条带加深;能够诱导甜菜夜蛾幼虫体内酯酶同工酶的表达。本研究发现甲氧虫酰肼能明显影响舞毒蛾4龄幼虫不同组织的蛋白质表达。处理12 h时,血淋巴和中肠组织中某些的蛋白质表达量较对照组增加;处理24 h后,血淋巴中出现新的蛋白带,中肠组织中某些蛋白质表达量有下降趋势,而某些蛋白质表达量却明显高于对照组。48 h后,血淋巴中出现新的蛋白带表达量增加;中肠组织中某些蛋白质表达量明显低于对照组;表皮组织中某些蛋白质表达量均低于对照组,某些蛋白质表达量较对照组有所升高,并出现了1条新的蛋白带。说明甲氧虫酰肼处理12 h和24 h时,对血淋巴和中肠组织中的蛋白质表达影响较大,48 h后,对表皮组织中蛋白质的影响明显,可能是因为甲氧虫酰肼模拟蜕皮激素功能,进入血淋巴及中肠,启动蜕皮过程,从而使这2个组织中蛋白质表达发生了改变,随着虫体皮层溶离等蜕皮过程的进行,体壁中蛋白质的形成及其表达量发生改变,从而使表皮中蛋白质的表达变化明显。由于蛋白质组成的变化源于基因表达的变化,说明甲氧虫酰肼处理后血淋巴、中肠及表皮中基因的表达也发生了改变。
| [] | 曹挥, 刘素琪, 王鸿雷, 等. 2003. 万寿菊根提取物对山楂叶螨几种酶活性的影响. 林业科学, 39(2): 114–118. DOI:10.11707/j.1001-7488.20030219 |
| [] | 丁双阳, 李怀业, 李学锋, 等. 2001. 转Bt基因杨树对美国白蛾幼虫中肠解毒酶及乙酰胆碱酯酶的影响. 东北林业大学学报, 29(3): 28–30. |
| [] | 顾秀慧, 贝亚维, 高春先. 2004. 蜕皮激素类似物美满防治甜菜夜蛾田间药效试验. 浙江农业学报, 16(5): 343–345. |
| [] | 郭庆龙. 2007. 棉铃虫对4种杀虫剂的抗性现状及Bt棉对棉铃虫抗药性的影响. 山东农业大学硕士学位论文. http://cdmd.cnki.com.cn/article/cdmd-10434-2007135572.htm |
| [] | 黄琳瑞. 2005. 甜菜夜蛾对虫酰肼抗药性选育和抗药性机理初探. 中国农业大学硕士学位论文. http://cdmd.cnki.com.cn/Article/CDMD-10019-2005084314.htm |
| [] | 兰亦全, 赵士熙. 2004. 甜菜夜蛾抗药性监测及机理. 福建农林大学学报:自然科学版, 33(1): 26–29. |
| [] | 李照民, 赵小凡, 王金星, 等. 2003. 非甾醇蜕皮激素竞争物(RH-2485)对棉铃虫六龄幼虫部分组织蛋白质表达和体壁结构的作用. 动物学研究, 24(2): 140–143. |
| [] | 廖月枝, 严善春, 曹传旺, 等. 2009. 低剂量甲氧虫酰肼对舞毒蛾生长发育的影响. 植物保护学报, 36(6): 555–560. |
| [] | 廖月枝, 严善春, 李小平, 等. 2011. 甲氧虫酰肼对舞毒蛾幼虫保护酶活性的影响. 林业科学, 47(9): 93–99. DOI:10.11707/j.1001-7488.20110916 |
| [] | 唐振华. 1993. 昆虫抗药性及其治理. 北京, 农业出版社: 166-203. |
| [] | 王建军, 田大军. 2009. 甲氧虫酰肼对斜纹夜蛾亚致死效应研究. 棉花学报, 21(3): 212–217. |
| [] | 吴青君, 张文吉, 张友军, 等. 2001. 解毒酶系在小菜蛾对阿维菌素抗性中的作用. 农药学学报(3): 23–28. |
| [] | 尹显慧, 吴青君, 李学锋, 等. 2008. 多杀菌素亚致死浓度对小菜蛾解毒酶系活力的影响. 农药学学报, 10(1): 28–34. |
| [] | 周利琳, 司升云, 汪钟信, 等. 2009. 甜菜夜蛾对虫酰肼抗性的生化机制. 昆虫学报, 52(4): 386–394. |
| [] | 朱丽梅. 2001. 一个新的蜕皮激素拮抗剂--甲氧酰肼. 世界农药, 23(6): 50–52. |
| [] | Booth B J, Boyland E, Sims P. 1961. An enzyme from rat liver catalysing conjugations with glutathione. Biochemical Journal, 79(3): 516–524. DOI:10.1042/bj0790516 |
| [] | Bradford M M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein unitizing the principle of protein-dye binding. Analytical Biochemistry, 72(7): 248–254. |
| [] | Hansen L G, Hodgson E. 1971. Biochemical characteristics of insect microsomes: N-ando-demethylation. Biochemical Pharmacology, 20(7): 1569–1578. DOI:10.1016/0006-2952(71)90285-1 |
| [] | Irigaray F S, Marco V, Zalom F G, et al. 2005. Effects of methoxyfenozide on Lobesia botrana Den & Schiff (Lepidoptera: Tortricidae) egg, larval and adult stages. Pest Management Science, 61(11): 1133–1137. DOI:10.1002/(ISSN)1526-4998 |
| [] | Mohan M, Gujar G T. 2003. Local variation in susceptibility of the diamondback moth, Plutella xylostella(Linnaeus)to insecticides and role of detoxification enzymes. Crop Protection, 22(3): 495–504. DOI:10.1016/S0261-2194(02)00201-6 |
| [] | Schneider M I, Smagghe G, Pineda S, et al. 2004. Action of insect growth regulator insecticides and spinosad on life history parameters and absorption in third-instar larvae of the endoparasitoid Hyposoter didymator. Biological Control, 31(2): 189–198. DOI:10.1016/j.biocontrol.2004.04.013 |
| [] | Smagghe G, Degheele D. 1992. Effects of RH-5849, the first nonsteroidal ecdysteroid agonist, on larvae of Spodoptera litoralis(Boisd.)(Lepidoptera: Noctuidae). Archives of Insect Biochemistry and Physiology, 21(2): 119–128. DOI:10.1002/(ISSN)1520-6327 |
| [] | Smagghe G, Vinuela E, Limbergen H V, et al. 1999. Nonsteroidal moulting hormone agonists: effects on protein synthesis and cuticle formation in Colorado potato beetle larvae. Entomologia Experimentalis et Applicata, 93(1): 1–8. DOI:10.1046/j.1570-7458.1999.00556.x |
| [] | Van Asperen K. 1962. A study of housefly esterases by means of a sensitive colorimetric method. Journal of Insect Physiology, 8(4): 401–416. DOI:10.1016/0022-1910(62)90074-4 |
| [] | Zhao J Z, Li Y X, Collins H L, et al. 2002. Monitoring and characterization of diamondback moth (Lepidoptera: Plutellidae) resistance to spinosad. Journal of Economic Entomology, 95(2): 430–436. DOI:10.1603/0022-0493-95.2.430 |
 2012, Vol. 48
2012, Vol. 48