文章信息
- 张召, 梁元存, 王利, 杨洪强, 李龙, 孙崟崟, 谢永波
- Zhang Zhao, Liang Yuancun, Wang Li, Yang Hongqiang, Li Long, Sun Yinyin, Xie Yongbo
- 钙对酸化处理平邑甜茶根系抗氧化酶活性及线粒体功能的影响
- Effect of Calcium on the Functions of Antioxidant Systems and Mitochondria in Malus hupehensis var. pingyiensis Roots under Acid Treatment
- 林业科学, 2012, 48(8): 87-93.
- Scientia Silvae Sinicae, 2012, 48(8): 87-93.
-
文章历史
- 收稿日期:2011-07-23
- 修回日期:2011-11-01
-
作者相关文章
2. 山东农业大学植物保护学院 泰安 271018;
3. 山东农业大学农业资源利用博士后流动站 泰安 271018
2. College of Plant Protection, Shandong Agricultural University Tai'an 271018;
3. Post-Doctoral Mobile Station of Agricultural Resource Utilization, Shandong Agricultural University Tai'an 271018
由于不合理的农业施肥、环境污染以及酸雨沉降等原因,中国土壤呈现出大规模的酸化。土壤酸化面积已超过国土面积的20%,随着工农业生产的不断发展,其酸化状况逐步恶化(易杰祥等,2006)。近年来,研究人员深入研究酸化(如酸雨)对植物茎叶的直接伤害,以及对植物茎叶细胞所产生的膜脂过氧化作用(周青等,1999;严重玲等,2000;邱栋梁等,2002)。张焕朝等(2003)研究了根际酸化作用对杨树(Populus deltoides×P. cathayana)无性系磷营养效率的影响,童贯和等(2005)研究了模拟酸雨及其酸化土壤对小麦(Triticum aestivum)幼苗膜脂过氧化水平的影响,但根区酸化对植物根系的线粒体功能以及抗氧化酶活性的研究未见报道。钙是植物生长发育所必需的大量元素,是偶联胞外信号与胞内生理反应的第二信使,在调节植物细胞对逆境反应和逆境适应性过程中发挥着重要作用(Xiong et al., 2002)。有关钙与植物对不良环境的关系已经有了一定的研究,但是,与低氧胁迫(生利霞等,2008)、盐胁迫(马怀宇等,2010)、高低温胁迫(Gong et al., 1998;Nayyar et al., 2002)等条件相比,酸化条件下,外源钙对植物耐性的影响尚不清楚。
平邑甜茶(Malus hupehensis var. pingyiensis)是我国特有的苹果砧木资源,耐涝性和耐盐性较强,具有较强的无融合生殖能力,实生苗个体间差异小,是理想的果树根系研究材料(杨洪强等,2007)。本试验以平邑甜茶为试材,通过调节根区营养液的pH值,研究根区酸化以及外源钙对其根系抗氧化酶活性、线粒体功能的影响,旨在探讨根区酸化对平邑甜茶根系的伤害机制以及钙在酸化条件下的生理功能及作用机制,为进一步揭示土壤酸化危害植物的机制奠定基础。
1 材料与方法 1.1 试验材料平邑甜茶种子经消毒层积后播在容器中进行育苗。待幼苗刚出现第2片真叶时,将其移至1/2 Hoagland营养液(pH 6)中培养,每3天换1次营养液,至第6片真叶展开后,选择长势一致的实生幼苗进行酸化处理。
1.2 根区酸化处理采用UB-10型酸度计测定,滴加98%浓硫酸配制pH值分别为3, 4,5,6的1/2 Hoagland营养液进行根区酸化处理(倪寿清等,2008),处理后第0,2,3,4天测定,重复3次。一般情况下苹果砧木生长的适宜pH值为5.5~6.7(束怀瑞,1999),因此,以pH 6的1/2 Hoagland营养液作为本试验的对照。
1.3 钙缓解处理选取pH 3的1/2 Hoagland营养液中分别加入浓度为10,20,30 mmol·L-1的CaCl2溶液进行缓解处理,处理后第0,2,3,4天测定,重复3次。
1.4 测定方法 1.4.1 抗氧化物酶活性的测定超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性的测定参照赵世杰等(1998)的方法,各3次重复。
1.4.2 线粒体的提取线粒体的提取参照杨玖英等(2004)的方法,进行略微改动,其方法为剪取平邑甜茶幼苗的幼根,并使用清水冲洗干净;加入缓冲液Ⅰ(内含Tris-HCl 50 mmol·L-1,甘露醇400 mmol·L-1,EDTA 10 mmol·L-1,BSA 0.1%,β-巯基乙醇0.05%,pH 7.4),于冰上将其研磨成浆;在4 ℃条件下600×g离心10 min;然后取上清液,4 ℃条件下10 000×g离心10 min;所得沉淀用缓冲液Ⅰ洗2遍,每次4 ℃条件下10 000×g离心5 min,放于冰上待用。线粒体提取过程不要超过1 h,提取的线粒体要在2 h之内用完。
1.4.3 线粒体膜通透性检测采用金超芳等(2002)的方法,并稍加改动,其具体方法为分离的线粒体用缓冲液Ⅱ(内含蔗糖250 mmol·L-1,Hepes 2 mmol·L-1,KH2PO40.5 mmol·L-1,琥珀酸钠4.2 mmol·L-1,pH 7.4)悬浮,然后调整悬浮液蛋白质含量为0.3 mg·mL-1,于20 ℃保温2 min。在紫外分光光度计检测540 nm处的吸光度变化。
1.4.4 线粒体细胞色素c/a测定参照马怀宇等(2006)的方法。分离的线粒体用0.2%BSA悬浮,调整悬浮液蛋白含量约0.5 mg·mL-1,用紫外分光光度计检测550和630 nm处的吸收值,2种波长的吸收值之比即为Cytc/a。
1.4.5 线粒体膜电位测定参照Braidot等(1998)的方法。分离的线粒体使用缓冲液Ⅱ悬浮,并调整悬浮液蛋白浓度为0.3 mg·mL-1。加入1 μg·mL-1罗丹明123(Rh 123)在25 ℃下孵育30 min,然后使用缓冲液Ⅱ洗3次。在荧光分光光度计上检测其荧光强度,激发波长为505 nm,发射波长为534 nm。每个样品重复测定3次,每次间隔5 min,样品荧光强度取平均值。
1.4.6 线粒体H2O2含量测定线粒体H2O2含量的测定采用赵世杰等(1998)的方法,利用紫外分光光度计检测415 nm处的吸收值。
1.5 数据处理利用Excel软件进行相关数据统计分析。
2 结果与分析 2.1 酸化处理对平邑甜茶根系抗氧化酶活性的影响 2.1.1 酸化处理对平邑甜茶根系SOD酶活性的影响如图 1A所示,酸化处理对平邑甜茶根系SOD酶活性的影响较大,各处理的SOD酶活性均呈现先升高后降低的趋势,在处理的前2天,酶活性均高于对照,且pH 5处理下的酶活性升高幅度最大,其次为pH 4, pH 3处理。此后,各处理SOD酶活性下降,pH 3处理下的酶活性在第3天就迅速下降并低于对照,而pH 4, pH 5处理在第4天才低于对照,且其下降幅度要低于pH 3处理。说明酸化处理诱导了SOD酶活性,SOD酶活性增加,可抵抗由于酸化造成根系内活性氧的增加,但随着处理时间的延长,酸化强度超过植物体SOD的耐受限度,则SOD活性会随pH下降而逐渐丧失(刘燕云等,1993),以至失去清除活性氧的能力。

|
图 1 酸化处理对平邑甜茶根系SOD, CAT, POD酶活性的影响 Fig.1 Effect of acid treatment on SOD, CAT, POD in M. hupehensis var. pingyiensis roots |
植物体内CAT酶的作用是把植物体SOD酶歧化产生的H2O2进一步还原为H2O和O2,以解除活性氧对植物的危害。如图 1B所示,随着处理时间的延长,CAT酶的活性先升高后迅速下降,在第2天时活性最高;随着酸度的增加,CAT酶的活性逐渐降低。这与SOD酶活性变化相似,但CAT酶活性升高的过程明显受到抑制,在处理第2天时,pH 3,pH 4,pH 5处理下CAT酶活性分别比对照高2.67%,5.33%,8.00%。
2.1.3 酸化处理对平邑甜茶根系POD酶活性的影响由图 1C可知,各处理的POD酶活性先明显升高,后随着处理时间的延长又逐渐下降。pH 3,pH 4处理在第2天达到最大值,之后下降,并在第4天后低于对照,而pH 5处理则在第3天达到最大值,随后缓慢下降。说明随着处理时间的延长及酸化强度增大的条件下,各处理的SOD,CAT酶逐渐失去作用,POD酶活性被激活,但随着时间的延长其自身的防御体系被打破,酶活性降低。
2.2 酸化处理对平邑甜茶根系线粒体功能的影响 2.2.1 酸化处理对平邑甜茶根系线粒体膜通透性的影响由图 2A可知,经酸化处理后,平邑甜茶根系线粒体悬浮液吸光度均下降,处理的酸度越大和时间越长,其吸光度降幅越大。这表明酸化处理会诱导线粒体膜通透性转变(mitochondrial permeability transition, MPT)的升高。

|
图 2 酸化处理对平邑甜茶根系线粒体膜透性、膜电位、细胞色素c/a及H2O2含量影响 Fig.2 Effect on the MPT, Δψm, cytochrome c/a and content of H2O2 of M. hupehensis var. pingyiensis roots under acid treatment |
线粒体膜电位(Δψm)的下降与膜通透性孔道(mitochondrial permeability transition pore, MPTP)有关,MPTP高通透性开放可引起Δψm的降低,甚至消失(Lemasters et al., 1998)。本试验中,不同酸强度处理下,Δψm变化显著,酸度加强、处理时间长的条件下,MPTP高度开放,线粒体Δψm也随之明显下降(图 2B)。
2.2.3 酸化处理对平邑甜茶根系线粒体细胞色素c/a的影响由图 2C可知,在酸化处理平邑甜茶根系的过程中,随着酸度的加强,根系线粒体Cytc/a逐渐降低;同一酸强度下,随着处理时间的延长,根系线粒体Cytc/a同样逐渐降低。说明酸化处理破坏了线粒体膜的完整性,在MPTP和Δψm不断变化的过程中,线粒体内膜上的Cytc也在不断流失。
2.2.4 酸化处理对平邑甜茶根系线粒体H2O2含量的影响由图 2D可知,在处理的前2天,线粒体H2O2含量都低于对照。这与其细胞内的抗氧化酶系统发挥作用有关(图 1中前2天SOD,CAT,POD活性升高)。从第3天开始,线粒体中H2O2含量急剧上升,其中pH 3处理在第4天H2O2含量大约是对照的1.5倍。这表明经酸化处理后根系抗氧化系统受到抑制,后期SOD,CAT,POD活性下降(图 1)。
2.3 钙对酸化处理下平邑甜茶根系抗氧化酶系统的影响 2.3.1 钙对酸化处理下平邑甜茶根系SOD酶活性的影响由图 3A可知,各处理的SOD酶活性仍呈现先升高后降低的趋势,其中加入10,20 mmol·L-1 CaCl2的处理组,其SOD酶活性明显高于单独酸处理,且随着处理时间的延长缓慢下降,而加入30 mmol·L-1 CaCl2处理组的SOD酶活性始终低于单独酸处理,且在第2天后急剧下降。在各酸化处理中,外源10,20 mmol·L-1 CaCl2能明显诱导SOD酶活性,且随着Ca2+浓度的增加,SOD活性逐渐增加,但当Ca2+浓度增加到30 mmol·L-1时,SOD活性不升反降。
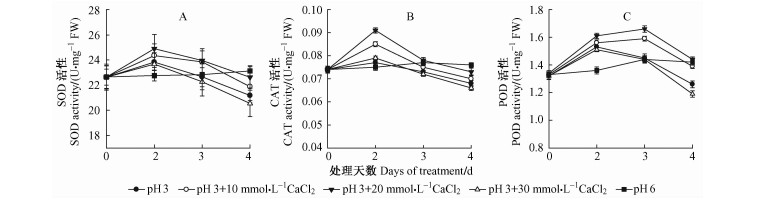
|
图 3 钙对酸化处理下平邑甜茶SOD,CAT,POD酶活性的影响 Fig.3 Effect of Calcium on SOD, CAT, POD in M. hupehensis var. pingyiensis under acid treatment |
由图 3B可知,处理期间,3组CaCl2处理(10,20,30 mmol·L-1)均能提高酸化条件下平邑甜茶根系的CAT酶活性,在处理2天时分别比单独酸处理(pH 3)高10.39%,18.18%,2.59%。而在第2天后,各处理CAT酶活性均下降,其中30 mmol·L-1 CaCl2处理急剧下降并低于单独酸处理。在各处理中,外源10,20 mmol·L-1 CaCl2能提高CAT酶活性以缓解胁迫所造成的伤害,但高浓度的钙同样会加重胁迫。
2.3.3 钙对酸化处理下平邑甜茶根系POD酶活性的影响由图 3C可知,3组加钙处理均对POD酶活性造成影响,其中10,20 mmol·L-1 CaCl2处理组在前3天缓慢升高并在第3天达到最大值,分别比单独酸处理(pH 3)提高了9.66%,14.48%,之后缓慢下降;而30 mmol·L-1CaCl2处理组则是在第2天达到最大值,且始终低于对照。这说明在各酸化处理中,外源10,20 mmol·L-1 CaCl2可以明显提高其根系POD酶活性,并能较长时间维持酶活性在较高的状态,从而增强其抗逆性。
2.4 钙对酸化处理下平邑甜茶根系线粒体功能的影响 2.4.1 钙对酸化处理下平邑甜茶根系线粒体膜通透性的影响如图 4所示,不同浓度的CaCl2在pH 3酸度处理平邑甜茶根系的过程中,对线粒体膜通透性具有不同程度的影响。其中在处理的第2天,10,20 mmol·L-1 CaCl2对酸化诱导的MPTP开放具有一定程度的抑制作用,处理后根系线粒体膜的吸光度都高于只用酸化处理的吸光度,说明处理后MPTP开放程度有所下降,而且20 mmol·L-1 CaCl2的抑制效果要好于10 mmol·L-1 CaCl2 的处理。而30 mmol·L-1 CaCl2处理的吸光度却低于单独的酸处理,即过高浓度的CaCl2 处理增强了酸化对MPTP开放的诱导(图 4A)。
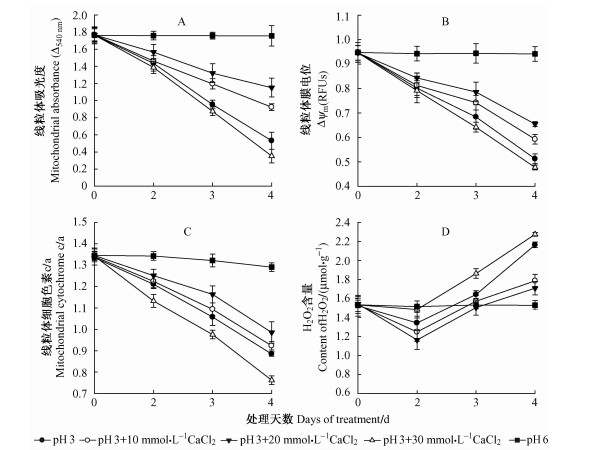
|
图 4 钙对酸化处理下平邑甜茶根系线粒体膜透性、膜电位、细胞色素c/a及H2O2含量的影响 Fig.4 Effect of Calcium on the MPT, Δψm, cytochrome c/a and content of H2O2 of Malus hupehensis var. pingyiensis roots under acid treatment |
如图 4B所示:因为10,20 mmol·L-1 CaCl2对酸化处理下MPTP的开放有抑制作用,MPTP开放程度下降,线粒体Δψm也随之有所缓解,但在强酸条件下,CaCl2只能对其有一定的缓解作用,在处理的第3天开始,Δψm仍出现明显下降的趋势。
2.4.3 钙对酸化处理下平邑甜茶根系线粒体细胞色素c/a的影响如图 4C所示,与单独酸化(pH 3)处理相比,在10,20 mmol·L-1 CaCl2处理下,随着MPTP开放程度的下降,Δψm的升高,Cytc/a也随之升高,说明钙可以在一定程度上保护线粒体膜的完整性。但随着处理时间的延长,Cytc/a仍呈缓慢的下降趋势。
2.4.4 钙对酸化处理下平邑甜茶根系线粒体H2O2含量的影响与酸化对照相比,随着抗氧化酶活性的提高(图 2),线粒体内H2O2含量有了一定程度的降低,在10,20 mmol·L-1 CaCl2处理下,H2O2含量在处理的第2天分别降低了6.78%,13.43%,而30 mmol·L-1 CaCl2 条件下,H2O2含量却上升了8.96%。这表明低浓度的Ca2+ (10和20 mmol·L-1)对线粒体H2O2的积累具有抑制作用,而高浓度的Ca2+(30 mmol·L-1)对线粒体H2O2的积累则有促进作用。
3 讨论植物在逆境胁迫下,其体内活性氧代谢系统的平衡被破坏,活性氧清除酶系SOD,CAT,POD酶活性降低,H2O2含量不断积累,细胞膜的结构和功能受到破坏,干扰了植物正常的生理代谢(严重玲等,1999;Blokhima et al.,2000)。同时,一定浓度的H2O2可以诱导细胞程序性死亡(马怀宇等,2006),而根细胞中的H2O2主要来源于线粒体电子传递链的电子渗漏(Liu et al.,2002;Jezek et al., 2005),因此,线粒体特性变化在细胞死亡过程中的作用不容忽视。本试验结果表明:在酸化处理条件下,各个酸强度都是先诱导后抑制平邑甜茶根系的抗氧化酶活性,酸度越强,抗氧化酶活性越低(图 1)。在处理初期,植物根系产生大量的超氧阴离子等活性氧,诱导SOD酶活性增强,并将超氧阴离子歧化为H2O2与O2,产生的H2O2又诱导CAT酶和POD酶活性的增强(彭立新等,2004)。但是,当细胞长时间地维持在较高的超氧阴离子浓度下,细胞内的活性物质包括酶也会受到损伤,致使SOD活性下降,而同时产生的大量H2O2已经超出CAT酶的消除能力,使得CAT酶活性下降。而在较低浓度的酸处理下,POD酶活性升高较慢可能是因为酸化对酶的激活具有时间效应,还有可能是初期产生的H2O2浓度较低不足以激活POD活性。以上结果说明:SOD,POD和CAT可能是平邑甜茶抵抗酸化胁迫的第一层保护系统,三者共同组成有效的活性氧清除系统,能有效地阻止植物体内活性氧的积累,提高植株的耐酸能力(Ushimaru et al., 2001;生利霞等,2008)。之后随着处理时间的延长,其自身的防御体系被打破,酶活性降低。
由于线粒体内膜的高选择透性,线粒体较少受到外界环境的影响,但在较严重的胁迫条件下,线粒体在能量合成和转换过程中也会受到影响,产生氧应激(邵小杰等,2009)。酸化处理使平邑甜茶根系线粒体MPTP过度开放,而线粒体作为死亡信号感受器,MPTP被诱导过度开放会导致Δψm的不断下降,而MPTP和Δψm不断下降的过程中,Cyt c/a同样逐渐降低(图 2)。随着酸度的增强,抗氧化酶系统(SOD,CAT,POD)活性逐渐降低,线粒体功能同样逐渐降低。可能是因为活性降低的抗氧化酶不能及时清除过多的活性氧,这些活性氧就会攻击膜系统,启动膜脂质过氧化,导致一系列膜功能障碍,这会进一步会提高线粒体膜通透性,最终诱导细胞死亡(生利霞等,2008)。
钙是植物生长过程中重要的元素,不仅能够通过稳定细胞结构等方式增强植物对各种胁迫的适宜性,还在逆境信号转导中充当第二信使。Bowler等(2000)发现,逆境胁迫过程中细胞内Ca2+水平变化与抗氧化酶活性在时间上有顺序性、空间上存在一致性,表明环境胁迫引起细胞内Ca2+水平的上升可能会直接调控部分氧化酶的活性。同时也有研究表明:H2O2和Ca2+的交互作用能使植物调节和忍耐受到的各种胁迫(Knight et al., 2001;Hye et al., 2004)。在本试验中,酸化处理下,低浓度的Ca2+(10,20 mmol·L-1)可以有效增强线粒体的流动性,提高线粒体的完整性,这可能是由于钙处理后降低线粒体内活性氧的含量,使膜完整性增强;同时,抗氧化酶(SOD,CAT,POD)活性增强(图 3),减轻酸化处理引起的膜脂过氧化对线粒体膜的伤害,保护了线粒体功能。而较高浓度的Ca2+(30 mmol·L-1)处理却在酸化的基础上加重对植物根系的伤害,这可能是因为细胞内钙离子超载会刺激氧自由基的生成,导致胁迫条件下线粒体损伤(Duchen,2000)。另外,低浓度的Ca2+(10和20 mmol·L-1)对线粒体H2O2的积累具有抑制作用,而较高浓度的Ca2+(30 mmol·L-1)对线粒体H2O2的积累则有促进作用(图 4),这与马怀宇(2006)的研究结果相一致。这可能是因为Ca2+激活了细胞质膜氧化还原酶类,使得线粒体产生的活性氧能很快被还原,缓解膜脂过氧化作用,降低了对电子传递链的阻抑,使得线粒体呼吸作用能比较正常的进行,从而提供了细胞代谢所需的能量,增强植株对逆境的抗性,缓解伤害(生利霞等,2008)。
4 结论1) 酸化处理使得平邑甜茶根系抗氧化酶活性呈现先上升后下降的趋势,各处理的SOD,CAT酶活性在处理的第2天达到最大值,POD酶活性变化不一,pH 3与pH 4处理在第2天达到最大值,pH 5处理在第3天达到最大值。
2) 酸化处理促进了MPTP开放,线粒体Δψm不断下降,根系线粒体Cyt c/a降低,H2O2含量先降低后升高,酸度越强,伤害越严重。
3) 在酸化处理下,低浓度Ca2+(10,20 mmol·L-1)能够明显诱导抗氧化酶的活性,而高浓度的Ca2+(30 mmol·L-1)加重了对抗氧化酶的胁迫。
4) 与单独酸化(pH 3)处理相比,低浓度的Ca2+(10和20 mmol·L-1)能够抑制MPTP开放,Δψm的下降,Cyt c的流失,线粒体H2O2的积累,而较高浓度的Ca2+(30 mmol·L-1)对线粒体功能的破坏与H2O2的积累则有促进作用。
| [] | 金超芳, 沈生荣, 赵保路. 2002. EGCG对线粒体PT孔开放及Ca2+转运的影响. 茶叶科学, 22(1): 14–18. |
| [] | 刘燕云, 曹洪法. 1993. 酸雨和SO2作用下SOD酶活性与菠菜叶片损伤相关性的研究. 应用生态学报, 4(2): 223–225. |
| [] | 马怀宇. 2006. 水分和盐胁迫下平邑甜茶根系细胞程序性死亡研究. 山东农业大学博士学位论文. http://d.wanfangdata.com.cn/Thesis_Y903554.aspx |
| [] | 马怀宇, 吕德国, 杨洪强. 2010. NaCl胁迫下平邑甜茶根系线粒体特性和细胞死亡特征. 植物生态学报, 34(12): 1448–1453. |
| [] | 马怀宇, 杨洪强. 2006. 外源H2O2对湖北海棠根系线粒体膜透性和细胞核DNA的影响. 植物生理与分子生物学学报, 32(5): 551–556. |
| [] | 倪寿清, 宋晓东, 崔清洁, 等. 2008. 模拟酸雨胁迫下中国北方小麦生理特性研究. 山东农业大学学报:自然科学版, 39(1): 19–22. |
| [] | 彭立新, 束怀瑞, 李德全. 2004. 水分胁迫对苹果属植物抗氧化酶活性的影响研究. 中国生态农业学报, 12(3): 44–46. |
| [] | 邱栋梁, 刘星辉, 王湘平. 2002. 模拟酸雨对龙眼叶绿体的伤害效应. 应用与环境生物学报, 8(2): 154–158. |
| [] | 邵小杰, 杨洪强, 乔海涛, 等. 2009. 氯化镉对葡萄根系线粒体特性与根系活力的影响. 应用生态学报, 20(6): 1390–1394. |
| [] | 生利霞, 冯立国, 束怀瑞. 2008. 低氧胁迫下钙对樱桃砧木根系抗氧化系统及线粒体功能的影响. 中国农业科学, 41(11): 3913–3919. DOI:10.3864/j.issn.0578-1752.2008.11.064 |
| [] | 束怀瑞. 1999. 苹果学. 北京, 中国农业出版社: 31-32, 273. |
| [] | 童贯和, 刘天骄, 黄伟. 2005. 模拟酸雨及其酸化土壤对小麦幼苗膜脂过氧化水平的影响. 生态学报, 25(6): 1509–1516. |
| [] | 严重玲, 洪业汤, 林鹏, 等. 2000. 酸雨胁迫下稀土元素对小麦生理生化响应的作用. 自然科学进展, 10(1): 80–84. |
| [] | 严重玲, 洪业汤, 王世杰, 等. 1999. 稀土元素对酸雨胁迫小麦活性氧清除系统响应的作用. 作物学报, 25(4): 504. |
| [] | 杨洪强, 束怀瑞. 2007. 苹果根系研究. 北京, 科学出版社: 87-90. |
| [] | 杨玖英, 谭艳平, 夏春皎, 等. 2004. 红莲型细胞质雄性不育性与线粒体渗透性转换. 武汉植物学研究, 22(5): 385–390. |
| [] | 易杰祥, 吕亮雪, 刘国道. 2006. 土壤酸化和酸性土壤改良研究. 华南农业大学学报, 12(1): 23–28. |
| [] | 张焕朝, 王改萍, 徐锡增, 等. 2003. 根际酸化作用对杨树无性系磷营养效率的影响. 应用生态学报, 14(10): 1607–1611. DOI:10.3321/j.issn:1001-9332.2003.10.004 |
| [] | 赵世杰, 刘华山, 董新纯. 1998. 植物生理学实验指导. 北京, 中国农业科技出版社: 149-161. |
| [] | 周青, 黄晓华, 王东燕, 等. 1999. 钙对酸雨伤害甜瓜幼苗的影响. 植物生态学报, 23(2): 186–190. |
| [] | Blokhima O B, Virolainen E, Fagetstedt K V, et al. 2000. Antioxidant status of anoxia-tolerant and -intolerant plant species under anoxia and reaetation. Physiologia Plantarum, 109(4): 396–403. DOI:10.1034/j.1399-3054.2000.100405.x |
| [] | Bowler C, Fluhr R. 2000. The role of calcium and activated oxygen as signals for controllingcross-tolerance. Trends in Plant Science, 5(6): 241–246. DOI:10.1016/S1360-1385(00)01628-9 |
| [] | Braidot E, Petrussa E, Macri F, et al. 1998. Plant mitochondrial electrical potential monitored by fluorescence quenching of rhodamine123. Biologia Plantarum, 41(2): 193–201. DOI:10.1023/A:1001898027218 |
| [] | Duchen M R. 2000. Mitochondria and calcium: from cell signaling to cell death. Journal of Physiology, 529(1): 57–68. DOI:10.1111/tjp.2000.529.issue-1 |
| [] | Gong M, van der Liut A, Knight M R, et al. 1998. Heat-shock-induced changes in intracellular Ca2+ level in tobacco seedlings in relation to thermotolerance. Plant Physiology, 116(1): 429–437. DOI:10.1104/pp.116.1.429 |
| [] | Hye R W, Jin H K, Hong G N. 2004. The delayed leaf senescence mutants of Arabidopsis, ore1, ore3 and ore9 are tolerant to oxidative stress. Plant Cell Physiology, 45(7): 923–932. DOI:10.1093/pcp/pch110 |
| [] | Jezek P, Hlavata L. 2005. Mitochondria in homeostasis of reactive oxygen species in cell, tissues, and organism. Journal of Biochemical Cell Biology, 37(12): 2478–2503. DOI:10.1016/j.biocel.2005.05.013 |
| [] | Knight H, Knight M R. 2001. Abiotic stress signaling pathway: specificity and cross-talk. Trends in Plant Science, 6(6): 262–267. DOI:10.1016/S1360-1385(01)01946-X |
| [] | Lemasters J J, Nieminen A L, Qian T. 1998. The mitochondrial permeability transition in cell death: a common mechanism in necrosis, apoptosis and autophagy. Biochem Biophys Acta, 1366(1/2): 177–196. |
| [] | Liu Y B, Fiskum G, Schubert D. 2002. Generation of reactive oxygen species by the mitochondrial electron transport chain. Journal of Neurochemistry, 80(5): 780–787. DOI:10.1046/j.0022-3042.2002.00744.x |
| [] | Nayyar H, Kaushal S K. 2002. Chilling induced oxidative stress in germinating wheat grains as affected by water stress and calcium. Biologia Plantarum, 45(4): 601–604. DOI:10.1023/A:1022308809328 |
| [] | Ushimaru T, Kanematsu S, Katayama M, et al. 2001. Antioxidative enzymes in seedlings of Nelumbo nucifera germinated under water. Physiologia Plantarum, 112(1): 39–46. DOI:10.1034/j.1399-3054.2001.1120106.x |
| [] | Xiong L M, Schumaker K S, Zhu J K. 2002. Cell signaling during cold, drought, and salt stress. The Plant Cell, 14(1): S165–S183. DOI:10.1105/tpc.010278 |
 2012, Vol. 48
2012, Vol. 48
