文章信息
- 黄艳, 刘虹, 袁丽, 贾之春, 罗克明
- Huang Yan, Liu Hong, Yuan Li, Jia Zhichun, Luo Keming
- 过量表达LAR3和Bbchit1以提高毛白杨对叶枯病的抗性
- Overexpression of LAR3 and Bbchit1 Genes in Transgenic Populus tomentosa Raising the resistance to Alternaria alternata
- 林业科学, 2012, 48(7): 92-97.
- Scientia Silvae Sinicae, 2012, 48(7): 92-97.
-
文章历史
- 收稿日期:2011-07-23
- 修回日期:2011-12-21
-
作者相关文章
毛白杨为我国重要的民用和工业用材,随着其种植面积的增加,各种病害也日趋严重。叶枯菌(Alternaria alternata)是杨树主要真菌病原体之一,可导致其提前落叶,丧失绿化作用,仅依靠化学防治等常规病害治理方法已经不能从根本上解决该问题。而植物防卫过程往往存在多个基因协同作用的情况,随着植物基因工程技术的不断发展,以转基因方式将不同来源的抗病基因同时导入杨树,提高其对叶枯病抗性具有重要意义。
几丁质酶在植物防御真菌病害时意义重大,其主要作用是降解真菌细胞壁主要成分几丁质,以妨碍病原真菌的生长。过量表达来源于不同物种中的几丁质酶基因可以增强转基因植物对真菌病的抗性,同时延缓病程(Horikoshi et al., 1959;Lorito et al., 1998;Bolar et al,2000;Marehant et al., 1998)。孟亮等(2004)利用植物几丁质酶基因转化美洲黑杨(Populus deltoides),提高了其对部分真菌性病害的抗性。几丁质酶基因Bbchit1来源于球孢白僵菌(Beauveria bassiana),本实验室已将其成功导入毛白杨中,发现其对杨树叶枯病具有良好的抗病效果(Jia et al., 2010)。
植物黄酮类化合物在植物抗病方面扮演着重要角色,其中单宁能直接阻碍病原微生物尤其是真菌的侵染和发育(李武汉等,1995;石雪辉等,1997;刘国坤等, 2003),LAR是单宁代谢合成过程中的关键酶基因,在前期工作中,本实验室成功克隆了杨树单宁代谢合成过程中的关键基因LAR3,将其导入毛白杨中过量表达,打破单宁合成代谢途径中的限速步骤,单宁合成量显著提高。抗病试验发现:单宁含量与转基因植株的抗病性成正相关关系(Yuan et al., 2012)。
基于上述结果,本研究将具有良好抗病效果的球孢白僵菌几丁质酶基因Bbchit1通过二次转化转入LAR3过量表达的毛白杨中,获得同时过量表达LAR3和Bbchit1基因毛白杨(贾之春等,2011),探讨了作用机制不同的2种抗病相关基因之间是否具有协同抗病效果,期望为杨树转基因抗病工程育种提供一条新的思路。
1 材料与方法 1.1 材料根癌农杆菌(Agrobacterium tumefaciens)菌株LAB4404,质粒p5-Bbchit1,以及二次遗传转化中所用植物材料超量表达LAR3毛白杨(Populus tomentosa)均为本实验室保存。杨树叶枯菌为由西北农林科技大学胡景江教授惠赠。
1.2 方法 1.2.1 二次遗传转化与转基因植株获得二次遗传转化所用的材料为LAR3过量表达毛白杨无菌苗,筛选基因为Hyg,用含p5-Bbchit1质粒的根癌农杆菌菌株LAB4404二次转化LAR3过量表达毛白杨, 筛选基因为NPTII,具体过程按Jia等(2010)进行。待转基因生根苗长至2 cm左右时移栽至温室土壤中培养。
1.2.2 转基因植株的PCR检测以二次转基因毛白杨基因组DNA为模板,通过扩增标记基因Hyg、NPTII和目的基因Bbchit1进行筛选。利用Vector NTI8和DNA Star生物学软件设计目的基因特异性引物,由金思特生物科技有限公司代为合成。引物序列如表 1所示。
|
|
PCR反应条件为94 ℃预变性3 min,然后94 ℃变性30 s、56 ℃退火30 s、72 ℃延伸1 min,共35个循环,最后72 ℃延伸10 min。扩增产物用1%琼脂糖凝胶电泳检测。
1.2.3 总RNA的提取、cDNA的合成以及Realtime-PCR扩增转基因杨树总RNA的提取按照RNA提取试剂盒(购自Qiagen公司)操作说明书进行,cDNA的合成使用试剂盒(Qiagen公司),-20 ℃保存备用。以反转录产物为模板进行Realtime-PCR扩增Bbchit1、LAR3基因,扩增引物见表 1。上述引物由金思特生物科技有限公司代为合成。qRT-PCR采用SYBR Green Master Mix Reagent (TaKaRa, 大连),反应体系为:SYBR Green Master Mix 10 μL,正反义引物(10 μmol·L-1)各1 μL,cDNA 2 μL(约30 ng),灭菌水6 μL。反应程序为:94℃,5 min;94℃变性30 s,58℃退火30 s,共40个循环。反应程序:95 ℃ 2 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共40个循环;95 ℃融解曲线分析15 s;随后执行60 ℃到95 ℃升温过程,此过程20 min。将目的基因和18S基因检测值的比值作为目的基因转录强度的相对定量值。每个样品设置3个重复对照。
1.2.4 二次转基因毛白杨体外抑菌试验菌丝生长抑制法参照吴文君(1988)方法进行,所有器皿及试剂均无菌。选取生长状态一致的转基因及非转基因植株,用TES缓冲液提取其细胞粗提液,吸取500 μL滴入20 mL已灭菌并降温至50 ℃的PDA培养基中,缓慢摇晃混匀,倒入平放的培养皿中。待平板冷却后,将28 ℃暗培养2~4天的杨树病原真菌的菌丝体及连带培养基用打孔器取6 mm圆块,将有菌丝的一面黏贴在PDA培养基正中央,每处理重复4次,28 ℃条件下倒置培养2~3天,并用十字交叉法测定叶枯菌生长直径,计算抑菌率(李春雷等,2009),菌丝生长抑菌率=(对照菌落直径-处理菌落直径)/对照菌落直径。
1.2.5 二次转基因毛白杨活体抗真菌病检测选取大小一致的转基因植株和野生型植株,将28 ℃暗培养2 ~ 4天的杨树叶枯病病原真菌的菌丝体及连带培养基用打孔器取6 mm圆块,用保鲜膜将生长菌丝的培养基固定在第2或第3片幼叶上,将其置于室外阴凉处,并保持湿润状态,30天后观察感病情况,具体方法见Jia等(2010)。
1.2.6 二次转基因毛白杨感病前后可溶性缩合单宁含量的测定可溶性缩合单宁含量的测定用的是香草醛法(Swain et al., 1959; Price et al., 1978), 取1 g植物材料研磨,加入适量丙酮和水的混合液(丙酮:水为7:3);2 500 r·min-1离心10 min,取上清于另一离心管中;加入2 mL乙醚萃取有机相,保留水相;重复2次;取0.5 mL提取液,3 mL 3%香草醛(甲醇溶解)1.5 mL浓盐酸避光反应15 min,测反应液在OD550 nm下的吸光度。取芦丁标准品稀释,并与香草醛反应测定其OD值,制作可溶性缩合单宁标准曲线,算出回归方程,计算出其含量(各株系随机选取2株,每株测3次)。
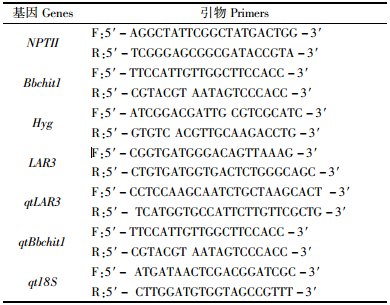
2 结果与分析 2.1 LAR3和Bbchit1共表达转基因毛白杨的获得以过表达LAR3基因的毛白杨(表达载体为PCXSN-LAR3, 由潮霉素筛选获得)为材料,将p5- Bbchit1表达载体采用农杆菌介导的叶盘法进行二次遗传转化,经卡那霉素筛选,获得大量再生小苗,移栽温室培养2个月左右。以转基因植株基因组DNA和载体质粒为模板,分别扩增LAR3 + Bbchit1共表达转基因植株的标记基因NPTII(749 bp)和Bbchit1(612 bp)以及Hyg(596 bp)。扩增结果如图 1,获得了与预期大小一致的片断,而非转基因植株未扩增出特异条带。上述结果初步证明目的基因LAR3与Bbchit1已整合到毛白杨基因组上。
|
图 1 PCR检测LAR3 和Bbchit1基因共表达的转基因毛白杨 Fig.1 PCR analysis of transgenic Chinese white poplar co-transformed with Bbchit1 and LAR3 a, b, c:PCR检测转基因毛白杨中Bbchit1, NPTⅡ, Hyg基因PCR analysis of transgenic plants used gene-specific primers of Bbchit1, NPTⅡ, Hyg; M:DNA marker DL2000;N:非转基因植株(阴性对照)Non-transgenic plants as negative control;P:质粒(阳性对照)Plasmid DNA as positive control;1~8:同时含LAR3, Bbchit1基因植株Transgenic plants overexpressed LAR3 and Bbchit1. |
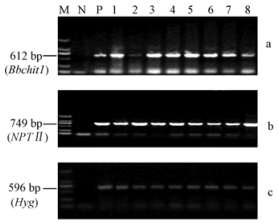
为了检测外源抗病基因Bbchit1和LAR3基因在转基因植株中的表达水平,荧光定量PCR检测发现(图 2),Bbchit1基因在5个转基因株系中表达量均较高;LAR3基因在转基因毛白杨中也成功转录并表达,与非转基因植株相比,株系L-B4、L-B6和L-B9中LAR3在mRNA水平上表达量最高,株系L-B3和L-B5次之。上述结果证明目的基因LAR3与Bbchit1在毛白杨中能够成功地表达。
|
图 2 Realtime-PCR检测转基因毛白杨中Bbchit1, LAR3基因的表达水平 Fig.2 Transcription levels of Bbchit1 and LAR3 in transgenic plants by realtime-PCR analysis. WT:非转基因植株Non-transgenic plants。L-B 3~6, 9:共表达LAR3 和Bbchit1的转基因株系Transgenic plants overexpressed LAR3 and Bbchit1. a,b表示不同转基因株系的差异显著性,字母相同表示差异不显著a,b means the significance of difference of transgenic plants, the same letter means no significance(α=0.05,with 3 replicates). |
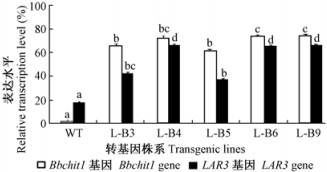
为了验证LAR3 和Bbchit1共表达是否提高了毛白杨对叶枯病的抗性,将叶枯病菌接种在含不同株系细胞粗提液的PDA培养基上,培养2天后发现,在含非转基因植株细胞粗提液的PDA培养基上,菌落直径较大(图 3 A-d),而在含转基因植株细胞粗提液的PDA培养基上菌落直径不同程度减小,其中含LAR3 + Bbchit1共表达转基因毛白杨细胞粗提液的培养基上菌落直径最小(图 3A-a)。计算各种细胞粗提液对叶枯病菌的抑制率(图 3B)。结果初步证明:在体外抑菌试验中,同时过量表达LAR3和Bbchit1基因的毛白杨可以较好的抑制叶枯病菌的生长。
|
图 3 各转基因植株体外抑菌试验 Fig.3 Inhibition of fungal growth by the cell extracts from transgenic plants in vitro A:细胞粗提液对叶枯病体的外抑菌效果Inhibition of fungal growth by the cell extracts from transgenic plants;B:细胞粗提液对叶枯病的抑制率The Inhibition rate of fungal growth by the cell extracts from transgenic plants.a:LAR3 + Bbchit1共表达基因毛白杨Transgenic plants overexpressed LAR3 + Bbchit1;b:过量表达LAR3基因毛白杨Transgenic plants overexpressed LAR3;c:过量表达Bbchit1基因毛白杨Transgenic plants overexpressed Bbchit1;d:非转基因植株Non-transgenic plants。a,b表示不同转基因株系的差异显著性,字母相同表示差异不显著a,b means the significance of difference of transgenic plants, the same letter means no significance(α=0.05,with 3 replicates). |
进一步对LAR3 + Bbchit1共表达转基因毛白杨进行活体抗病效果分析。选取非转基因植株、过量表达LAR3、过量表达Bbchit1以及上述Realtime-PCR检测过的LAR3 + Bbchit1共表达转基因植株,在其叶上接种叶枯病,保湿培养,发现非转基因植株和转空载体植株感病情况严重,培养3天时叶片上就出现病斑,过量表达 LAR3和过量表达Bbchit1基因植株叶片在接种病原菌第6天时仅菌块粘附的部分感病,至12天时仅小面积感病(图 4a);植株培养30天,接种叶枯病菌的非转基因和转空载体毛白杨整株感病,其感病面积高达90%以上(图 4b);然而LAR3 + Bbchit1共表达转基因毛白杨仅接种菌块的叶片上少面积感病(图 4c)。上述结果表明,LAR3 + Bbchit1共表达转基因毛白杨对叶枯病具有更好的抗病效果。
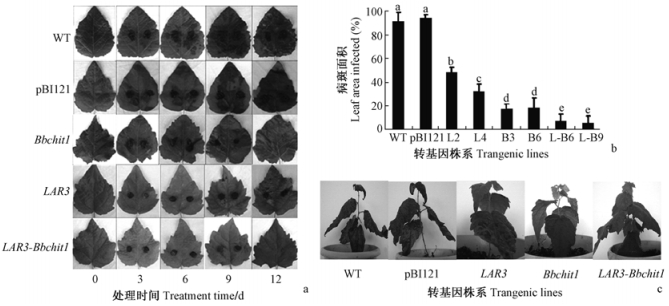
|
图 4 转基因毛白杨对叶枯病的抗性分析 Fig.4 Anti-fungal assay of transgenic plants against A. alternate in vivo a:转基因植株叶片抗病结果Anti-fungal assay of the leaves excised from transgenic plants;b:转基因毛白杨叶片感病面积The calculation of lesion areas in transgenic leaves;c:转基因毛白杨植株抗病结果Anti-fungal assay of transgenic plants in vivo. WT:非转基因植株Non-transgenic plants;pBI121:空载体Empty vector;L2,L4:过量表达LAR3毛白杨Transgenic plants overexpressed LAR3;B3,B6:转Bbchit1基因毛白杨Transgenic plants overexpressed Bbchit1;L-B6、L-B9:过量表达LAR3和Bbchit1基因毛白杨Transgenic plants overexpressed LAR3 + Bbchit1;下同The same below.a,b表示不同转基因株系的差异显著性,字母相同表示差异不显著a,b mean the significance of difference of transgenic plants, the same letter mean no significance(α=0.05,with 3 replicates); 下同The same below. |
在高等植物中,无色花色素还原酶基因LAR是控制单宁代谢合成的关键酶基因,而单宁化合物可有效抑制的真菌生长。在本文中LAR3在抗病过程中并不起直接作用,而是通过单宁来实现,为了进一步验证上述转基因毛白杨抗病结果,笔者检测了转基因毛白杨在叶枯病处理前后单宁含量的变化。
从图 5发现:在叶枯菌处理前,LAR3 +Bbchit1共表达转基因毛白杨具有较高的单宁含量,过量表达LAR3的株系次之;在叶枯菌处理12天后,单宁含量均有不同程度的增加,各个株系处理前后单宁总量的差异达到显著水平。上述结果表明:LAR3 +Bbchit1共表达转基因毛白杨中过量表达的LAR3显著提高了单宁含量,其对提高杨树叶枯病抗病性起到了重要作用。
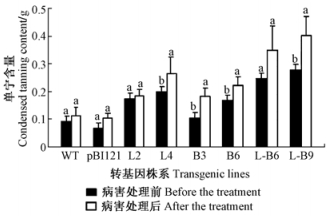
|
图 5 叶枯病处理前后转基因毛白杨中单宁化合物含量测定 Fig.5 Condensed tannin contents in transgenic Chinese white poplar after infection with A. alternate (Fr.) Keissler |
本研究将球孢白僵菌几丁质酶基因Bbchit1通过二次转化转入LAR3过量表达毛白杨中,Real time-PCR检测发现:2基因均能在转基因毛白杨体内有效表达(图 2)。离体抑菌试验证实:LAR3 + Bbchit1共表达转基因毛白杨抑制叶枯菌的效果比单独过量表达LAR3和Bbchit1的植株更明显(图 3)。进一步的活体接菌试验也得到了同样的结果(图 4),叶枯病处理的转基因毛白杨后可溶性缩合单宁含量均不同程度上升,LAR3 +Bbchit1共表达转基因毛白杨中的含量比仅过量表达单个基因的植株略高(图 5)。上述结果表明:过量表达LAR3和Bbchit1基因能协同提高毛白杨对叶枯病的抗性。
LAR是单宁合成途径中的关键酶基因,将杨树内源基因LAR导入毛白杨中过量表达,从而打破单宁合成代谢途径中的限速步骤,使得单宁的合成量提高,对改善杨树生长状况和提高杨树抗病性具有重要意义(Stevens et al.,2004)。单宁重要生物活性之一是对真菌病害的抗性,但其抗病机制并不是很清楚,推测原因在于,大多病原真菌可以分泌水解酶来分解植物组织内大分子物质,而植物也可分泌出抑制水解酶的酸性物质,单宁就是其中之一,真菌水解酶受到抑制后在一定程度上延缓了病程的发展(刘国坤等, 2003;Miranda et al., 2007;Mellway et al., 2009)。
另外,来自于球孢白僵菌的几丁质酶Bbchit1基因转入杨树后均表现出了良好的抗病效果(Jia et al., 2010),主要在于其表达的蛋白能降解真菌菌丝体壁的主要成分之一几丁质,从而达到抑真菌的效果,同时该几丁质酶基因来源于真菌,相比植物特有的几丁质酶来说真菌几丁质酶基因转化植物后表达水平更高,植物可以获得更高效的抗病性(冯金荣等,2006)。本研究将来源于球孢白僵菌几丁质酶基因Bbchit1通过二次转化转入杨树内源基因LAR3过量表达株中,发现共表达株表现出明显的抗病效果。
本试验仅初步研究了LAR基因与Bbchit1的协同抗病作用,并未对其协同机制进行深一层次的研究,但这2种抗病基因之间或者其蛋白之间是否存在更层次的协调机制还有待进一步验证。
| [] | 冯金荣, 惠丰立, 文祯中. 2006. 真菌几丁质酶及其在植物真菌病害防治中的作用. 河南农业科学(8): 83–85. |
| [] | 贾之春. 2011. 外源抗病基因和单宁代谢合成关键酶基因LAR3在毛白杨中协同抗病机理研究. 西南大学生命科学学院硕士学位论文. |
| [] | 李春雷, 崔国新, 许志茹, 等. 2009. 植物二氢黄酮醇4-还原酶基因的研究进展. 生物技术通讯, 39(3): 442–445. |
| [] | 李武汉, 朱伟, 景耀. 1995. 马尾松瘤锈病与酚类物质关系的研究. 西北林学院学报, 10(3): 252–258. |
| [] | 刘国坤, 吴祖建, 谢联辉, 等. 2003. 植物单宁对烟草花叶病毒的抑制活性. 福建农林大学学报:自然科学版, 32(3): 292–295. |
| [] | 孟亮, 崔德才. 2004. 转几丁质酶基因黑杨的获得. 生物技术通报(3): 48–51. |
| [] | 石雪辉, 王淑英, 吴艳纯, 等. 1997. 葡萄叶片中单宁、木质素与抗黑痘病的关系. 葡萄栽培与酿酒(4): 8–11. |
| [] | 吴 文君. 1988. 植物化学保护实验技术导论. 西安, 陕西科学与教育出版社: 141-145. |
| [] | Bolar J P, Norelli L, Wong K W, et al. 2000. Expression of endochitinase from Trichoderma harzianum in transgenic apple increases resistance to apple scab and reduces vigor. Phytopathology, 90(1): 72–77. DOI:10.1094/PHYTO.2000.90.1.72 |
| [] | Horikoshi K, Iida S. 1959. Effect of lytic enzyme from Bacillus circulans and chitinase from Streptomyces sp.on Aspergillus oryzae. Nature, 183(4655): 186–187. |
| [] | Jia Z C, Sun Y M, Yuan L, et al. 2010. The chitinase gene (Bbchit1) from Beauveria bassiana enhances resistance to Cytospora chrysosperma in Populus tomentosa Carr. Biotechnology Letters, 32(9): 1325–1332. DOI:10.1007/s10529-010-0297-6 |
| [] | Lorito M, Sheridan L. Woo, Irene Garcia Fernandez, et al. 1998. Genes from mycoparasitic fungi as a source for improving plant resistance to fungal pathogens. Proc Natl Acad Sci USA, 95(14): 7860–7865. DOI:10.1073/pnas.95.14.7860 |
| [] | Marehant R, Davey M R, Lucas J A, et al. 1998. Expression of a chitinase transgene in rose (Rosa hybrid L.) reduces development of blackspot disease (Diploearpon rosae Wolf). Molecular Breeding, 4(1): 187–194. |
| [] | Mellway R D, Tran L T, Prouse M B, et al. 2009. The wound-, pathogen-, and ultraviolet B-responsive MYB134 gene encodes an R2R3 MYB transcription factor that regulates proanthocyanidin synthesis in poplar. Plant Physiology, 150(2): 924–941. DOI:10.1104/pp.109.139071 |
| [] | Miranda M, Ralph S G, Mellway R, et al. 2007. The transcriptional response of hybrid poplar (Populus trichocarpa×P. deltoides) to infection by Melampsora medusae leaf rust involves induction of flavonoid pathway genes leading to the accumulation of proanthocyanidins. Molecular Plant-Microbe Interactions, 20(7): 816–831. DOI:10.1094/MPMI-20-7-0816 |
| [] | Price P J, Suk W A, Freeman A E, et al. 1978. In vitro and in vivo indications of the carcinogenicity and toxicity of food dyes. International Journal of Cancer, 21(3): 361–367. DOI:10.1002/(ISSN)1097-0215 |
| [] | Swain T, Hills W E. 1959. The phenolic constituents of Prunus domestica. Journal of the Science of Food and Agriculture, 10(2): 63–68. |
| [] | Stevens M T, Lindroth R L. 2004. Induced resistance in the indeterminate growth of aspen (Populus tremuloides). Oecologia, 145(2): 298–306. |
| [] | Yuan L, Wang L J, Han Z J, et al. Molecular cloning and characterization of PtrLAR3, a gene encoding leucoanthocyanidin reductase from Populus trichocarpa, and its constitutive expression enhances fungal resistance in transgenic plants. Journal of Experimental Botany(first published online)(2012-01-20). http://jxb.oxfordjournals.org/content/early/2012/01/20/jxb.err425. |
 2012, Vol. 48
2012, Vol. 48