文章信息
- 王艳梅, 刘震, 牛晓锋
- Wang Yanmei, Liu Zhen, Niu Xiaofeng
- 1年生泡桐不同部位顶芽内源激素的动态变化
- Dynamic Changes of Endogenous Hormones in Terminal Buds from Different Crown Position of One-Year-Old Paulownia
- 林业科学, 2012, 48(7): 61-65.
- Scientia Silvae Sinicae, 2012, 48(7): 61-65.
-
文章历史
- 收稿日期:2011-10-31
- 修回日期:2011-12-06
-
作者相关文章
泡桐(Panlownia)是我国重要的速生用材树种,但在生产中,幼年期泡桐顶芽枯死导致冠大干低,直接影响到泡桐用材的产量和质量。泡桐分布区横跨亚热带和暖温带,范围广,自然变异丰富。在长期的进化过程中,我国北方地区泡桐幼年期顶芽死亡,靠其他侧芽发育成冬休眠芽来适应冬季的寒冷和干燥,翌年由顶芽下第3或第4对侧芽萌发成枝或接干(刘震等,2004)。
针对泡桐顶芽死亡的原因,目前有4种观点:1)泡桐顶芽是由于冬季寒冷冻死的,或在寒害到来时泡桐尚未封顶或未完全木质化造成顶芽枯死(蒋建平,1990);但研究表明:适应我国南方气候特点的白花泡桐(P.fortunei)并不是所有顶芽都能自然接干(刘震等,2004),从河南暖温带地区引种到广东南亚热带地区(广东河源市、广东高要市)后仍存在顶芽在休眠期死亡的现象(叶金山等,2009)。2)由于泡桐顶芽的水分亏缺导致的(侯元凯,2001)。3) “低温-水分胁迫假说”认为冬季休眠期的低温和干燥共同作用的结果导致泡桐顶芽死亡的(叶金山,2009),并通过平埋试验,发现泡桐顶芽不死(叶金山,2009;侯元凯等,2009);4)在泡桐长期进化过程中获得的一种生理生态适应。对泡桐顶侧芽休眠发育的温度特性后发现,栽植于河南郑州的毛白33号泡桐(P.tomentosa ×P.fortunei ‘33’)的顶芽死于11月份之前,侧芽1死于11月中旬之前,不是因为早霜或低温冻害而死(刘震等,2004;王艳梅等,2009)。
上述观点为泡桐顶芽死亡的机理研究提供了参考,但顶芽死亡是一个复杂的过程,受很多内外因素的影响。植物内源激素的变化对环境条件改变响应的灵敏性及在植物生命活动中起着重要的调节功能,因此多数研究者认为内源激素最有可能充当信号物质,调节芽的生长发育,与木本植物芽休眠死亡等适应机制存在着必然的联系(黄鑫等,2008;Arora et al., 2003),是最重要的影响因素之一(Zheng et al., 2004),在悬铃木(Platanus acerifolia) (赵俊勇等,2009)、杨树(Populus)(郝宇等,2010)、银杏(Ginkgo biloba)(张万萍等,2004)、牡丹(Paeonia suffruticosa)(郑国生等,2009)及苹果(Malus pumila)(张雪梅等,2009)等果树的研究报道较多,而目前尚未见有关泡桐顶芽内源激素与死亡方面的研究报道。为此,本文通过研究泡桐不同部位顶芽死亡与激素动态变化的关联性,探索泡桐顶芽死亡的机理。
1 材料与方法 1.1 试验地概况试验地位于郑州市河南农业大学第3生活区林业试验站(113°42′ E,34°43′ N),属于暖温带大陆性气候,年平均气温14.2 ℃,极端最高温度43 ℃,极端最低温度-17.9 ℃,≥10 ℃积温4 717 ℃,无霜期220天,年平均降水量为623.3 mm,全年日照时数大约为2 400 h。2009年年平均气温15.6 ℃,极端最高温度41.9 ℃,极端最低温度-8.6 ℃,≥10 ℃积温5 235.7 ℃,无霜期270天(终霜日2009年2月6日,初霜日2009年11月2日),年平均降水量为762.5 mm。试验地土壤条件为沙壤土,pH8.0左右。
1.2 试验材料采用购自商丘泡桐良种繁殖基地1年生毛白33泡桐埋根苗。苗木平均高度3.64 m,平均胸径4.12 cm,平均地径5.94 cm。
2009年3月上旬进行整地,南北方向打畦,挖1 m×1 m树坑,3月中旬进行种植。从5月开始一直持续到9月,每月的15号进行采样。采样时每个处理随机选取3株泡桐。泡桐芽对生,根据侧枝对数,在树冠上划分出上中下3部分。采取新鲜样品0.5 g,采样的部位分别为主干梢枝的顶芽、上部侧枝的顶芽、中部侧枝的顶芽、下部侧枝的顶芽。
1.3 试验方法采用酶联免疫吸附法(ELISA)测定泡桐顶芽内源激素的变化。试剂盒由中国农业大学作物化学控制实验室提供。
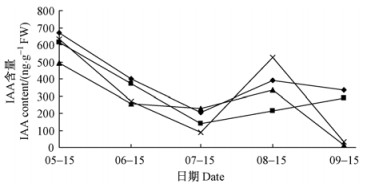
2 结果与分析 2.1 泡桐不同部位顶芽IAA含量的变化由图 1可知:5月15日—8月15日梢枝顶芽、上部侧枝顶芽、中部侧枝顶芽及下部侧枝顶芽IAA的变化趋势一致,为先降低后升高的“V”字形趋势,在5月15日,顶芽的IAA含量普遍较高,表明泡桐顶芽生长处于旺盛时期;5月15日—7月15日,各部位顶芽IAA含量有所下降,尤其是7月15日,IAA含量为谷底,表明泡桐顶芽经过1个速生阶段后,生长量在此期间有所减缓;7月15日—8月15日,不同部位顶芽IAA含量又有所上升,表明泡桐在7, 8月份又有1个生长高峰;8月15日—9月15日,梢枝顶芽、中部侧枝顶芽及下部侧枝IAA顶芽含量呈下降趋势,而上部侧枝顶芽IAA含量却仍处于继续升高趋势,可以预测其下降的趋势可能会推迟;在9月15日,梢枝顶芽IAA含量最高,上部侧枝顶芽的IAA含量尽管处于上升趋势,但仍稍低于梢枝顶芽。整体看来,在9月15日,梢枝顶芽、上部侧枝顶芽的IAA含量整体高于中部侧枝顶芽与下部侧枝顶芽,表明在9月中上旬,泡桐顶芽IAA的极性运输及顶端优势的维持功能;但不同部位顶芽IAA含量的整体呈下降趋势,而中部侧枝顶芽与下部侧枝顶芽的IAA含量已经接近于0,表明泡桐上部枝条的顶芽中IAA的生长速度大幅度减弱,中下部顶芽生长已经接近停止,而梢枝顶芽及上部顶芽有着较高的IAA含量,表明其进入休眠的过冬准备不足。较高的IAA含量可能是导致芽死亡的主因。
|
图 1 泡桐不同部位顶芽IAA含量的变化 Fig.1 The change of IAA content in different position terminal bud in Panlownia —◆—梢枝顶芽Top terminal bud —■—上部侧枝顶芽Upper terminal bud —▲—中部侧枝顶芽Central terminal bud —×—下部侧枝顶芽Lower terminal bud下同。 The same elow. |
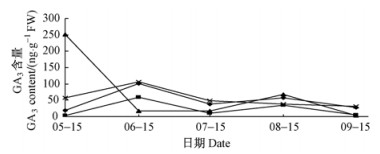
由图 2可知:5月15日—9月15日,梢枝顶芽、上部侧枝顶芽和下部侧枝顶芽含量变化趋势基本相同,均呈现出“上升-下降-上升-下降”的“双峰”形;而中部侧枝顶芽GA3含量呈现出“下降-上官周平477201220上升-下降”的趋势,且在5, 6月份比较剧烈,5月15日最高,为250.52 ng·g-1FW,之后急剧下降,6月15日降到17.22 ng·g-1FW。总体看来,泡桐不同部位顶芽GA3的含量在9月15日较低。赤霉素最显著的效应是促进植物茎伸长,其含量较低,表明泡桐顶芽及泡桐高生长已处于缓慢期。另外,GA3能拮抗ABA的合成,从而能抑制器官的衰老和脱落,但生长后期不同部位顶芽GA3的含量较低甚至降为0,难以起到避免顶芽死亡的作用。
|
图 2 泡桐不同部位顶芽GA3含量变化 Fig.2 The change of GA3 content in different position terminal bud in Panlownia |
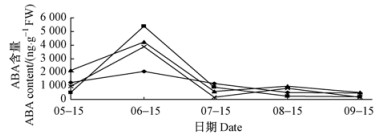
由图 3可知:5月15日—7月15日,泡桐不同部位顶芽ABA含量随时间的变化呈现出大致相同的趋势,均是先升高,至6月15日最高,之后下降;7月15日—9月15日,不同部位顶芽ABA含量均较低,其中梢枝顶芽、上部侧枝顶芽ABA含量变化基本一致,呈持续下降趋势;中部侧枝顶芽、下部侧枝顶芽ABA含量先小幅度上升,8月15日后开始下降;至9月15日,泡桐不同部位顶芽含量基本一致,差别不大。脱落酸多存在于植物的叶、休眠芽、成熟种子中。通常在衰老的器官或组织中的含量比在幼嫩部分中的多;它的作用在于抑制RNA和蛋白质的合成,从而抑制茎和侧芽生长,因此是一种生长抑制剂,有利于细胞体积增大;与赤霉素有拮抗作用;但从试验结果来看:7月15日后,泡桐不同部位顶芽ABA含量反而普遍较低,这一方面表明泡桐顶芽可能未朝着形成休眠芽的方向发展;另一方面也表明其顶芽可能在生长后期逐渐丧失其顶端优势或上端优势。
|
图 3 泡桐不同部位顶芽ABA含量变化 Fig.3 The change of ABA content in different position terminal bud in Panlownia |
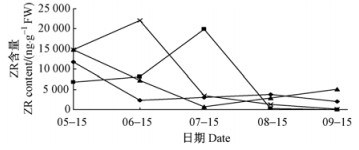
从图 4可知:在5月15日,泡桐不同部位顶芽ZR含量普遍较高且差异较大,最高为中部侧枝顶芽与下部侧枝顶芽,ZR含量达15 000 ng·g-1FW;5月15日,下部侧枝顶芽、上部侧枝顶芽中ZR含量继续上升,分别在6月15日、7月15日达到峰值,而后就持续下降,至9月15日,ZR含量已经为0,下部侧枝顶芽、上部侧枝顶芽中ZR含量变化趋势基本一致,只是上部侧枝顶芽ZR峰值推迟1个月。枝梢顶芽、中部侧枝顶芽中ZR含量趋势基本一致,均呈先下降后上升的趋势,谷底分别出现在6月15日和7月15日,中部侧枝顶芽的谷底推迟1个月;8月15日,枝梢顶芽中ZR在上升后开始下降,而中部侧枝顶芽的ZR仍处上升趋势,但可能是阶段性、暂时性的,其下降趋势可能有所推迟。
|
图 4 泡桐不同部位顶芽ZR含量变化 Fig.4 The change of ZR content in different position terminal bud in Panlownia |
6月15日,下部侧枝顶芽ZR含量为峰值,而枝梢顶芽ZR含量为谷底;7月15日,上部侧枝顶芽ZR含量为峰值,而中部侧枝顶芽ZR含量的谷底,可以看出不同部位顶芽ZR含量存在竞争关系及抑制作用;但不同部位顶芽含量ZR基本呈下降趋势的,到9月15日上部侧枝顶芽与下部侧枝顶芽的ZR含量已经趋于0。
2.5 泡桐不同部位顶芽(IAA+GA3+ZR)/ABA比值变化的影响从图 5可知:5月15日—7月15日,不同部位顶芽(IAA+GA3+ZR)/ABA比值变化趋势大致相似,呈“降低-升高”;7月15日后,上部侧枝顶芽、下部枝梢顶芽的比值一直呈下降趋势,枝梢顶芽的比值继续上升直至8月15日后开始下降;各个部位顶芽的比值均可能呈现“降低-升高-降低”的趋势,只是出现的时间不同;以比值峰值计,上部侧枝顶芽、下部侧枝顶芽同时出现在7月15日;枝梢顶芽推迟1个月,出现在8月15日;而中部侧枝顶芽可能继梢枝顶芽继续推迟1个月,拐点可能就出现在9月15日。
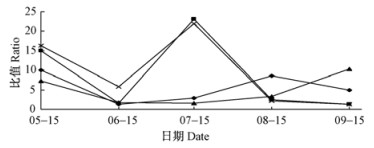
|
图 5 泡桐不同部位顶芽(IAA+GA3+ZR)/ABA比值变化 Fig.5 The change of (IAA+GA3+ZR)/ABA in different position terminal bud in Panlownia |
在6月15日,不同部位顶芽的(IAA+GA3+ZR)/ABA并不比9月15日高,但造成6月15日与9月15日比值低的原因却相差很大。综合图 1~5可知:在6月15日,(IAA+GA3+ZR)/ABA比值低主要是是因为IAA,GA3及ZR降低而ABA上升导致的,而在9月15日,(IAA+GA3+ZR)/ABA比值低,不但IAA,GA3及ZR降低,而ABA也是含量很低,表明泡桐顶芽的内源激素动态平衡出现异常。根据形态学观测,在9月中下旬,泡桐生长已经非常缓慢,顶芽逐渐变褐,顶芽生命迹象基本丧失。
3 讨论与结论 3.1 讨论毛白33号泡桐的高生长停止于9月末10月初,同期泡桐顶芽多数已经由绿变褐而干枯(王艳梅等,2009)。泡桐顶芽生长停止、死亡的发育过程,实质上是促进衰老的激素和抑制衰老的激素之间相互制约、相互平衡的过程,即激素是以系统的方式调控顶芽衰老死亡,而且每种激素都有不同的效应。
Whitelam等(1997)利用转基因技术手段培育的转基因杨树植株为试材研究表明赤霉素和生长素在光周期调控的休眠诱导中具有重要作用。泡桐在8月15日—9月15日,顶芽IAA含量基本上呈下降趋势,有些部位的顶芽IAA含量已经接近于0。顶芽IAA含量的降低,预示着泡桐生长的减缓及停止;而在8,9月份泡桐IAA含量的下降,将导致细胞生命活动降低,特别是细胞生长变缓慢甚至停止,顶芽生长变缓必然伴随着合成内源激素的能力下降,激素含量的减少又影响到顶芽的生长及发育,二者相互影响和制约。较高密度的泡桐片林树体上部能接收到的光照要多于树体下部,梢枝和上部侧枝顶芽得到了更多的光照,即使在生长末期仍有可能进行着生长发育和内源激素的合成,使得生长期延长;顶芽提供的IAA能抑制侧芽的生长,保持顶端优势(夏玉凤等,2008),但顶芽IAA含量的整体降低趋势表明泡桐的顶端优势已经丧失,顶芽衰老死亡不可避免。
GA3具有促进高生长,增强顶端生长优势(闫绍鹏等,2010),延缓衰老的作用。各部位顶芽GA3含量明显比其他3种内源激素低。这能与顶芽的生长发育过程更侧重叶原基细胞数量的增加有关。8月15日— 9月15日,顶芽中GA3的含量普遍不高,且在持续下降,甚至部分部位顶芽的GA3含量已经为0,因此GA3不能发挥抑制顶芽衰老死亡的作用。
ABA是休眠中某些过程的诱导和维持,其含量与休眠、逆境有着密切联系(黄鑫等,2008;杨瑞丽等,2008;郑国生等,2009)。各部位顶芽ABA含量的变化趋势极为相似,即先升高,6月15日时达到峰值,之后开始下降,7月15日之后基本稳定在较低水平。如此相似的变化趋势可能与ABA的抗逆性相关,5月份试验地已有较高气温,之后逐渐升高,伴随着气温的升高ABA含量也开始增加,7月份月平均气温最高,在7月份之前ABA积累到最大量,可能是用于抵抗即将到来的高温胁迫,大量ABA的积累一方面抵抗高温胁迫,另一方面使植株生长减缓,生长缓慢的组织合成ABA的能力下降,7月15日之后ABA含量基本稳定在一定水平。从5月15日—7月15日, GA3与ABA变化趋势一致,而在泡桐生长后期,GA3含量较低,可见GA3未必能拮抗ABA的产生;7月15日—9月15日,ABA含量停留在1个比较稳定的水平线上且含量不高,并未因为GA3含量低而升高;ABA低水平分布不利于泡桐顶芽形成冬休眠芽,可能直接导致泡桐顶芽的死亡。
ZR最基本的作用是促进细胞的分裂,梢枝顶芽和中部侧枝顶芽ZR含量下降后基本稳定在一定水平,上、下部侧枝顶芽含量升高后下降,可能与泡桐顶端优势不明显有关;8月15日—9月15日,顶芽ZR含量总体下降,部分顶芽甚至在9月份已经为0,表明泡桐顶芽在9月中旬已经趋于衰老。
内源激素对植物生长发育的影响不仅仅取决于某种内源激素绝对含量的多少,更重要的是取决于各内源激素的相互作用、动态平衡及某一时期某一激素的主导作用。(IAA+GA3+ZR)/ABA的比值能反映植物的生长与休止状况,比值低说明抑制型激素含量占优势,植物处于休眠状态;促进型激素含量占优势时,(IAA+GA3+ZR)/ABA比值高,植物生长旺盛(李雪梅等,2007)。整体看来,泡桐顶芽(IAA+GA3+ZR)/ABA的比值起变幅较大;8月15日前后,(IAA+GA3+ZR)/ABA的比值较小,反映出促进生长类物质含量整体在降低,表明顶芽和其他邻近组织相比其竞争优势在逐渐丧失,这与毛白33泡桐顶芽死亡,侧芽2,3,4发育成了冬休眠芽基本一致(刘震等,2004):而促进形成休眠芽的ABA事实上也在降低,表明生长后期(IAA+GA3+ZR)/ABA的比值虽然较小,但却不是ABA增加导致的,而是泡桐顶芽内源激素的动态平衡可能已被打破,最终导致了顶芽的死亡。
3.2 结论泡桐不同部位顶芽的死亡与内源激素的变化有着密切关系。在泡桐生长后期,泡桐顶芽内源激素中促进生长的IAA,GA3,ZR含量降低,而促进休眠的ABA不升反而降低,泡桐顶芽内源激素的动态平衡被打破,泡桐顶端优势丧失,这可能就导致泡桐生长停止,顶芽却无法形成冬休眠芽,最终导致顶芽的死亡。
| [] | 郝宇, 梁海永, 杨敏生. 2010. 多拷贝rol基因对转基因杨树生长及内源激素的影响. 林业科学, 46(5): 58–63. DOI:10.11707/j.1001-7488.20100510 |
| [] | 侯元凯, 翟明普, 聂爱社. 2001. 兰考泡桐苗木顶芽水分变化规律研究. 北京林业大学学报, 23(6): 17–21. |
| [] | 侯元凯, 翟明普. 2009. 兰考泡桐苗木顶芽的萌发与接干. 林业科学, 45(3): 167–170. DOI:10.11707/j.1001-7488.20090329 |
| [] | 黄鑫, 戴思兰, 郑国生. 2008. 木本植物芽内休眠机制的研究进展. 林业科学, 44(2): 129–133. DOI:10.11707/j.1001-7488.20080220 |
| [] | 蒋建平. 1990. 泡桐栽培学. 北京, 中国林业出版社: 263-283. |
| [] | 李雪梅, 何兴元, 陈玮, 等. 2007. 大气二氧化碳浓度升高对银杏叶片内源激素的影响. 应用生态学报, 18(7): 1420–1427. |
| [] | 刘震, 何松林, 王艳梅, 等. 2004. 泡桐顶侧芽休眠发育的温度特性研究. 林业科学, 40(3): 46–50. DOI:10.11707/j.1001-7488.20040307 |
| [] | 王艳梅, 牛晓峰, 刘震, 等. 2009. 泡桐生长停止和顶芽死亡过程中的光合特性研究. 北京林业大学学报, 31(6): 121–127. |
| [] | 夏玉凤, 夏桂雪, 汪翠琴, 等. 2008. 生长素与植物顶端优势. 河北师范大学学报:自然科学版, 32(4): 523–525. |
| [] | 闫绍鹏, 杨瑞华, 关录凡. 2010. 转基因与非转基因杂种山杨组培苗内源激素的比较. 林业科学, 46(9): 40–44. DOI:10.11707/j.1001-7488.20100907 |
| [] | 杨瑞丽, 王迎春, 常艳旭. 2008. 长叶红沙劈裂生长的形态发生及其内源激素含量变化. 植物生态学报, 32(2): 385–391. |
| [] | 叶金山, 杨文萍. 2009. 泡桐假二叉分枝机理. 东北林业大学学报, 37(2): 6–7, 24. |
| [] | 张万萍, 史继孔. 2004. 银杏雄花芽分化期间内源激素、碳水化合物和矿质营养含量的变化. 林业科学, 40(2): 51–54. DOI:10.11707/j.1001-7488.20040209 |
| [] | 张雪梅, 李保国, 赵志磊, 等. 2009. 苹果自花授粉花粉管生长和花柱保护酶活性与内源激素含量的关系. 林业科学, 45(11): 20–25. DOI:10.11707/j.1001-7488.20091104 |
| [] | 赵俊勇, 朱平乐, 王艳梅, 等. 2009. 悬铃木冬芽休眠过程中内源激素的动态变化研究. 河南农业大学学报, 43(3): 269–273. |
| [] | 郑国生, 盖树鹏, 盖伟玲. 2009. 低温解除牡丹芽休眠进程中内源激素的变化. 林业科学, 45(2): 48–52. DOI:10.11707/j.1001-7488.20090208 |
| [] | Arora R, Rowland L J, Taninok K. 2003. Induction and release of bud dormancy in woody perennials: A science comes of age. Hort Sei, 38(5): 911–921. |
| [] | Whitelam G C, Devlin P. 1997. Roles of different phytochromes in Arabidopsisphotomorphoge-nesis. Plant Cell Environ, 20(6): 752–758. DOI:10.1046/j.1365-3040.1997.d01-100.x |
| [] | Zheng C, Jin G, Ohno H, et al. 2004. Ethylene production and endogenous gibberellin content in chrysanthemum plants as affected by uniconazole, brushing and aminoethoxyvinylglycine treatments. J Japan Soc Hort Sci, 73(6): 558–567. DOI:10.2503/jjshs.73.558 |
 2012, Vol. 48
2012, Vol. 48

