文章信息
- 柏新富, 朱建军, 王仲礼, 谭永芹, 刘林德
- Bai Xinfu, Zhu Jianjun, Wang Zhongli, Tan Yongqin, Liu Linde
- 干旱区木本植物盐分积累与其耐旱性的关系
- Relationship between the Salt Accumulation and the Drought
- 林业科学, 2012, 48(7): 45-49.
- Scientia Silvae Sinicae, 2012, 48(7): 45-49.
-
文章历史
- 收稿日期:2011-07-30
- 修回日期:2011-10-17
-
作者相关文章
干旱地区由于蒸发量远大于降水量以及植物根系的吸水作用而导致近地表层土壤溶液盐分浓度升高,土壤溶液的离子浓度升高一方面使得土壤溶液的离子更容易被植物吸收,另一方面使土壤溶液的水势降低导致植物水分吸收更加困难。根际环境高浓度的Na+对大多数高等植物会产生渗透胁迫、离子毒害作用,扰乱植物的营养元素平衡(Akita et al., 1990; Stepien et al., 2006),并诱发氧化胁迫等次生胁迫作用(张志刚等, 2009; 韩冰等, 2010),从而影响植物正常生长。目前植物抗盐性的主要研究方向是Na+对植物的不利影响,而有关植物细胞通过质膜和液泡膜Na+/H+逆向转运蛋白(Na+/H+ antiporter)将Na+外排或区域化至液泡的机制以及质膜H+-ATPase和液泡膜H+-PPase, H+-ATPase在此过程的作用,及其相关基因表达更是近年来植物抗性生理及分子生物学研究的热点(Maeshima, 2001; Yu et al., 2007; Roslyakova et al., 2011)。已有试验证明:Na+对许多植物的生长发育或产量、品质都有良好的作用(Harmer et al., 1945;Truog et al., 1953)。荒漠旱生植物霸王(Zygophyllum xanthoxylum)更是把地上部积累Na+作为适应干旱环境的有效策略之一(Wang et al., 2004; 杨鑫光等, 2007)。
在盐渍环境条件下,植物细胞质膜内负外正的膜电势和胞外Na+浓度升高建立起的Na+电化学势梯度,有利于Na+从外界环境到植物细胞内的被动运输(Niu et al., 1995;陈敏等, 2007),因此,干旱环境条件将诱使更多Na+被植物体吸收和积累。目前有关干旱区植物生理生态适应性研究多集中在植物光合作用、水分利用效率、渗透调节等方面,而对干旱环境盐渍化导致的植物积盐及其在植物适应干旱中的作用则少有报道。因此,分析花棒(Hedysarum scoparium)、沙枣(Elaeagnus angustifolia)、梭梭(Haloxylon ammodendron)和柽柳(Tamarix ramosissima)等植物在荒漠干旱环境条件下组织的盐分吸收、积累及其在干旱适应中的作用,将有助于人们对干旱区植物耐旱机制的了解。
1 材料与方法 1.1 试验材料本试验在中国科学院寒区旱区环境与工程研究所临泽试验站进行。试验区属温带干旱荒漠气候类型,多年平均降水量117 mm,年潜在蒸发量2 390 mm。选择站区内同一生境的4种木本植物花棒、沙枣、梭梭和柽柳为材料,每种植物各选3株为供试样株,以树冠外围生长势一致的健壮枝条作为测试样枝。
1.2 试验方法 1.2.1 土壤Na+、K+浓度的测定分别取各种植物的3个供试样株冠幅内地表下40~150 cm深度(地表下0~40 cm为干沙土)的混合土样(每株植株的冠幅下均“品”字形设置3个取样点),共36份土壤样品,立即称其鲜质量,在70 ℃下烘干、磨碎,按四分法取每份样品干土样5 g,按1:5土水比浸提K+、Na+。提取液中Na+、K+含量用原子吸收分光光度计(GBC-932B型,澳大利亚)测定。根据土壤含水量计算土壤溶液Na+、K+的相应浓度。
1.2.2 叶片(同化枝)Na+、K+浓度的测定每种植物的每个供试样株选向阳面外围3个样枝,剪取近顶端当年生成熟叶片或同化枝称鲜质量后在70 ℃下烘干,参照王宝山等(1995)的方法提取Na+、K+。提取液中Na+、K+含量测定同土壤样品。根据叶片(同化枝)含水量计算组织Na+,K+的相应浓度。
1.2.3 植株水势、渗透势的测定在黎明前和中午取每种植物每个供试样株向阳面外围各3个样枝,采用Miller(1985)的压力室法测定植株水势; 叶片(同化枝)渗透势(以近顶端当年生成熟叶片或同化枝为测定对象)采用露点微伏压计(HR-33-T-R, 美国Wescor公司)测定,叶片(同化枝)先在冰箱冷冻24 h以上,取出解冻后挤压出组织液进行测定。
1.2.4 蒸腾失水量的测定利用光合蒸腾测定系统(LI-6400,美国)测定蒸腾速率。测定时光照强度1 450~1 520 μmol·m-2s-1,温度31.5~32.8 ℃,大气相对湿度23.0%~23.7%。为了便于不同植物之间的比较,测定后立即称量叶室中叶片(同化枝)的鲜质量,然后将测定结果转换为每克鲜质量每小时蒸腾失水量(mg·g-1h-1)。每株植物测定3次。
1.2.5 光合作用有效水势范围的测定将剪取的供试枝条在室内进行水分饱和处理,使测试枝达到水分饱和,随后在室内对测试枝进行自然脱水,在脱水过程中的不同时间取测试枝测其水势和光合速率,从而获得不同水势下的光合速率。光合速率测定利用美国LI-COR公司生产的LI-6400便携式光合作用测定系统,采用开放式气路进行测定,测定时光照强度1 150~1 200 μmol·m-2s-1,CO2浓度为大气CO2浓度(380~395 μL·L-1)。
2 结果与分析 2.1 4种植物对环境盐分吸收和积累的比较对花棒、沙枣、梭梭和柽柳组织(叶片或同化枝)以及植株冠幅内根际土壤的K+、Na+浓度的测定结果(表 1)发现,不同植物的组织K+浓度无显著差异(P > 0.05),而组织Na+浓度除花棒和沙枣之间差异不显著外,其他植物相互之间有极显著差异(P < 0.01),其中梭梭组织Na+浓度是柽柳的2倍多、花棒和沙枣的约8倍;不同植物根际环境中K+差异不大,但Na+浓度却有极显著差异(P < 0.01),其中梭梭和柽柳根际环境Na+浓度显著高于花棒和沙枣。可见,梭梭和柽柳能够吸收、积累较多的Na+,且根际具有明显的“盐岛”效应(郗金标等, 2004; 刘德江等, 2009),而花棒和沙枣组织Na+浓度相对较低,根际“盐岛”效应也不及梭梭和柽柳。
|
|
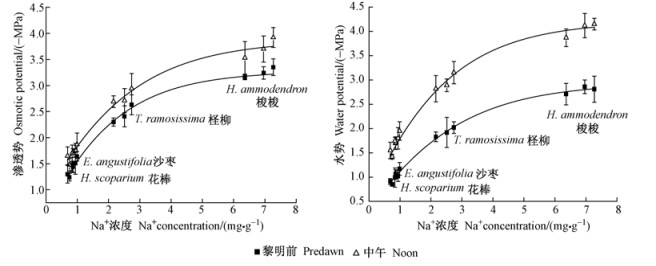
水势是反映植物水分状况的重要指标(Chone et al., 2001),水势越低,吸水能力越强,忍耐和抵抗干旱的能力也越强(Jongdee et al., 2002; 付爱红等, 2005)。在渗透胁迫下,植物多积累有机渗透调节物质或无机离子来降低组织渗透势,增强吸水动力(董伊晨等2009),其中又以积累无机离子较为经济(陈成升等, 2009)。4种植物中午的水势和渗透势均低于黎明前,且各种植物的水势变化幅度均大于渗透势的变化幅度(表 2)。在4种植物中,梭梭的水势和组织渗透势最低,柽柳次之,花棒和沙枣则较高。进一步分析水势和渗透势变化与组织Na+、K+离子浓度的关系可见,两者均与其组织Na+浓度呈极显著相关(图 1),而与组织K+浓度无明显相关性,即Na+的吸收和积累是降低梭梭、柽柳等组织渗透势,增强其植株吸水力的重要因素。
|
|
|
图 1 植物组织Na+浓度与组织渗透势和水势的关系 Fig.1 The relationship between the Na+ concentration in tissue solutions and the osmotic/water potentials of the tissues |
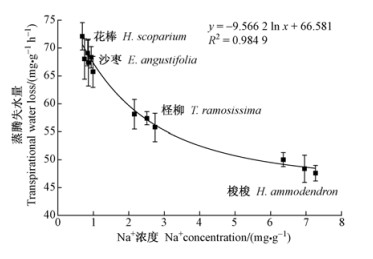
低的组织渗透势和水势,可以增强组织的保水力、降低蒸腾失水(周海燕等, 1996)。通过对4种植物K+、Na+含量与蒸腾失水量关系的分析发现,蒸腾失水量与组织Na+浓度呈显著负相关(R2=0.98) (图 2),而与组织K+浓度无明显相关性,即组织Na+的积累增强了植株的保水能力、降低了蒸腾失水量。
|
图 2 植物组织Na+浓度与蒸腾失水量的关系 Fig.2 2 Na+ concentrations in tissues in relation to the transpirational water loss |
已有研究表明: Na+能够保持叶绿体结构的完整性(Brownell et al., 1996)、增加植物组织的含水量,从而提高光合能力(Martinez et al., 2005; Slama et al., 2007)。对4种植物不同枝叶水势状态下叶片(同化枝)光合速率的测定及其与组织Na+浓度的关系的分析发现,梭梭在枝叶水势-0.5~-5.2 MPa的范围内可维持有效的光合作用;柽柳在枝叶水势-0.5~-4.1 MPa的范围内可维持有效的光合作用;而沙枣和花棒仅在-0.4~-2.5 MPa和-0.4~-2.1 MPa的范围内可维持有效的光合作用(图 3)。可见,组织Na+浓度高的植物其光合速率的有效水势范围较大。进一步分析发现,组织Na+浓度与光合作用有效水势范围之间呈显著正相关(图 4)。
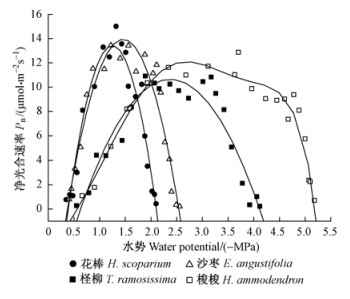
|
图 3 4种植物离体脱水条件下光合速率与水势的变化关系 Fig.3 The photosynthetic rate in relation to the changes in water potentials in detached twigs in the four plants |
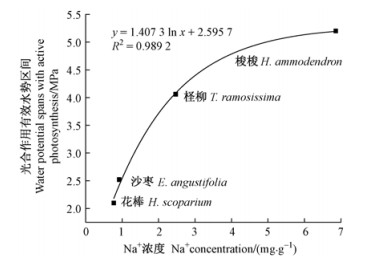
|
图 4 4种植物光合作用水势阈值与组织Na+浓度的关系 Fig.4 The water potential spans with active photosynthesis in relation to the Na+ concentrations in tissues of the four arid plants |
在干旱条件下,盐分的摄入使植物在较低能耗的前提下吸收、积累Na+,降低渗透势、维持膨压,从而增强渗透调节能力和提高根系从外界吸收水分的能力(Slama et al., 2007; 陈成升等, 2009)。而荒漠干旱区植物一方面需要在提高吸水能力的同时尽可能地减少水分的消耗,另一方面又需要在水分供应有限的条件下最大限度地生长和累积有机物,以增加个体大小、增强对不利环境的抵抗力(柏新富等,2008)。对花棒、沙枣、梭梭和柽柳等4种植物组织Na+吸收及其与组织水势、渗透势、蒸腾耗水量以及光合作用的关系的测定发现:在同样的生境下,梭梭、柽柳体内能够积累更多的Na+离子,特别是梭梭,而花棒和沙枣则相对较少;且组织水势、渗透势和蒸腾失水率与组织Na+浓度均呈显著负相关,而光合作用对水分亏缺的耐受范围则与组织Na+浓度呈正相关,即对Na+的吸收和积累不仅有利于增强渗透调节能力和吸水动力、减少水分的消耗,还有助于有机物的积累。已有试验证明:Na+能够显著提高荒漠植物的渗透调节能力(Song et al., 2006)、增强叶片净光合速率和抗氧化酶活性(马清等,2010;蔡建一等,2011),且NaCl提高荒漠植物抗旱能力的原因并非是促进植物体内有机渗透调节物质的积累,而是在于植物从外界吸收Na+并发挥Na+在植物体内的渗透调节作用(Wang et al., 2004; 蔡建一等, 2011)。一些非盐生植物在盐胁迫下也可以通过积Na+来调节渗透势、降低水势、减少蒸腾耗水(丁菲等,2009;Zhu et al., 2011)。由此可见,在荒漠干旱环境条件下,由于蒸发量远大于降水量以及植物根系的吸水作用而导致近地表层土壤溶液盐分浓度升高,形成干旱和盐渍的双重胁迫,荒漠干旱区植物以消耗尽可能少的能量吸收和积累较多的Na+等无机离子参与渗透调节,增强水分吸收能力和减少水分消耗量,是其适应荒漠干旱、盐渍化环境的最佳选择。
无论是盐生植物还是非盐生植物细胞质都要维持低Na+水平(Blumwald, 2000; 陈敏等, 2007),因此高等植物一般利用质膜H +-ATPase水解ATP产生能量把Na+逆电化学势梯度排出到细胞外(Quintero et al., 2000),或将Na+区隔化入液泡降低植物细胞的水势增强植物的吸水动力(李平华等, 2003)。梭梭等在地上部积累大量的Na+,其细胞质如何避免高浓度Na+的影响以及Na+在细胞内的区域化情况需要进一步研究,才能更深入的了解荒漠植物梭梭等积Na+抗旱的机制。
| [] | 柏新富, 朱建军, 赵爱芬, 等. 2008. 几种荒漠植物对干旱过程的生理适应性比较. 应用与环境生物学报, 14(6): 763–768. |
| [] | 蔡建一, 马清, 周向睿, 等. 2011. Na+在霸王适应渗透胁迫中的生理作用. 草叶学报, 20(1): 89–95. |
| [] | 陈成升, 谢志霞, 刘小京. 2009. 旱盐互作对冬小麦幼苗生长及其抗逆生理特性的影响. 应用生态学报, 20(4): 811–816. |
| [] | 陈敏, 李平华, 王宝山. 2007. Na+转运体与植物的耐盐性. 植物生理学通讯, 43(4): 617–622. |
| [] | 丁菲, 杨帆, 张国武, 等. 2009. NaCl胁迫对构树幼苗叶片水势、光合作用及Na+、K+吸收和分配的影响. 林业科学研究, 22(3): 428–433. |
| [] | 董伊晨, 刘悦秋. 2009. 土壤水分对异株荨麻(Urtica dioica)保护酶和渗透调节物质的影响及其与叶片光合和生物量的相关性. 生态学报, 29(6): 2845–2851. |
| [] | 付爱红, 陈亚宁, 李卫红, 等. 2005. 干旱、盐胁迫下的植物水势研究与进展. 中国沙漠, 25(5): 744–749. |
| [] | 韩冰, 孙锦, 郭世荣, 等. 2010. 钙对盐胁迫下黄瓜幼苗抗氧化系统的影响. 园艺学报, 37(12): 1937–1943. |
| [] | 李平华, 张慧, 王宝山. 2003. 盐胁迫下植物细胞离子稳态重建机制. 西北植物学报, 23(10): 1810–1817. DOI:10.3321/j.issn:1000-4025.2003.10.028 |
| [] | 刘德江, 刘耘华, 盛建东, 等. 2009. 北疆荒漠植被梭梭立地土壤盐分特征研究. 水土保持学报, 23(2): 47–51. |
| [] | 马清, 楼洁琼, 王锁民. 2010. Na+对渗透胁迫下霸王幼苗光合特性的影响. 草业学报, 19(3): 198–209. DOI:10.11686/cyxb20100326 |
| [] | 王宝山, 赵可夫. 1995. 小麦叶片中Na、K提取方法的比较. 植物生理学通讯, 31(1): 50–52. |
| [] | 郗金标, 张福锁, 陈阳, 等. 2004. 盐生植物根冠区土壤盐分变化的初步研究. 应用生态学报, 15(1): 53–58. |
| [] | 杨鑫光, 傅华, 牛得草. 2007. 干旱胁迫下幼苗期霸王的生理响应. 草业学报, 16(5): 107–112. |
| [] | 张志刚, 尚庆茂, 王立浩, 等. 2009. 亚适温、弱光照及盐胁迫下辣椒叶片活性氧代谢特征. 园艺学报, 36(11): 1603–1610. DOI:10.3321/j.issn:0513-353X.2009.11.007 |
| [] | 周海燕, 黄子琛. 1996. 不同时期毛乌素沙区主要植物种光合作用和蒸腾作用的变化. 植物生态学报, 20(2): 120–131. |
| [] | Akita S, Cabuslay G S. 1990. Physiological basis of differential response to salinity in rice cultivars. Plant and Soil, 123(2): 277–294. DOI:10.1007/BF00011281 |
| [] | Blumwald E. 2000. Sodium transport and salt tolerance in plants. Current Opinion in Cell Biology, 12(4): 431–434. DOI:10.1016/S0955-0674(00)00112-5 |
| [] | Brownell P F, Bielig L M. 1996. The role of sodium in the conversion of pyruvate to phosphoenolpyruvate in mesophyll chloroplasts of C4 plants.Australian Journal of Plant Physiology, 23(2): 171 -177. Australian Journal of Plant Physiology, 23(2): 171–177. DOI:10.1071/PP9960171 |
| [] | Chone X, Van Leeuwen C, Dubourdieu D, et al. 2001. Stem water potential is a sensitive indicator of grapevine water status. Annals of Botany, 87(4): 477–483. DOI:10.1006/anbo.2000.1361 |
| [] | Harmer P M, Benne E J. 1945. Sodium as a crop nutrient. Soil Science, 60(2): 137–148. DOI:10.1097/00010694-194508000-00007 |
| [] | Jongdee B, Fukaib S, Cooper M. 2002. Leaf water potential and osmotic adjustment as physiological traits to improve drought tolerance in rice. Field Crops Research, 76(2-3): 153–163. DOI:10.1016/S0378-4290(02)00036-9 |
| [] | Maeshima M. 2001. Tonoplast transporters: organization and function. Annual Review of Plant Physiology and Plant Molecular Biology, 52: 469–497. DOI:10.1146/annurev.arplant.52.1.469 |
| [] | Martinez J P, Kinet J M, Bajji M, et al. 2005. NaCl alleviates polyethylene glycol-induced water stress in the halophyte species Atriplex halimus L. Journal of Experimental Botany, 56(419): 2421–2431. DOI:10.1093/jxb/eri235 |
| [] | Miller D M. 1985. Studies of root function in Zea mays.Ⅲ. Xylem sap composition at maximum root pressure provides evidence of active transport into the xylem and a measurement of the reflection coefficient of the root. Plant Physiology, 77(1): 162–167. |
| [] | Niu X, Bressan R A, Hasegawa P M, et al. 1995. Ion homeostasis in NaCl stress environments. Plant Physiology, 109(3): 735–742. DOI:10.1104/pp.109.3.735 |
| [] | Quintero F J, Blatt M R, Parda J M. 2000. Functional conservation between yeast and plant endosomal Na+/H+ antiporters. FEBS Letters, 471(2-3): 224–228. DOI:10.1016/S0014-5793(00)01412-5 |
| [] | Roslyakova T V, Molchan O V, Vasekina A V, et al. 2011. Salt tolerance of barley: Relations between expression of isoforms of vacuolar Na+/H+-antiporter and Na+ accumulation. Russian Journal of Plant Physiology, 58(2): 24–35. |
| [] | Slama I, Ghnaya T, Messedi D, et al. 2007. Effect of sodium chloride on the response of the halophyte species Sesuvium portulacastrum grown in mannitol-induced water stress. Journal of Plant Research, 120(2): 291–299. DOI:10.1007/s10265-006-0056-x |
| [] | Song J, Feng G, Tian C Y, et al. 2006. Osmotical adjustment traits ofSuaeda physophora, Haloxylon ammoderon and Haloxylon persicum in filed or controlled conditions. Plant Science, 170(1): 113–119. DOI:10.1016/j.plantsci.2005.08.004 |
| [] | Stepien P, Klobus G. 2006. Water relations and photosynthesis in Cucumis sativus L.leaves under salt stress. Biologia Plantarum, 50(4): 610–616. |
| [] | Truog E, Berger K C, Attoe O J. 1953. Response of nine economic plants to fertilization with sodium. Soil Science, 76(1): 41–50. DOI:10.1097/00010694-195307000-00005 |
| [] | Wang S M, Wan C G, Wang Y R, et al. 2004. The characteristics of Na+, K+ and free proline distribution in several drought resistant plants of the Alxa Desert, China. Journal of Arid Environments, 56(3): 525–539. DOI:10.1016/S0140-1963(03)00063-6 |
| [] | Yu J N, Huang J, Wang Z N, et al. 2007. An Na+/H+ antiporter gene from wheat plays an important role in stress tolerance. Journal of Biosciences, 32(9): 1153–1161. |
| [] | Zhu Z, Zhang R F, Liu T W. 2011. Solute accumulation and osmotic adjustment characteristics of the mangrove Avicennia marina under NaCl-induced salinity stress. Botanica Marina, 54(3): 335–341. |
 2012, Vol. 48
2012, Vol. 48