文章信息
- 甘国峰, 陆叶, 徐进, 施季森
- Gan Guofeng, Lu Ye, Xu Jin, Shi Jisen
- 杉木花粉和花粉管中的微管分布
- Microtubule Organization in Pollen and Pollen Tube of Cunninghamia lanceolataGan Guofeng Lu Ye Xu Jin Shi Jisen
- 林业科学, 2012, 48(7): 39-44.
- Scientia Silvae Sinicae, 2012, 48(7): 39-44.
-
文章历史
- 收稿日期:2011-11-10
- 修回日期:2012-01-09
-
作者相关文章
花粉萌发、花粉管生长是一个复杂的生理过程。在花粉萌发、花粉管内原生质流动、花粉管顶端生长等方面不仅有微丝的活动,而且许多研究表明微管在花粉萌发中也起着重要的作用,认为微管在花粉管生长中的作用与微丝相反,微管不是控制花粉管生长的主要因子(Mascarenhas,1993)。但一些研究发现微管马达蛋白在花粉管顶端存在并与高尔基体囊泡结合(Liu et al., 1994),因此微管和微管马达蛋白很可能在花粉管的生长中起作用。由于不同物种花粉中微管分布不同,甚至同一物种花粉不同部位、不同生长阶段微管分布不尽相同,所以对于在花粉和花粉管中的微管分布还没有统一的观点。与花粉萌发中微丝骨架的研究相比较,微管骨架的研究显得较滞后。目前关于裸子植物微管骨架的研究报道较少,主要集中在欧洲云杉(Picea abies) (Lazzaro,1999)、黑松(Pinus thunbergii) (李国平等,2006)、银杏(Ginkgo biloba)(Liu et al., 2005)等树种。
杉木(Cunninghamia lanceolata)是我国特有树种,也是我国重要的用材树种。由于裸子植物与被子植物在生理活动和进化上存在差别,其细胞骨架的分布也可能有所差异。本研究应用间接免疫荧光标记结合激光共聚焦显微镜对杉木花粉和花粉管中的微管骨架分布进行观察,研究杉木花粉萌发过程中微管骨架的变化,可为进一步探究裸子植物受精过程提供参考,为林木育种研究提供依据。
1 材料与方法 1.1 试验材料2008年3月中上旬在南京林业大学树木园采集即将散粉的杉木小孢子,用70%酒精灭菌20 s,0.1%升汞灭菌5 min,用无菌水洗3次,无菌滤纸吸干,放入灭菌干燥小瓶,置于放有干燥剂的容器中,用硅胶干燥后分别于4 ℃和-20 ℃下密封保存待用。
1.2 杉木花粉微管骨架的间接免疫荧光定位花粉从冰箱内取出,均匀撒在10%蔗糖、0.004%硼酸,pH5.8培养基上,在26 ℃下萌发。从培养基中取出萌发花粉,参考Lazzaro(1999)以及Liu等(2005)中间接免疫荧光标记技术。具体方法如下:将取出的杉木花粉及花粉管用4%多聚甲醛固定液固定1 h,同时抽气5min。用PEM缓冲液洗涤花粉,重复3次,每次10 min;加入1%纤维素酶+1%果胶酶的混合液,35 ℃下酶解30~50 min,并不时摇晃;加入封闭液处理5 min,重复3次;封闭处理后分3份,1份加入一抗鼠抗兔脑β-微管蛋白的单克隆抗体IgG,在4 ℃条件下孵育过夜,PBS冲洗;加入二抗FITC交联的羊抗鼠IgG在35 ℃黑暗条件下孵育2 h,另2份作为对照试验组,1份仅加入二抗,1份一抗和二抗都不加。滴入50%甘油封片;用Leica TCS SL共聚焦激光扫描系统进行连续光学切片扫描,所采用激发光波长为488 nm(FITC),采集记录图像。
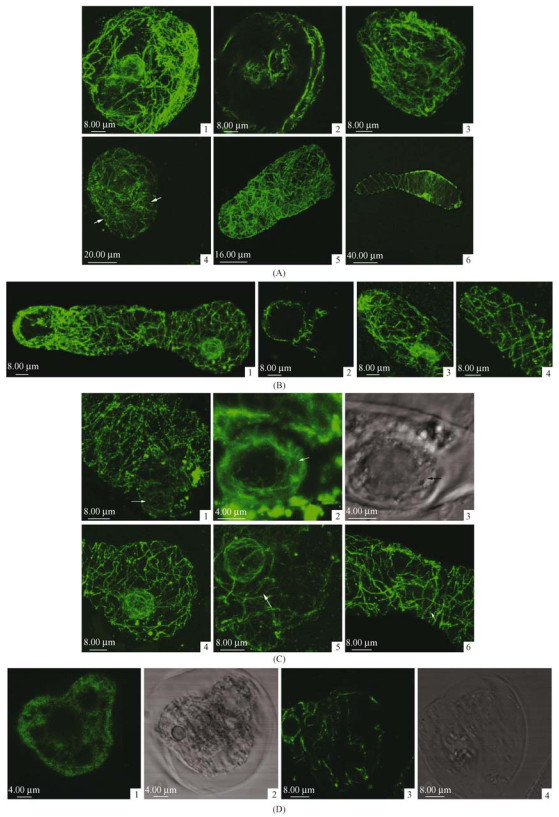
2 结果与分析 2.1 杉木花粉萌发过程中微管骨架的动态变化经过大量取材制片,结合间接免疫荧光标记表明在水合膨大的花粉中存在浓密的微管网络,通过3D图和单切面图显示微管主要存在于花粉粒的周质,在周质中的微管互相交错排列,呈现横向或斜向分布(图 1A-1, 2, 4);在不同的角度可以看到涡旋状的微管排列(图 1A-3);但随着花粉水合极化,花粉中微管横向或斜向分布更加清楚(图 1A-4);同时有部分微管存在核周围,这些微管向外发散与周质微管相连形成网络(图 1A-2, 4)。
|
图 1 杉木花粉萌发时花粉和花粉管中的微管变化 Fig.1 Microtubules in germinating pollen of Cunninghamia lanceolata |
当花粉萌发后,微管开始从花粉粒延伸入花粉管中,在花粉管中形成横向、斜向或螺旋状的微管排列(图 1A-5),在少数处于花粉萌发初期的花粉管中这种横向或螺旋的排列会延伸到花粉管中部,甚至于顶端(图 1A-6)。随着花粉管的生长,花粉及花粉管中微管分布出现一定的变化,在花粉粒细胞质中微管分布更加整齐有序,在花粉及花粉管基部质膜下构成类似于“弹簧”形式的环状结构,与花粉管生长方向形成垂直的横向或螺旋状分布(图 1B-1)。
在杉木花粉管中微管分布呈现不同的结构。在部分杉木花粉管中部微管骨架逐步呈现出与花粉管伸长方向相平行的网络状分布,并延伸到花粉管顶端(图 1B-1)。而在部分花粉亚顶端区域微管形成一个垂直于花粉管伸长方向的排列,在花粉管亚顶端区域荧光信号强烈,通过3D图和单切面图显示在花粉管顶端区域微管主要分布在质膜下,但在花粉管顶端的中央区域微管分布较少(图 1B-2)。同时在有些花粉管顶端却未出现上述的亚顶端垂直分布以及中央区域微管缺失的现象,在这类花粉管中螺旋状分布的微管一直延伸到亚顶端,微管在顶端形成复杂的网络结构(图 1B-3)。而在另一部分花粉中花粉管顶端微管排列有序,呈明显的螺旋形,仅仅在最顶端质膜下出现向后折回(图 1B-4)。
2.2 微管骨架与生殖细胞及管细胞的关系在萌发的杉木花粉中,在生殖细胞周围存在浓密的微管,微管围绕在生殖细胞的细胞膜周围(图 1C-1);通过单一切面图显示生殖细胞内也存在微管分布,在生殖细胞膜下交错排列成网络状结构,但微管未伸入细胞核(图 1C-2, 3);可以看出微管从生殖细胞膜上发散,并围绕生殖细胞形成网络结构,有的在生殖细胞周围形成环状结构(图 1C-4, 5)。
在管细胞周围也存在微管分布,管细胞周围微管主要以网络状排列为主,管细胞悬浮在花粉管微管网络中(图 1C-6)。微管沿着管细胞膜延伸,部分围绕在管细胞周围,但微管未伸入管细胞内,并且通过与生殖细胞周围微管分布相比较,管细胞周围的微管分布比生殖细胞周围微管分布稀疏(图 1C-1, 2)。
2.3 微管骨架与花粉生活力的关系通过观察不同活力的杉木花粉内微管分布,发现在培养后的无生活力花粉中细胞出现变形,呈现不规则形状,在花粉中无清晰的微管结构,微管荧光呈现弥散状,有较多的点状荧光分布(图 1D-1, 2),而在正常水合萌发花粉中已经形成明显的微管分布(图 1D-3, 4)。
A.杉木花粉及花粉管中微管骨架分布
Microtubules in the pollen and pollen tube of Cunninghamia lanceolata
1.水合花粉中微管骨架;2.单切面图显示花粉中横向分布的微管骨架;3.花粉中涡旋分布的微管骨架;4.花粉中螺旋或横向分布的微管;5.花粉管伸出后微管分布;6.萌发初期幼嫩花粉管中的微管呈现横纹状分布并延伸到顶端。
1. Microtubules in the hydrated pollen; 2. In the single scan, microtubules were arranged transversely in the hydrated pollen; 3. Microtubules displayed as a swirl in the hydrated pollen; 4. Microtubules distributed obliquely or transversely in pollen; 5. Microtubules in early stage of germinated pollen; 6. In young and tender pollen tube, microtubules were arranged transversely and extended into the pollen tube tip.
B.杉木花粉管中微管骨架分布
Microtubules in the pollen tube of Cunninghamia lauceolata
1.杉木花粉管基部中微管骨架呈现横向或螺旋状分布;2.花粉管顶端与生长方向垂直分布的微管;3.微管在花粉管顶端构成复杂的网络;4.花粉管顶端螺旋状分布的微管。
1. In germinated pollen tubes, microtubules were arranged obliquely or transversely, but from the sub-apex in the pollen tube, they were rearranged along the tube long axis; 2. The transition of microtubules from net radial to net axial is marked by arrows; 3.Microtubules form a complex network in the tip of pollen tube; 4. Microtubules were arranged obliquely in the tip of pollen tube.
C.杉木花粉及花粉管中的微管与核
Microtubules and nucleus in the pollen and pollen tube of Cunninghamia lanceolata
1.生殖细胞周围微管骨架;2.生殖细胞内微管骨架单切面图;3.生殖细胞荧光图像所对应的显微图像;4.花粉中微管骨架;5.生殖细胞周围环状微管骨架;6.花粉管内微管围绕着管核。
The microtubules around the generative cell; 2. Microtubules formed a network in the generative cell; 3. Phase contrast microscopic figure of the same tube as 2; 4. Microtubules within the germinated pollen grain; 5. Microtubules ringed the generative cell; 6. Microtubule bundles surrounded the tube cell surface.
D.不同生活力的杉木花粉中微管分布
Microtubules in different viability pollen of Cunninghamia lanceolata
1, 2.无生活力花粉中微管分布; 3, 4.正常萌发的水合花粉微管分布单切面图。
1, 2. The Microtubules in pollen have no viability; 3, 4. The single scan of microtubules in the hydrated pollen.
在杉木花粉粒中,微管主要是分布在细胞周质,同时其分布方式主要是横向或斜向的螺旋为主,从一定角度观察会呈现类似涡旋的微管分布,这与被子植物(洋水仙Narcissus cyclamineus)类似。但这种分布形式与裸子植物银杏、欧洲云杉不同,在银杏和欧洲云杉的花粉粒细胞中,微管分布主要为网络状分布(Lazzaro,1999;Liu et al., 2005), 而在黑松花粉中也发现在花粉粒中微管呈斜向或横向分布(李国平等,2006),这说明裸子植物花粉中微管分布不尽相同。
在杉木花粉管基部微管也是以横向或斜向的螺旋为主,这与裸子植物白皮松(Pinus bungeana)的花粉管中微管分布类似(Terasaka et al., 1994),在处于花粉萌发初期的白皮松花粉管中会呈现出斜向的螺旋状排列,而在处于花粉萌发初期的的杉木花粉管中也会出现螺旋状分布的微管,并一直延伸到花粉管的顶端;同时通过两者图片比较,两者也是存在一定差异,杉木花粉管中微管分布更加规则,在杉木花粉管中更倾向于横向的螺旋分布,而在白皮松花粉管中微管是斜向的螺旋分布。杉木花粉管中的微管分布与其他裸子植物相比较也存在较大差别,如欧洲云杉、银杏、黑松花粉管中微管是以平行于花粉管生长方向的网络状分布为主(Lazzaro,1999;Liu et al., 2005;李国平等,2006)。同时与被子植物花粉相比较,杉木花粉管中微管主要是螺旋分布,在一般被子植物花粉管中微管主要是沿花粉管纵轴排列(王晓华等,2007;王凤茹等,2002)。
杉木花粉管顶端微管分布与被子植物相比较有很大差别,被子植物花粉管顶端缺乏微管(王凤茹等,2002),而杉木花粉管顶端存在有浓密的微管网络。但是在杉木花粉管顶端的微管分布形式较多样:有些花粉管顶端的微管不再平行分布于周质,而是形成互相交错的复杂网络;同时在部分花粉管顶端区域端存在与裸子植物欧洲云杉花粉管顶端一样的分布方式,即存在与花粉管生长方向相垂直的微管分布,而且通过单一切面观察,在花粉管顶端与微管垂直分布区的中间区域微管分布减少,并且在这区域周围有微管围绕;而有些花粉管中螺旋分布的微管会一直延伸到顶端。这些分布形式在其他裸子植物中并无介绍。
杉木花粉及花粉管中这种微管分布形式可能与花粉的发育有密切联系。花粉是幼嫩的植物细胞,处于不断延伸扩展的阶段,它的细胞壁较幼嫩,对细胞的支撑作用不足,因而在花粉及花粉管基部的平行排列的横向或螺旋状微管可能对细胞形态的维持起到一定的作用,同时横向或螺旋状的微管又不会影响花粉的顶端生长,所以在杉木花粉及花粉管基部一般都是平行排列的横向或螺旋分布的微管。杉木花粉管顶端不同的微管分布形式,可能是花粉管顶端的不断生长导致微管在花粉管顶端分布呈现相应的动态变化。所以花粉管顶端微管分布差异与花粉管顶端生长的关系值得进一步研究。
3.2 微管骨架与生殖细胞及管细胞的关系对洋水仙花粉的免疫荧光研究表明:在洋水仙花粉原生质体皮层部分有涡旋状的微管网络,微管束从营养核核膜向外辐射,在生殖细胞周围的微管分布未出现特殊形式,但在生殖核内微管分布呈现多种形式,多数呈网状,也有部分与长轴平行排列(徐是雄, 1993;1996;王凤茹等, 2002;Justus et al., 2004)。
对欧洲云杉的研究表明:在欧洲云杉花粉的精原细胞和柄细胞复合体周围存在贯穿整个花粉细胞质的微管网络,而且在精原细胞和柄细胞内也有复杂的微管网络存在;而在营养核周围微管与核膜相连接,形成轴向排列的包裹营养核的微管网络(Lazzaro,1999)。
本文研究表明杉木花粉生殖细胞内微管主要是以环状结构为主,这与洋水仙生殖细胞和欧洲云杉精原细胞内微管分布都存在区别。而杉木花粉管细胞周围的微管分布与欧洲云杉的营养核周围微管分布较为类似。
3.3 微管骨架与花粉生活力的关系研究表明微管蛋白在花粉发育过程中有着重要的作用,如由于核酸或蛋白质的变化可产生不具有活力的花粉,所以微管蛋白的变化对花粉发育有重要的作用。此外花粉正常发育基因的表达受到干扰,也会造成花粉在发育的某个时期缺乏核酸和蛋白质,使花粉的发育因核酸和蛋白质的缺乏而受阻(Fernando et al., 2005)。周涵韬等(2003)对玉米(Zea mays)雄性不育系败育前后的α-微管蛋白基因转录量进行研究,证实雄性不育系败育前后的α-微管蛋白基因转录量存在差异,这也证明α-微管蛋白与玉米细胞质雄性不育性密切相关,在花粉发育中起着重要的作用。Ye等(2003)对水稻(Oryza sativa)雄性不育系珍汕97A小孢子母细胞减数分裂期间微管变化的研究表明微管系统的变化与花粉败育有着密切联系。本文观察到在杉木萎缩变形的无生活力花粉细胞中无清晰的微管结构,微管荧光呈现弥散状,有较多的点状荧光分布,这也从形态上说明微管系统的变化与花粉生活力存在密切的联系。
3.4 杉木花粉管生长中微管与微丝的共同作用对各类极性生长的细胞研究发现微丝与微管共同参与细胞的极性生长过程,由于花粉管生长是一种典型的极性生长,对其生长机制也有一些报道。花粉管生长所依赖的物质常包被在囊泡和膜被细胞器中(Hepler et al., 2001),研究发现在花粉管中囊泡、膜被细胞器主要以微丝为轨道转运到顶端(王晓华等,2007),而在花粉管中微管主要负责定位细胞生长所需的膜物质和壁物质,决定细胞生长方向,使细胞产生极性并维持极性生长。研究表明用微管的稳定剂(taxol)或解聚剂(oryzalin propyzamide)处理叶表皮细胞、胚轴等极性生长的细胞,细胞可继续生长,但生长方向不定向(Mathur et al., 2000);通过对欧洲云杉的研究表明当用微管特异性药物秋水仙素、Propyzamide等处理时,花粉管生长受抑制,易出现分枝(Anderhag et al., 2000)。这说明微管对维持细胞生长方向和生长极性非常重要,但对细胞的伸长生长影响较小,细胞伸长生长主要受微丝的调控。
微丝微管对花粉管的胞质环流也有重要作用,在裸子植物花粉管中微管和微丝协同调控花粉管顶端喷泉式胞质流动,用Latrunculin B处理松科(Pinaceae)植物的花粉管,破坏花粉管中微丝骨架,可以完全抑制花粉管的顶端生长,降低细胞器的运动;用Propyzamide或Oryzalin破坏微管会导致细胞器的向顶运输和微丝的结构改变,改变胞质环流方向,使顶端微丝变形,说明微管控制细胞器在花粉管中具有定位作用,通过影响微丝结构,从而影响胞质流动方向(Justus et al., 2004)。而且用低浓度的CD或LatB处理花粉管,会使近顶端区域的环状微丝结构受到明显破坏,花粉管极性生长也受到明显抑制,但是这种处理不会对花粉管主干部分的粗微丝束和胞质环流造成明显影响,这说明近顶端环状微丝结构与花粉管主干中的粗微丝束不同,可能是由于精细的微丝束构成在调控花粉管极性生长的过程中发挥不同的作用(Gibbon et al., 1999)。所以花粉管中微丝和微管相互作用共同调控花粉管的极性生长。
本试验中发现,杉木花粉粒和花粉管基部微管主要在质膜下呈横向的螺旋分布,而杉木花粉及花粉管基部微丝主要分布在核周围和花粉管中央(甘国峰等,2011),据此推断在花粉粒及花粉管基部微丝与微管的分布可能不同,微丝在此部位可能主要负责花粉管的生长所需物质的运输,微管负责维持细胞形态的功能;而杉木花粉管的顶端微管与微丝都会呈现多样的分布方式,所以在花粉管顶端微管可能负责调节花粉管的生长方向,而微丝调节花粉管的伸长,两者互相配合共同调控花粉管的正常生长。因此还需要通过药理学、免疫学的试验方法去进一步研究杉木花粉管生长过程中微管与微丝的作用。
| [] | 甘国峰, 徐进, 陆叶, 等. 2011. 杉木花粉和花粉管中微丝骨架. 林业科学, 47(3): 175–177. DOI:10.11707/j.1001-7488.20110326 |
| [] | 李国平, 黄群策, 杨鹭生, 等. 2006. 黑松花粉与花粉管中微管分布. 林业科学, 42(9): 13–16. |
| [] | 王晓华, 郝怀庆, 王钦丽, 等. 2007. 花粉管细胞机构与生长机制研究进展. 植物学通报, 24(3): 340–354. |
| [] | 王凤茹, 张笑归. 2002. 植物细胞骨架及其在花粉萌发中的作用. 河北农业科学, 6(2): 18–22. |
| [] | 徐是雄. 1993. 洋水仙花粉原生质体中微管骨架的免疫荧光及共焦显微镜观察. 植物学报, 35(7): 513–518. |
| [] | 徐是雄, 朱澂. 1996. 植物细胞骨架. 北京, 科学出版社: 40-47. |
| [] | 周涵韬, 许莉, 郑文竹, 等. 2003. α-微管蛋白与玉米细胞质雄性不育的相关性研究. 厦门大学学报:自然科学版, 42(1): 107–111. |
| [] | Anderhag P, Hepler P K, Lazzaro M D. 2000. Microtubules and microfilaments are both responsible for pollen tube elongation in the conifer Picea abies (Norway spruce). Protoplasma, 214(3/4): 141–157. |
| [] | Fernando D D, Lazzaro M D, Owens J N. 2005. Growth and development of conifer pollen tubes. Sex Plant Reprod, 18(4): 149–162. DOI:10.1007/s00497-005-0008-y |
| [] | Gibbon B C, Kovar D R, Staiger C J. 1999. Latrunculin B has different effects on pollen germination and tube growth. Plant Cell, 11(12): 2349–2363. DOI:10.1105/tpc.11.12.2349 |
| [] | Hepler P K, Vidali L, Cheung A Y. 2001. Polarized cell growth in higher plants. Annu Rev Cell Dev Biol, 17(1): 159–187. DOI:10.1146/annurev.cellbio.17.1.159 |
| [] | Justus C D, Anderhag P, Goins J L, et al. 2004. Microtubules and microfilaments coordinate to direct a fountain streaming pattern in elongating conifer pollen tube tips. Planta, 219(1): 103–109. DOI:10.1007/s00425-003-1193-2 |
| [] | Lazzaro M D. 1999. Microtubules organization in germinated pollen of the conifer Picea abies (Norway spruce). American Journal of Botany, 86(6): 759–766. DOI:10.2307/2656696 |
| [] | Liu G Q, Cai G, Casino C D, et al. 1994. Kinesin-related polypeptide is associated with vesicles from Corylus avellana pollen. Cell Motil Cytoskeleton, 29(2): 155–156. DOI:10.1002/(ISSN)1097-0169 |
| [] | Liu J, Zhang H, Li Y. 2005. Cytoskeleton in pollen and pollen tubes of Ginkgo biloba L. Journal of Integr Plant Biol, 47(8): 952–958. DOI:10.1111/jipb.2005.47.issue-8 |
| [] | Mascarenhas J. 1993. Molecular mechanisms of pollen tube growth and differentiation. Plant Cell, 5(10): 1303–1314. DOI:10.1105/tpc.5.10.1303 |
| [] | Mathur J, Chua N H. 2000. Microtubule stabilization leads to growth reorientation in Arabidopsis trichome. Plant Cell, 12(4): 465–477. DOI:10.1105/tpc.12.4.465 |
| [] | Terasaka O, Niitsu T. 1994. Differential roles of microtubule and actin-myosin cytoskeleton in the growth of Pinus pollen tubes. Sex Plant Reprod, 7(5): 264–272. |
| [] | Ye Xiulin, Edward Yeung, Xu Shixiong, et al. 2003. Microtubule structure and male sterility in a gene-cytoplasmic male sterile line of rice, Zhen Shan 97A. Acta Botanica Sinica, 45(2): 183–192. |
 2012, Vol. 48
2012, Vol. 48

