文章信息
- 孙海伟, 刘静, 宋健, 翁曼丽, 罗磊, 黄艳艳, 张虹, 牛庆霖, 王斌, 冯殿齐
- Sun Haiwei, Liu Jing, Song Jian, Weng Manli, Luo Lei, Huang Yanyan, Zhang Hong, Niu Qinglin, Wang Bin, Feng Dianqi
- 转AmGS基因红叶石楠的分子检测及抗寒性分析
- Molecular Identification and Cold-Resistance Analysis of the AmGS Transgenic Photinia×fraseri 'Red Robin' Plants
- 林业科学, 2012, 48(7): 30-38.
- Scientia Silvae Sinicae, 2012, 48(7): 30-38.
-
文章历史
- 收稿日期:2012-02-29
- 修回日期:2012-05-21
-
作者相关文章
2. 泰山林业科学研究院 泰安 271000;
3. 中国科学院遗传与发育生物学研究所 北京 100101
2. Taishan Institute of Forestry Science Tai'an 271000;
3. Institute of Genetics and Developmental Biology, Chinese Academy of Sciences Beijing 100101)
红叶石楠(Photinia× fraseri ‘Red Robin’)由石楠(Photinia serrulata)和光叶石楠(Photinia glabra)杂交育成(黄美娟等,2003),被誉为“红叶绿篱之王”,是用途广泛的乔、灌兼用型高档彩色树种,具有生长快、耐修剪、观赏价值高的特点,深受人们喜爱,是当前重要的热点彩色绿化树种之一(芦建国等,2007;杜建会等,2009)。针对红叶石楠抗寒性较差、冬季在我国北方易受到低温冻害的缺点,近年来国内研究人员对红叶石楠抗寒性、变色机制、越冬适应性等方面开展了相关研究,以期通过驯化和抗寒适应性筛选得到抗寒品种(芦建国等,2008;杨静等,2008),但一直没有选育成功的报道。随着分子生物学的发展,利用基因工程技术将抗寒基因转到植物体内培育抗寒品种成为当前林木抗寒育种研究的热点之一(Griffith et al., 1992;Thomashow, 1998;Worrall et al., 1998),也为红叶石楠抗寒育种开辟了一条新途径。
肌醇半乳糖苷合成酶(galactinol synthase,GS,早期称之为GolS)催化UDP-半乳糖和myo-肌糖合成肌醇半乳糖苷的反应,该反应是蜜三糖家族的低聚糖(raffinose family oligosaccharides, RFOs)合成的第1个步骤,是RFOs合成途径最关键的调控步骤(Liu et al., 1998)。GS基因的表达对RFOs的积累和植株在冬季的存活起到重要的作用(Cunningham et al., 2002)。在研究最深入的拟南芥(Arabidopsis thaliana)中已经鉴定出了7个GS基因。低温能诱导其中之一(AtGS3)的表达,干旱能诱导其中2个GS基因(AtGS1和AtGS2)的表达。随着研究不断深入,迄今,研究人员已经先后在拟南芥、匍匐筋骨草(Ajuga reptans)、玉米(Zea mays)、沙冬青(Ammopiptanthus mongolicus)、741杨(Populus alba×grandidentata)等植物中发现了GS基因40多个(Sprenger et al., 2000;Taji et al., 2002;Zhao et al., 2004;Cao et al., 2009;Philippe et al., 2010;Unda et al., 2012)。但迄今从木本植物中克隆的GS基因只有1个,即AmGS基因(宋健, 2007)。
AmGS基因(galactinol synthase gene of Ammopiptanthus mongolicus,AmGS)是从高度抗寒的常绿树种沙冬青中克隆的抗寒基因(宋健,2007;Fei et al., 2008),其基因全长989 bp,含有3个外显子和2个内含子,在GenBank的注册登录号DQ519361,并申报了国家发明专利。该基因不仅受到冷冻胁迫的诱导,同时还受到干旱、高盐以及激素ABA的诱导。用AmGS基因转化大肠杆菌(Escherichia coli)菌株BL21(DE3),获得的转基因菌株抗寒性明显提高,转AmGS基因拟南芥抗寒性和抗冻性也明显增强(宋健,2007)。经过泰安市泰山林业科学研究院和中国科学院遗传与发育生物学研究所研究人员多年努力,建立了AmGS基因转化石楠的高效转化体系,并且成功地将AmGS基因转入红叶石楠,初步获得了转AmGS基因的红叶石楠株系。为了从转AmGS基因红叶石楠植株中选育出抗寒能力强、应用前景好的新株系,本研究在以前获得转基因植株的基础上,继续对转AmGS基因红叶石楠植株进行分子检测和抗冻性研究,为选育红叶石楠抗寒新品系打下基础。
1 材料与方法 1.1 转基因植株用于研究的转AmGS基因红叶石楠株系是中国科学院遗传与发育生物学研究所和泰山林业科学研究院在前期转化试验中获得的7个转基因株系,R6—R12。由泰安市泰山林业科学研究院生物技术中心组培保存并进行切芽扦插扩繁,提供本试验用。
1.2 转基因植株的抗生素筛选将初步获得的转基因红叶石楠株系植株转移到50 mg·L-1卡那霉素MS固体培养基上培养。苗高1.5~2.0 cm,培养温度(25±2) ℃,光照强度约为2 000 lx,光周期为12 h·d-1。非转基因植株逐步枯黄、死亡,30天继代培养1次,60天后仍能正常生长的植株初步被认为是转基因植株。
1.3 转基因植株的PCR检测对通过抗生素筛选得到的抗卡那霉素的植株,再进行PCR检测(polymerase chain reaction, 聚合酶链式反应)。按照刘静等(2011)报道的方法,分别提取转基因植株和未转化植株组培苗的总DNA,用作PCR反应的模板。所用的引物序列如下:
正向引物:5′-TCATGGCACCTGATATCACCACCGCT-3′;
反向引物:5′-TATTAGGCAGCGGATGGGGCGGGAA-3′。
反应体系:反应总体积为25 μL,包括:2.5 μL 10×Buffer,0.4 mmol·L-1 dNTP, 2 mmol·L-1 MgCl2,1 U Taq DNA polymerase,1 μL正向引物,1 μL反向引物,1 μL模板DNA(DNA浓度10 ng·μL-1),ddH2O加至终体积25 μL。
反应程序:预变性,94 ℃,5 min;94 ℃变性40 s,55 ℃扩增40 s,72 ℃延伸1 min,35个循环;最后,在72 ℃延伸5 min。扩增产物用1%的琼脂糖凝胶电泳检测。
1.4 转基因植株的Southern检测对PCR检测结果阳性的植株和未转基因植株同时送到北京美莱博医学科技有限公司生物技术服务部采用地高辛标记法进行Southern检测(Sambrook et al., 1989)。标记的DNA是从pCAMBIA2300-AmGS质粒DNA中用XbaⅠ和SalⅠ双酶切得到包含AmGS基因的1 kb的片段。红叶石楠植株的核基因组DNA同样也经过XbaⅠ和SalⅠ双酶切。
1.5 转基因植株的RT-PCR分析按照Chomczynski等(1987)的方法提取转基因植株和未转化植株组培苗的去根全苗(茎和叶)的总RNA,按照厂家提供的说明书的介绍,用cDNA合成试剂盒(Promega, USA)合成cDNA第1链。再用RT-PCR试剂盒(Promega, USA)进行RT-PCR(reverse transcription-PCR,逆转录PCR)分析。试验分为冷冻处理组和不进行冷冻处理的对照组:进行冷冻处理的材料从组培室转移到4 ℃光照培养箱中预培养24 h(使植株在4 ℃下有个过渡适应), 然后将温度降至-12 ℃,继续培养24 h,冷冻处理结束后立即提取其总RNA;不进行冷冻处理的对照组,在提取总RNA前24 h从组培室转移到4 ℃光照培养箱中预培养24 h后, 立即提取其总RNA。
RT-PCR所用的引物序列如下:
正向引物: 5′-TGTGAAGAAGTGGTGGGACA-3′;
反向引物: 5′-CCCAAAACGAAAAGGAAATG-3′。
反应体系:反应总体积为25 μL,包括:2.5 μL 10×Buffer,0.4 mmol·L-1 dNTP, 2 mmol·L-1 MgCl2,1 U Taq DNA polymerase,PCR引物各1 μL,模板DNA 1 μL,ddH2O加至终体积25 μL。
反应程序:预变性,94 ℃,4 min;94 ℃变性1 min,58 ℃扩增1 min,72 ℃延伸1 min,34个循环;最后,在72 ℃延伸10 min。试验中用446 bp的水稻(Oryza sativa)actin1基因片段作为扩增产物的内参对照。扩增产物经1%的琼脂糖凝胶电泳后在Densito Meter(Model GS-670, Bio-Rad)检测仪上进行检测。试验重复3次。目标产物条带和内参对照actin条带的强度比用于衡量RT-PCR产物的相对含量。
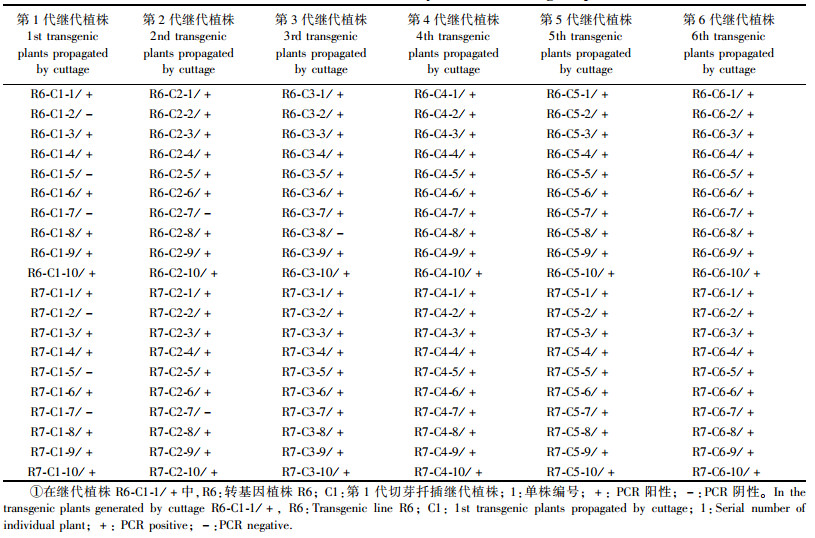
1.6 转基因植株的遗传传递为了解AmGS基因在转基因红叶石楠中的遗传传递,对转基因株系通过切芽扦插进行扩繁,获得了各个转基因株系的第1次至第6次切芽扦插继代植株,将其分别命名为C1—C6。对C1—C6继代植株随机选取10个单株进行PCR检测,根据扩增产物的有无来判断导入的AmGS基因在转基因红叶石楠植株中的存在与否。
1.7 转基因植株的抗寒能力试验将通过切芽扦插扩繁得到足够数量的继代植株C6,移栽于增殖培养基上(配方为:MS+BA1.0 mg·L-1+NAA0.05 mg·L-1),每瓶6株,继续培养20天。在4 ℃条件下预处理24 h,然后分别在0 ℃和-6 ℃冷冻处理6, 12, 24和36 h。冷冻处理结束后,在4 ℃黑暗条件下解冻培养基3 h,然后放在正常生长温度下复苏培养(温度24 ℃,光照时间12 h·d-1)48 h后,观察其表型,叶片冻伤情况,复苏后叶片仍失绿的植株视为死亡植株,其余的视为成活植株。统计各种处理中的植株存活率(复苏后成活株数/供试总株数×100%)。每种处理20株(共5瓶),重复3次。用DPS软件统计分析,用EXCEL软件作图。
1.8 植株相对电导率和LT50的测定相对电导率(relative electrical conductivity,REC)是反映植株抗寒性的重要生理指标。将转基因植株与未转基因的对照植株置于4 ℃,12 h·d-1的条件下进行光照培养,预处理24 h,然后于0,-4,-8,-12,-16 ℃各处理24 h。每个处理温度组中每种供试材料随机取3株,将叶片用去离子水冲洗2次,再用洁净滤纸吸净表面水分。用6~8 mm的打孔器避开主脉打取叶圆片,每组叶片打取叶圆片30片,分装在3支洁净的刻度试管中,每管放10片,采用膜渗透-电解质外渗法(赵世杰等,2002)测定叶片相对电导率,重复3次,用DPS软件进行分析、比较。
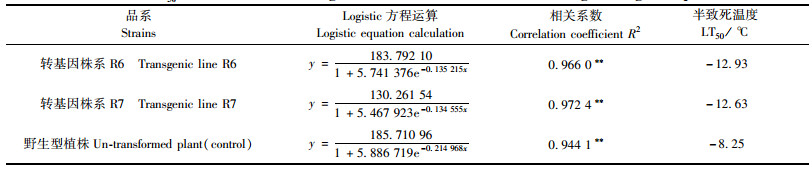
半致死温度(semilethal temperature,LT50)是植物抗寒性测定中广泛采用的一个形态指标。采用膜渗透-电解质外渗法测定的植物组织在不同温度下电解质外渗的累积量总是呈“S”形曲线分布,Lyons等(1970)把低温对植物细胞膜伤害过程用Logistic曲线加以表示。在Logistic方程y= k/(1+ae-bx)中,y为相对电导率(REC),x为处理温度,k,a,b则是方程的参数。把前面试验中得到的转基因株系R6,R7和未转基因的对照植株REC数值利用唐士勇(1993)的方法,计算得出方程的参数(k,a和b)数值,推导Logistic方程的二阶导数并令其为零,计算方程的拐点温度LT50。
2 结果与分析 2.1 转化株系抗生素筛选在含有50 mg·L-1卡那霉素的MS固体培养基上培养后,非转基因的植株逐渐枯黄,生长受到抑制,最后死亡(图 1);60天后能够存活下来而且生长正常的植株就初步被认定为转基因植株。本研究中共得到32个抗卡那霉素的转基因植株,经培养分别形成株系。

|
图 1 转基因植株的卡那霉素筛选 Fig.1 Kanamycin screening of the transgenic plants A:转化受体红叶石楠; B:转化体在卡那霉素筛选培养基上的生长情况;C:筛选出的抗卡那霉素的植株。 A: The transformation receptor Photinia×fraseri'Red Robin'; B: Transformants growing on the kanamycin screening medium; C:The screened kanamycin-resistant transformants. |
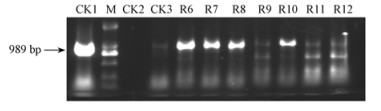
32个抗卡那霉素的转化体中PCR阳性的有22个,这些PCR阳性的植株中都扩增出1条与预期长度一样大小的989 bp的片段,这表明AmGS基因已经整合到这些植株的基因组DNA中,初步认为这些植株为转基因植株。本研究中对7个转基因株系(R6—R12)进行了PCR分析(图 2),可以看出4个转基因株系(R6,R7,R8和R10)PCR检测结果呈强阳性。
|
图 2 转基因红叶石楠的PCR检测 Fig.2 PCR identification of the transgenic plants CK1:阳性对照(AmGS基因, pCAMBIA2300-AmGS);M:DNA marker(DL2000);CK2:阴性对照1(水);CK3:阴性对照2(未转基因的植株);R6-R12:本研究中所用的7个转基因株系。箭头指出特异的PCR扩增产物条带。 CK1: Positive control (pCAMBIA2300-AmGS); M: DNA marker(DL2000); CK2: Negative control 1(water); CK3: Negative control 2 (Untransformed plant); R6-R12: The 7 transgenic lines used in this study. Arrow indicates the specific PCR product. |
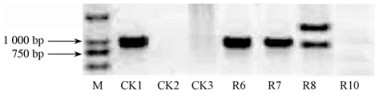
对PCR检测结果阳性的4个转基因株系(R6,R7,R8和R10)进行了Southern杂交分析,结果显示:其中1个转基因株系(R10)没有给出杂交信号;另外3个转基因株系(R6,R7和R8)都给出明显的杂交信号,其中R6和R7显示出单一的杂交带,R8显示出2条杂交带。上述结果说明AmGS基因已经整合到这3个转基因株系(R6,R7和R8)的基因组DNA中(图 3)。
|
图 3 转基因红叶石楠的Southern检测 Fig.3 Southern identification of the transgenic plants M:DNA marker(DL2000);CK1:阳性对照(AmGS基因,pCAMBIA2300-AmGS);CK2:阴性对照1(水);CK3:阴性对照2 (未转基因的植株);R6,R7,R8和R10:4个不同的转基因株系。 M: DNA marker(DL2000); CK1: Positive control (pCAMBIA2300-AmGS); CK2: Negative control 1 (ddH2O); CK3: Negative control 2 (untransformed plant); R6, R7, R8 and R10: Four different transgenic lines. |
RT-PCR(reverse transcription-PCR)结果(图 4)表明:未转基因的对照植株在低温处理和没经低温处理的2组试验中都没有扩增产物,而2个转基因株系在低温处理和没经低温处理2组试验中都得到扩增产物,在低温处理的试验组中,扩增产物的数量大大提高(大约为不经低温处理试验组的3倍左右)。上述结果表明:低温处理诱导了导入的AmGS基因的表达,提高了转基因植株抗寒性。
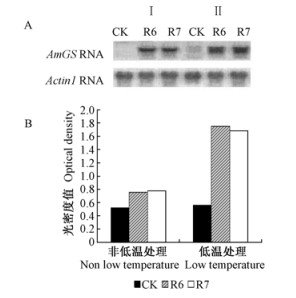
|
图 4 转基因株系的RT-PCR分析 Fig.4 RT-PCR analysis of the transgenic lines A: RT-PCR产物的Agarose(1%)凝胶电泳分析Ⅰ.未经低温处理的试验组; Ⅱ.低温处理试验组(-6 ℃, 24 h). B. RT-PCR产物条带的光密度测定。 A: Agarose gel electrophoresis of the RT-PCR products Ⅰ. Without cold treatment; Ⅱ. Treated for 24 h at -6 ℃. B: Densitometry analysis of the RT-PCR products. |
对上面得到的2个含有单拷贝AmGS基因的转基因株系(R6和R7)进一步进行了AmGS基因的遗传传递试验。对R6和R7株系通过连续切芽扦插扩繁得到的第1次至第6次切芽扦插继代植株分别命名为C1, C2, C3, C4, C5和C6,对C1至C6继代植株分别进行PCR检测(表 1)。从表 1的结果可以看出:在C1,C2和C3继代植株中,个别植株出现过PCR阴性的结果,但从C4至C6继代植株中都没出现PCR阴性的植株,这表明导入的AmGS基因在这2个转基因株系中能遗传下去,在C4以后的继代植株基本趋向稳定。
|
|
按照材料和方法中介绍的方法对2个转基因株系(R6和R7)和未转基因的对照植株分别在0 ℃和-6 ℃进行了6, 12, 24和36 h的冷冻处理(图 5)。可以看出:在0 ℃处理试验中,2个转基因株系在直至处理24 h,都没有表现出明显的伤害。但未转基因的对照植株在处理12 h后,表现出明显的伤害;处理24 h后,植株大量死亡;处理36 h后,全部死亡。在-6 ℃处理试验中,2个转基因株系直至处理12 h后都没有表现出明显的伤害;在处理24 h后,植株表现出明显的伤害,部分植株死亡;在处理36 h后,植株大量死亡。而未转基因的对照植株在处理6 h后即表现出明显的伤害,部分植株死亡;处理12 h后,植株全部死亡。上述结果表明转基因株系R6和R7的抗寒性得到了明显提高,导入的AmGS基因提高了转基因株系的抗寒性。

|
图 5 转基因植株的抗寒能力测定 Fig.5 Determination of the cold-tolerance of transgenic plants |
随后,对转基因株系R6和未转基因的对照植株进行了更大温度范围和处理时间范围的抗寒能力测定,对转基因株系和未转基因的对照植株在各种低温处理条件下的存活率进行了比较(图 6)。从图 6A可以看出:转基因植株在-3 ℃处理3,6,12,24 h后,存活率均接近100%;处理48 h后存活率下降,但存活率显著高于对照未转基因植株(α=0.05)。对照存活率呈逐渐下降趋势,在处理48 h后几乎全部死亡。图 6B的结果表明:转基因植株在-6 ℃处理3,6,12,24 h后存活率逐渐下降,但存活率一直显著高于同处理组的未转基因对照植株(α=0.05),但在处理48 h后全部死亡。未转基因的对照植株在-6 ℃处理3,6 h后存活率迅速下降,12 h后几乎全部死亡。图 6C的结果表明:转基因植株-12 ℃处理3,6,12 h后的存活率显著高于对照,在24 h后几乎全部死亡;而对照未转基因植株在处理6 h后几乎全部死亡。图 6D的结果表明:转基因植株在-18 ℃处理12 h后几乎全部死亡,而对照在处理3 h后全部死亡。从以上试验看出,在多种低温处理下,转基因植株都比未转基因的对照植株表现出较好低温存活率,抗寒能力明显优于未转基因的对照植株,说明导入的抗寒基因确实提高了红叶石楠的抗寒性。
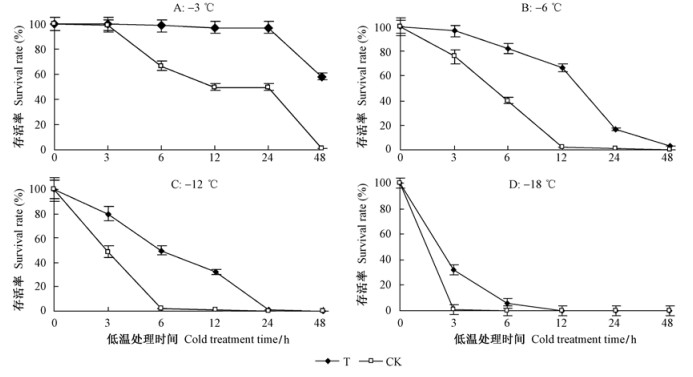
|
图 6 转基因株系R6和未转基因的对照植株在-3,-6,-12,-18 ℃不同处理时间的存活率 Fig.6 Survival rate of the transgenic line R6 and the untransformed control plant treated at -3, -6, -12, -18 ℃ for different time T:转基因株系R6;CK:未转基因的对照植株 T:Transgenic line R6; CK:Untransformed plant(control) |
转基因株系R6,R7和未转基因的对照植株相对电导率(REC)的测定结果示于图 7。REC测定结果表明:随处理温度的逐渐降低,转基因株系和未转基因的对照植株的REC都逐渐升高;但转基因株系升高的程度明显低于未转基因的对照植株。经低温处理后,在0 ℃和-4 ℃处理的转基因株系和未转基因对照植株REC的变化都达到差异显著的程度(α=0.05),在-8,-12,-16 ℃处理的转基因株系和对照植株的REC的变化都达到极显著差异(α=0.01),转基因株系R6和R7间的差异不显著。
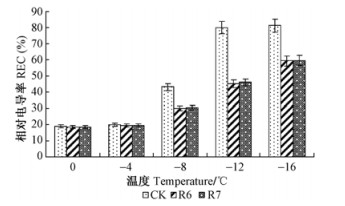
|
图 7 低温处理后相对电导率的变化 Fig.7 Relative electrical conductivity (REC) changes after low temperature treatment |
由表 2可以看出:R6株系的LT50是-12.93 ℃,R7株系的LT50是-12.63 ℃,未转基因的对照植株的LT50是-8.25 ℃;2个转基因株系的LT50很接近,都明显低于未转基因对照植株,分别下降了4.68 ℃和4.38 ℃。这一结果说明转基因株系的抗寒能力有了明显提高。
|
|
近年来,利用遗传转化技术将外源植物抗寒基因转入植物中,在模式植物、蔬菜和农作物中都取得了很大的进展(黄永芬等, 1997;王冬梅等,2011;Worrall et al., 1998;Wallis et al., 1997;Fan et al., 2002),但成功转化木本植物的报道很少(Lal et al., 2008)。国内外林木抗寒基因克隆研究中,已经在蓝桉(Eucalyptus globulus)、白桦(Betula platyphylla)、甜杨(Populus suaveolens)、毛白杨(Populus tomentosa)等木本植物中克隆获得抗冻基因25个(Gamboa et al., 2007;Welling et al., 2008;林元震,2006;林元震等,2007;Zhou et al., 2007;李少锋等,2011),迄今为止,还未见到木本植物的抗寒基因成功转化木本植物并获得表达的报道。由于草本植物和木本植物结构的不同,用来自木本植物的抗寒基因转化林木、果树更容易成功,也更容易表达。本文通过对AmGS转基因红叶石楠的综合分析、表型分析和功能验证,获得了多方面、多层次的证据,充分说明AmGS基因已经整合到木本植物红叶石楠转基因植株的基因组DNA中,并能稳定地遗传下去。转基因植株的一些与抗寒性相关的生理指标(如REC,LT50)、形态指标(存活率等)发生了明显变化,抗寒性得到了提高,筛选得到了抗寒性明显提高的红叶石楠转基因新种质,为林木、果树的抗寒育种提供了新的选择途径。
分子鉴定(包括PCR,Southern,Northern,RT-PCR,Western等)可以提供有力的资料证明目标基因克隆成功与否,可以使研究者快速鉴定出真正的转基因植株,提高工作效率,但要选出有实用价值的材料还必须进行目标农艺性状的田间鉴定和筛选(如本研究中抗寒能力、LT50的测定和筛选)以及与目标农艺性状直接相关的生理指标的测定(如本研究中的REC)。目标农艺性状的田间形态的鉴定和筛选一般需要连续进行几个世代。由于多种原因转基因植株会发生分离,目标基因会丢失或沉默,因此,从得到的转基因植株中鉴定出稳定、纯合的转基因植株并了解导入的目标基因在转基因植株中的遗传传递和遗传稳定性,对于最终选出理想的株系也是不可忽视的。由于木本植物的多年生特性,要像草本植物那样用每个世代的种子长出的新一代材料进行导入基因遗传传递和遗传稳定性研究是不可能的,本研究中用切芽扦插得到的继代材料研究了导入的AmGS基因在切芽扦插继代材料中的遗传传递和遗传稳定性,提供了一些可供参考的资料。
许多植物抗寒性的鉴定试验都证明了应用电导法测定REC的变化并配以Logistic方程求拐点温度作为植物的半致死温度(LT50),能较直观且准确地反映植物的抗寒性和所能忍耐的低温极限,在草本植物和木本植物抗寒性测定中都得到广泛应用(朱根海等,1985;刘友良等,1985;许瑛等,2008;刘建等,2009;郭卫东等,2009;焦奎宝等,2010)。本研究的结果也表明LT50是一个实用的抗寒性检测指标。
本研究通过对已获得的转AmGS基因红叶石楠植株进行分子鉴定和抗寒性测定,选出了2个抗寒性明显提高的转基因株系,为最终选出红叶石楠抗寒新品系打下基础,进一步的研究还在进行中。
| [] | 杜建会, 魏兴琥. 2009. 园林红叶植物新贵—红叶石楠. 安徽农业科学, 37(11): 5263–5265. DOI:10.3969/j.issn.0517-6611.2009.11.169 |
| [] | 郭卫东, 张真真, 蒋小韦, 等. 2009. 低温胁迫下佛手半致死温度测定和抗寒性分析. 园艺学报, 36(1): 81–86. |
| [] | 黄美娟, 邓小梅, 符树根, 等. 2003. 红叶石楠"红罗宾"组培快繁技术研究. 江西农业大学学报, 25(4): 604–607. |
| [] | 黄永芬, 汪清胤, 付桂英, 等. 1997. 美洲鲽抗冻蛋白基因(afp)导入番茄的研究. 生物化学杂志(4): 418–422. |
| [] | 焦奎宝, 高庆玉. 2010. 葡萄嫁接苗根系半致死温度的测定. 黑龙江农业科学(3): 67–68. |
| [] | 李少锋, 苏晓华, 张冰玉. 2011. 林木基因克隆研究进展. 植物学报, 46(1): 79–107. |
| [] | 林元震, 张志毅, 刘纯鑫, 等. 2007. 甜杨抗冻转录因子ICE1基因的in silico克隆及其分析. 分子植物育种, 5(3): 424–430. |
| [] | 林元震. 2006. 甜杨葡萄糖-6-磷酸脱氢酶基因克隆及结构分析与功能鉴定. 北京林业大学博士学位论文: 96–107. |
| [] | 刘建, 项东云, 陈健波, 等. 2009. 应用Logistic方程式确定三种桉树的低温半致死温度. 广西林业科学, 38(2): 75–78. |
| [] | 刘静, 黄艳艳, 翁曼丽, 等. 2011. TCS基因转化泡桐的遗传表达及抗病能力研究. 林业科学, 47(5): 171–176. DOI:10.11707/j.1001-7488.20110529 |
| [] | 刘静, 王长宪, 王斌, 等. 2009. 石楠抗寒基因AmGS高效转化体系的研究. 山东农业大学学报:自然科学版, 40(2): 191–194. |
| [] | 刘友良, 朱根海, 刘祖祺. 1985. 植物抗冻性测定技术的原理和比较. 植物生理学通讯(1): 40–43. |
| [] | 芦建国, 连洪燕. 2007. 红叶石楠在园林中的应用. 现代农业科技(1): 40–41. |
| [] | 芦建国, 杨金红, 武翠红. 2008. 山东地区引种的5种石楠属植物抗寒性比较. 南京林业大学学报:自然科学版, 32(5): 153–156. |
| [] | 宋健. 2007. 沙冬青耐寒基因AmGols的克隆和遗传转化研究. 山东农业大学硕士学位论文: 1–54. |
| [] | 唐士勇. 1993. Logistic方程在果树半致死温度测定中的应用. 北方果树(4): 23–24. |
| [] | 王冬梅, 李晓荣, 李静, 等. 2011. 转blti2抗寒基因棉花的抗寒性分析. 分子植物育种(9): 1632–1636. |
| [] | 许瑛, 陈发棣. 2008. 菊花8个品种的低温半致死温度及其抗寒适应性. 园艺学报, 35(4): 559–564. |
| [] | 杨静, 王迎, 王华田, 等. 2008. 不同越冬栽培措施对红叶石楠抗寒生理生化特性的影响. 中国农学通报, 24(5): 160–165. |
| [] | 赵世杰, 史国安, 董新纯. 2002. 植物生理学实验指导. 北京, 中国农业科学技术出版社: 130-131. |
| [] | 朱根海, 刘祖棋, 朱培仁. 1985. 应用Logistic方程确定植物组织低温半致死温度的研究. 南京农业大学学报(3): 11–16. |
| [] | Cao P X, Song J, Zhou C J, et al. 2009. Characterization of multiple cold induced genes from Ammopiptanthus mongolicus and functional analyses of gene AmEBP1. Plant Mol Biol, 69(5): 529–539. DOI:10.1007/s11103-008-9434-1 |
| [] | Chomczynski P, Sacchi N. 1987. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal Biochem, 162: 156–159. |
| [] | Cunningham S M, Nadeau P, Castonguay Y, et al. 2002. Raffinose and stachyose accumulation, galactinol synthase expression, and winter injury of contrasting alfalfa germplasms. Crop Physiology & Metabolism, 43(2): 562–570. |
| [] | Fan Y, Liu B, Wang H, et al. 2002. Cloning of an antifreeze protein gene from carrot and its influence on cold tolerance in transgenic tobacco plant. Plant Cell Rep, 21(4): 296–301. DOI:10.1007/s00299-002-0495-3 |
| [] | Fei Y B, Cao P X, Gao S Q, et al. 2008. Purification and structure analysis of antifreeze proteins from Ammopiptanthus mongolicus. Preparative Biochemistry & Biotechnology, 38(2): 172–183. |
| [] | Gamboa M C, Rasmussen-Poblete S, Valenzuela P D T, et al. 2007. Isolation and characterization of a cDNA encoding a CBF transcription factor from E.globulus. Plant Physiol Biochem, 45(1): 1–5. DOI:10.1016/j.plaphy.2006.12.006 |
| [] | Griffith M, Ala P, Yang D S C, et al. 1992. Antifreeze protein produced endogenously in winter rye leaves. Plant Physiol, 100(2): 593–596. DOI:10.1104/pp.100.2.593 |
| [] | Lal S, Gulyani V, Khurana P. 2008. Overexpression of HVA1 gene from barley generates tolerance to salinity and water stress in transgenic mulberry(Morus indica). Transgenic Research, 17(4): 651–663. DOI:10.1007/s11248-007-9145-4 |
| [] | Liu J J, Deanne J, Krenz C, et al. 1998. Galactinol Synthase (GS): increased enzyme activity and levels of mRNA due to cold and desiccation. Plant Science, 134(1): 11–20. DOI:10.1016/S0168-9452(98)00042-9 |
| [] | Lyons J M, Raison J K. 1970. Oxidative activity of mitochondria isolated from plant tissues sensitive and resistant to chilling injury. Plant Physiol, 45(41): 386–389. |
| [] | Philippe R N, Ralph S G, Mansfield S D, et al. 2010. Transcriptome profiles of hybrid poplar(Populus trichocarpa×deltoides)reveal rapid changes in undamaged, systemic sink leaves after simulated feeding by forest tent caterpillar(Malacosoma disstria). New Phytol, 188(3): 787–802. DOI:10.1111/j.1469-8137.2010.03392.x |
| [] | Sambrook J, Fritsch E F, Maniatis T. 1989. Molecular Cloning, A Laboratory Manual. 2nd ed. New York, Cold Spring Harbor Laboratory Press: 487-509. |
| [] | Sprenger N, Keller F. 2000. Allocation of raffinose family oligosaccharides to transport and storage pools in Ajuga reptans: the roles of two distinct galactinol synthases. The Plant Journal, 21(3): 249–258. DOI:10.1046/j.1365-313x.2000.00671.x |
| [] | Taji T, Ohsumi C, luchi S, et al. 2002. Important roles of drought-and cold-inducible genes for galactinol synthase in stress tolerance in Arabidopsis thaliana. The Plant Journal, 29(4): 417–426. DOI:10.1046/j.0960-7412.2001.01227.x |
| [] | Thomashow M F. 1998. Role of cold-responsive genes in plant freezing tolerance. Plant Physiol, 118(1): 1–8. DOI:10.1104/pp.118.1.1 |
| [] | Unda F, Canam T, Preston L, et al. 2012. Isolation and characterization of galactinol synthases from hybrid poplar. J Exp Bot, 63(5): 2059–2069. DOI:10.1093/jxb/err411 |
| [] | Wallis J G, Wave H Y, Guerra D J. 1997. Expression of a synthetic antifreeze protein in potato reduces electrolyte release at freezing temperature. Plant Mol Biol, 35(3): 323–330. DOI:10.1023/A:1005886210159 |
| [] | Welling A, Palva E T. 2008. Involvement of CBF transcription factors in winter hardiness in birch. Plant Physiol, 147(3): 1199–1211. DOI:10.1104/pp.108.117812 |
| [] | Worrall D, Elias L, Ashford D, et al. 1998. A carrot leucine-rich-repeat protein that inhibits ice recrystallization. Science, 282(5386): 115–117. DOI:10.1126/science.282.5386.115 |
| [] | Zhao T Y, Thacker R, Corum J W, et al. 2004. Expression of the maize GALACTINOL SYNTHASE gene family: (Ⅰ) Expression of two different genes during seed development and germination. Physiologia Plantarum, 121(4): 634–646. DOI:10.1111/ppl.2004.121.issue-4 |
| [] | Zhou Z, Zhang D Q, Lu M Z. 2007. Cloning and expression analysis of PtFAD2 gene encoding the endoplasmic reticulum fatty acid 18:1 desaturase in Populus tomentosa. Sci Silvae Sin, 43(7): 16–21. |
 2012, Vol. 48
2012, Vol. 48