文章信息
- 樊后保, 刘文飞, 徐雷, 许鲁平, 孟庆银
- Fan Houbao, Liu Wenfei, Xu Lei, Xu Luping, Meng Qingyin
- 杉木人工林土壤酶活性对氮沉降的响应
- Impacts of Nitrogen Deposition on Soil Enzyme Activities in a Chinese Fir Plantation
- 林业科学, 2012, 48(7): 8-13.
- Scientia Silvae Sinicae, 2012, 48(7): 8-13.
-
文章历史
- 收稿日期:2011-06-09
- 修回日期:2012-05-18
-
作者相关文章
2. 江西农业大学园林与艺术学院 南昌 330045;
3. 中国科学院南京土壤研究所 南京 210008;
4. 沙县官庄国有林场 沙县 365503
2. College of Landscape and Art, Jiangxi Agricultural University Nanchang 330045;
3. Institute of Soil Science, Chinese Academy of Sciences Nanjing 210008;
4. Guanzhuang National Forest Farm of Shaxian Shaxian 365503)
随着人口增长、化石燃料燃烧增加以及大量使用工业化肥,陆地生态系统氮超标问题已引起广泛关注(Nihlgard, 1985; Köchy et al., 2001;李新艳等,2011)。1988年美国科学家在马萨诸塞中部的Harvard试验林中进行了长期氮素增加试验(Bauer et al., 2004)。实施36年的瑞典SFONE(瑞典最适森林营养试验)项目为揭示氮沉降对森林生态系统的长期影响提供了宝贵资料(Högberg et al., 2006)。研究表明,氮沉降会使温带森林生态系统生产力降低、土壤酸化及生物多样性降低(Emmet, 1999; Magill et al., 2000; Damgaard et al., 2011)。近几年我国逐步开展了氮沉降对亚热带森林生长、生物量分配、土壤养分和凋落物养分循环影响的研究(樊后保等,2007;刘文飞等,2011;李德军等,2005)。土壤酶是土壤组分中最活跃的有机成分之一,是土壤生物过程的主要调节者(Max et al., 2001)。已有研究表明,土壤酶活性对外界的干扰非常敏感(Sinsabaugh et al., 2002; 杨万勤等,2004;李国雷等,2008)。长期氮增加会造成土壤酶活性降低,特别是木质素溶解酶和纤维素降解酶(Carreiro et al., 2000; Deforest et al., 2004; Waldrop et al., 2004)。我国学者研究发现,不同氮沉降水平对不同种类酶的活性影响有差异(赵玉涛等,2008;周晓兵等,2011)。杉木(Cunninghamia lanceolata)是我国南方重要的用材树种之一,杉木林是中国亚热带的典型森林生态系统。本研究野外模拟氮沉降试验,研究氮沉降对杉木人工林土壤酶活性的影响,为开展氮沉降对森林生态系统影响机理研究提供基础数据。
1 研究区概况研究区位于福建三明沙县官庄国有林场(117°43′29″E,26°30′47″N)。属中亚热带季风气候,年平均气温18.8~19.6 ℃,年平均降水量1 606~1 650 mm,全年无霜期271天。试验林位于该林场的白溪工区21大班8小班南坡上,平均海拔200m,土壤为山地红壤。试验林为1992年营造的杉木人工林,面积为6 hm2。林下植被稀疏,以五节芒(Miscanthus floridulus)、芒萁(Dicranopteris olichotoma)和蕨(Pteridium aquilinum var. latiusculum)等为主,盖度为3%~5%。
2 研究方法依据随机区组试验设计原理,于2003年12月选择12块20 m×20 m立地条件基本相似的杉木人工林样地,每个样地内设15 m×15 m中心区域,中心区外围为缓冲区。2003年12月进行了样地林分特征和立地条件调查,结果见表 1。
|
|
试验设4个处理,按施氮量由低到高分别标记为N0(0 kg N·hm-2a-1)、N1(60 kg N·hm-2a-1)、N2(120 kg N·hm-2a-1)和N3(240 kg N·hm-2a-1),每种施氮水平设3块样地。
2004年1月开始对样地中心区模拟氮沉降处理,一直延续到2006年9月份。将每年施氮量换算成每月施氮量,每月月初按照月施氮量,将尿素CO(NH2)2溶解在20 L水中,以背式喷雾器在样地中心区人工来回均匀喷洒。对照样地中心区喷施同样量的水。为探讨短期内高剂量的氮输入对土壤酶活性的影响,2006年6月23日在样地缓冲区一次性施入全年氮量。
2006年6月23日、7月3日、7月13日和7月23日在一次性施氮区域进行土壤取样,观察施氮后每10天的酶活性变化情况。在每月施氮样地中心区内,于2006年7月15日、8月15日和9月15日采集土样,以观察施氮后酶活性月动态变化情况。取样时在中心区和缓冲区各随机挖取土壤剖面3个,分层(表层0~20 cm,中层20~40 cm,底层40~60 cm)取新鲜土样带回实验室。室内挑出肉眼可见植物残体,研碎过2 mm筛后储于玻璃瓶中待土壤酶活性分析。
采用3,5-二硝基水杨酸比色法测定蔗糖酶活性:采用苯酚-次氯酸钠比色法测定脲酶活性;采用高锰酸钾滴定法测定过氧化氢酶活性(关松荫,1986)。
利用SPSS软件进行统计分析,对各处理土壤酶活性数据进行重复单因素方差分析,然后以LSD多重检验法检验不同处理间的差异显著性。
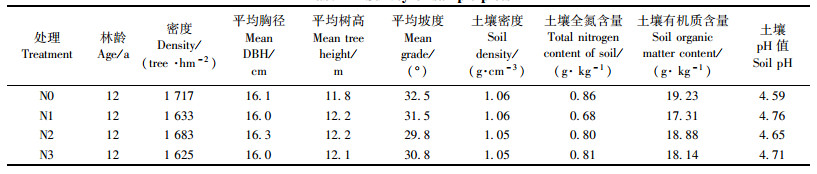
3 结果与分析 3.1 缓冲区氮沉降后30天内土壤酶活性变化由图 1可知,相对N0处理,缓冲区处理后30天内N1处理明显提高土壤过氧化氢酶活性,N2和N3处理作用不明显;在40~60 cm土层除N0处理表现为施氮后30天时过氧化氢酶活性低于施氮当天外,其余均高于施氮当天过氧化氢酶活性;0~20 cm土层,N0处理在施氮后30天时土壤过氧化氢酶活性与施氮当天差异达到显著水平(P < 0.05);40~60 cm土层中,N3处理施氮当天与施氮后30天时过氧化氢酶活性差异达到显著水平(P < 0.05)。
|
图 1 缓冲区氮沉降后30天内过氧化氢酶活性动态 Fig.1 Dynamics of catalase activities within 30 days after nitrogen addition in buffer |
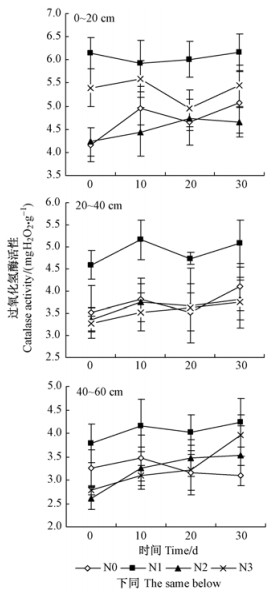
由图 2可知,相对N0处理,缓冲区处理后30天内N1处理提高土壤蔗糖酶活性的作用最为明显,N2和N3处理没有表现出明显的促进或抑制作用;0~20 cm土层中,除N2处理在施氮后30天时土壤蔗糖酶活性低于施氮当天外,其余处理在施氮后30天时土壤蔗糖酶活性均高于施氮当天,N3处理施氮当天与施氮后30天时蔗糖酶活性差异达到显著水平(P < 0.05);20~40 cm土层中,除N3处理施氮后30天时土壤蔗糖酶活性高于施氮当天外,其余处理施氮后30天时土壤蔗糖酶活性均低于施氮当天;40~60 cm土层中,除N0处理施氮后30天时土壤蔗糖酶活性低于施氮当天外,其余处理施氮后30天时土壤蔗糖酶活性均高于施氮当天。
|
图 2 缓冲区氮沉降后30天内蔗糖酶活性动态 Fig.2 Dynamics of invertase activities within 30 days after nitrogen addition in buffer |
由图 3可知,相对N0处理,缓冲区处理后30天内N1处理始终提高土壤脲酶活性,N2处理作用不明显,N3处理总体表现为抑制作用;各土层中,N0和N1处理施氮后30天时土壤脲酶活性低于施氮当天,N2和N3处理施氮后30天时土壤脲酶活性高于施氮当天;0~20 cm土层中,N3处理施氮当天与施氮后30天时脲酶活性差异显著(P < 0.05)。

|
图 3 缓冲区氮沉降后30天内脲酶活性动态 Fig.3 Dynamics of urease activities within 30 days after nitrogen addition in buffer |
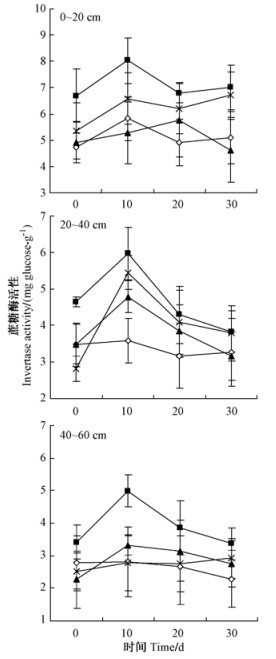
由图 4可知,不同氮处理土壤过氧化氢酶活性随着土层深度的增加而降低。N1处理对提高土壤过氧化氢酶活性作用明显,N2和N3处理不同月份和不同土层对过氧化氢酶活性影响存在差异,但没有明显的规律。在7—9月份,N0和N2处理0~ 20 cm土层过氧化氢酶活性表现为先降低后升高,最大值分别出现在9月份和7月份,N1和N3处理过氧化氢酶活性持续升高,最大值均出现在9月份。
|
图 4 中心区氮沉降后土壤过氧化氢酶活性月变化 Fig.4 Monthly dynamics of soil catalase activities in the inner plots after nitrogen loading 相同土层不同处理不同字母表明差异显著(P < 0.05,LSD法),下同。 Values with the various letter in different treatments of the same soil horizon are significantly different according to LSD's multiple range test (P < 0.05), the same below. |
由图 5可知,不同氮处理土壤蔗糖酶活性随着土层深度的增加而降低。相对于N0处理,N1处理对提高土壤蔗糖酶活性作用明显,N2和N3处理对不同月份和不同土层蔗糖酶活性的影响存在差异,但没有明显规律。在7—9月份,除N2处理土壤蔗糖酶活性呈先上升后下降外,其余处理均处于持续上升状态,N2处理8月份蔗糖酶活性最高,N0,N1和N2处理土壤蔗糖酶活性均在9月份最高。
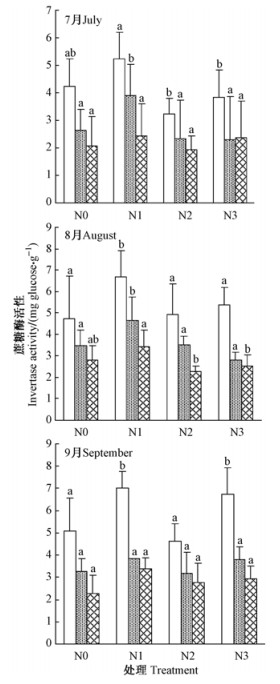
|
图 5 中心区氮沉降后土壤蔗糖酶活性月变化 Fig.5 Monthly dynamics of soil intertase activities in the inner plots after nitrogen loading |
由图 6可知,不同氮处理土壤脲酶活性随着土层深度的增加而降低。N1处理提高土壤蔗糖酶活性作用明显,N2和N3处理对不同月份和不同土层的蔗糖酶活性影响存在差异,但没有表现出明显规律。在7—9月份,0~20 cm土层中,N0处理土壤脲酶活性持续下降,N2处理土壤脲酶活性持续上升,N1处理土壤脲酶活性先上升下后降,N3处理土壤脲酶活性呈先下降后上升,N0和N1处理土壤脲酶活性峰值分别出现在7和8月份,N2和N3处理土壤脲酶活性峰值均出现在9月份。
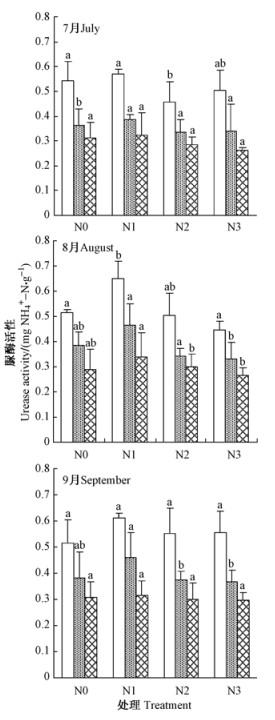
|
图 6 中心区氮沉降后土壤脲酶活性月变化 Fig.6 Monthly dynamics of soil urease activities in the inner plots after nitrogen loading |
本研究发现,土壤酶活性对氮沉降较为敏感,不同水平的氮沉降处理对酶活性的影响有所不同,从施氮后不同时间酶活性动态来看,相对于N0处理,N1处理始终表现出促进3种酶活性(过氧化氢酶、蔗糖酶和脲酶)活性提高。Jessica等(2010)对一些水解酶(葡萄糖苷酶,磷酸酶和木糖苷酶等)的研究表明,输入50 kg N·hm-2 a-1显著增加了酶活性;赵玉涛等(2008)对长白山天然红松(Pinus koraiensis)林的研究发现,输入25 kg N·hm-2 a-1在短期内(生长期5—9月)显著增强了纤维素酶、多酚氧化酶和蔗糖酶活性;在热带夏威夷森林,100 kg N·hm-2 a-1氮输入降低了木质素酶活性(Hobbie, 2000);对新疆古尔班通古特沙漠的研究也表明,240 kg N·hm-2 a-1的氮输入水平明显抑制了氧化酶活性(周晓兵等,2011);杜红霞等(2006)对四川岷江上游连香树(Cercidiphyllum japonicum)的研究表明,施450和750 kgN·hm-2 a-1的NH4NO3后连香树林地土壤脲酶和过氧化氢酶活性降低,且有随施氮用量增加而减小的趋势。以上结果说明较低水平的氮输入有利于土壤酶活性的提高,高水平的氮输入对土壤酶活性有抑制作用。本研究还发现,不同处理杉木人工林土壤过氧化氢酶、蔗糖酶和脲酶活性均随土层的增加而显著降低,其主要原因是随着土层的增加土壤养分含量呈下降趋势,从而引起土壤酶活性的下降(García-Gill et al., 2004; 宋学贵等,2009;何斌等,2002)。
| [] | 杜红霞, 刘增文, 潘开文. 2006. 外源性C、N干扰对森林土壤酶活性的影响. 西北林学院学报, 21(2): 35–38. |
| [] | 樊后保, 刘文飞, 李燕燕. 2007. 亚热带杉木(Cunninghamia lanceolata)人工林生长与土壤养分对氮沉降的响应. 生态学报, 27(11): 4630–4641. DOI:10.3321/j.issn:1000-0933.2007.11.031 |
| [] | 关松荫. 1986. 土壤酶及其研究方法. 北京, 农业出版社. |
| [] | 何斌, 温远光, 袁霞. 2002. 广西英罗港不同红树植物群落土壤理化性质与酶活性的研究. 林业科学, 38(2): 21–26. DOI:10.11707/j.1001-7488.20020205 |
| [] | 李德军, 莫江明, 方运霆. 2005. 模拟氮沉降对南亚热带两种乔木幼苗生物量及分配的影响. 植物生态学报, 29(4): 543–549. DOI:10.17521/cjpe.2005.0073 |
| [] | 李国雷, 刘勇, 甘敬. 2008. 飞播油松林地土壤酶活性对间伐强度的季节响应. 北京林业大学学报, 30(2): 82–88. |
| [] | 李新艳, 李恒鹏. 2011. 江西省陆地生态系统氮平衡的时空分布规律研究. 环境科学学报, 31(6): 1320–1329. |
| [] | 刘文飞, 樊后保. 2011. 杉木(Cunninghamia lanceolata)人工林凋落物C、N、P通量对氮沉降的响应. 林业科学, 47(3): 89–95. DOI:10.11707/j.1001-7488.20110314 |
| [] | 宋学贵, 胡庭兴, 鲜骏仁. 2009. 川南天然常绿阔叶林土壤酶活性特征及其对模拟N沉降的响应. 生态学报, 29(3): 1234–1240. |
| [] | 杨万勤, 王开运. 2004. 森林土壤酶的研究进展. 林业科学, 40(2): 152–159. DOI:10.11707/j.1001-7488.20040227 |
| [] | 赵玉涛, 李雪峰, 韩士杰. 2008. 不同氮沉降水平下两种林型的主要土壤酶活性. 应用生态学报, 19(12): 2769–2773. |
| [] | 周晓兵, 张元明, 陶冶. 2011. 古尔班通古特沙漠土壤酶活性和微生物量氮对模拟氮沉降的响应. 生态学报, 31(12): 3340–3349. |
| [] | Bauer G A, Bazzaza F A, Minocha R, et al. 2004. Effects of chronic N additions on tissue chemistry, photosynthetic capacity, and carbon sequestration potential of a red pine (Pinus resinosa Ait.)stand in the NE United States.. Forest Ecology and Management, 196(1): 173–186. |
| [] | Carreiro M M, Sinsabaugh R L, Repert D A, et al. 2000. Microbial enzyme shifts explain litter decay responses to simulated nitrogen deposition. Ecology, 81(9): 2359–2365. DOI:10.1890/0012-9658(2000)081[2359:MESELD]2.0.CO;2 |
| [] | Damgaard C, Jensen L, Frohn L M, et al. 2011. The effect of nitrogen deposition on the species richness of acid grasslands in Denmark: a comparison with a study performed on a European scale. Environmental Pollution, 159(7): 1778–1782. DOI:10.1016/j.envpol.2011.04.003 |
| [] | Deforest J L, Zak D R, Pregitzerc K S, et al. 2004. Atmospheric nitrate deposition and themicrobial degradation of cellobiose and vanillin in a northern hardwood forest. Soil Biology & Biochemistry, 36(6): 965–971. |
| [] | Emmet B A. 1999. The impact of nirtogen on forest soils and feedbacks on tree growth. Water, Air, and Soil Pollution, 116(1/2): 65–74. DOI:10.1023/A:1005209622313 |
| [] | García-Gill J C, Plaza C, Solwe-Rovira P, et al. 2000. Long-term effects of municipal solid waste compost app lication on soil enzyme activities and microbial biomass. Soil Biology & Biochemistry, 32(13): 1907–1913. |
| [] | Hobbie S E. 2000. Interactions between litter lignin and soil nitrogen availability during leaf litter decomposition in a Hawaiian montane forest. Ecosystems, 3(5): 484–494. DOI:10.1007/s100210000042 |
| [] | HÖgberg P, Fan H B, Quist M, et al. 2006. Tree growth and soil acidification in response to 30 years of experimental nitrogen loading on boreal forest. Global Change Biology, 12(3): 489–499. DOI:10.1111/gcb.2006.12.issue-3 |
| [] | Jessica L M, Gutknecht, HughA L, et al. 2010. Inter-annual variation in soil extra-cellular enzyme activity in response to simulated global change and fire disturbance. Pedobiologia, 53(5): 283–293. DOI:10.1016/j.pedobi.2010.02.001 |
| [] | KÖchy M, Wilson S D. 2001. Nitrogen deposition and forest expansion in the northern great plains. Journal of Ecology, 89(5): 807–817. DOI:10.1046/j.0022-0477.2001.00600.x |
| [] | Magill A H, Aber J D, Berntson G M, et al. 2000. Long-term nitrogen additions and nitrogen saturation in two temperate forests. Ecosystems, 3(3): 238–253. DOI:10.1007/s100210000023 |
| [] | Max M C, Wood M, Jarvis S C. 2001. A microplate flurimetric assay for the study of enzyme diversity in soils. Soil Biology & Biochemistry, 33(12/13): 1633–1640. |
| [] | Nihlgard B. 1985. The ammoniumhypothesis—an additional explanation to the forest die back in Europe. Ambio, 14(1): 2–8. |
| [] | Sinsabaugh R L, Carreiro M M, Repert D A. 2002. Allocation of extracellular enzymatic activity in relation to litter composition, N deposition, and mass loss. Biogeochemistry, 60(1): 1–24. DOI:10.1023/A:1016541114786 |
| [] | Waldrop M P, Zaka D R, Sinsabaugh R L. 2004. Microbial community response to nitrogen deposition in northern forest ecosystems. Soil Biology & Biochemistry, 36(9): 1443–1451. |
 2012, Vol. 48
2012, Vol. 48