文章信息
- 谢安强, 洪伟, 吴承祯
- Xie Anqian, Hong Wei, Wu Chengzhen
- 桉树内生菌对尾巨桉幼苗抗寒生理指标的影响
- Cold Resistance Nutrient Characters with Ten Kinds of Fungus in Eucalyptus urophylla×E. grandis
- 林业科学, 2012, 48(6): 170-174.
- Scientia Silvae Sinicae, 2012, 48(6): 170-174.
-
文章历史
- 收稿日期:2010-09-30
- 修回日期:2011-12-25
-
作者相关文章
20世纪50年代我国开始大规模种植桉树(Eucalyptus spp.),现在栽植已经遍布我国17个省、自治区的600多个县,栽植面积达到150多万hm2(祁述雄,2002)。然而,随着桉树大面积的种植,影响其种植的主要限制因子低温伤害也逐渐呈现。目前对桉树抗寒性的研究主要有抗寒锻炼、良种选育与引种、抗寒分子水平的研究等方面(庄国庆等,2010; 赵娟娟,2006; 郭祥泉,2003; 黄德先等,2002; 李晓储等,2000; 汤珧华等,2000; Byrne et al., 1997; Jaglo et al., 1998; Lu et al., 1998, 陈少雄等,2008)。
内生菌(Endophyte)的概念最早是由De Bary于1886年提出的,主要是指生活在植物组织内的微生物,用来区别那些生活在植物表面的微生物(Epiphyte)。内生菌存在于目前所研究过的大部分植物中,种、属多样性极其丰富(张烨等,2010; Nalini et al., 2005; Strobel et al., 2004; Pirttil et al., 2003; Hyde et al., 1997; Este1 et al., 2005; Cannon et al., 2002; Anorld et al., 2000)。对桉树真菌方面的研究主要是菌根的方面,桉树是菌根营养型的树种,它不仅有外生菌根(ectomycorrhiza),也有内生菌根(endomycorrhiza),还有混合型的菌根(郭秀珍等,1989; 弓明钦等,1997; Brundrett et al., 1996)。目前对桉树菌根菌的研究主要在促进生长和提高宿主抗逆性方面(刘月廉等,2010; Lapeyrie et al., 1985)。但在内生真菌促进桉树低温条件下抗寒能力提高方面的研究尚未见报道。
本文通过提取野外邓恩桉(E.dunnii)和尾巨桉(E.urophylla×E.grandis)等植株内生菌,得到65株内生菌,保存在福建农林大学森林生态研究所内。通过初步筛选,获取10株菌种,并接种于尾巨桉幼苗,研究其对尾巨桉幼苗抗寒功能的影响,试图寻找对促进尾巨桉抗寒有益的菌种应用于生产。
1 材料与方法 1.1 试验地点试验地点设在福州市福建农林大学森林生态研究所苗圃内。试验地点处于118°08′—120°31′E,25°15′—26°39′N之间,属于亚热带海洋性气候,年均温19.6 ℃,无霜期326天,降水量1 342.5 mm,平均湿度77%。气候温和,雨量充沛。
1.2 试验材料福建省林科院提供了尾巨桉3229号无性系组培苗,苗木于2009年3月盆栽于福建农林大学桉树研究中心田间试验地。用直径15 cm,高14 cm的塑料盆栽种,所用土壤为黑色泥炭土,经过严格蒸汽消毒灭菌待用。经过称量每盆放入相等质量的5 kg泥土,经过一个月的恢复性生长,在桉树根际施入相同浓度的10株菌种的菌液50 mL,每种菌株重复6次,用水溶液处理作为空白对照。
菌液的制备:将10株内生菌(表 1)接入等体积的液体培养基,经过24 h的培养,利用血球计数板计算菌液浓度,将菌液共同用超纯水稀释成5.0×106 cfu·mL-1。接种后30天后进行低温试验处理。
|
|
1) 温度胁迫试验设计桉树幼苗分别用菌液处理30天后,在高低温交变湿热试验箱中进行低温胁迫试验。光照时间为10 h·d-1,光强为4 000 lx,光源为白炽灯,湿度控制80%~100%。
处理分为7种温度梯度即常温,0,-1, -2,-3,-4和-5 ℃。每个温度梯度胁迫时间为10 h,并在胁迫结束后立刻进行可溶性糖(soluble sugar, SS)、可溶性蛋白(soluble proein, SPR)、脯氨酸(proline, PRO)和叶绿素含量测定。
2) 测定方法SS含量、SPR含量、PRO含量和叶绿素含量测定均参照李合生(2000)的方法。
2 结果与分析 2.1 SS含量分析试验结果表明:随着胁迫温度的下降,植株SS含量刚开始呈现上升的趋势。当胁迫温度达到-2~-3 ℃时,SS含量达到最大值。当胁迫温度达到-4~-5 ℃时,SS含量呈现下降趋势(图 1)。
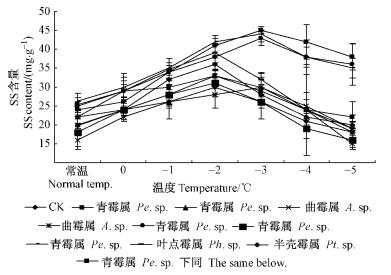
|
图 1 11种处理的SS含量变化 Fig.1 The diagrams of SS content in eleven treatments |
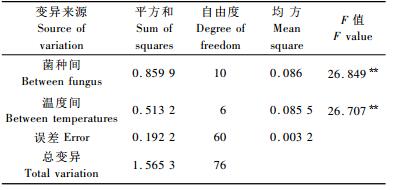
不同处理和不同温度间的差异均达到了极显著水平(表 2)。表明SS含量在不同菌种间和不同温度间均呈现明显的差别。与对照CK相比,处理1,5和7达到极显著水平,处理1,8,5,7和10 SS含量分别增加41.11%,11.11%,32.78%,38.89%和6.67%,处理4,6,9,2,3和8 SS含量分别减少10.56%,10.00%,8.33%,0.56%和0.56%(表 3)。LSD多重比较分析表明:与对照CK相比,处理1,5和7达到极显著水平。这表明低温处理对植株的SS含量产生较大影响,并且不同菌种处理植株的SS含量具有显著差异,这可能是由于不同菌种处理对植株的抗寒性产生一定程度的影响,某些菌种特别是菌种1,5,7对植株SS含量的增加产生极显著的影响。
|
|
|
|
SPR测定结果(图 2)表明:当温度下降到-2~-3 ℃时,SPR含量达到最大值。当温度达到-3 ℃时,1,5和7分别比对照高出15%,13%和29%。当温度达到-4~-5 ℃时,SPR含量呈现下降的趋势。
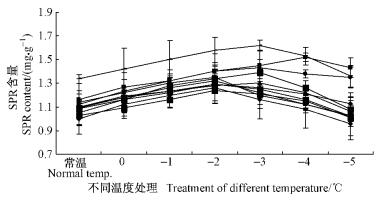
|
图 2 11种处理的SPR含量变化 Fig.2 The diagrams of SPR content in eleven treatments |
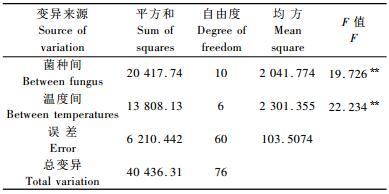
对不同温度处理的SPR含量进行方差分析(表 4)。不同处理的植株达到差异极显著水平,不同温度处理间也达到了差异极显著水平。对不同温度处理的SPR含量进行LSD多重比较分析(表 3),处理3, 9与对照CK达到差异显著水平,处理1,5,7与对照处理达到了差异极显著水平。其中处理3和9低于对照,其余均高于对照。处理1,2,5,6,7和10的SPR含量分别增加了14.90%,0.72%,10.94%,3.37%,24.40%和0.36%,处理3,4,8和9分别下降了5.17%,1.20%,1.09%和6.50%。这表明大部分菌株提高了SPR的生成量,对植株抵御低温伤害起到了重要的作用。
|
|
随着温度的降低,PRO含量呈现上升的趋势,当温度下降到-2~-3 ℃时,PRO含量达到最大值(图 3)。当温度达到-3 ℃时,处理1,5和7比对照高27%,42%和29%。当温度下降到-4~-5 ℃时,PRO含量呈现下降的趋势。处理1,5和7比对照高46%,50%和46%。这表明在低温胁迫初期,植株体内PRO含量呈现上升趋势,PRO属于一种自我保护物质,有利于植株抵御低温寒害。但随着胁迫温度的降低,PRO含量下降,低温对植株产生了难以修复的伤害。
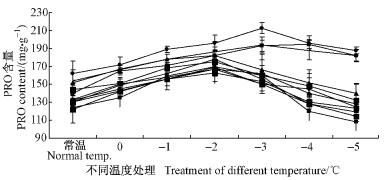
|
图 3 11种处理的PRO含量变化 Fig.3 The diagrams of PRO content in eleven treatments |
不同处理PRO含量方差分析结果表明(表 5),不同处理的植株达到差异极显著水平,不同温度处理间也达到了差异极显著水平。不同处理PRO含量LSD多重比较分析结果表明(表 3):处理1,2,5,7与对照CK达到差异极显著水平。处理5,7,1,2,4和9的PRO含量分别增加了28.77%,22.11%,20.16%,11.25%,5.48%和1.57%,处理8的PRO含量与对照相同,处理10,6和3的PRO含量下降了4.50%,4.21%和2.35%。这表明不同菌种处理的植株PRO含量差异较大,菌种对提高植株的抗寒能力起到了积极作用。
|
|
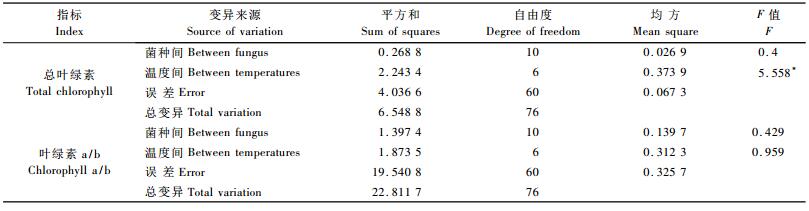
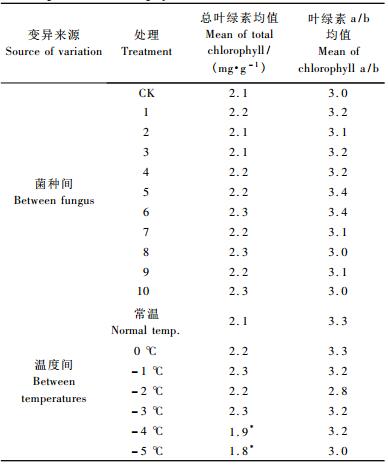
不同处理总叶绿素和叶绿素a/b方差分析结果表明(表 6):总叶绿素含量在不同温度处理水平达到差异极显著水平,不同菌种间未达到显著水平。叶绿素a/b在不同菌种间和不同温度间均未达到显著水平。不同处理总叶绿素和叶绿素a/b LSD多重比较分析结果表明(表 7),总叶绿素含量在当温度达到-4 ℃和-5 ℃时,总叶绿素出现下降,与对照形成显著差异。处理6,8,10,1,9,5,7,4,2和3的叶绿素含量分别增加了9.52%,7.48%,7.48%,6.80%,5.44%,3.40%,3.40%,2.72%,2.04%和2.04%。这表明不同菌种处理的植株的叶绿素含量存在较大差异,大部分植株的叶绿素含量均大于对照,表明在一定程度上菌种有利于在冻害胁迫条件下保护叶绿素不受破坏。
|
|
|
|
从上述研究可以看出:菌种1接种桉树后,从营养特性角度其对桉树的抗寒能力的提高有很大的促进作用。但也有个别菌种处理的植株表现出了不一致性,例如处理8,在SS和叶绿素方面都表现出了抗寒能力的提高,而在SPR的研究方面却体现出了一定程度的降低。这说明有些处理所测指标变化不明显,不能用于代表植株的抗寒能力是否增强。抗寒能力的提高需要各因素综合指标的测定。以上指标只是从SS、SPR、游离PRO和叶绿素4个指标来确定植株的抗寒性,另一篇文章将从半致死温度、过氧化物酶、超氧化物歧化酶和丙二醛4个方面来阐述内生菌对植株抗寒性的影响。
内生菌能通过增强植物吸收氮、磷等营养元素的能力,或产生拮抗物质或与病原菌竞争空间而达到促进植株生长的作用(Adhikari et al., 2001)。内生菌也可以增强宿主对环境胁迫如低温、干旱和环境污染等的抗逆性,维持宿主在逆境条件下正常生长(Magan et al., 1996),但其机制尚不明确,主要原因是一方面由于内生菌与宿主之间的互利共生关系非常复杂。另一方面内生菌长期生活在植株体内,生存环境相对稳定,研究者难以在不损害植株活体的条件下对其体内的内生菌展开研究,同时也难以建立相同或相似的环境模型。
植株接种菌株后抗寒能力得到了一定程度的提高,菌种是如何促进植株抗寒能力的提高,需要进一步研究菌株和植株间的相互作用机制。
| [] | 陈少雄, 吴志华. 2008. 桉树分子育种研究进展.中南林业科技大学学报. 中南林业科技大学学报, 28(4): 42–48. |
| [] | 弓明钦, 陈应龙, 仲祟禄. 菌根研究及应用. 北京, 中国林业出版社: 84-88. |
| [] | 郭祥泉. 2003. 尾巨桉与马尾松不同混交处理3年生造林研究. 福建林学院学报, 23(4): 338–343. |
| [] | 郭秀珍, 毕国昌. 1989. 林木菌根及应用技术. 北京, 中国林业出版社: 161-163. |
| [] | 黄德先, 邓元德. 2002. 巨尾桉在龙岩市引种状况的调查分析. 福建林业科技, 29(2): 50–53. |
| [] | 李合生. 2000. 植物生理生化原理和技术. 北京, 高等教育出版社: 167-169. |
| [] | 李晓储, 黄利斌, 季永华. 2000. 南京引种邓恩桉、冈尼桉苗期试验初报. 江苏林业科技, 27(3): 7–10. |
| [] | 刘月廉, 吴钿, 刘素青. 2010. 20株真菌对桉树苗高和根系活力的效应. 广东林业科技, 26(3): 18–22. |
| [] | 祁述雄. 2002. 中国桉树. 北京, 中国林业出版社: 18-19. |
| [] | 汤珧华, 李志辉. 2000. 耐寒性桉树早期选择研究综述. 中南林学院学报, 20(3): 70–74. |
| [] | 张烨, 廖怡, 陈尚武. 2010. 文冠果一、二年生植株根系内生菌的分离、鉴定和固氮活性. 植物生态学报, 34(7): 839–844. |
| [] | 赵娟娟. 2006. 桉树无性系冻害胁迫与抗寒锻炼实验与生理特性的评价. 福建农林大学硕士学位论文. |
| [] | 庄国庆, 胡天宇, 郭洪英. 2010. 不同种源地桉树抗寒性能的比较. 桉树科技, 27(1): 14–20. |
| [] | Adhikari T B, Joseph C M. 2001. Evaluation of bacteria isolated from rice for plant growth promotion and biological control of seeding disease of rice. Can J Microbiol, 47(7): 916–924. |
| [] | Anorld A E, Maynard Z, Gilbert G S. 2000. Are tropical fungal endophytes hyperdiverse. Ecology Letters, 3(4): 267–274. DOI:10.1046/j.1461-0248.2000.00159.x |
| [] | Brundrett M, Bourgher N, Dell B. 1996. Working with mycorrhixas in forestry and agriculture. Canberra: ACIAR Monograph, 82(1): 34–35. |
| [] | Byrne M, Murrell J C, Owen J V. 1997. Mapping of quantitative trait loci influencing frost torrance in Eucalyptus nitens. Theor Appl Genet, 95(1): 975–979. |
| [] | Cannon P F, Simmons C M. 2002. Diversity and host preference of leaf endophytic fungi in the Iwokrama Forest Reserve. Guyana.Mycologia, 94(2): 210–220. DOI:10.1080/15572536.2003.11833226 |
| [] | Este1 L, Durán L, Daniel P. 2005. The foliar fungal endo-phytes of Citrus limon in Argentina. Canadian Journal of Botany, 83(4): 350–355. DOI:10.1139/b05-009 |
| [] | Hyde K D, Frohlich J, Taylor J. 1997. Biodiversity of tropical micro fungi. Hong Kong: Hong Kong University Press: 141–156. |
| [] | Jaglo-Ottoaen K R, Gilmour S J. 1998. Arabidopsis CBF1 over expression induces COR genes and enhances freezing tolerance. Science, 280(2): 104–106. |
| [] | Lapeyrie F F, Chilvers G A, 1985.An endomycorrhizal-ectomycorrhiza succession associated with enhanced growth by Eucalyptus dumosa seedlings planted in a calcareous soil, New Phytol, 100(2):93-104, http://www.scielo.br/scielo.php?script=sci_abstract&pid=S1517-83822001000200002&lng=pt&tlng=en |
| [] | Lu Q, Kasuga M, Kamuma Y. 1998. Two transcription factors, DREB1 and DREB2, with an EREBP/AP2 DNA binding domain separate two celluar signal transduction pathways in drought and low temperature responsive gene expression respectively, in Arabidopsis. Plant Cell, 10(3): 1390–1406. |
| [] | Magan N, Smith M K. 1996. Isolation of the endophytes Lophodermium piceae and rhizosphaera kalkhoffii from Sitka spruce needles in poor and good growth sites and in vitro effects of environmental factors. Phyton(Horn), 36(4): 103–110. |
| [] | Nalini M S, Mahesh B, Tejesvi M V. 2005. Fungal endophytes from the three-leaved caper, Crataeva magna(Lour.)DC.(Capparidaceae). Mycopathologia, 159(2): 245–249. DOI:10.1007/s11046-004-5497-y |
| [] | Pirttil A M, Pospiech H, Lukkanen R. 2003. Two endophytic fungi in different tissues of scots pine Buds (Pinus sylvestris L.). Microbial Ecology, 45(1): 53–63. DOI:10.1007/s00248-002-1038-8 |
| [] | Strobel G, Daisy B, Castillo U. 2004. Natural products from endophytic microorganisms. J Nat Prod, 67(1): 257–268. |
 2012, Vol. 48
2012, Vol. 48