文章信息
- 张庆贺, 马建海, 赵丰钰, 史全顺, 王国仓
- Zhang Qinghe, Ma Jianhai, Zhao Fengyu, Shi Quanshun, Wang Guocang
- 青海云杉(拟)齿小蠹聚集信息素研究进展
- Research Progress on Aggregation Pheromone Systems of Major Ips/Pseudips Pseudips Bark Beetles Attacking the Thickleaf Spruce: A Mini-Review
- 林业科学, 2012, 48(6): 118-126.
- Scientia Silvae Sinicae, 2012, 48(6): 118-126.
-
文章历史
- 收稿日期:2010-11-25
- 修回日期:2011-03-22
-
作者相关文章
2. 青海省森林病虫害防治检疫总站 西宁 810007;
3. 青海省林业调查规划院 西宁 810007;
4. 青海省黄南州森林病虫害防治检疫站 黄南 811300;
5. 青海省黄南州麦秀林场 黄南 811300
2. Forest Pest Control and Quarantine Station of Qinghai Province Xining 810007;
3. Institute of Forestry Survey and Design of Qinghai Province Xining 810007;
4. Forest Pest Control and Quarantine Station of Huangnan Prefecture Huangnan 811300;
5. Maixiu Forest Farm Huangnan 811300
20世纪90年代中期开始,青海省三江源国家级自然保护区云杉(Picea spp.)天然林普遍遭到以光臀八齿小蠹(Ips nitidus)、香格里拉齿小蠹(Ips shangrila)和东方拟齿小蠹(Pseudips orientalis)为主的小蠹虫危害,致使林木大量死亡(刘丽等, 2007; Zahradnik et al., 2007; 潘宏阳等,2008; 薛永贵,2008; Liu et al., 2008; Jakušet al., 2011)。经调查,2005年青海省小蠹虫发生面积达2.1万hm2,成灾面积约0.6万hm2,主要危害区域包括长江、澜沧江流域的白扎、江西林区,大渡河流域的玛可河、多可河林区,黄河流域的麦秀林区等22个国有林场。云杉是中国西部地区森林的主要建群树种,生态和经济价值极大,如果该区域天然林资源被以小蠹虫为主的林业有害生物毁灭,后果不堪设想。为了尽快控制云杉齿小蠹对森林的危害蔓延,利用仿生学原理,采取害虫信息素诱杀技术,有针对性地研究开发云杉齿小蠹的聚集信息素引诱剂用于生产防治已成为当务之急。
虫害发生后,青海省森防总站及当地森防部门及时采取伐除虫害木,设置诱虫饵木等应急营林措施,并积极与国内科研、教学单位合作,对3种(拟)齿小蠹生物生态学进行了研究(刘丽等, 2007; Zahradnik et al., 2007; Liu et al., 2008; 薛永贵,2008)。特别是2006—2009年,在青海省外专局智力引进项目资助下,邀请欧美小蠹专家15人(次),对青海天然云杉林小蠹种类组成,尤其对3种大发生(拟)齿小蠹聚集信息素进行了深入系统的研究,在国际上首次鉴定出3种(拟)齿小蠹的聚集信息素组分。此项研究成果已于2009—2011年分别在3个国际权威性SCI学术期刊上发表(Zhang et al., 2009a; 2009b; Zhang et al., 2011)。3种小蠹的人工合成聚集信息素诱捕器已应用于发生期、发生量及种群动态监测的生产实践,并取得预期效果。
笔者对上述3种(拟)齿小蠹的聚集信息素系统等最新研究成果进行综述,供同仁参考。
1 研究背景光臀八齿小蠹、香格里拉齿小蠹及东方拟齿小蠹具有同地发生、同株危害、高海拔分布、寄主专一以及危害严重等特点。3种小蠹目前尚无国外分布报道,在我国,光臀八齿小蠹分布于四川、云南、青海、甘肃、新疆、西藏,香格里拉齿小蠹分布于四川、云南、青海,东方拟齿小蠹分布在西藏、四川、云南、青海。受害寄主主要为粗枝云杉(P. asperata)、青海云杉(P. crassifolia)、天山云杉(P. schrenkiana)、川西云杉(P. likiangensis)等(傅辉恩, 1983; 刘丽等,2007; Cognato et al., 2007; Liu et al., 2008; 薛永贵,2008)。它们大多危害风倒木、风折木、火烧木及其他原因造成的衰弱木,但在大发生时也可直接危害健康活立木,致使林木大量死亡。光臀八齿小蠹和东方拟齿小蠹虫体相对较大,主要侵蛀云杉树干的中下部,香格里拉齿小蠹虫体较小,主要危害树干的中上部。
光臀八齿小蠹是德国著名林学家Hans Eggers先生1933年根据采自我国四川康定地区的小蠹标本命名的。傅辉恩(1983)对该虫生物学特性及防治进行了首次报道,并认为是我国西部高原地区云杉特别是青海云杉的最重要蛀干害虫之一。2001年以来,该虫与香格里拉齿小蠹及东方拟齿小蠹一起协同发生,危害青海云杉,是导致青海省黄南州等地天然云杉大量枯死的主要原因(薛永贵等,2003; 薛永贵,2008; Zahradnik et al., 2007; Jakušet al., 2011)。在大发生初期,该虫被误鉴定为云杉八齿小蠹(Ips typographus)(薛永贵等,2003)。直到2006年,捷克小蠹分类专家Milo Kníek博士复查后将其鉴定为光臀八齿小蠹(薛永贵,2008)。最近, 刘丽等(2007)、Liu等(2008)和薛永贵(2008)先后报道了光臀八齿小蠹在青海云杉天然林中基本的生物学和生态学特性。由于该虫与云杉八齿小蠹在形态特征和系统发育上都很相似(Cognato et al., 2007),早在1985年周嘉熹等便尝试用云杉八齿小蠹聚集信息素[早期的3组分商业化诱芯为2-甲基-3-丁烯-2-醇/(S)-顺式-马鞭草烯醇/小蠹二烯醇,原文报道的3种组分中2种存在印刷错误,即“甲基丁烯”和“小蠹烯醇”应分别为“2-甲基-3-丁烯-2-醇”和“小蠹二烯醇”]诱集和监测光臀八齿小蠹成虫,并取得较好的诱虫效果(周嘉熹等,1986; Zhou et al., 1995)。近年来,当地森防部门曾多次引进国外云杉八齿小蠹聚集信息素引诱剂进行林间生测,虽然诱到一定数量的光臀八齿小蠹,但其诱虫效果与云杉八齿小蠹相差甚远。
香格里拉齿小蠹是根据采自我国四川、云南及青海不同云杉上的齿小蠹标本,近期描述的一新种(Cognato et al., 2007)。2007年以前,该小蠹在我国一直被误认为是中重齿小蠹(Ips mannsfeldi)(殷蕙芬等,1984)(中重齿小蠹仅分布于中欧并只危害松树)。2006年7月捷克小蠹分类专家Milo Kníek博士在青海考察时,曾就危害青海云杉的“中重齿小蠹”的种名提出质疑。随后,Cognato等(2007)综合四川、云南及青海的标本,依据DNA及形态特征数据的支序分类分析,命名了该新种。除刘丽等(2007)及Liu等(2008)发表的该虫在青海云杉天然林中基本生物学和生态学特性外,尚未见其他方面的详细报道。
东方拟齿小蠹[P. orientalis(wood & Yin)]是近期修正的拟齿小蠹属的一种。最早由Wood & Yin(1986)根据采自我国西藏、四川云杉上的小蠹标本于1986命名为Ips orientalis。10年前,美国Cognato(2000)根据对齿小蠹族45种小蠹进行的DNA(COI)(分子生物学)、形态和行为特征的同系发生学分析的结果,将包括Ips orientalis在内的3种齿小蠹从齿小蠹属中单列出来,重组一新属,并命名为拟齿小蠹属(Pseudips)。除刘丽等(2007)发表的该虫在青海云杉天然林内的种群生态位研究外,尚未见其他方面的详细报道。
2 聚集信息素研究方法 2.1 信息素的收集和制备2008年5月下旬,在青海省黄南藏族自治州麦秀林场(35°08′—35°30′N,101°33′—102°03′E; 海拔2 900~3 000 m)的青海云杉风倒木上收集不同入侵阶段的光臀八齿小蠹、香格里拉齿小蠹及东方拟齿小蠹活成虫。入侵阶段参照Zhang等(2000)划分如下:第1阶段为处女雄成虫取食并刚刚完成交配室; 第2阶段为坑道内1雄1雌,雄虫交配1次; 第3阶段为坑道内1雄2雌,雄虫交配2次; 第4阶段为坑道内1雄3雌,雄虫交配3次; 第5阶段为坑道内1雄4雌,雄虫交配4次。同一个坑道内的成虫被放在1个2 mL的聚乙烯离心管中,并立即置于冰盒中(大约4 ℃)低温保存,并于当日在实验室内将离心管按不同小蠹种类、入侵阶段分类。随后认真区分雌雄,解剖后肠,并迅速将其置于装有1 mL重蒸戊烷(加2 μg乙酸庚酯作内标)的2 mL玻璃瓶进行萃取。对同种小蠹将采自同一株树并且处于同一入侵阶段的雄性后肠放入同一溶剂瓶中萃取,并对装有后肠的溶剂瓶分别标记。同种小蠹不同入侵阶段的雌虫后肠也按类似方法混合萃取(Zhang et al., 2009a; 2009b; 2011)。除此之外,还对新鲜青海云杉木段,被香格里拉齿小蠹天然危害的云杉风倒木及人工接种东方拟齿小蠹雄虫的青海云杉木段进行了2 h顶空气味吸附抽提。然后用1 mL重蒸戊烷对已抽提的Porapak Q吸附剂分别洗脱并装入2 mL玻璃瓶(Zhang et al., 2009b; 2011)。后肠提取物及气味吸附抽提液均在-20 ℃保存,直到进行气相色谱(GC-FID)和气质联用仪(GC-MS)分析。
2.2 GC-MS分析所有的后肠提取物及气味抽提样品均利用装有极性柱(INNOWax,60 m×0.25 mm×0.5 μm; 安捷伦,美国)的Agilent 6890N气相色谱与Agilent 5973N质谱联用仪进行分析。气相色谱程序炉温为50 ℃ 1 min,10 ℃·min-1升温至230 ℃, 保持25 min,进样口和连线的温度保持在250 ℃。载气为氦气,其电控流量为26 cm·s-1。利用人工合成标样对比保留时间及质谱标准鉴定可能的信息化合物(Zhang et al., 2009a; 2009b; 2011)。
2.3 GC-FID分析利用装有极性柱(INNOWax; 30 m×0.53 mm×1.0 μm; 安捷伦,美国)的Varian CP-3800气相色谱仪(FID:火焰离子检测器)对后肠提取样品在内标(每个样品中含有2 μg乙酸庚酯)的基础上进行化合物的定量。载气为氦气,进样口温度220 ℃,柱温50 ℃保持1 min, 以10 ℃·min-1升温至240 ℃, 保持10 min(Zhang et al., 2009a; 2009b; 2011)。
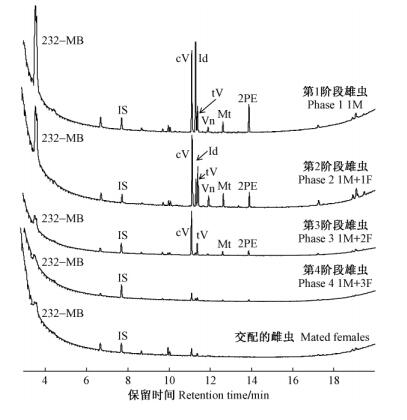
2.4 GC-FID手性分析采用无分流进样技术及装有Rt-bDEXmTM手性柱(30 m×0.25 mm×0.25 μm,Restek)的Varian CP-3800气相色谱仪对雄性后肠提取物(第1~2入侵阶段雄虫)中的手性化合物进行手性分析。同时分析了几种人工合成的齿小蠹信息素的混合物[(±)-小蠹烯醇、(±)-小蠹二烯醇、(S)-顺式马鞭草烯醇、(-)-反式马鞭草烯醇、反式-2-甲基-6-亚加基-3,7-辛二烯-2-醇、(-)-马鞭草烯酮及反式-2-甲基-6-亚加基-2,7-辛二烯-1-醇(50 ng·μL-1溶于正己烷)],并与后肠提取物样品进行比较。载气为氦气,进样口与检测器温度均设定为230 ℃,柱温80 ℃保持1 min,以2 ℃·min-1速率升温至200 ℃。小蠹烯醇和小蠹二烯醇的(-)-或(+)-对应异构体的洗提顺序由注入人工合成的97% (+)-小蠹二烯醇和97% (-)-小蠹烯醇固相微萃取样品确定(Zhang et al., 2009a)。
2.5 野外林间生测野外诱捕试验分别于2008年7月下旬至8月中旬及2009年4月底至5月下旬在青海省黄南州麦秀林场青海云杉天然林林缘进行。林间生测采用北京中捷四方有限公司生产的十字交叉板式小蠹诱捕器。诱捕器组间距离30 m以上,组内距离约10 m, 诱捕器与树之间的距离要保持10 m以上。每组内设9个诱捕器,包括8种不同的引诱剂(全部或部分信息素的不同组合,另外还包括消旋或纯对应异构体), 编号为A、B、C、D、E、F、G、H和1个空白对照(I),以确定它们对供试小蠹的诱虫活性。初设时组内引诱剂及诱捕器位置随机排列,当组内某个诱捕器最多诱集到10头以上小蠹时,收集并记录所有诱到的小蠹,随后随机更换引诱剂的位置,以消除诱捕器位置对引诱剂效果的影响。所有供试的化合物、引诱剂组合、释放装置及数据见Zhang等, (2009a; 2009b; 2011)。
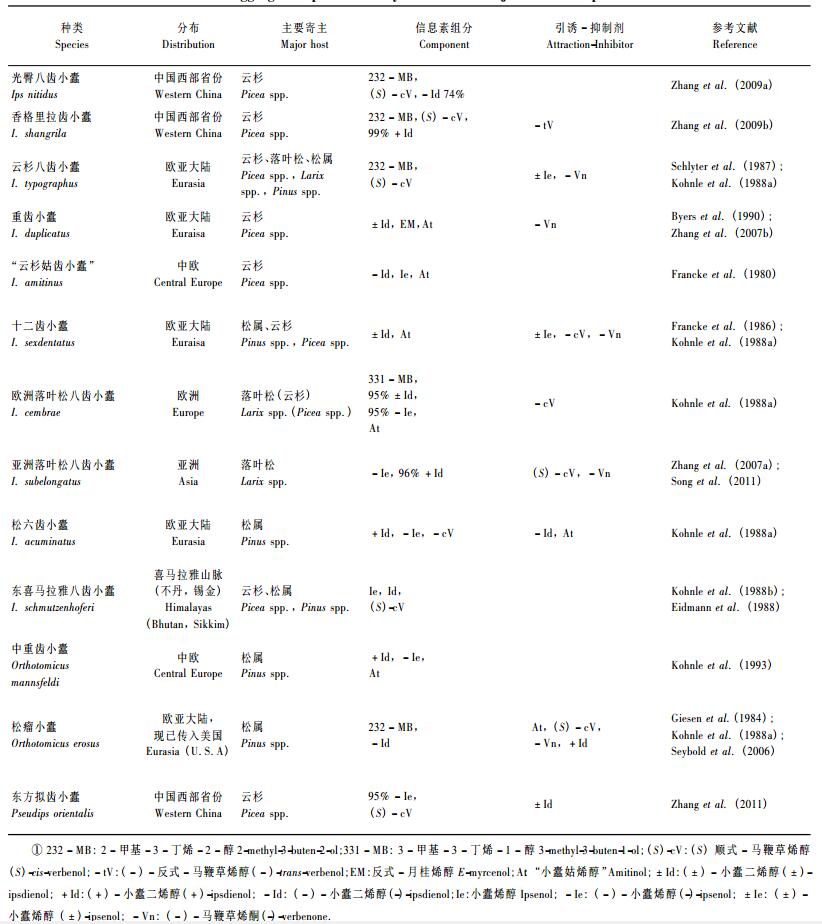
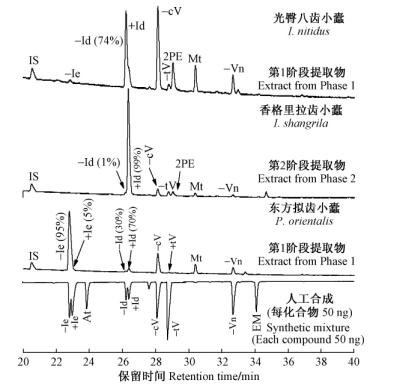
3 3种(拟)齿小蠹聚集信息素系统的鉴定 3.1 光臀八齿小蠹GC-MS/FID分析显示取食、完成交配室尚未交配的雄虫(第1入侵阶段),其后肠产生的3种主要挥发性组分为2-甲基-3-丁烯-2-醇(232-MB: 2 800 ng·头-1)、小蠹二烯醇(Id: 760 ng·头-1)和顺式-马鞭草烯醇(cV: 330 ng·头-1)(比例为7:2:1),以及几种微量/痕量化合物,即反式-马鞭草烯醇(tV), 小蠹烯醇(Ie), 马鞭草烯酮(Vn),桃金娘烯醇(Mt),2-苯基乙醇(2PE)(图 1)。1头雄虫可与3头雌虫交配,其后肠分泌的挥发性化合物的含量随交配次数增加而明显减少,交配3次后几乎停止分泌(图 1)。交配雌虫后肠萃取样品中未见可能小蠹信息化合物的分泌。对第1~2入侵阶段雄虫后肠手性挥发物的分析发现,该虫分泌(74±3)%-(-)-小蠹二烯醇、(S)-顺式-马鞭草烯醇、(-)-反式-马鞭草烯醇、(-)-马鞭草烯酮和(-)-小蠹烯醇(图 2)(Zhang et al., 2009a)。
|
图 1 不同入侵阶段光臀八齿小蠹雄虫(及交配雌虫)后肠提取物气相色谱分析(Zhang et al., 2009a) Fig.1 Representative gas chromatograms of compounds in hindgut extracts of male I. nitidus from different attack phases and mated females from mixed phases(Zhang et al., 2009a) IS:内标化合物Internal standard; 232-MB: 2-甲基-3-丁烯-2-醇2-methyl-3-buten-2-ol; cV:顺式-马鞭草烯醇cis-verbenol; Id:小蠹二烯醇Ipsdienol; tV:反式-马鞭草烯醇trans-verbenol; Vn:马鞭草烯酮Verbenone; Mt:桃金娘烯醇Myrtenol; 2PE: 2-苯基乙醇2-phenyl ethanol; Ie:小蠹烯醇Ipsenol. M:雄虫Male; F:雌虫Female.下同The same below. |
|
图 2 3种小蠹第1~2入侵阶段雄虫后肠提取物及人工合成齿小蠹聚集信息素混合物的手性气相色谱分析(Zhang et al. 2009a; 2009b; 2011) Fig.2 Enantioselective GC-FID analyses of compounds in hindgut extracts of males from attack phases 1 or 2 of three bark beetles and a synthetic mixture of Ips-related compounds(Zhang et al., 2009a; 2009b; 2011) At: “小蠹姑烯醇”Amitinol; EM:反式-月桂烯醉(E)-myrcenol.下同The same below. |
林间试验结果表明:3种主要组分2-甲基-3-丁烯-2-醇、消旋的(±)-小蠹二烯醇和(S)-顺式-马鞭草烯醇,与微量组分(-)-反式-马鞭草烯醇的混合物的诱虫效果最佳(♂:♀=1:2.2),但其诱虫量与3种主要组分(2-甲基-3-丁烯-2-醇、消旋的(±)-小蠹二烯醇和(S)-顺式-马鞭草烯醇)的混合物并无明显统计学差异。微量组分(-)-反式-马鞭草烯醇的助效作用不显著,有待进一步研究。用97%-(-)-小蠹二烯醇[接近纯的(-)-对应异构体]取代混合物中消旋的(±)-小蠹二烯醇明显降低其诱虫效果(Zhang et al., 2009a)。进一步的野外诱集试验发现:含有74%-(-)-小蠹二烯醇(雄虫分泌的天然对应异构体比率)的3种主要组分混合物诱芯与含有消旋体(±)-小蠹二烯醇的混合物诱芯在诱虫效果上无明显差异。由此认为雄虫后肠分泌的3种主要成分2-甲基-3-丁烯-2-醇、74%-(-)-小蠹二烯醇和(S)-顺式-马鞭草烯醇为光臀八齿小蠹聚集信息素的有效组分。
3.2 香格里拉齿小蠹GC-MS/FID分析显示取食、完成交配室尚未交配的香格里拉齿小蠹雄虫(第1入侵阶段)其后肠产生2种主要挥发性组分:2-甲基-3-丁烯-2-醇(232-MB: 500 ng·头-1)和小蠹二烯醇(Id: 660 ng·头-1),以及几种微量化合物:顺式-马鞭草烯醇(cV: 140 ng·头-1),反式-马鞭草烯醇(tV:70 ng·头-1), 桃金娘烯醇(Mt:30 ng·头-1)及2-苯基乙醇(2PE:80 ng·头-1)。小蠹烯醇(Ie)和马鞭草烯酮(Vn)几乎未检测到(图 3)。1头雄虫可与5头以上雌虫交配,其后肠分泌的2-甲基-3-丁烯-2-醇和顺式-马鞭草烯醇的含量未随交配次数增加而明显减少,而小蠹二烯醇的含量也仅在交配3次后开始明显下降(图 3)。交配雌虫后肠萃取样品中未见可能小蠹信息化合物的分泌。对第1~2入侵阶段雄虫后肠手性挥发物的分析发现:该虫分泌99%-(+)-小蠹二烯醇、(S)-顺式-马鞭草烯醇及(-)-反式-马鞭草烯醇(图 2)(Zhang et al., 2009b)。对被香格里拉齿小蠹天然危害的青海云杉风倒木顶空气味吸附抽提样品分析发现:α-蒎烯及β-蒎烯为青海云杉树干的主要挥发性气味(占总量的70%以上); 同时也证实了树干皮下香格里拉齿小蠹雄虫分泌释放2-甲基-3-丁烯-2-醇、小蠹二烯醇、顺式-马鞭草烯醇及反式-马鞭草烯醇(Zhang et al., 2009b)。

|
图 3 不同入侵阶段香格里拉齿小蠹雄虫后肠提取物气相色谱分析(Zhang et al., 2009b) Fig.3 Representative gas chromatograms of compounds in hindgut extracts of male I. shangrila from different attack phases (Zhang et al., 2009b) |
野外生测结果表明:2种主要组分2-甲基-3-丁烯-2-醇和97%-(+)-小蠹二烯醇与微量组分(S)-顺式-马鞭草烯醇的混合物的诱虫效果最佳(♂:♀=1:2.14),明显高于空白对照(Zhang et al., 2009b)。用消旋的(±)-小蠹二烯醇取代混合物中97%-(+)-小蠹二烯醇(接近雄虫分泌的天然对应异构体比率)降低其诱虫效果50%,但诱虫量仍明显高于空白对照。而微量组分中的(-)-反式-马鞭草烯醇对上述混合物的诱虫效果具有明显的抑制作用。由此认为雄虫后肠分泌的2种主要成分:2-甲基-3-丁烯-2-醇、99%-(+)-小蠹二烯醇与一种微量组分(S)-顺式-马鞭草烯醇为香格里拉齿小蠹聚集信息素的有效组分(Zhang et al., 2009b)。
3.3 东方拟齿小蠹GC-MS/FID分析显示取食、完成交配室尚未交配的东方拟齿小蠹雄虫(第1入侵阶段)其后肠产生2种主要挥发性组分:小蠹烯醇(Ie: 1 450 ng·头-1)和顺式-马鞭草烯醇(cV: 400 ng·头-1),以及几种微量化合物:反式-马鞭草烯醇(tV:170 ng·头-1),小蠹二烯醇(Id: 80 ng·头-1),马鞭草烯酮(Vn:80 ng·头-1)及桃金娘烯醇(Mt:20 ng·头-1)(图 4)。1头雄虫可与2头雌虫交配,其后肠分泌的挥发性化合物的含量随交配次数增加而明显减少,交配2次后几乎停止分泌(图 4)。交配雌虫后肠萃取样品中未见可能小蠹信息化合物的分泌。对第1入侵阶段雄虫后肠手性挥发物的分析发现:该虫分泌95%-(-)-小蠹烯醇、70%-(+)-小蠹二烯醇、(S)-顺式-马鞭草烯醇、(-)-反式-马鞭草烯醇及(-)-马鞭草烯酮(图 2)(Zhang et al., 2011)。对被东方拟齿小蠹雄虫危害的青海云杉木段顶空气味吸附抽提样品分析,证实了皮下取食的东方拟齿小蠹雄虫分泌释放小蠹二烯醇、顺式-马鞭草烯醇、小蠹二烯醇、反式-马鞭草烯醇及马鞭草烯酮(Zhang et al., 2011)。

|
图 4 不同入侵阶段东方拟齿小蠹雄虫后肠提取物气相色谱分析(Zhang et al., 2011) Fig.4 Representative gas chromatograms of compounds in hindgut extracts of male P. orientalis from different attack phases (Zhang et al., 2011) |
林间诱集生测结果表明:2种主要组分97%-(-)-小蠹烯醇和(-)-顺式-马鞭草烯醇与一微量组分(-)-反式-马鞭草烯醇的3种化合物混合物的诱虫效果最佳(♂:♀=1:2.7),明显高于空白对照(Zhang et al., 2011)。但其诱虫量与2种主要组分97%-(-)-小蠹烯醇和(-)-顺式-马鞭草烯醇的混合物并无明显差异。微量组分中(-)-反式-马鞭草烯醇的助效作用不显著,有待进一步研究。用消旋的(±)-小蠹烯醇取代混合物中97%-(-)-小蠹烯醇(接近雄虫分泌的天然对应异构体比率)降低其诱虫效果。而微量组分中的(±)-小蠹二烯醇对上述混合物的诱虫效果具有明显的抑制作用。由此认为雄虫后肠分泌的2种主要成分95%-(-)-小蠹烯醇和(-)-顺式-马鞭草烯醇为东方拟齿小蠹聚集信息素的有效组分(Zhang et al., 2011)。
4 我国(拟)齿小蠹聚集信息素系统的相似性及异质性纵观欧亚大陆齿小蠹族(特别是齿小蠹,拟齿小蠹和瘤小蠹属)聚集信息素系统组成,不难看出属种间即存在明显的相似性又具有一定程度的异质性(表 1)。表 1所列的13种小蠹其聚集信息素系统仅由7种化学成分(不计手性化合物的对应异构体)组成; 其中有11种小蠹分泌释放小蠹二烯醇作为其聚集信息素必要组分之一,被认为是齿小蠹族最常见的信息素成分; 其次为小蠹烯醇(7种),顺式-马鞭草烯醇(6种),而amitinol(暂译为“小蠹姑烯醇”)(5种)和2-甲基-3-丁烯-2-醇(4种)居中; 反式-月桂烯醇及3-甲基-3-丁烯-1-醇分别是重齿小蠹和欧洲落叶松八齿小蠹的聚集信息素组分之一。
|
|
光臀八齿小蠹与云杉八齿小蠹在形态特征和系统发育上都很相似,其聚集信息素系统中有2种成分完全相同,即2-甲基-3-丁烯-2-醇和(S)-顺式-马鞭草烯醇。然而前者还分泌释放74%-(-)-小蠹二烯醇作为其信息素的必要组分之一,后者虽然在交配后分泌微量的95%-(-)-小蠹二烯醇,但不被认为是其信息素组分(Schlyter et al., 1987; Kohnle et al., 1988)。二者之间聚集信息素系统的异质性说明了为什么近期从欧洲引进云杉八齿小蠹的商业化诱芯(具体配方不详)诱集光臀八齿小蠹效果不尽理想的原因。同时也对周嘉熹等(1986)使用云杉八齿小蠹早期3组分商业化诱芯[含2-甲基-3-丁烯-2-醇(1 500 mg),(S)-顺式-马鞭草烯醇(70 mg)及小蠹二烯醇(15 mg)]诱到相当数量光臀八齿小蠹的报道给予合理的解释。令人遗憾的是原文[周嘉熹等(1986)]报道的3种组分中有2种存在印刷或翻译错误,即文中的“甲基丁烯”和“小蠹烯醇”应分别为“2-甲基-3-丁烯-2-醇”和“小蠹二烯醇”。这也许是导致后期(2002—2006年)的林间诱集生测和筛选试验无法重复(证实)其诱虫效果的原因之一。
香格里拉齿小蠹及光臀八齿小蠹属同地发生,乃至同株危害的密切相关种类。在时空生态位上既有交替又有重叠,故对其寄主(青海云杉)存在一定程度食物和繁殖空间的竞争(刘丽等,2007; 韩富忠等,2010)。二者聚集信息素系统的化学组成十分相似(均由3种成分组成),但其主要组分之一小蠹二烯醇对应异构体的组成差异显著,即香格里拉齿小蠹分泌释放99%-(+)-小蠹二烯醇,而光臀八齿小蠹产生74%-(-)-小蠹二烯醇。此外,(-)-小蠹二烯醇似乎对香格里拉齿小蠹聚集信息素有一定的抑制作用(Zhang et al., 2009a; 2009b)。最近,Cognato等(2007)依据DNA数据的支序分类分析将香格里拉齿小蠹与分布于中欧的“云杉姑齿小蠹”Ips amitinus (Eichhoff)划分为亲缘的姊妹种。有趣的是二姊妹种间的聚集信息素系统完全不同,后者由95%-(-)-小蠹二烯醇,小蠹烯醇和“小蠹姑烯醇”3种成分组成(Francke et al., 1980)(表 1)。2006年以前,香格里拉齿小蠹在我国一直被误认为是中重齿小蠹(Ips mannsfeldi Wachrl.)(殷蕙芬等,1984),现已被重组到瘤小蠹属(Orthotomicus mannsfeldi)(Cognato et al., 2001)。二者不仅在形态、地理分布及寄主种类(后者仅分布中欧,和仅危害松属树木)上存在明显差异,而且在聚集信息素成分组成上也相差显著(表 1)。
东方拟齿小蠹与上述2种齿小蠹在时空生态位上既有交替,又有重叠(刘丽等,2007; 韩富忠等,2010)。故对其云杉食物和繁殖空间等寄主资源的利用存在一定程度的竞争。然而与上2种齿小蠹相比,东方拟齿小蠹成虫越冬后出蜇扬飞期要早1~3周,一定程度上降低了竞争的压力。除此之外,东方拟齿小蠹聚集信息素系统的化学组成与同地发生的2种齿小蠹差异显著,即由95%-(-)-小蠹烯醇和(-)-顺式-马鞭草烯醇2种成分组成。作为香格里拉齿小蠹和光臀八齿小蠹聚集信息素主要组分之一的小蠹二烯醇对东方拟齿小蠹信息素有一定的抑制作用(Zhang et al., 2011)。东方拟齿小蠹聚集信息素主要组分之一的小蠹烯醇是否对香格里拉齿小蠹或光臀八齿小蠹聚集信息素反应产生行为抑制,有待进一步研究。
齿小蠹族昆虫聚集信息素系统组成的相似性一方面反映了其遗传同系发生的亲缘关系,另一方面体现了小蠹主要聚集信息素组分生物合成前体及途径的类似性。然而种间(特别是同地种间)聚集信息素系统化学及对应异构体组成的异质性,以及其信息化合物潜在的行为交互作用,在维系种间生殖隔离,调节时空竞争及生态位方面起到至关重要的作用。同一寄主不同小蠹种间同地乃至同期发生的现象是否能对其聚集信息素系统的进化产生深刻影响,目前尚无明确定论(Zhang et al., 2011)。
5 展望近年来青海省森防总站与国内外专家合作对光臀八齿小蠹、香格里拉齿小蠹及东方拟齿小蠹聚集信息素系统进行了深入研究,并在国际上首次成功鉴定出上述3种(拟)齿小蠹的聚集信息素组分(Zhang et al., 2009a; 2009b; 2011)。人工合成的聚集信息素诱芯已在3种小蠹发生期及种群动态监测的生产实践中得以应用并取得预期效果。对其聚集信息素组分的最佳配比、有效释放速率、最佳释放载体剂型以及引诱剂诱捕器应用技术等的研究正在进行之中。本项研究成果也将对我国其他主要森林小蠹信息化学物质的深入研究将起到积极的促进作用。
21世纪伊始,我国在森林小蠹化学生态学基础及应用研究方面取得了一些令人鼓舞的成绩,特别是对红脂大小蠹、重齿小蠹、落叶松八齿小蠹、云杉八齿小蠹等信息化学物质的应用技术研究已取得突破性进展,但在仪器操作技能、目标昆虫取样、信息素提取方法以及人工合成信息素诱芯制作技术等关键性技术方面还存在明显的差距。因此,在加强国际合作、提高自主科研能力的基础上,应积极加强和拓展以下几方面的研究工作:一是集中力量鉴定华山松大小蠹(Dendroctonus armandi)、纵坑切梢小蠹(Tomicus piniperda)、柏肤小蠹(Phloeosinus aubei)等重要森林小蠹聚集信息素系统的化学结构; 二是加强人工合成已知小蠹聚集信息素诱芯剂型优化技术; 三是完善聚集信息素诱捕器的监测和大量诱杀技术; 四是开展非寄主挥发物及抗聚集信息素等信息化学物质基础及相关应用技术研究; 五是积极探讨当今世界针叶树小蠹综合防治中最先进、最成功的非寄主挥发物等趋避剂与聚集信息素诱捕器相结合的“推-拉”技术。
| [] | 傅辉恩. 1983. 光臀八齿小蠹生活习性及其防治试验. 北京林学院学报(4): 30–38. |
| [] | 韩富忠, 丁启含, 冶均森, 等. 2010. "三江源"龙务河流域天然林区小蠹区系初步研究. 中国森林病虫, 29(2): 28–30. |
| [] | 刘丽, 阎伟, 骆有庆, 等. 2007. 青海云杉天然林内小蠹种群空间生态位的研究. 北京林业大学学报, 29(5): 165–169. |
| [] | 潘宏阳, 尤德康, 柴守权, 等. 2008. 我国天然次生林小蠹虫发生形势与防控对策. 中国森林病虫, 27(1): 41–43. |
| [] | 薛永贵. 2008. 光臀八齿小蠹生物学特性及防治初报. 安徽农学通报, 14(13): 162. DOI:10.3969/j.issn.1007-7731.2008.13.084 |
| [] | 薛永贵, 马永胜, 王晓萍. 2003. 黄南州云杉八齿小蠹发生危害及防治对策. 青海农林科技(3): 18–19. |
| [] | |
| [] | 周嘉熹, 李孟楼, 王东升, 等. 1986. 云杉八齿小蠹外激素对光臀八齿小蠹引诱效果的初步研究. 陕西林业科技(4): 48–50. |
| [] | Byers J A, Schlyter F, Birgersson G. 1990. E-myrcenol in Ips duplicatus: an aggregation pheromone component new for bark beetles. Experientia, 46(11/12): 1209–1211. |
| [] | Cognato A I. 2000. Phylogenetic analysis reveals new genus of Ipini bark beetle (Scolytidae). Annals of the Entomological Society of America, 93(3): 362–366. DOI:10.1603/0013-8746(2000)093[0362:PARNGO]2.0.CO;2 |
| [] | Cognato A I, Sun J H. 2007. DNA based cladograms augment the discovery of a new Ips species from China (Coleoptera: Curculionidae: Scolytinae). Cladistics, 23(6): 539–551. |
| [] | Cognato A I, Vogler A P. 2001. Exploring data interaction and nucleotide alignment in a multiple gene analysis of Ips (Coleoptera: Scolytinae). Systematic Biology, 50(6): 758–780. DOI:10.1080/106351501753462803 |
| [] | Eidmann H H, Birgersson G. 1988. Semiochemicals in the East Himalaya spruce bark beetle. Anzeiger für Schdlingskunde, Pflanzenschutz, Umweltschutz, 61(8): 147–148. DOI:10.1007/BF01905990 |
| [] | Francke W, Pan M L, Bartels J. 1986. The odour bouquet of three pine engravers (Ips spp.). Journal of Applied Entomology, 101(1-5): 543–461. |
| [] | Francke W, Sauerwein P, Vite J P. 1980. The pheromone bouquet of Ips amitinus. Naturwissenschaften, 67(3): 147–148. DOI:10.1007/BF01073623 |
| [] | Giesen H, Kohnle U, Vite J P, et al. 1984. The aggregation pheromone of the Mediterranean pinebark-beetle Ips (Orthotomicus) erosus. Journal of Applied Entomology, 98(1-5): 95–97. |
| [] | Jakuš R, Kalinová B, Hoskovec M. 2011. Outbreak of Ips nitidus and Ips shangrila in north eastern margin of the Tibetan Plateau//IUFRO Working Party 7.03.10. Proceedings of the Workshop on"Biotic Risks and Climate Change in Forests: Methodology of Forest Insect and Disease Survey in Central Europe. Freiburg. Germany: 20–23. |
| [] | Kohnle U, Pajares J A, Bartels J. 1993. Chemical communication in the Europaen pine engraver, Ips mannsfeldi (Wachtl) (Coleoptera Scolytidae). Journal of Applied Entomology, 115(1-5): 1–7. DOI:10.1111/jen.1993.115.issue-1-5 |
| [] | Kohnle U, Vité J P, Erbacher C. 1988a. Aggregation response of European engraver beetles of the genus Ips mediated by terpenoid pheromone. Entomologia Experimentalis et Applicata, 49(1/2): 43–53. |
| [] | Kohnle U, Schmutzenhofer H, Bartels J. 1988b. Oxygenated terpenes in the chemical communication system of the bark beetle, Ips schmutzenhoferi (Col., Scolytidae), a species recently described for the Southeastern Himalaya. Journal of Applied Entomology, 106(1-5): 46–51. DOI:10.1111/jen.1988.106.issue-1-5 |
| [] | Liu L, Wu J, Luo Y Q, et al. 2008. Morphological and biological investigation of two pioneer Ips bark beetles in natural spruce forests in Qinghai Province, northwest China. Forestry Studies in China, 10(1): 19–22. DOI:10.1007/s11632-008-0005-y |
| [] | Schlyter F, Birgersson G, Byers J A. 1987. Field response of spruce bark beetle, Ips typographus, to aggregation pheromone candidates. Journal of Chemical Ecology, 13(4): 701–716. DOI:10.1007/BF01020153 |
| [] | Seybold S J, Huber D P W, Lee J C, et al. 2006. Pine monoterpenes and pine bark beetles: a marriage of convenience for defense and chemical communication. Phytochemistry Reviews, 5(1): 143–178. DOI:10.1007/s11101-006-9002-8 |
| [] | Song L W, Zhang Q H, Chen Y Q, et al. 2011. Field responses of the Asian larch bark beetle, Ips subelongatus, to potential aggregation pheromone components: disparity between two populations in northeastern China. Insect Science, 18(3): 311–319. DOI:10.1111/ins.2011.18.issue-3 |
| [] | Wood S L, Yin H F. 1986. Relict occurrence of three 'American' Scolytidae (Coleoptera) in Asia. Great Basin Naturalist Memoirs, 46(3): 461–464. |
| [] | Zahradnik P, Kníek M, Kubac I. (2011-06-28)[2012-05-08]. 青海、吉林两省小蠹虫危害考察报告暨建议防治方案. http://www.forestpest.org/senfang/youhai/jyjl/2011-06-28/Article6742.shtml. |
| [] | Zhang Q H, Birgersson G, Schlyter F, et al. 2000. Pheromone components in the larch bark beetle, Ips cembrae from China: Quantitative variation among different attack phases and individuals. Journal of Chemical Ecology, 26(4): 841–858. DOI:10.1023/A:1005447922939 |
| [] | Zhang Q H, Ma J H, Zhao F Y. 2011. Aggregation pheromone of the Oriental spruce engraver, Pseudips orientalis (Wood & Yin), from China. Agricultural and Forest Entomology, 13(1): 67–75. DOI:10.1111/afe.2011.13.issue-1 |
| [] | Zhang Q H, Ma J H, Zhao F Y, et al. 2009a. Aggregation pheromone of the Qinghai spruce bark beetle, Ips nitidus Eggers. Journal of Chemical Ecology, 35(5): 610–617. DOI:10.1007/s10886-009-9634-4 |
| [] | Zhang Q H, Schlyter F, Chen G. 2007a. Electrophysiological and behavioral responses of Ips subelongatus to semiochemicals from its hosts, nonhosts and conspecifics in china. Journal of Chemical Ecology, 33(2): 391–404. DOI:10.1007/s10886-006-9231-8 |
| [] | Zhang Q H, Schlyter F, Liu G T, et al. 2007b. Electrophysiological and behavioral responses of Ips duplicatus to aggregation pheromone in Inner Mongolia, China: amitinol as a potential pheromone component. Journal of Chemical Ecology, 33(7): 1303–1315. DOI:10.1007/s10886-007-9320-3 |
| [] | Zhang Q H, Song L W, Ma J H, et al. 2009b. Aggregation pheromone of a newly described spruce bark beetle, Ips shangrila Cognato and Sun, from China. Chemoecology, 19(4): 203–210. DOI:10.1007/s00049-009-0026-6 |
| [] | Zhou J, Li M, Li H, et al. 1995. A study on luring some beetles of China by using pheromones of North American beetles. Journal of Northwest Forestry College, 10(2): 74–80. |
 2012, Vol. 48
2012, Vol. 48