文章信息
- 孙业民, 马兰, 李朝周
- Sun Yemin, Ma Lan, Li Chaozhou
- 不同类型酸胁迫对云杉叶细胞膜及其保护系统损伤机制的比较
- Comparison on the Damage Mechanism of Cell Membrane and Its Protective Systems in Picea asperata Leaves under Different Acid Stress Types
- 林业科学, 2012, 48(6): 56-62.
- Scientia Silvae Sinicae, 2012, 48(6): 56-62.
-
文章历史
- 收稿日期:2011-06-22
- 修回日期:2011-12-23
-
作者相关文章
2. 甘肃农业大学生命科学技术学院 兰州 730070
2. College of Life Sciences and Technology, Gansu Agricultural University Lanzhou 730070
随着现代工业的飞速发展,酸雨已成为世界性重大环境问题。由于二氧化硫大量排放所致,我国成为酸雨重灾之一。自“九五”期间实行二氧化硫总量控制,但由于我国汽车保有量的迅速增加,另一致酸物质氮氧化物的排放量却持续增长,大气氧化性增强,降水中的硝酸根离子与硫酸根离子比值增加,酸雨类型也由原来的硫酸型逐渐转变为硫酸、硝酸混合型,并且硝酸根在酸雨中所占比例逐年增高,这使得我国酸雨不仅没有得到根本控制,反而有整体加重的趋势,且污染情况也比20年前更复杂(Zhao et al., 2010;王自发等,2007)。
目前关于酸雨的成因(邓伟等,2009)、危害(吴丹等,2006)及植物本身对酸雨的抗性(Rinallo et al., 1996)等已有一些研究,并证明酸雨对植物的伤害主要表现在改变根际土壤pH和有效养分,侵蚀叶片角质层,破坏细胞膜系统,腐蚀叶肉组织,使气孔调节机制失灵、营养元素淋失、叶绿素含量下降、光合作用和呼吸作用紊乱等(付晓萍等,2006;张金梅,2011);此外,酸雨还影响花粉萌发(Bellani et al., 1997),使根际微生物种群发生变化,改变植物对极端环境条件和病原体的敏感性(周光益等,2009)。上述研究主要是针对硫酸型酸雨,而关于硫酸、硝酸混合型酸雨对森林、水体和农田生态系统危害还缺乏系统研究。
细胞膜使得细胞具有选择性的吸收和排出功能。在酸胁迫和其他逆境胁迫下,由于活性氧的过量累积和膜蛋白、不饱和脂肪酸等物质的破坏,细胞膜的结构和选择透性可能遭受破坏,而在植物细胞内抗氧化酶和抗氧化物质则起保护作用(刘建新等,2008;沈静等,2010)。
云杉(Picea asperata)为我国特有树种,分布于东北、华北、西北、西南及台湾地区,其生态群落对我国的水土保持、水源涵养及生态平衡均具有重要作用。本文依据国内外常见酸雨的实际情形采用硫酸与硝酸不同配比的2种酸溶液模拟硫酸型和硝酸型酸雨,并用其浸泡离体云杉针叶,比较在不同程度酸胁迫下云杉叶一系列抗性生理指标的变化,以及云杉叶对以硫酸和硝酸为主的酸溶液胁迫下的抗逆生理差异,以期探讨酸雨成分变化及酸雨类型转换的情况下植物的抗性生理机制,为农林生产和生态建设提供理论支持。
1 材料与方法 1.1 试验材料在甘肃农业大学校园内,选取云杉成年树,树龄28年。采集向阳方向生长的当年新生且整齐一致枝叶,分别用pH1.0,pH2.0,pH3.0,pH4.0和pH5.0的硫酸型酸液(SRA)、硝酸型酸液(NRA)和蒸馏水浸泡云杉针叶24 h,用蒸馏水冲洗干净后测定各项生理指标。
1.2 试验方法 1.2.1 酸溶液的配制本试验所用酸溶液由分析纯的浓硫酸和浓硝酸与蒸馏水混合而成。酸液类型分别为硫酸根含量较多的酸液(SRA):n(SO42-):n(NO3-)=4:1(表示酸液中硫酸根与硝酸根的摩尔数之比为4:1,下同);硝酸根含量较多的酸液(NRA):n(SO42-):n(NO3-)=1:4。先将以上2种酸溶液配制成pH为1.0的母液,用上海雷磁仪器厂生产的pH-29A型数显酸度计测定并配制出pH值分别为1.0,2.0,3.0,4.0,5.0的酸溶液,用蒸馏水做对照(pH5.8)。
1.2.2 膜稳定指数(MSI)参照Sairam等(1997)的方法。称取0.1 g的针叶,依次用自来水和重蒸水彻底冲洗,放入塑料试管中,加入10 mL的重蒸水,加盖,于30 ℃下持续振荡30 min,测定该水溶液的电导率并记作C1,然后将该试管内重蒸水煮沸15 min,冷却至室温后测量其电导率并记作C2,膜稳定性指数(MSI)按照下式计算:MSI=(1-C1/C2)100%。
1.2.3 叶绿素和类胡萝卜素含量乙醇比色法(邹琦,2007),用722型分光光度计测定665,649,470 nm波长下的光密度值。
1.2.4 丙二醛(MDA)含量采用硫代巴比妥酸法(赵世杰,1994)。
1.2.5 可溶性糖含量采用蒽酮法(邹琦,2007)。
1.2.6 脯氨酸含量采用茚三酮比色法(邹琦,2007),显色后用722型分光光度计测定520 nm波长下的光密度值,通过标准曲线计算游离脯氨酸含量。
1.2.7 O2·产生速率参照王爱国等(1990)方法,测定环境中的光照强度为120 μmol·m-2s-1。
1.2.8 H2O2含量参照林植芳等(1998)的方法。
1.2.9 抗氧化酶活性超氧化物歧化酶(SOD)活性用氮蓝四唑法(邹琦,2007);过氧化物酶(POD)活性用愈创木酚比色法(赵世杰,1994);过氧化氢酶(CAT)活性参照陈利锋等(1997)的方法。
1.2.10 多胺含量的测定参照Li等(2004)的方法。称取200 mg针叶,剪碎,用2 mL冰冷的5% HClO4于冰冷的研钵中研磨。将研磨后的混合物在冰浴中放置60 min,摇匀后4 ℃下27 700 g离心20 min。将沉淀物用2 mL冰冷HClO4重新溶解,冰浴中放置5 min,摇匀后重复进行上述离心。将2次离心的上清液收集在一起测定腐胺、精胺和亚精胺含量。
1.2.11 乙烯产生速率的测定参照Flores等(1982)方法。将处理过的材料迅速放于青霉素小瓶中,盖上橡皮盖子,置于25 ℃下,4 h后用注射器从瓶中抽取气体进行测定。
1.3 数据分析各项试验重复3~5次,数据采用SPSS13.0统计分析,选用Duncan新复极差法进行差异显著性分析。
2 结果与分析 2.1 不同类型酸胁迫对云杉叶片MSI和MDA含量的影响云杉叶在酸溶液中浸泡24 h,在pH≥3.0的条件下细胞膜稳定指数无显著变化。pH值降为2.0和1.0时云杉叶细胞膜稳定指数(MSI)大幅度下降,且NRA处理MSI下降幅度显著大于SRA酸液处理(P < 0.05)(图 1A)。叶片MDA含量随着处理液酸度的增强逐渐增大,当pH≤3.0时,NRA酸液处理云杉叶MDA含量显著高于SRA酸液处理(P < 0.05)(图 1B)。上述结果说明:当pH值为2.0和1.0时,NRA酸胁迫云杉叶脂质过氧化程度及细胞膜损伤程度显著高于SRA酸胁迫。
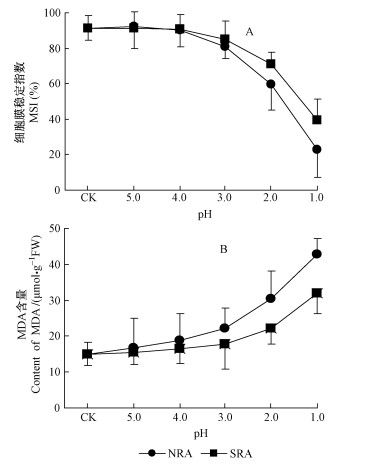
|
图 1 硫酸型和硝酸型酸胁迫对云杉叶细胞膜稳定指数(MSI)和丙二醛(MDA)含量的影响 Fig.1 Influences of SRA and NRA stress on membrane stability index (MSI) and MDA content in P. asperata leaves NAR:硝酸型酸液Nitric-rich cuid; SAR:硫酸型酸液Sulphur-righ acid |
除在pH5.0时NRA酸胁迫云杉叶叶绿素含量稍有升高外,云杉叶叶绿素和类胡萝卜素含量在2种类型的酸胁迫下皆随着酸液酸度的增强而下降。酸溶液pH值在4.0和3.0时,NRA酸胁迫云杉叶片叶绿素含量显著高于SRA酸处理,之后随pH值下降NRA胁迫的云杉叶叶绿素含量的下降幅度明显大于SRA胁迫,至pH1.0时,NRA酸胁迫叶绿素含量显著低于SRA酸胁迫(P < 0.05)(图 2A,B)。
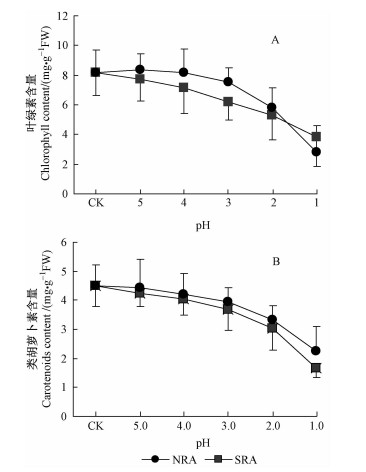
|
图 2 硫酸型和硝酸型酸胁迫对云杉叶叶绿素含量和类胡萝卜素含量的影响 Fig.2 Influences of SRA and NRA stress on the contents of chlorophyll and carotenoid in P. asperata leaves |
2种类型酸胁迫云杉叶可溶性糖和脯氨酸含量变化均随着酸液酸度的增强先增大后下降,在pH值为3.0时达到峰值,在pH1.0时降至最低(图 3A,B)。
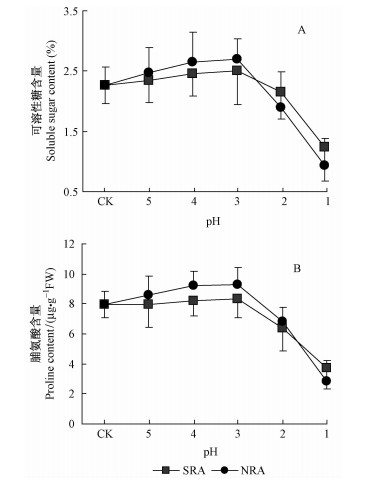
|
图 3 硫酸型和硝酸型酸胁迫对云杉叶可溶性糖含量和脯氨酸含量的影响 Fig.3 Influences of SRA and NRA stress on the content of soluble sugar and proline in P. asperata leaves |
随处理液酸度的增加,云杉叶O2·产生速率加快,H2O2含量增高(图 4A,B)。对比同等酸度下2种类型酸胁迫之间云杉叶活性氧的水平(图 4A,B),发现NRA酸液处理O2·的产生速率和H2O2含量均高于SRA酸液处理,在pH≤4.0时差异显著(P < 0.05)。
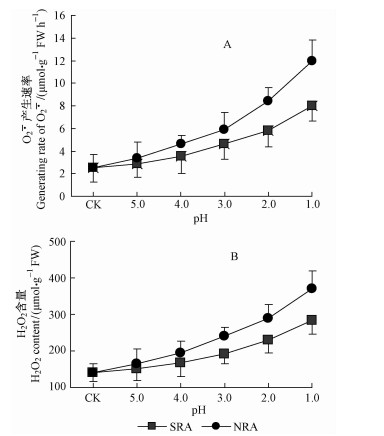
|
图 4 硫酸型和硝酸型酸胁迫对云杉叶O·-2产生速率和H2O2含量的影响 Fig.4 Influences of SRA and NRA stress on the generating rate of O·-2 and content of H2O2 in P. asperata leaves |
SOD,POD和CAT是植物体内清除活性氧的酶促防御系统中重要抗氧化酶。SOD能清除O2·而形成H2O2,POD和CAT能催化H2O2形成H2O,从而有效阻止O2·和H2O2的积累并抑制毒性更强的·OH的产生(蒋明义,1999)。云杉叶SOD和CAT活性随着酸液酸度的增强先增大后下降,在pH3.0,pH4.0时达到最大值(图 5A,B)。POD活性在pH≥3.0时变化不显著,之后随酸度增加迅速下降(图 5C)。对比这2种类型的酸胁迫(图 5A~C),SOD活性在pH5~pH2以硝酸型酸胁迫活性较高,pH降至1时,NRA型酸胁迫下SOD活性下降幅度较大,且显著低于SRA型酸胁迫(P < 0.05)。CAT活性和POD活性差异在2种不同类型的胁迫差异不显著(P>0.05)。
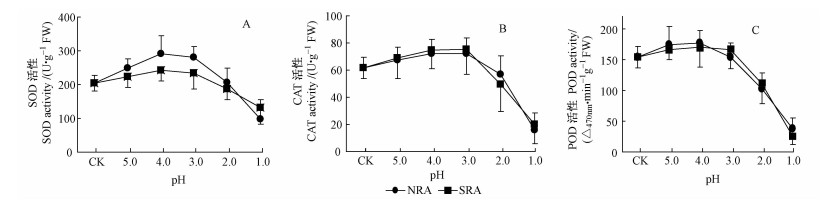
|
图 5 硫酸型和硝酸型酸胁迫对云杉叶抗氧化酶活性的影响 Fig.5 Influences of SRA and NRA stress on the activities of antioxidative enzymes in P. asperata leaves |
云杉叶腐胺、精胺和亚精胺含量在酸胁迫下皆表现出显著变化,并在pH4.0时达到最大值,之后随酸胁迫程度的加强而逐渐下降。对比2种不同类型的胁迫,云杉叶多胺含量在pH5.0,pH4.0时以NRA酸胁迫较高,而在pH2.0和pH1.0时以SRA型较高(图 6A~C),均达到差异显著(P < 0.05)。云杉叶乙烯产生速率随酸液酸度的增加逐渐增强,在pH3.0~pH1.0时乙烯产生速率升高幅度加大,且NRA型在pH3.0~pH1.0时升高幅度远大于SRA型(P < 0.05)(图 6D)。
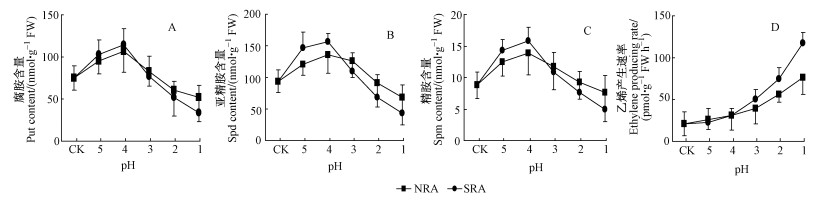
|
图 6 硫酸型和硝酸型酸胁迫对云杉叶多胺含量及乙烯产生速率的影响 Fig.6 Influences of SRA and NRA stress on polyamines content and ethylene production rate in P. asperata leaves |
酸雨对植物影响的大小、危害轻重取决于植物本身特征(如物种与品种、生物学特征、生长发育阶段等)、酸雨的特点(如酸雨的化学组成、酸度、频次、作用时间及雨量等因子)以及酸雨与其他污染物的复合作用。含有硫酸根的pH3.5的模拟酸雨降低了美国红果云杉(Picea rubens)地上部分的生长,而含有硝酸根的同样酸度的模拟酸雨则促进了生长(Jacobsen et al., 1999)。硝态氮作为植物最容易吸收和利用的氮素之一,对叶绿素的合成和生长发育都具有重要影响(张继澍等,2008)。可见,不仅酸度本身,而且SO42-和NO3-的比例也对酸雨在植物中的作用有着重要影响。
叶绿素是植物光合作用的主要色素,植物在逆境中叶绿素加速分解致使其含量下降。类胡萝卜素作为光合作用的辅助色素具有吸收和传递电子的能力,在清除光合作用中产生的叶绿素三线态和单线态及超氧阴离子自由基方面也起着重要的作用(Bartley et al., 1995)。通过比较不同类型酸胁迫下云杉叶叶绿素含量和类胡萝卜素含量的变化,发现酸溶液pH≥3.0时,NRA酸液处理叶绿素含量高于SRA酸液处理,而这一现象可能与低浓度的NO3-促进叶绿素合成有关;当pH < 3.0时,由于NRA酸液处理细胞内活性氧水平相对较高(图 4A~B),可能导致叶绿素分解较快,致使其含量低于SRA酸液处理的叶(图 2A)。类胡萝卜素含量在各胁迫条件下(pH1.0处理除外)2种处理没有显著差别(图 2B),这可能为类胡萝卜素对氧化胁迫的敏感程度相对较低有关(萧浪涛等,2004)。
可溶性糖和脯氨酸都是植物细胞内重要渗透调节物质,植物遭受逆境胁迫后其含量一般呈增加趋势,通过增加胞内溶质浓度可减轻逆境胁迫对植物的伤害(刘爽等,2010;严美玲等,2010)。本试验结果显示:pH≥3.0时,酸雨胁迫云杉叶可溶性糖和脯氨酸含量上升,NRA酸液处理可溶性糖和脯氨酸含量略高于SRA酸液(图 3A,B);这可能因为酸胁迫较弱时(pH≥3.0),NRA酸处理给云杉叶提供了较多的NO3-,NO3-经过还原在叶绿体中形成NH4+,NH4+通过同化作用形成谷氨酰胺及谷氨酸,谷氨酸有可能转化为脯氨酸(许祥明等,2000),进而调节酸胁迫下云杉叶的渗透势,增强抗性。而当酸溶液酸性较强(pH < 3.0)时,NRA酸液处理氧化性高,造成叶内大量O2·累积(图 4A),O2·虽可能不直接参与对氨基酸的作用,但可通过歧化反应产生H2O2,而H2O2可对含有不饱和键和含巯基的氨基酸如脯氨酸进行氧化而导致可溶性糖和脯氨酸含量下降(汪德清等,1994)。
叶片细胞膜稳定指数(MSI)的变化表示细胞膜的损伤程度(Sairam et al., 1997),丙二醛(MDA)含量变化也可表示脂质过氧化的程度(谢明吉等,2005)。植物在逆境中会产生和积累氧自由基与活性氧,当其含量超过一定的阈值时,会对细胞膜及许多生物大分子产生破坏作用(Li et al., 2003)。生物体内的活性氧主要包括超氧阴离子自由基(O2·)、单线态氧和H2O2等,其中O2·具有很强的氧化性,它对植物造成伤害机制之一在于启动膜脂过氧化或膜脂脱脂化作用(吕庆等,1996;沈静等,2010)。本研究采用硫酸根和硝酸根摩尔比不同的2种类型的酸溶液处理云杉叶,通过检测细胞膜损伤的相关指标,发现在酸胁迫程度较轻时(pH≥3.0),云杉通过自身的调节功能,如提高抗氧化酶活性和多胺含量减轻活性氧的累积程度,降低了酸液对细胞膜系统的伤害。当酸度增大(pH < 3.0)时,细胞膜出现损伤(图 1A)。对比2种不同类型的酸胁迫,在酸度较大时(pH2.0和pH1.0)NRA酸液处理下云杉叶细胞膜稳定指数较低、MDA含量较高(图 1A,B)、O2·的产生速率和H2O2含量较大(图 4A,B)。产生上述结果的原因可能为稀硝酸氧化性强于稀硫酸,所以当酸溶液中NO3-所占比例较大时,在强酸度下(pH2.0,pH1.0)云杉叶O2·产生速率较快,H2O2积累量较多,从而对细胞膜造成较大的伤害。
细胞膜的损伤是酸胁迫对植物伤害的重要方面,由于植物在长期进化过程中形成了完善的抗氧化系统,使得植物能够对酸雨等逆境有着一定的适应和抵御,这些抗氧化系统主要包括抗氧化酶系统和一系列的抗氧化剂,如多胺、类胡萝卜素等。当植物遭受的胁迫超过一定阈值时,会使得细胞膜的酶促和非酶促保护系统受到伤害(沈静等,2010;Gaspar et al., 2002)。研究结果可知:当溶液的酸度下降至pH1.0和pH2.0时,抗氧化酶的活性皆大幅度下降,而腐胺、亚精胺和精胺这3种主要多胺的含量也大幅度降低。对比富含硫酸根和富含硝酸根的这2种酸溶液胁迫的云杉叶,NRA胁迫在强酸度下(pH1.0,pH2.0)造成云杉叶活性氧水平较高,这与其抗氧化酶的活性及多胺含量显著低于SRA胁迫是一致的。
综上所述,相对于SRA酸胁迫,在较强的酸度下,NRA酸胁迫对云杉叶表现出较强的氧化能力,从而更大幅度地减弱了其抗氧化酶、多胺、类胡萝卜素等构成的细胞膜保护系统,进而加重了细胞膜的损伤。本研究所选用试验材料的处理不是在活体上进行,而是取其针叶在酸液中浸泡处理,这是为了取材便利以及处理的均匀和一致性,可消除不同树木、气象条件和枝条间的差别造成的系统误差,而这种处理结果虽然重复性相对较好,但同实际情形的酸雨对树木的影响并不等同,仅可作为了解不同类型酸雨对云杉等针叶植物影响的参照。
随着大气污染中氮氧化物排放量的增加,酸雨中增加的硝酸根离子在增加酸液氧化性的同时,还会造成光化学烟雾等一系列环境问题,因此针对酸雨中硝酸根浓度增加造成的生态影响也需要进行深入系统研究。
| [] | 陈利锋, 宁玉立, 俞刚, 等. 1997. 抗感赤霉病小麦品种超氧化物歧化酶和过氧化物酶的活性比较. 植物病理学报, 27(3): 209–213. |
| [] | 邓伟, 刘荣花, 熊杰伟, 等. 2009. 当前国内酸雨研究进展. 气象与环境科学, 32(1): 82–87. |
| [] | 付晓萍, 田大伦. 2006. 酸雨对植物的影响研究进展. 西北林学院学报, 21(4): 23–27. |
| [] | 蒋明义. 1999. 水分胁迫下植物体内的·OH产生和细胞的氧化损害. 植物学报, 41(3): 229–234. |
| [] | 林植芳, 李双顺. 1988. 衰老叶片和叶绿体中H2O2的累积和膜脂过氧化的关系. 植物生理学报, 14(1): 16–22. |
| [] | 刘建新, 胡浩斌, 赵国林. 2008. 干旱胁迫下多裂骆驼蓬叶片乙烯释放和多胺含量变化与活性氧累积的关系. 生态学, 28(4): 1579–1585. |
| [] | 刘爽, 王庆成, 刘亚丽, 等. 2010. 土壤pH值对脂松苗木脂质过氧化及内源保护系统的影响. 林业科学, 46(2): 152–156. DOI:10.11707/j.1001-7488.20100225 |
| [] | 吕庆, 郑荣梁. 1996. 干旱及活性氧引起小麦脂质过氧化与脱脂化. 中国科学: C卷, 26(1): 26–30. |
| [] | 鲁美娟, 江洪, 李巍, 等. 2009. 模拟酸雨对刨花楠幼苗生长和光合生理的影响. 生态学报, 29(11): 5986–5994. DOI:10.3321/j.issn:1000-0933.2009.11.029 |
| [] | 沈静, 杨青川, 曹致中, 等. 2010. 低温胁迫对野牛草细胞膜和保护酶活性的影响. 中国草地学报, 32(2): 98–102. |
| [] | 汪德清, 沈文梅, 田亚平. 1994. 自由基对生物大分子损伤及防护的研究进展//方允中. 自由基生命科学进展. 第2集. 北京: 原子出版社, 31-34. |
| [] | 王爱国, 罗广华. 1990. 植物的超氧自由基与羟胺反应的定量关系. 植物生理学通讯, 26(6): 55–57. |
| [] | 王自发, 高超, 谢付莹, 等. 2007. 中国酸雨模式研究回顾与面临的挑战. 自然杂志, 29(2): 78–82. |
| [] | 吴丹, 王式功, 尚可政. 2006. 中国酸雨研究综述. 干旱气象, 24(2): 70–77. |
| [] | 萧浪涛, 王三根. 2004. 植物生理学. 北京, 中国农业出版社: 131. |
| [] | 谢明吉, 柯文山, 王万贤, 等. 2005. 铜胁迫下两种海州香薷的膜脂过氧化水平及抗氧化能力比较. 生态学杂志, 24(8): 935–938. |
| [] | 许祥明, 叶和春, 李国凤. 2000. 脯氨酸代谢与植物抗渗透胁迫的研究进展. 植物学通报, 17(6): 536–542. |
| [] | 严美玲, 李忠, 丛振红, 等. 2010. 水分胁迫对烟农21根系抗旱特性的影响. 中国农学通报, 26(2): 113–117. |
| [] | 尹永强, 胡建斌, 邓明军. 2007. 植物叶片抗氧化系统及其对逆境胁迫的响应研究进展. 中国农学通报, 23(1): 105–106. |
| [] | 张继澍. 2008. 植物生理学. 北京, 高等教育出版社: 68. |
| [] | 张金梅. 2011. 酸雨的成因、危害和控制措施. 微量元素与健康研究, 28(1): 61–62. |
| [] | 赵世杰. 1994. 植物组织中丙二醛测定方法的改进. 植物生理学通讯, 30(3): 207–210. |
| [] | 周光益, 田大伦, 杨乐苏, 等. 2009. 酸雨胁迫下乡土植物根际土壤的化学行为. 林业科学, 45(11): 161–166. DOI:10.11707/j.1001-7488.20091126 |
| [] | 邹琦. 2007. 植物生理学实验指导. 北京, 中国农业出版社: 72-168. |
| [] | Bartley G E, Scolnik P A. 1995. Plant carotenoids: pigments for photoprotection, visual attraction, and human health. Plant Cell, 7(7): 1027–1038. DOI:10.1105/tpc.7.7.1027 |
| [] | Bellani L M, Rinallo C, Muccifora S. 1997. Effects of simulated acid rain on pollen physiology and ultrastructure in the apple. Environment Pollution, 95(3): 357–362. DOI:10.1016/S0269-7491(96)00127-3 |
| [] | Béranger-Novat N, Monin J, Jassey J. 1997. Polyamine catabolism in dormant embryos of spindle tree (Euonymus europaeus L.) and in dormancy break obtained after treatment with gibberellic acid. Plant Growth Regulation, 21: 65–70. DOI:10.1023/A:1005728313877 |
| [] | Flores H E, Galston A W. 1982. Analysis of polyamines in higher plants by performance liquid chromatography. Plant Physiology, 69: 701–706. DOI:10.1104/pp.69.3.701 |
| [] | Gaspar T, Franck T, Bisbis B, et al. 2002. Concepts in plant stress physiology-Application to plant tissue cultures. Plant Growth Regulation, 37(3): 263–285. DOI:10.1023/A:1020835304842 |
| [] | Jacobsen J S, Bethard T, Heller L I, et al. 1999. Response of Picea rubens seedlings to intermittent mist varying in acidity, and in concentrations of sulfur-, and nitrogen-containing pollutants. Physiologia Plantarum, 78: 595–601. |
| [] | Li C Z, Wang G X. 2004. Interactions between reactive oxygen species, ethylene and polyamines in leaves of Glycyrrhiza inflata seedlings under root osmotic stress. Plant Growth Regulation, 42(1): 55–60. DOI:10.1023/B:GROW.0000014890.97789.fe |
| [] | Rinallo C, Mori B. 1996. Damage in apple (Malus domestica Borkh) fruit exposed to different levels of rain acidity. J Hortsci, 71(1): 17–23. |
| [] | Sairam R K, Shukla D S, Saxena D C. 1997. Stress induced injury and antioxidant enzymes in relation to drought tolerance in wheat genotypes. Biol Plant, 40(3): 357–364. DOI:10.1023/A:1001009812864 |
| [] | Zhao Y X, Hou Q. 2010. Characteristics of the acid rain variation in China during 1996-2006 and associated causes. Acta Meteorologica Sinica, 24(2): 239–250. |
 2012, Vol. 48
2012, Vol. 48

