文章信息
- 崔丽娟, 李伟, 赵欣胜, 张岩, 张曼胤, 王义飞, 高常军, 马琼芳
- Cui Lijuan, Li Wei, Zhao Xinsheng, Zhang Yan, Zhang Manyin, Wang Yifei, Gao Changjun, Ma Qiongfang
- 北京西卓家营湿地沉水植物群落组成与水环境因子的关系
- Relationships between Submerged Plants Community Composition and Hydro-Environmental Factors in Xizhuojiaying Wetland, Beijing
- 林业科学, 2012, 48(6): 18-23.
- Scientia Silvae Sinicae, 2012, 48(6): 18-23.
-
文章历史
- 收稿日期:2011-04-29
- 修回日期:2012-04-20
-
作者相关文章
沉水植物一般指主要生活史在水下度过,根固着在水下基质中的高等维管束植物(Cronk et al., 2001)。沉水植物作为湿地生态系统的初级生产者,是湿地食物链赖以维持的重要基础。沉水植物的生长、生存、繁殖等与湿地水环境因素有着密切关系,对湿地生态系统过程具有重要影响,在维持湿地生态系统结构和功能以及生物多样性方面具有重要作用(Cook et al., 1974;苏胜齐等,2002)。目前,对于沉水植物的研究已有不少报道,有些研究注意到了水环境(如水深、底质、水化学性质、流速等)对沉水植物生态分布的影响(Lougheed et al., 2001;王辰等,2002;刘晓燕等,2004;Fortney et al., 2004;Kajsa et al., 2005;熊飞等,2006;翟水品等,2008;Khaznadar et al., 2009),但多是在室内或半自然条件下进行(余国营等,2000;杨海龙等,2001;苏睿丽等,2005),缺少自然条件下水体物理化学性质对沉水植物群落组成的影响研究,更是缺乏对沉水植物与水环境关系的数量分析。本研究分析北京西卓家营湿地12个水环境因子与沉水植物群落的关系,以期为湿地生态系统恢复提供科学依据。
1 研究区概况研究区西卓家营湿地位于北京市延庆县城以西9.00 km处,系官厅水库的库滨带(115°51′31.68″E,40°27′02.46″N),面积约66.67 hm2,年平均气温8.0 ℃,平均降水量493.00 mm,年际变化较大(274.0~747.1 mm),属温带大陆性季风气候。该区为采砂迹地,土壤砂砾质,原生植物群落主要有芦苇(Phragmites australis)群落、香蒲(Typha orientalis)群落、荇菜(Nymphoides peltatum)群落和狐尾藻(Myriophyllum verticillatum)群落等,主要树种有旱柳(Salix matsudana)和榆树(Ulmus pumila)等(李伟等,2010)。水域主要由13个大小不等的不连续水体构成,水源补给主要源于自然降水及地下渗水。
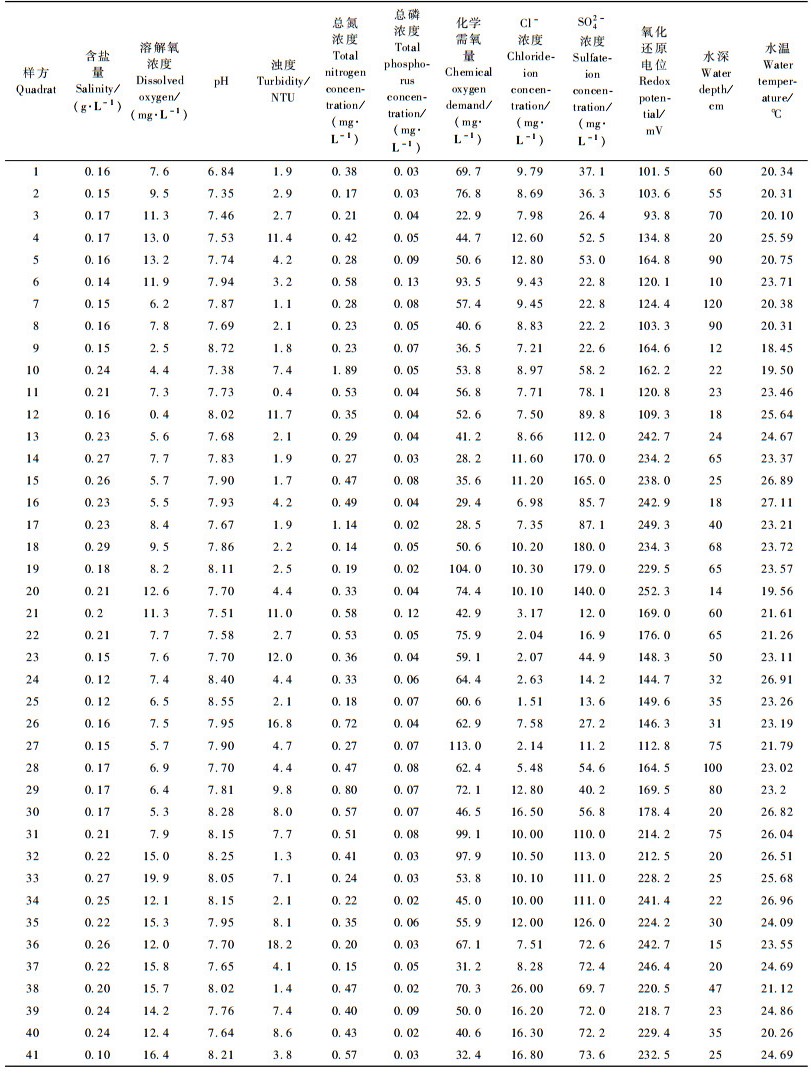
2 研究方法研究于2010年9月进行,利用GPS定位在每个明水面设置3~4块1 m ×1 m样方,采样人持GPS对每块样方进行群落学调查,包括植物种类、盖度和多度等。共记录样方41个,各样方水深约30~130 cm。在每块样方随机取水样3个,回室内分析,并取平均值作为计算参数。水环境指标包括含盐量、溶解氧浓度、pH值、浊度、总氮浓度、总磷浓度、化学需氧量、Cl-浓度、SO42-浓度、氧化还原电位、水深和水温,共计12个。其中,含盐量、溶解氧浓度、pH值、浊度和水温由美国YSI公司便携式水质测试仪6820测定;总氮浓度采用碱性过硫酸钾消解紫外分光光度法测定;总磷浓度采用钼酸铵分光光度法测定;化学需氧量采用碱性高锰酸钾法测定;Cl-浓度采用离子色谱法测定;SO42-浓度采用离子色谱法测定;氧化还原电位采用电位测定法测定(国家环保总局,2002);水深采用钢卷尺测量。
采用双向指示种分析(two way indicator species analysis,简称TWINSPAN)进行沉水植物群落分类。该方法是国际上通用的一种等级分类方法,能够同时完成样地和种的分类,广泛应用于植被生态学中,采用Cornell生态学软件包中的TWINSPAN程序对植物群落进行TWINSPAN数量分类,得到第1排序轴,再以排序轴为基础进行分类。在执行TWINSPAN分析的过程中需要设定相应参数,包括“假种(pseudospecies)”切割水平、分类最大水平数、各假种水平加权值、指示种指示潜力等(张金屯,2004)。
采用除趋势典范对应分析(detrended canonical correspondence analysis,简称DCCA)分析沉水植物群落组成与水环境因子的关系。除趋势典范对应分析的排序轴包含了种类组成信息和环境因子信息,DCCA采用了综合排序和回归方法,它克服了弓形效应,能更好地反映群落与环境的关系(张金屯,2004)。应用CANOCO软件建立沉水植物群落矩阵和水环境因子矩阵,进行DCCA分析(王翠红等,2004)。
3 结果与分析 3.1 沉水植物群落数量分类41块样方中共发现13种沉水植物,各沉水植物及它们所分布的样方见表 1。
|
|
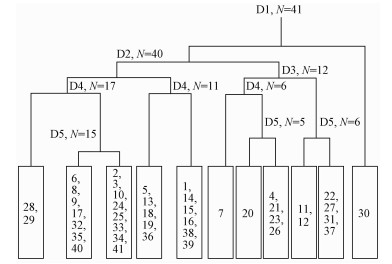
根据表 1沉水植物出现频率以及各样方沉水植物多度值,并借助关键物种的指示作用,对研究区植物进行TWINSPAN分类,其结果如图 1所示,共划分为8个群落类型。各群落类型的名称依据其优势种和TWINSPAN分类时的指示种确定。
|
图 1 沉水植物群落物种的TWINSPAN分类 Fig.1 TWINSPAN classification for submerged plant species |
Ⅰ:大茨藻(Najas marina)+菹草(Potamogeton crispus)群落该群落以大茨藻和菹草为优势种,伴生物种主要有篦齿眼子菜(Potamogeton pectinatus)和眼子菜(Potamogeton distinctus),包括样方28和29。
Ⅱ:黑藻(Hydrilla verticillata)+北京水毛茛(Batrachium pekinense)+眼子菜群落该群落以黑藻、北京水毛茛和眼子菜为优势种,伴生物种主要有小茨藻(Najas minor)和大茨藻,个别样地中有少量金鱼藻(Ceratophyllum demersum)、线叶眼子菜(Potamogeton pusillus)和狐尾藻(Myriophyllum verticillatum)分布,包括样方2,3,6,8,9,10,17,24,25,32,33,34,35,40和41。
Ⅲ:狐尾藻+马来眼子菜(Potamogeton malaianu)群落该群落以狐尾藻和马来眼子菜为优势种,伴生物种主要有金鱼藻,包括样方5,13,18,19和36。
Ⅳ:狐尾藻+小茨藻群落该群落以狐尾藻和小茨藻为优势种,伴生物种主要有穿叶眼子菜(Potamogeton perfoliatus)和菹草,包括样方1,14,15,16,38和39。
Ⅴ:北京水毛茛单优群落该群落以北京水毛茛为优势种,存在于样方7。
Ⅵ:马来眼子菜+金鱼藻该群落以马来眼子菜、金鱼藻为优势种,伴生物种主要有篦齿眼子菜,主要分布于研究区水体透明度较大的区域,包括样方4,20,21,23和26。
Ⅶ:马来眼子菜+小茨藻该群落以马来眼子菜、小茨藻为优势种,伴生物种主要有菹草、眼子菜和篦齿眼子菜,此外,个别样地中有少量狐尾藻分布,包括样方11,12,22,27,31和37。
Ⅷ:光叶眼子菜(Potamogeton lucens)单优群落,该群落以光叶眼子菜为优势种,存在于样方30。
3.2 影响沉水植物群落组成的水环境因子结合3个样方的水环境数据,取其平均值,得到41个样方的水环境特征,如表 2所示。
|
|
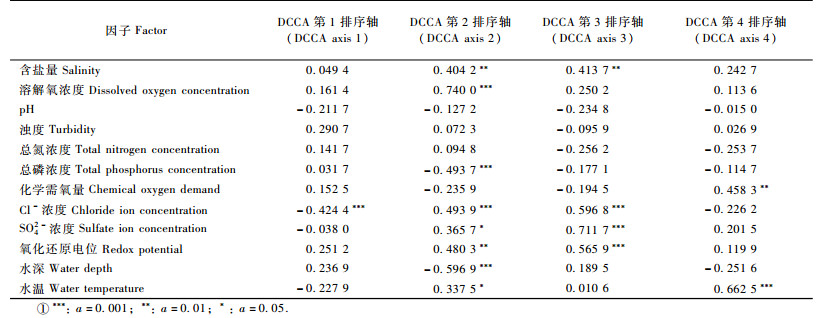
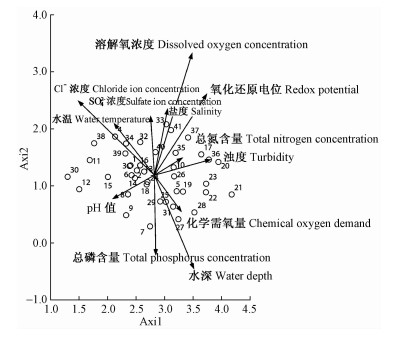
排序轴1和排序轴2特征值贡献率之和大于80%,因此选取第1,2轴做排序图,以反映各类群落样地受环境因子制约和影响的状况(图 2)。其中,数字为样方编号,箭头矢量代表各个水环境因子,箭头矢量的长度表示环境因子对排序的影响,连线越长,表明该环境因子对排序的贡献越大。箭头矢量连线之间的夹角表示各环境因子间的相关性大小,夹角接近垂直,表示其间无显著相关。
|
图 2 沉水植物样方DCCA二维排序 Fig.2 Two-dimensional DCCA ordination diagram of 41 samples |
为了进一步分析各个水环境因子是如何影响植物及其群落的组成,哪些环境因子的作用最突出,以及植物和群落对环境因子的耐受范围,结合群落所在水域的水环境因子进行DCCA分析。由图 2和表 3可以看出:Cl-浓度与DCCA第1排序轴显著负相关(α=0.01);溶解氧浓度、Cl-浓度与DCCA第2排序轴极显著正相关(相关系数分别为0.740 0和0.493 9,α=0.001);水深、总磷浓度与DCCA第2排序轴极显著负相关(相关系数分别为-0.596 9和-0.493 7,α=0.001);含盐量、氧化还原电位与DCCA第2排序轴显著正相关(相关系数分别为0.404 2和0.480 3,α=0.01),SO42-浓度、水温与DCCA第2排序轴显著正相关(相关系数分别为0.365 7和0.337 5,α=0.05);SO42-浓度、Cl-浓度、氧化还原电位与DCCA第3排序轴极显著正相关(相关系数分别为0.711 7,0.596 8和0.565 9,α=0.001);含盐量与DCCA第3排序轴显著正相关(相关系数分别为0.413 7,α=0.01);水温与DCCA第4排序轴极显著正相关(相关系数为0.662 5,α=0.001),化学需氧量与DCCA第4排序轴显著正相关(相关系数为0.458 3,α=0.01)。通过水环境因子与排序轴分析,得出第1排序轴主要反映了Cl-浓度,第2排序轴反映了溶解氧浓度、Cl-浓度、水深和总磷含量。第3排序轴主要反映了SO42-浓度、氧化还原电位和Cl-浓度,第4排序轴主要反映了水温。
|
|
运用双向分类矩阵,将13种沉水植物分为8个类群。对环境因子和沉水植物群落样方进行DCCA排序,得出第1排序轴主要反映了Cl-浓度,而第2排序轴反映了溶解氧浓度和水深,第3排序轴主要反映了SO42-浓度、氧化还原电位和Cl-浓度,而第4排序轴主要反映了水温。而沈亚强等(2010)研究表明水深、透明度以及总氮浓度是影响滇中五湖沉水植物群落分布及物种丰富度的主要因素。袁婧等(2009)研究表明影响北京地区湿地沉水植物群落组成的因子是流速、总氮浓度、化学需氧量、电导率和氧化还原电位。上述2项研究并未分析Cl-浓度对沉水植物群落分布的影响。本研究中Cl-浓度、溶解氧浓度和水深都对沉水植物分布产生了影响。不同类型沉水植物因其生理学特征不同,对pH值的响应也有所差异(苏睿丽等,2005)。
本研究中北京水毛茛群落对应着独特的水环境化学因子,水清澈见底,浊度显著低于其他群落,同时,水体的化学需氧量相对较低。黑藻群落的环境因子组成变化较大,黑藻在茎节上能产生分枝和不定根,可通过断枝进行繁殖。狐尾藻群落无论是单优群落还是共优群落均分布较广,主要是由于狐尾藻对水环境因子有着广泛的适应性。邱东茹等(1997)把狐尾藻+眼子菜的群落看作是水体富营养化程度较高时出现的群落。而袁婧等(2009)将狐尾藻+菹草群落视为水体严重富营养化的表现。金鱼藻群落的水环境因子与黑藻和狐尾藻群落的水环境因子较为接近。马来眼子菜群落和眼子菜群落,无论是单优群落还是共优群落,都对水环境因子有着广泛的适应性。本研究出现了6种眼子菜,这6种眼子菜属(Potamogeton)植物植株的柔韧性较强。在恢复沉水植物群落时,需兼顾到水体pH值以及沉水植物种类所适合的pH值范围。营养盐对沉水植物生长的影响机制一直存在分歧(王华等,2008)。Beklioglu等(1996)通过对英国湖泊水质变化研究发现,沉水植物对水体营养盐浓度具有较宽的耐受范围。营养盐浓度是沉水植物生长的影响因子之一,但不是限制其生长的关键因子(叶春等,2007;雷泽湘等,2008)。Barko等(1981)研究发现沉水植物最佳生长状态总对应着某一合适的温度范围,而过低或过高都会对其生长过程产生一些不利影响。
| [] | 国家环保总局. 2002. 水和废水监测分析方法. 4版. 北京, 中国环境科学出版社. |
| [] | 雷泽湘, 徐德兰, 顾继光, 等. 2008. 太湖大型水生植物分布特征及其对湖泊营养盐的影响. 农业环境科学学报, 27(2): 698–704. |
| [] | 李伟, 崔丽娟, 赵欣胜, 等. 2010. 采砂迹地型湿地恢复过程中植物群落分布与土壤环境因子的关系. 生态环境学报, 19(10): 2325–2331. DOI:10.3969/j.issn.1674-5906.2010.10.011 |
| [] | 刘晓燕, 胡东, 陈卫. 2004. 北京白河沉水植物研究. 首都师范大学学报:自然科学版, 25(1): 46–51. |
| [] | 邱东茹, 吴振斌. 1997. 富营养化浅水湖泊沉水水生植被的衰退与恢复. 湖泊科学, 9(1): 82–88. DOI:10.18307/1997.0113 |
| [] | 沈亚强, 王海军, 刘学勤. 2010. 滇中五湖水生植物区系及沉水植物群落特征. 长江流域资源与环境, 19(Z1): 111–119. |
| [] | 苏睿丽, 李伟. 2005. 沉水植物光合作用的特点与研究进展. 植物学通报, 22(增刊S1): 128–138. |
| [] | 苏胜齐, 姚维志. 2002. 沉水植物与环境关系评述. 农业环境保护, 21(6): 570–573. |
| [] | 王辰, 刘全儒. 2002. 北京北沙河湿地维管植物区系的研究. 北京师范大学学报:自然科学版, 38(6): 8–15. |
| [] | 王翠红, 张金屯. 2004. 汾河水库水源河着生硅藻群落的DCCA研究. 中国环境科学, 2(41): 28–31. |
| [] | 王华, 逢勇, 刘申宝, 等. 2008. 沉水植物生长影响因子研究进展. 生态学报, 28(8): 3958–3968. |
| [] | 熊飞, 李文朝, 潘继征, 等. 2006. 云南抚仙湖沉水植物分布及群落结构特征. 云南植物研究, 28(3): 277–282. |
| [] | 杨海龙, 叶居新. 2001. 江西省水生维管束植物群落与环境因子关系的初步研究. 生态学杂志, 20(1): 45–47. |
| [] | 叶春, 邹国燕, 付子轼, 等. 2007. 总氮浓度对3种沉水植物生长的影响. 环境科学学报, 27(5): 739–746. |
| [] | 余国营, 刘永定, 丘昌强, 等. 2000. 滇池水生植被演替及其与水环境变化关系. 湖泊科学, 12(1): 73–80. DOI:10.18307/2000.0112 |
| [] | 袁婧, 崔国发, 雷霆. 2009. 影响北京地区湿地沉水植物群落组成的主要水环境因子. 生态学杂志, 28(11): 2189–2196. |
| [] | 翟水品, 胡维平, 邓建才, 等. 2008. 不同水深和底质对太湖马来眼子菜(Potamogeton alaianus)生长的影响. 生态学报, 28(7): 3035–3042. |
| [] | 张金屯. 2004. 数量生态学. 北京, 科学出版社. |
| [] | Barko J W, Smart R M. 1981. Comparative influences of light and temperature on the growth and metabolism of selected submerged freshwater macrophytes. Ecological Monographs, 51(2): 219–236. DOI:10.2307/2937264 |
| [] | Beklioglu M, Moss B. 1996. Existence of amacrophyte-dominated clear water state over a very wide range of nutrient concentrations in a small Shallow Lake. Hydrobioloyia, 337(1-3): 93–106. DOI:10.1007/BF00028510 |
| [] | Cook C D K, Gut B J, Rix F M, et al. 1974. Water plants of the world: a manual for the identification of the genera of freshwater macrophytes. Hague, Junk: 4-5. |
| [] | Cronk J K, Fennessy M S. 2001. Wetland plants: biology and ecology. New York, Lewis Publishers: 88-99. |
| [] | Daniel H, Bernez I, Haury J. 2006. Relationships between macrophytic vegetation and physical features of river habitats: the need for a morphological approach. Hydrobiologia, 570(1): 11–17. DOI:10.1007/s10750-006-0156-6 |
| [] | Fortney R H, Benedict M, Gottgens J F. 2004. Aquatic plants community composition and distribution along an inundation gradient at two ecologically two distinct sites in the Pantanal region of Brail. Wetlands Ecology and Management, 12(6): 575–585. DOI:10.1007/s11273-005-1763-0 |
| [] | Appelgren K, Mattila J. 2005. Variation in vegetation communities in shallow bays of the northern Baltic Sea. Aquatic Botany, 83(1): 1–13. DOI:10.1016/j.aquabot.2005.05.001 |
| [] | Lougheed V L, Crosbie B. 2001. Primary determinants of macrophyte community structure in 62 marshes across the Great Lakes basin: latitude, land use, and water quality effects. Canadian Journal of Fisheries and Aquatic Sciences, 58(8): 1603–1612. DOI:10.1139/f01-102 |
| [] | Khaznadar M, Vogiatzakis I N, Griffiths G H. 2009. Land degradation and vegetation distribution in Chott EI Beida wetland, Algeria. Journal of Arid Environments, 73(3): 369–377. DOI:10.1016/j.jaridenv.2008.09.026 |
 2012, Vol. 48
2012, Vol. 48